副干酪乳酪杆菌PC-01复配剂量对发酵乳产品特性的影响
2023-10-09张哲于学健李宏姚粟
张哲,于学健,李宏,姚粟*
1(中国食品发酵工业研究院有限公司,中国工业微生物菌种保藏管理中心,北京,100015)2(中国合格评定国家认可中心,北京,100062)
根据国际乳品联合会[1](International Dairy Federation,IDF)和GB 19302—2010《食品安全国家标准 发酵乳》定义,发酵乳是指以乳或乳粉为原料,通过微生物作用后制成的pH值降低的产品。常用的发酵剂菌株有德氏乳杆菌保加利亚亚种(Lactobacillusdelbrueckiisubsp.bulgaricus)、嗜热链球菌(Streptococcusthermophilus),同时可以使用其他我国卫生与健康委员会批准使用的菌株。
发酵乳作为一种传统乳制品,在世界各地有着悠久的食用历史。21世纪以来,随着人们生活水平的不断提高以及对健康的重视,对食品的诉求也在不断提升,发酵乳取得快速的发展和广泛的普及。此外,随着素食人群的不断增长和高蛋白饮食的普及,市场上发酵乳的需求也在不断扩大。同时,乳糖不耐症发病率的增加也是推动发酵乳消费的另一原因。发酵乳作为益生菌良好的载体,近些年来的研究和发展都非常迅速[2-4]。
酸奶是由德氏乳杆菌保加利亚亚种和嗜热链球菌发酵产生,二者的相互作用构成了酸奶的基本理化特性、质构特征及代谢产物的组成。益生菌的加入除了带来其本身的功能特点外,还会与发酵剂共同发酵,改变产品特征。在以往的研究中发现,瑞士乳杆菌(LactobacillushelveticusH9)对发酵乳质构的影响与其添加量有关,在低添加量(5×106CFU/g)时,发酵乳特征与仅添加商业发酵剂对照组最为相近。此外,L.helveticusH9的添加增加了发酵乳黏度,这可能是该菌株产胞外多糖所导致的[5]。LI等[6]的研究表明,植物乳杆菌对发酵乳理化及质构的影响与所添加的菌株相关,添加植物乳杆菌的发酵乳相较于对照组可以在贮藏期间保持产品的硬度,增加产品的稳定性。根据药璐[7]的研究发现,添加植物乳杆菌LP 23508可以显著提高发酵乳在贮藏第21天时的硬度与稠度。
相较于发酵乳产品的健康功效,质地和口感是决定消费者喜爱程度的首要因素。一株益生菌是否适合复配于发酵乳中,需通过产品的多种特征进行综合判断。副干酪乳酪杆菌PC-01分离自西藏拉萨地区自然发酵的酸牦牛乳中,此前的研究表明,该菌株消化液耐受性良好,同时可以促进葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠结肠炎的恢复[8]。此外,副干酪乳酪杆菌PC-01复配于发酵乳中可以提高产品的感官评分,特别是起始添加量为5×106CFU/g时,发酵乳在贮藏期间滋味评分上始终显著高于商业化菌剂对照组,并且显著增加产品中特征风味物质,如2,3-丁二酮和乙偶姻的含量[9]。本研究以不同剂量的副干酪乳酪杆菌PC-01与商业化发酵剂复配,探究不同添加量的菌株PC-01对发酵乳产品理化及质构特性带来的影响,旨在确定该菌株在发酵乳中的最适添加剂量,为产品开发提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
副干酪乳酪杆菌PC-01直投式菌粉,内蒙古农业大学。商业发酵剂YF-L904包含德氏乳杆菌保加利亚亚种和嗜热链球菌,科汉森(中国)。
1.1.2 试验试剂
纯牛奶,内蒙古蒙牛乳业(集团)股份有限公司;白砂糖,广西凤糖生化股份有限公司;氯化钠,广东西陇化工厂;MRS肉汤培养基、万古霉素,北京陆桥技术股份有限公司;琼脂,青岛海博生物技术有限公司;氢氧化钠(分析纯),天津科茂化学试剂有限公司;酚酞,天津市化学试剂三厂。
1.1.3 仪器与设备
FE28型pH计,梅特勒(上海)有限公司;恒温水浴锅、BHG-8082型恒温培养箱,上海一恒科技有限公司;Brookfield DV-2T型黏度计,美国Brookfield公司;Rheolaser Master微流变仪,法国Formulaction公司;TA-XT plus质构测试仪、A/BE质构仪探头,英国SMS公司;SW-CJ-2FD洁净工作台,苏州苏净集团;SRH60-70型高压均质机,上海申鹿均质机有限公司;立式低速离心机,德国Eppendorf公司;HG-50高压灭菌锅,日本HIRAYAMA公司。
1.2 实验方法
1.2.1 搅拌型发酵乳样品的制备
将牛奶预热到60 ℃,按照白砂糖6.5%(质量分数)、牛乳93.5%(质量分数)比例加入白砂糖;加热到65 ℃,以1 000 r/min转速,化料15 min;20 MPa下均质;90 ℃加热10 min灭菌;冷却至37 ℃后于无菌操作台内接种菌剂,样品分组如表1所示。将接种后样品置于42 ℃恒温发酵直至pH值降到4.50达到发酵终点,置于冰水浴冷却后无菌分装于蓝盖瓶中;将达到发酵终点样品置于4 ℃后熟24 h;将后熟样品置于10 ℃贮藏28 d。发酵期间每2 h取1次样品,贮藏期间每7 d取1次样进行各指标测定。
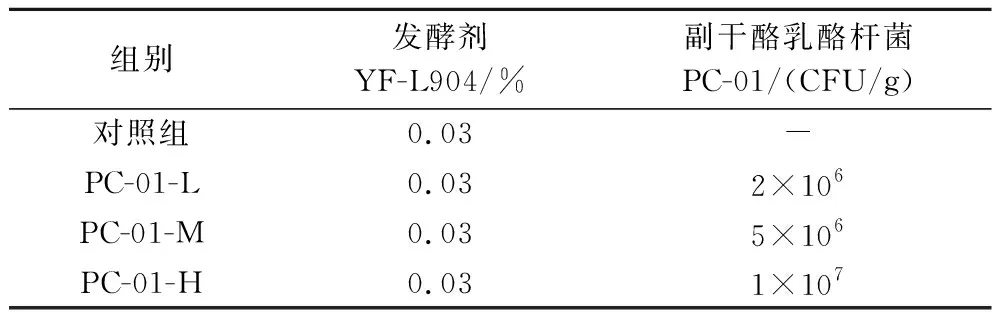
表1 试验分组Table 1 Experiment grouping
1.2.2 发酵乳流变特性的测定
取各组接种后发酵乳样品20 mL于Rheolaser Master微流变仪器专用玻璃管中,保证玻璃管壁清洁,以免造成误差。将玻璃管置于仪器测定槽内,将仪器温度设置为42 ℃,每60 s测定1次样品直至发酵结束[10]。通过微流变仪器配套软件直接得到微观黏性因子(macroscopic viscosity index,MVI)、固液平衡值(solid liquid balance,SLB)、弹性因子(elastic index,EI)和流动因子(fluidity index,FI)数据。
1.2.3 发酵乳pH及滴定酸度的测定
将发酵乳放置室温后直接用pH计进行测定,每个样品测定3组平行。滴定酸度(titratable acidity,TA)测定发酵乳中总酸含量,吉尔涅尔度(°T)为100 mL发酵乳消耗0.1 mol/L NaOH溶液的体积(mL)。滴定酸度测定依据GB 5009.239—2016《食品安全国家标准 食品酸度的测定》,取10 g发酵乳于锥形瓶中,加入20 mL蒸馏水,摇匀后加入3滴0.5%的酚酞指示剂,使用经过标定的0.1 mol/L NaOH溶液进行滴定,一边滴加NaOH溶液一边摇动锥形瓶,当样品变为浅粉红色并保持30 s内不褪色即为滴定终点,每组样品测定3组平行。
1.2.4 发酵乳持水性的测定
取空三角烧瓶并称重,称取发酵乳样品20 g于放有滤纸的漏斗中置于三角烧瓶上,于室温下放置2 h 后收集滤液并称重,每组发酵乳样品测定3个平行[11],计算如公式(1)所示:

(1)
1.2.5 发酵乳中活菌数的测定
发酵乳中活菌数测定依据GB 4789.18—2010《食品安全国家标准 食品微生物学检验 乳与乳制品检验》,取发酵乳样品15 g于加有玻璃珠的灭菌蓝盖瓶中,加入灭菌生理盐水135 g,充分摇匀后梯度稀释。采用平板倾注法计数,吸取稀释后不同梯度的菌液1 mL于平板中,加入含有10 mg/L万古霉素的MRS琼脂培养基并摇匀,待培养基凝固后置于37 ℃培养箱厌氧培养72 h后计数。
1.2.6 发酵乳黏度的测定
将发酵乳放置室温后,采用Brookfield DV-2T黏度仪进行测定,测定时选择4#转子,转速100 r/min,扭矩10%~100%,测定时间30 s,每组样品于不同位置测定3次平行[12]。
1.2.7 发酵乳质构的测定
采用TA-XT plus质构测试仪,A/BE探头,将恢复到室温的样品放入样品杯中,通过5 kg称重传感器进行单次压缩循环试验来对发酵乳样品的硬度、稠度、内聚性和黏度指数,测试中速1.0 mm/s, 测试后速1.5 mm/s,初始应力2.0 g,压缩程度20%,压缩时间5 s,测试距离20 mm,每个样品测定3次平行[12-13]。
1.2.8 数据分析
本文章中数据表示为“平均值±标准差”,使用软件SPSS 19.0对数据进行显著性分析,采用t检验。使用软件Origin 2019绘制数据图。
2 结果与分析
2.1 发酵乳活菌数的变化
添加副干酪乳酪杆菌PC-01各组发酵乳在发酵过程及贮藏期间发酵乳中PC-01活菌数变化情况如图1所示。在整个发酵及贮藏期间,各组样品中PC-01活菌数持续上升。PC-01低、中、高剂量组在发酵开始时添加量分别为(6.27±0.022)、(6.74±0.027)、(7.008±0.004) lg CFU/mL。在贮藏第28天,低、中、高剂量组发酵乳中PC-01活菌数分别上升到(7.84±0.010)、(8.13±0.013)、(8.22±0.004) lg CFU/mL。各组发酵乳样品在贮藏期间PC-01活菌数均上升了一个数量级,且满足国标及相关法规要求,活菌数始终高于1×106CFU/g。结果表明,该菌株在发酵乳中有着良好的活力及耐酸性,能在pH值相对较低的环境下保持活菌数稳定增长。这也与刘凯龙等[14]、苗壮壮等[15]对该菌株的研究相一致。本研究表明,菌株PC-01添加于发酵乳中,活菌数稳定增长,可以充分保证其在产品中相关功效的发挥。
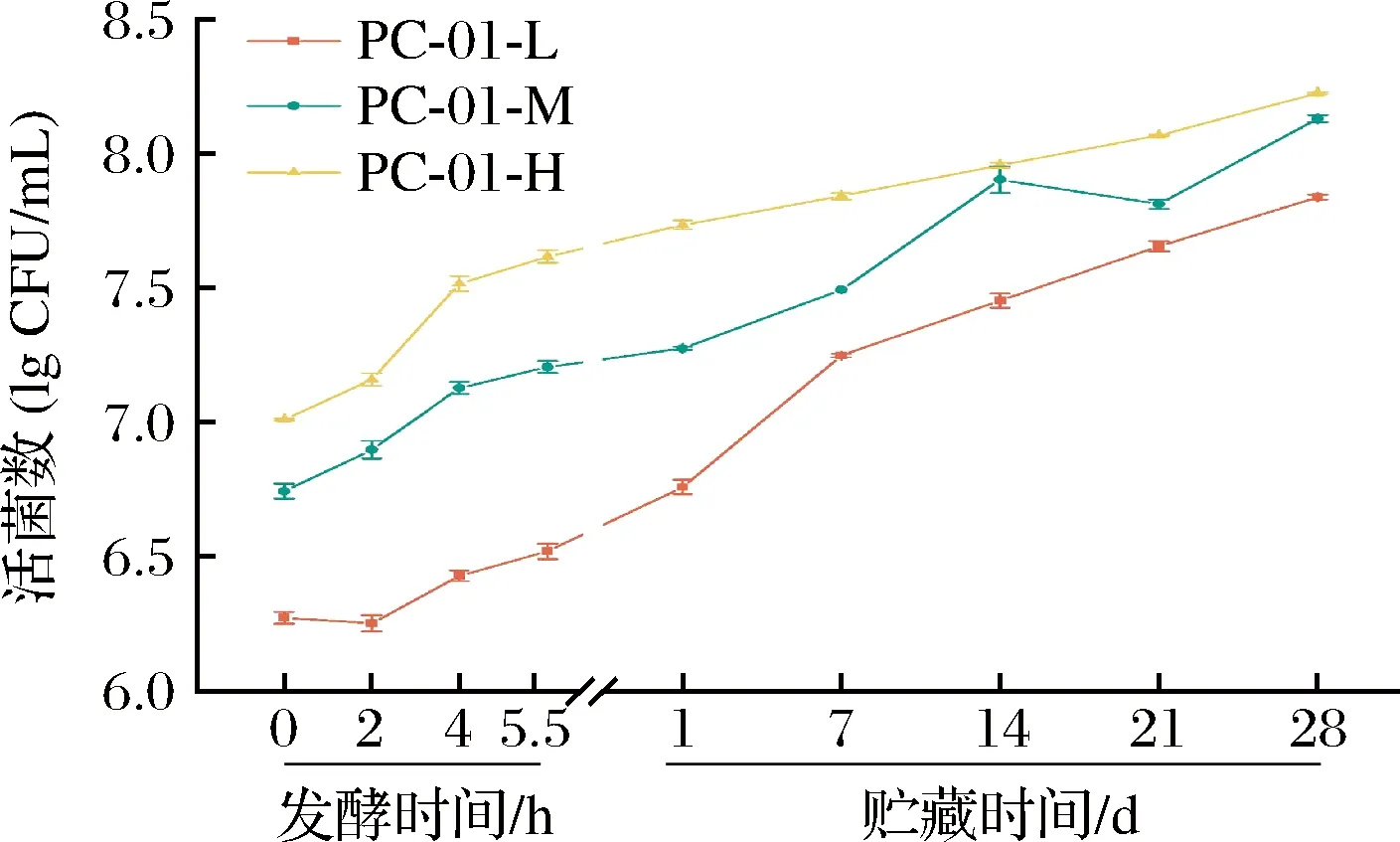
图1 发酵及贮藏过程中PC-01活菌数的变化Fig.1 Viable counts of PC-01 during fermentation and storage
2.2 发酵乳酸度的变化
pH值和滴定酸度是评价发酵乳的重要指标,对于益生菌发酵乳来说,它们不仅影响产品的口感和质量,对贮藏期间产品中益生菌的活菌数也有着重要影响。如图2所示,发酵5.5 h时,各组发酵乳pH值均下降到4.5以下,到达发酵终点。到达发酵终点时,添加不同剂量副干酪乳酪杆菌PC-01的发酵乳与不添加PC-01发酵乳pH值及滴定酸度没有显著性差异(P>0.05)。在发酵乳贮藏期间,乳酸菌会继续通过β-半乳糖甘酶分解发酵乳中乳糖产生乳酸,进而造成产品后酸化。相关研究表明,当发酵乳pH值保持在4.3~4.1时,产品拥有较高的质构及感官品质;当pH值下降到3.5左右时会导致乳清析出较多且产品口感过酸。因此,产品后酸程度是判定菌株是否适宜应用于发酵乳中的重要指标[16]。如图2所示,各组发酵在贮藏期间pH值由4.3下降到4.0左右,变化不明显,且组之间没有显著性差异(P>0.05)。各组发酵乳到达发酵终点时平均滴定酸度在82.5~83.5 °T,酸度适中。在10 ℃贮藏期间,发酵乳滴定酸度随贮藏时间的增加逐渐上升,最终稳定在120 °T左右,各组之间无显著性差异(P>0.05)。本研究表明,添加不同剂量PC-01对发酵乳到达发酵终点的时间以及发酵乳在贮藏期间的pH值及滴定酸度没有显著性影响,PC-01对发酵乳酸度变化起着非决定性作用,其添加不会增加产品的后酸化程度,这可能是由于该菌株利用糖类产生胞外多糖而非有机酸[17-18]。
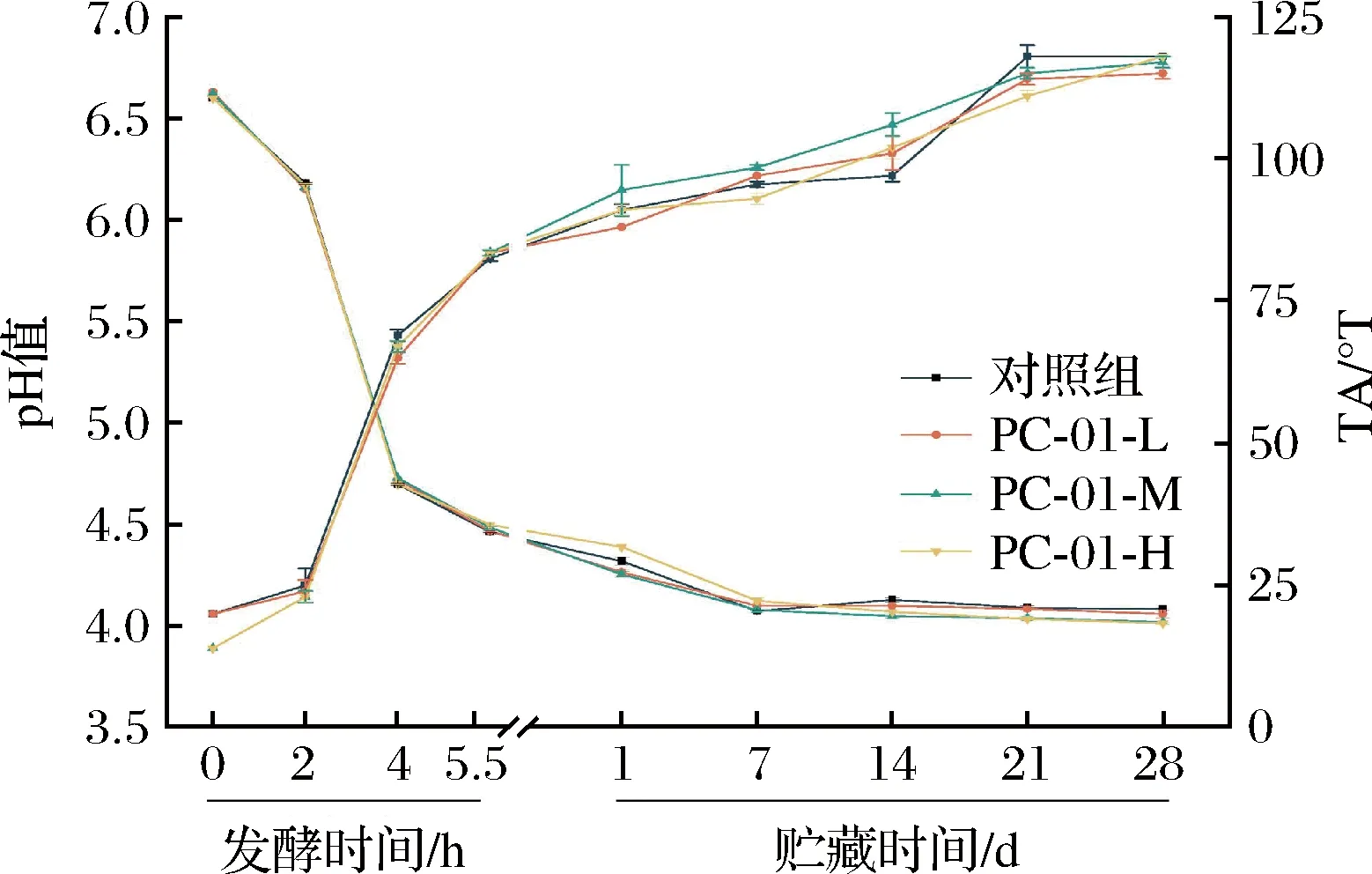
图2 发酵及贮藏过程中pH和滴定酸度的变化Fig.2 Changes of pH and TA during fermentation and storage
2.3 发酵期间发酵乳的微观流变学特征
2.3.1 微观黏性因子
MVI与黏性模量呈正比,反映的是样品的微观黏性特征,可以体现发酵乳黏度随时间的变化情况[19]。如图3所示,从发酵开始到2.5 h左右,酪蛋白还未形成交联的网状凝胶结构,各组样品的黏度始终保持在一较低水平范围波动。在发酵2.5 h后,添加不同剂量PC-01的3组发酵乳的MVI值开始直线上升,这是由于随着pH下降,酪蛋白胶束开始瓦解,酪蛋白重排开始形成凝胶结构[20]。发酵剂对照组相较添加益生菌各组MVI值开始上升时间略晚,说明添加PC-01可以加快凝胶结构的形成速度。此后,各组发酵乳MVI值迅速上升至最大值,样品进入高黏阶段,并在4 h左右进入稳定状态,此后各组发酵乳MVI值之间无显著性差异。根据MVI值结果可以得到,PC-01的添加可以加快产黏速度,但对最终产品的微观黏性无显著影响(P>0.05)。苗壮壮等[15]研究也得到相似的结果,益生菌的添加对发酵乳MVI值无显著性影响。
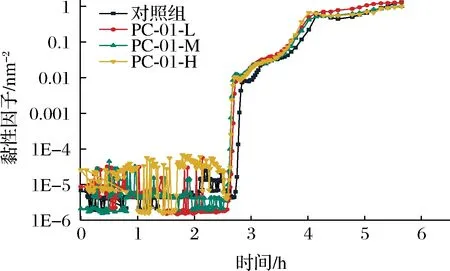
图3 发酵过程中黏性因子的变化Fig.3 Changes of MVI during fermentation
2.3.2 固液平衡值
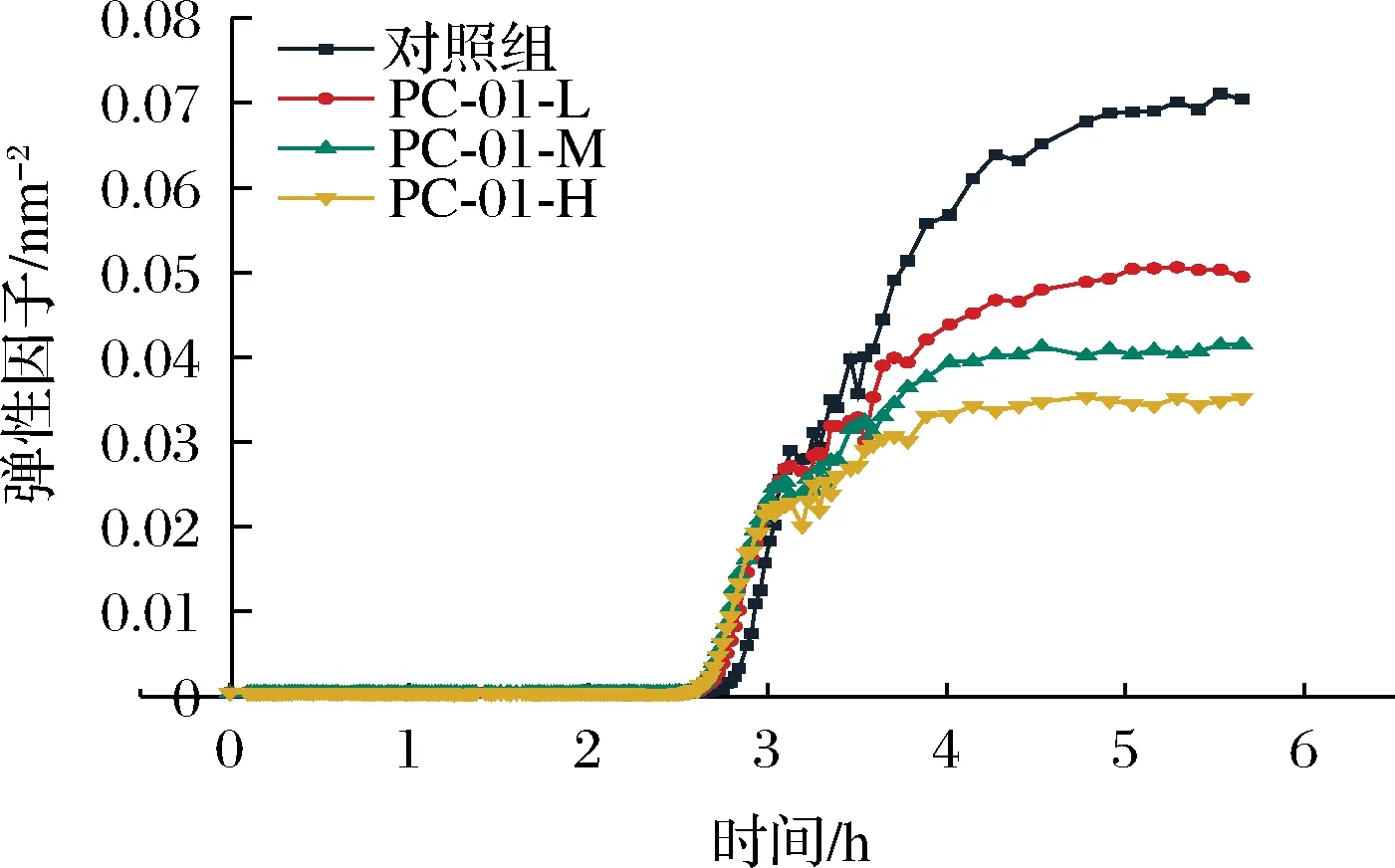
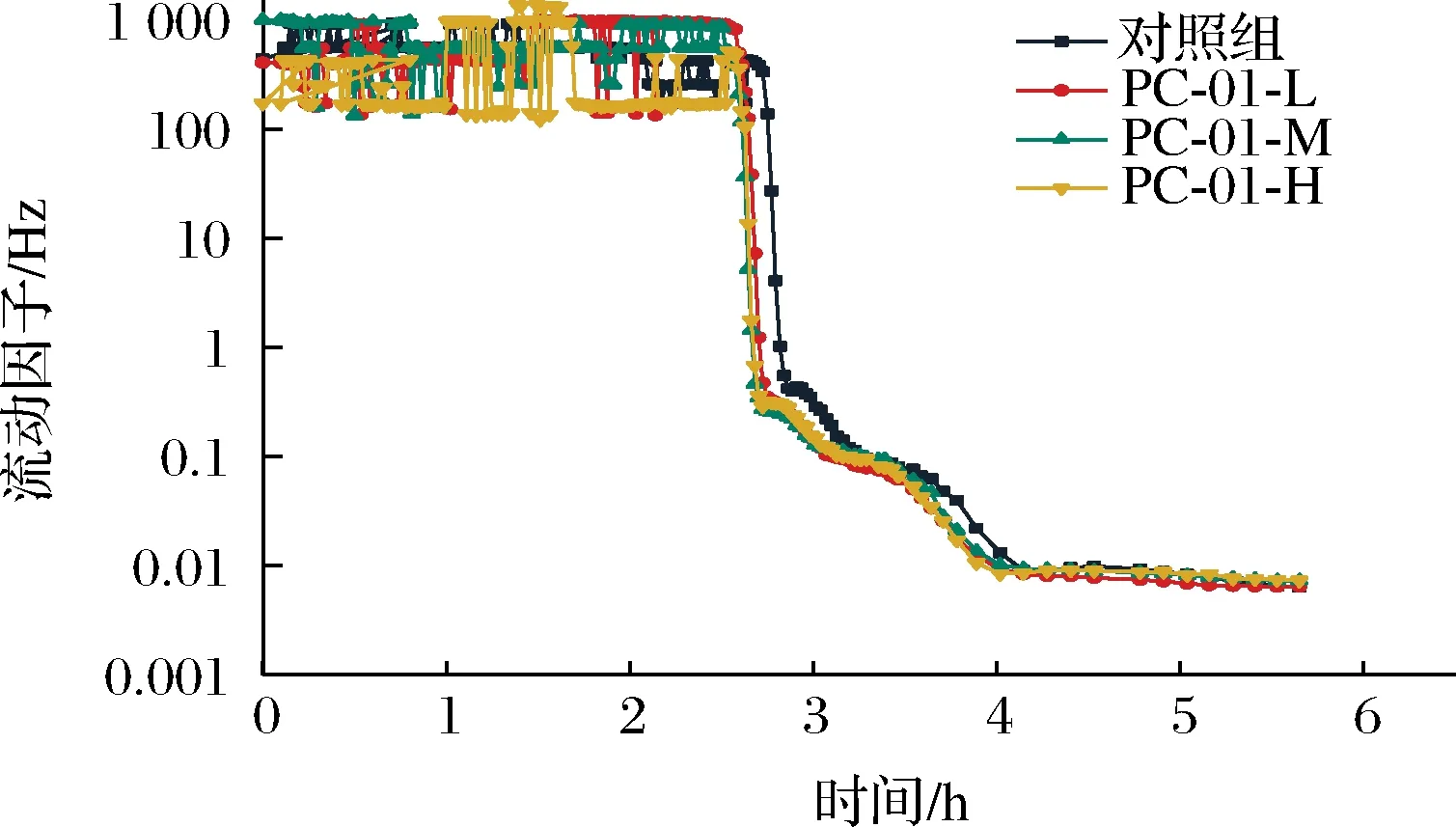
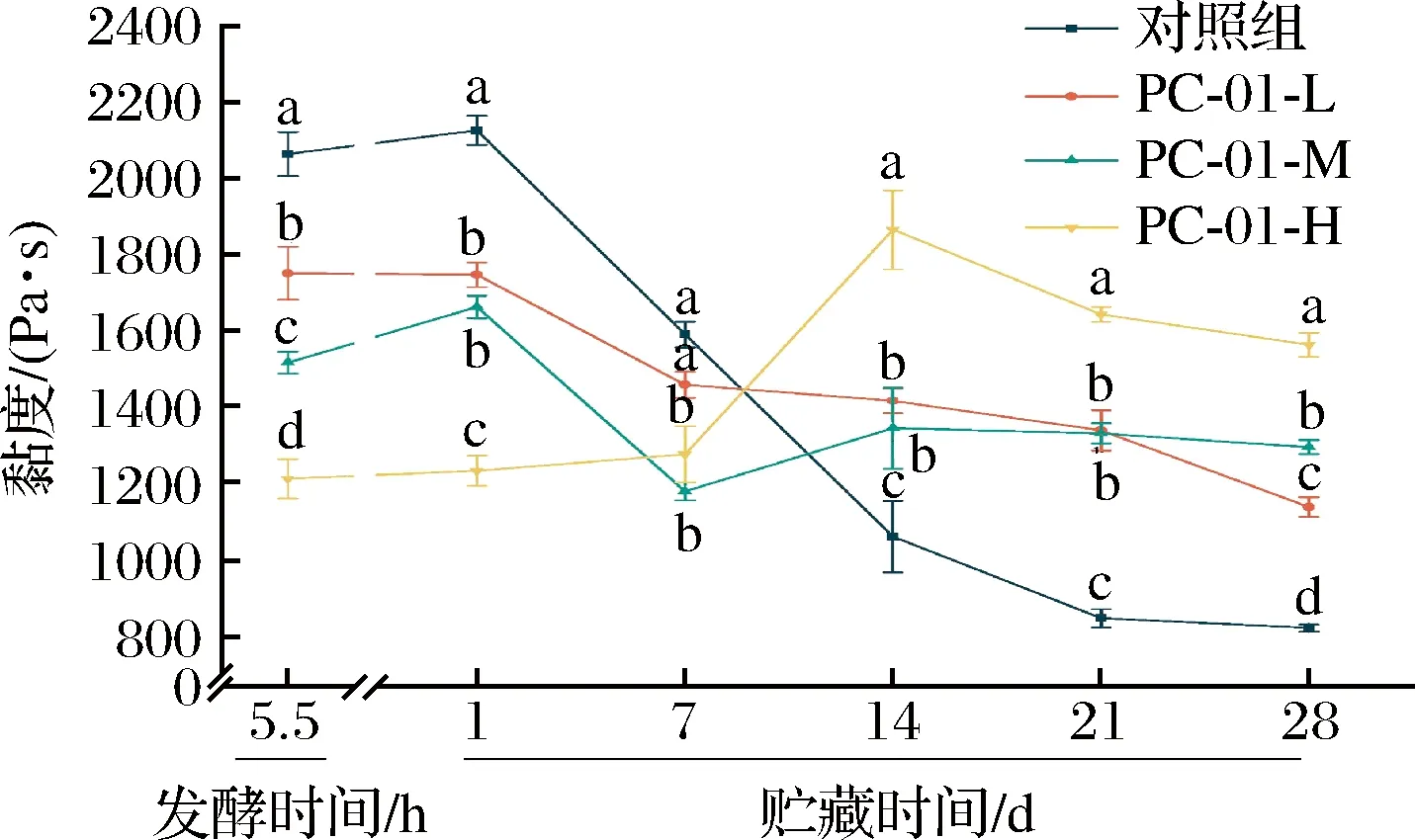
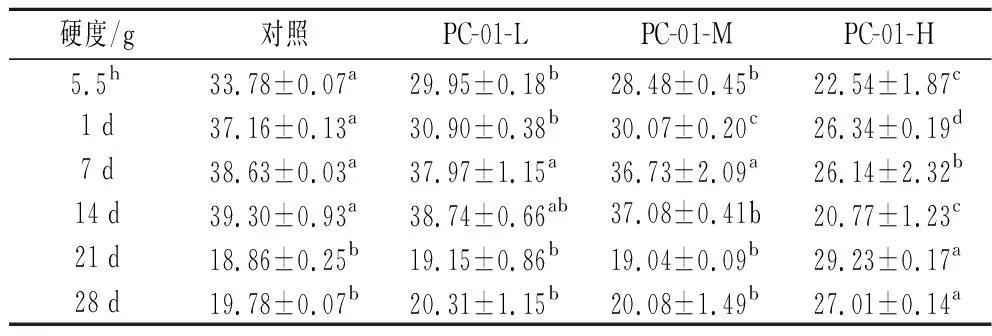
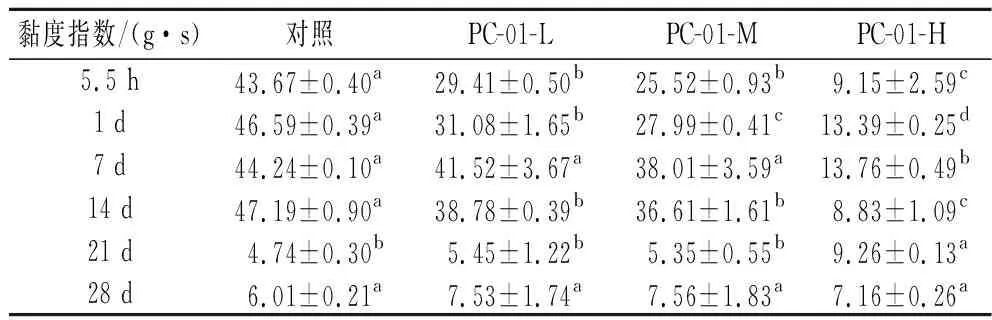
SLB反映的是不同时间样品中固体性质和液体性质的比率,固液平衡曲线斜率越小代表粒子的移动速度越小,说明此时产品更加接近固体状态。当0 图4 发酵过程中固液平衡值的变化Fig.4 Changes of SLB during fermentation 2.3.3 弹性因子 EI与弹性模量成正比,可以直接反应样品弹性随时间的变化情况。EI值越大说明发酵乳的凝胶弹性越大,发酵乳样品越稳定[17]。发酵过程各组样品弹性因子变化如图5所示,发酵乳样品的EI值在初始的前2.5 h内保持稳定。在2.5 h后,添加副干酪乳酪杆菌PC-01各组发酵乳EI值率先上升,到达凝胶点。发酵剂对照组出现拐点时间相较其他各组较晚。各组发酵乳EI值均在发酵4 h后到达稳定状态,说明样品形成稳定的凝胶结构。可以看出在发酵结束时,随着PC-01接种量的增多,样品EI值下降越明显,这说明发酵乳在添加益生菌后,在一定程度上降低了样品的弹性,且弹性下降程度与益生菌的接种量有关,这也与苗壮壮等[15]的研究结果相一致。 图5 发酵过程中弹性因子的变化Fig.5 Changes of EI during fermentation 2.3.4 流动因子 FI反映的是粒子在乳液中运动速度的快慢,FI值越大代表此时样品中微观粒子运动速度越快,样品的流动性越强。如图6所示,发酵开始的前2.5 h,各组样品的FI值在高水平波动,说明此时样品仍处于液体状态,微观粒子高速运动。在此阶段,样品的MVI值和SLB也处于波动状态,因为酪蛋白还未形成网状的凝胶结构,样品表现为高流动,低黏度和低弹性的不稳定状态[20]。2.5 h后,添加PC-01的各组发酵乳率先到达拐点,FI值直线下降。之后对照组样品也呈现相同的趋势。各组FI值均在4 h后进入稳定状态,在发酵结束时各组发酵乳FI值间无显著性差异(P>0.05)。 图6 发酵过程中流动因子的变化Fig.6 Changes of FI during fermentation 微流变的结果表明,4组发酵乳均在2.5 h左右开始凝乳,并在4 h后基本到达稳定状态。同时,副干酪乳酪杆菌PC-01的添加会将凝乳时间点提前,但是在发酵结束时随着PC-01添加量的增多样品的凝胶强度与稳定性有所下降,并且提高了发酵乳中液体性质的比率,这与蔡淼等[21]的研究结果相一致。 黏度是反映发酵乳品质的关键指标,适宜的黏度能给发酵乳带来良好的组织状态和感官品质。各组发酵乳在贮藏期间黏度变化如图7所示,整体上看,各组发酵乳在贮藏期间黏度呈现先上升后下降的趋势。其中,添加PC-01组发酵乳样品起始黏度相较发酵剂对照组较低,且随着副干酪乳酪杆菌PC-01添加量的增加,发酵乳的起始黏度降低,这一结果与微流变中弹性因子相一致。PC-01-L和PC-01-M两组发酵乳在整个贮藏期间黏度相对稳定,而PC-01-H组的发酵乳在前14 d黏度始终处于上升状态,在贮藏结束时黏度最高。发酵剂YF-L904对照组起始黏度较高,但在贮藏期间下降明显,在贮藏14 d后黏度显著低于其他各组(P<0.05)。添加中低剂量的副干酪乳酪杆菌PC-01可以保持发酵乳黏度的稳定性,而添加高剂量PC-01则可以在贮藏后期显著提高发酵乳的黏度。说明益生菌PC-01对发酵乳黏度的影响情况与添加量有关,并且相较于对照组,可以在贮藏期间使发酵乳处于一个更稳定的状态。 图7 贮藏过程中发酵乳黏度的变化Fig.7 Viscosity of fermentation milk during storage 发酵乳的持水性与产品的组织状态和稳定性都密切相关,持水性强说明发酵乳组织状态良好,凝胶结构稳定,乳清析出较少。随着贮藏期间发酵乳pH值的降低,会导致乳清析出,造成持水力下降。如图8 所示,4组样品在10 ℃贮藏期间,持水性都保持在一个相对稳定的区间内波动,无明显下降,这一结果也与各组发酵乳在贮藏期间pH值的变化情况相一致。随着贮藏时间的增长,各组发酵乳持水性之间差异减小,在第28天,各组发酵乳持水性之间无显著性差异。 图8 贮藏过程中发酵乳持水力的变化Fig.8 Water capacity of fermented milk during storage注:不同小写字母表示差异显著(P<0.05)。 发酵乳的质构特征包含硬度,稠度,内聚性和黏度指数。硬度是指压缩过程中的最大受力点,即在压缩至20 mm时测量。硬度是决定酸奶质量的关键性指标,根据研究表明,发酵乳的硬度与选用的发酵剂以及牛奶中的干物质含量、蛋白质组成和含量都高度相关。稠度是指向下压缩至最大受力点时的正面积,稠度越高代表样品的黏度越大。稠度与原奶中蛋白质的含量有关,蛋白质含量越高,发酵乳往往稠度更高更稳定。内聚性是指探头向上返回时负向力的最大值,内聚性是胶体结构结合强度的标志,它反映了酸奶结构的完整性,与内部的凝胶强度正相关。黏度指数是指探头向上返回时图中负值区域的面积,利用产胞外多糖的菌株做发酵剂往往可以提高发酵乳的黏度指数[17,22-23]。 发酵乳的质构受到多种因素的影响,除了牛乳中蛋白质和脂肪的含量外,还受到发酵剂的种类及添加量,发酵条件和贮藏时间等多种因素影响。如表2~表5所示,在5.5 h时各组发酵乳质构指标与弹性因子和黏度相一致,随着PC-01添加量的增加而下降。在贮藏期间,添加中、低剂量PC-01两组发酵乳与对照组质构变化趋势相一致,这3组发酵乳的硬度、稠度、内聚性和黏度指数在前14 d呈现上升趋势,在14 d后大幅度下降,且在贮藏14 d后3组之间无显著性差异,这也与潘潇[13]的研究结果相一致。而PC-01-H组与其他3组之间质构差异较大,PC-01-H组发酵乳在贮藏开始时各项质构指标显著低于其他各组,但在贮藏期间各质构指标变化幅度较小,保持在一个相对较为稳定的状态。 表2 贮藏期间发酵乳硬度的变化Table 2 Firmness of fermented milk during storage 表3 贮藏期间发酵乳稠度的变化Table 3 Consistency of fermented milk during storage 表5 贮藏期间发酵乳黏度指数的变化Table 5 Viscosity index of fermented milk during storage 为了更好的了解PC-01的添加及贮藏时间对发酵乳质构的综合影响,分别按样品分组和按时间分组对质构进行了进一步分析。 如图9所示,通过对商业化发酵剂直接发酵和添加PC-01发酵乳做主成分分析及聚类分析可以得到,4组发酵乳中,添加中、低剂量益生菌PC-01组发酵乳在质构上更为相近,PC-01-H组发酵乳在质构上与其他3组存在显著性差异。结果表明副干酪乳酪杆菌的添加会对发酵乳质构产生影响,且其对质构的影响程度与添加量有关。 a-主成分分析;b-聚类分析图9 根据分组对发酵乳质构进行主成分分析和聚类分析Fig.9 PCA analysis and clustering analysis of fermented milk texture based on group 将发酵乳样品按照发酵及贮藏时间分组,对4组发酵乳进行主成分分析及聚类分析。如图10所示,在质构方面,后熟后(1 d)的样品与贮藏7 d的样品质构更为相似;贮藏21 d和贮藏28 d样品相似。且前14 d的样品整体上更为相近,与贮藏21、28 d样品之间存在显著性差异。由此可见,贮藏时间对发酵乳的质构有着显著影响。 a-主成分分析;b-聚类分析图10 根据时间对发酵乳质构进行主成分分析和聚类分析Fig.10 PCA and clustering analysis of fermented milk texture based on storage time 副干酪乳酪杆菌因其多样的益生特性而被越来越多应用于功能性乳制品的制备中。当益生菌作为共发酵菌株用于乳制品的开发时,更重要的是考虑它们对产品质量、特性和消费者喜爱度的影响。本试验以副干酪乳酪杆菌PC-01为共发酵菌株,在先前的研究中发现,该菌株具有良好的消化液耐受性、单菌株发酵能力,同时在以5×106CFU/g的起始添加量与商业化发酵剂复配时拥有最优的感官特性。本试验研究了不同起始添加量的PC-01与商业化发酵剂复配对发酵乳理化特性、微观流变学特性和质构特性的影响。旨在更加综合、全面比较不同添加剂量对发酵乳产品特性的影响,确定该菌株在发酵乳中的最适添加剂量。 试验结果表明,添加不同剂量副干酪乳酪杆菌PC-01不会对发酵及贮藏期间发酵乳的pH及滴定酸度带来显著性影响,不会加剧产品的后酸化,且PC-01活菌数保持持续稳定增长。在发酵过程中,相较于YF-L904对照组,添加不同剂量PC-01的发酵乳开始凝乳时间略有提前,且随着PC-01的增加,发酵结束时产品的弹性因子呈现下降趋势。在贮藏期间,副干酪乳酪杆菌PC-01的添加有助于维持产品的黏度,各组发酵乳持水力均在一个稳定的范围内波动。在质构方面,除PC-01-H组外其他3组在贮藏期间质构变化趋势相一致,且在贮藏14 d后质构特性无显著性差异。 综上所述,副干酪乳酪杆菌PC-01在起始添加量为5×106CFU/g(PC-01-M)时,不仅可以提高产品感官。同时,能在不改变产品基本特征的情况下提高产品在贮藏期间的稳定性,并保持活菌数,适合复配于发酵乳中。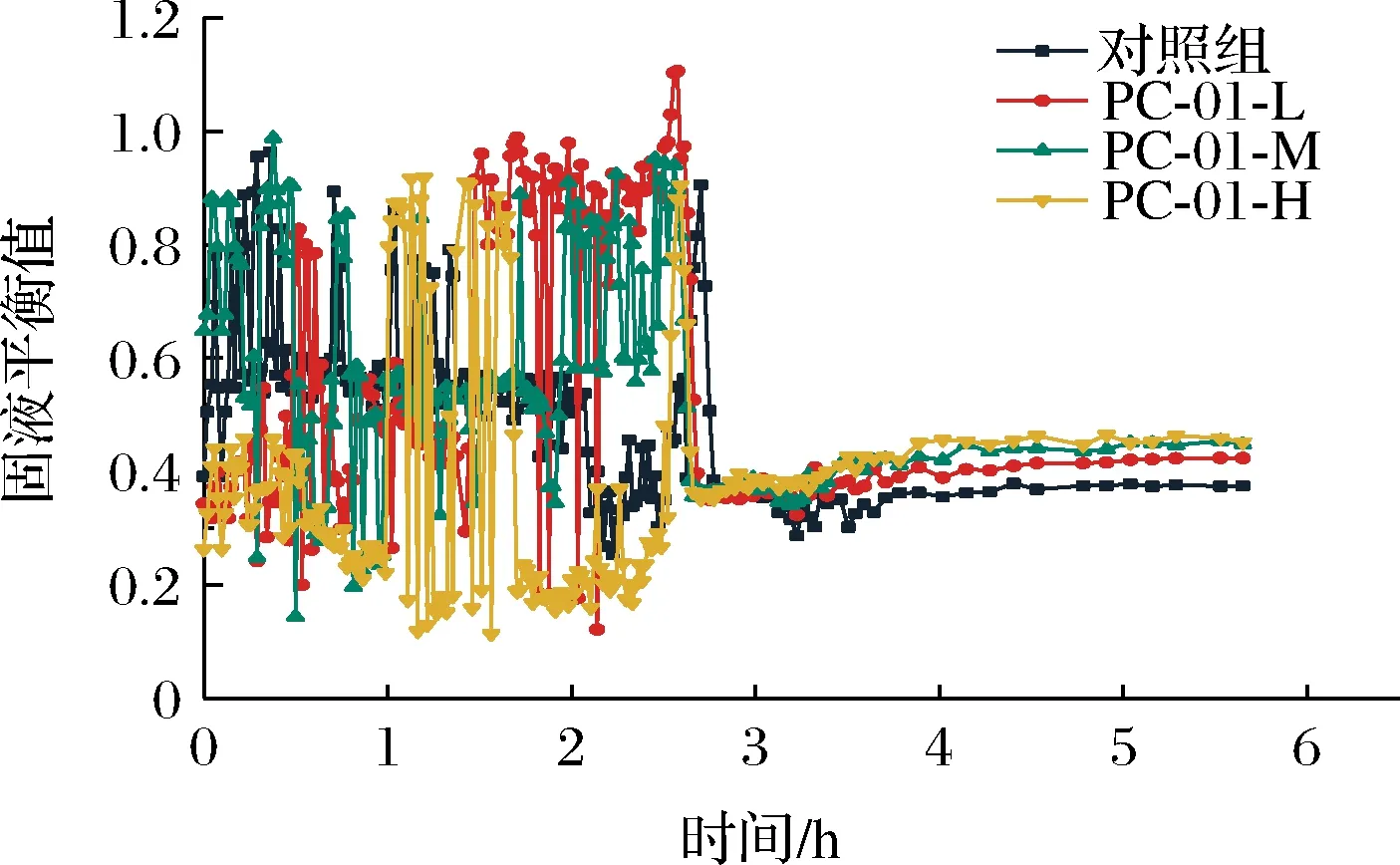
2.4 发酵乳黏度的变化
2.5 发酵乳持水性的变化

2.6 发酵乳持水性的变化



3 结论与讨论
