液相色谱串联质谱法测定肉制品中氯霉素
2023-10-08陈宁宁张志然
◎ 陈宁宁,张志然
(烟台市标准计量检验检测中心,山东 烟台 264003)
氯霉素是一种抑菌性广谱抗生素,对革兰氏阳性菌和革兰氏阴性菌均有较好的抑制作用,对立克次体、衣原体也有抑制作用[1]。因其高效廉价,曾在畜牧业中广为应用[2]。然而由于其对造血系统有严重的不良反应,且细菌对氯霉素有发展缓慢的耐药性,所以对其使用已经做出严格控制,国家全面禁止将氯霉素用于所有食品动物[3]。我国发布的《食品中可能违法添加的非食用物质和易滥用的食品添加剂品种名单(第五批)》(整顿办函〔2011〕1 号)中将氯霉素列为在肉制品中可能违法添加的非食用物质,在肉制品中不得检出。
肉制品中氯霉素的国家标准检测方法为GB/T 22338—2008,包括气相色谱-质谱法和液相色谱-质谱/质谱法[4]。两种方法的前处理均较为复杂,存在步骤烦琐、耗时长的问题。本文旨在通过简化、优化液相色谱串联质谱法的前处理过程,在满足检验需求的基础上提高检测效率,节约检测时间,减少试剂的使用。
1 材料与方法
1.1 材料与设备
样品:肉制品,市售。
氯霉素标准溶液、氯霉素-D5 标准溶液,浓度均为100 μg·mL-1,天津阿尔塔科技有限公司;实验用水为Millipore 制18.2 MΩ·cm 超纯水;乙腈、甲醇,均为色谱纯,德国默克股份两合公司;正己烷(色谱纯),天津市科密欧化学试剂有限公司。
LCMS-8050 液相色谱-质谱联用仪,配有电喷雾离子源,日本岛津公司;GM200 刀式研磨仪,德国Retsch(莱驰)公司;Vortex Point-2 迷你混合仪,上海力辰邦西仪器科技有限公司;KQ-500DB 数控超声波清洗器,昆山舒美超声仪器有限公司;HC-12A 自动氮吹浓缩仪,上海安谱科学仪器有限公司;TGL20MW 台式高速冷冻离心机,湖南赫西仪器装备有限公司。
1.2 仪器工作条件
(1)色谱条件。Hypersil GOLD 液相色谱柱(100 mm×2.1 mm×3 μm);流动相A 为水,流动相B 为乙腈。流动相梯度:0 ~1.5 min,乙腈由5%升到25%;1.5 ~2.5 min,乙腈由25%升到45%;2.5 ~3.0 min,乙腈由45%升到95%,保持1 min;4.0 ~4.5 min 乙腈由95%降到5%,保持1.5 min。流动相流速为0.4 mL·min-1,进样量5 μL,柱温40 ℃。
(2)质谱条件。LC-MS 接口为电喷雾接口(ESI)负离子模式,检测方式为多重反应监测(MRM)。以m/z321.00/152.10 和321.00/257.00 为目标物氯霉素的定性离子对,以m/z326.00/157.00 和326.00/262.00为内标物氯霉素-D5 的定性离子对,分别以m/z321.00/152.10 和m/z326.00/157.00 为氯霉素和氯霉素-D5 的定量离子对。雾化气和干燥气为氮气,雾化气流速为3.00 L·min-1,干燥气流速为5.00 L·min-1。脱溶剂管温度为250 ℃,加热温度为400 ℃。碰撞能量(CE)为-25.0 eV。
1.3 样品前处理
称取5 g 粉碎的肉制品于50 mL 具塞离心管中,加入100 ng·mL-1内标溶液100 μL 和10 mL 乙腈,在混合仪上涡旋振荡1 min,离心取上清液,再提取一次合并提取液于分液漏斗中。加入5 mL 乙腈饱和的正己烷,振荡5 min,静置分层,取上清液氮气吹干。用1 mL 甲醇/水(1+1,V/V)定容,涡旋振荡30 s,经0.45 μm 有机相滤膜过滤后,上机待测。
1.4 标准溶液配制
氯霉素标准中间液(100 ng·mL-1、10 ng·mL-1):氯霉素标准物质(100 μg·mL-1)用甲醇稀释得到;氯霉素-D5 标准中间液(100 ng·mL-1):氯霉素-D5 标准物质(100 μg·mL-1)用甲醇稀释得到。
氯霉素标准系列溶液:氯霉素标准中间液和氯霉素-D5 标准中间液用甲醇/水(1+1,V/V)稀释得到,其中氯霉素浓度分别为0.5 ng·mL-1、1.0 ng·mL-1、2.0 ng·mL-1、5.0 ng·mL-1、10.0 ng·mL-1; 内 标 氯 霉素-D5 的浓度为10.0 ng·mL-1。
2 结果与分析
2.1 前处理方法的选择
氯霉素液质法的样品前处理步骤一般包括提取、净化、浓缩、溶解。标准和相关文献中提取剂主要有乙腈[4-5]和乙酸乙酯[6-7]两种,本实验分别以乙腈和乙酸乙酯为提取剂进行对比实验,色谱图见图1。比较后发现以乙腈作为提取剂时基质干扰更少、响应值更高、灵敏度更好,最后选用乙腈为提取剂。净化步骤的目的是去除脂肪和其他干扰物质,一般使用有机溶剂萃取和固相萃取,使用固相萃取柱需要淋洗液和洗脱液,且步骤多、过程烦琐,因此本实验仅使用正己烷净化。
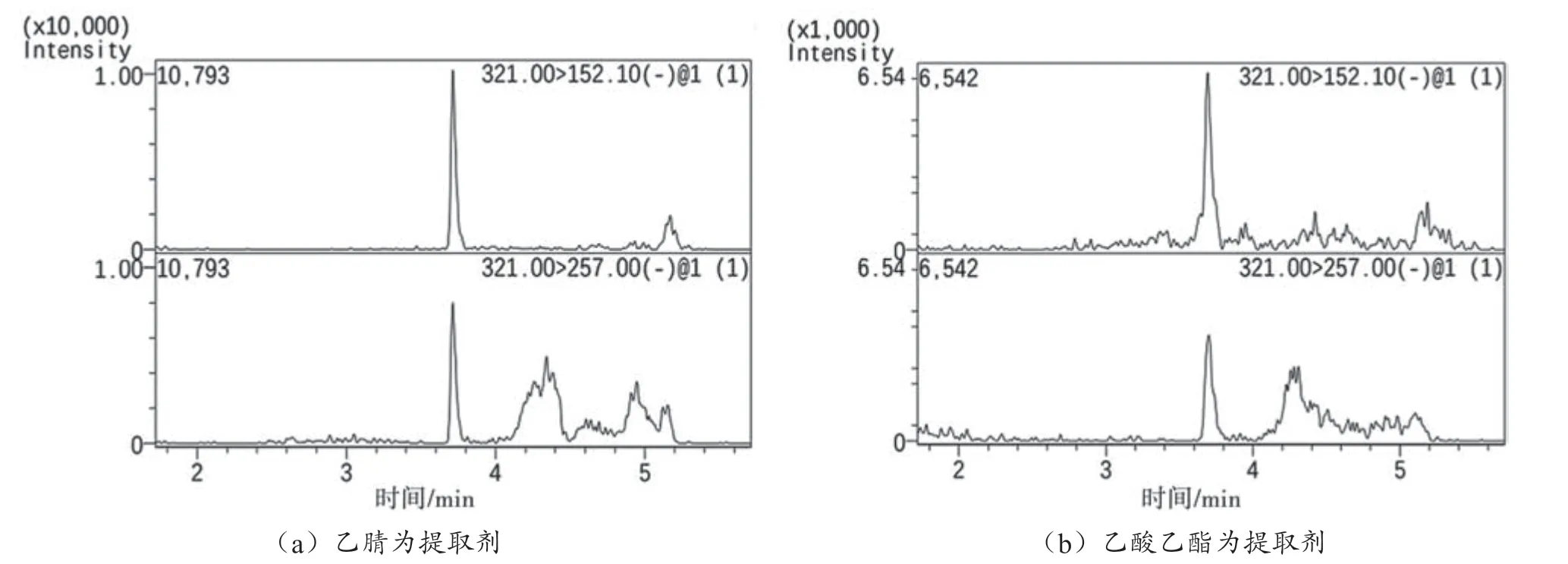
图1 不同提取剂下氯霉素加标0.2 μg·kg-1 样品色谱图
2.2 标准曲线绘制
按上述仪器工作条件测定氯霉素标准溶液系列,以目标物与内标物浓度比值为横坐标,目标物与内标物的峰面积比值为纵坐标,绘制标准曲线。回归方程为y=0.073 2x+0.004 6,相关系数r2=0.999 8,氯霉素浓度在0.5 ~10.0 ng·mL-1的线性关系良好。
2.3 检出限和定量限
通过空白样品加标获得方法的检出限和定量限,加标浓度为0.1 μg·kg-1时信噪比平均值为12,逐步降低加标浓度,信噪比(RSD)约等于10 时得出氯霉素的定量限为0.08 μg·kg-1,信噪比(RSD)约等于3 时得出氯霉素的检出限为0.03 μg·kg-1。
2.4 精密度和加标回收实验
取空白样品进行不同水平加标回收实验,每个加标水平进行6 次平行实验,结果如表1 所示。由表1可知,氯霉素的加标回收率在90%~95%,RSD 为3.9%~9.4%,符合实验室质量控制规范要求。
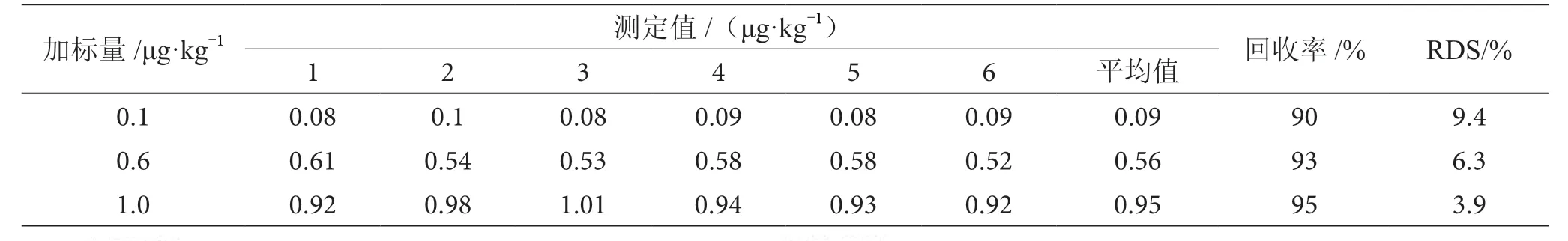
表1 精密度和加标回收实验结果表(n=6)
2.5 加标样品检测谱图
氯霉素加标0.6 μg·kg-1样品色谱图见图2。由图2可知,氯霉素和氯霉素-D5 出峰明显,峰形较好,与杂峰分离良好,没有明显干扰,且分析时间短。说明本方法在样品检测时可以实现良好的分离分析。

图2 加标0.6 μg·kg-1 样品的色谱图
3 结论
本文通过优化前处理过程,实现了肉制品中氯霉素的简单、快速、准确的检测。该方法不仅降低了检测成本,提高了检测效率,同时方法的检出限和回收率均能满足肉制品中氯霉素的分析要求。
