荆条种子无菌萌发过程中污染菌的分离鉴定及抑菌剂筛选
2023-10-04李宇霞王霞张敏邱悦张袁菲梁慧梁丽琴陈惠
李宇霞 王霞 张敏 邱悦 张袁菲 梁慧 梁丽琴 陈惠


摘要:荆条具有生态、观赏、药用及实用等方面的价值,但在荆条快速繁殖体系的建立中发现,种子在无菌萌发过程中污染率极高,达50%~75%。为降低荆条种子无菌萌发过程中的污染率,试验通过鉴定其主要污染菌株,筛选出有效抑菌剂,并利用组织分离法对污染菌进行分离和纯化;同时,通过光学显微镜和扫描电镜对污染菌的分生孢子进行细胞学观察,然后采用真菌rDNA 基因的ITS 序列通用引物进行分子生物学鉴定,最后选择百菌清、代森锰锌、多菌灵、氟吗锰锌4 种杀菌剂添加到PDA 培养基中进行抑菌效果分析。结果表明,主要污染菌为种子表面附着的真菌,菌落呈绒状黄绿色同心圆形,菌丝为有隔褐色分支状菌,分生孢子为橄榄棕色、有隔、梭型;细胞学和分子生物学鉴定表明,该污染菌为链格孢菌。抑菌研究结果发现,60% 氟吗锰锌对链铬孢菌的抑制效果最佳,菌落直径最小。将60% 氟吗锰锌稀释1 400 倍添加到荆条种子无菌萌发培养基(水琼脂培养基)中,污染率明显下降到5.5%。荆条种子无菌萌发中主要污染菌为链格孢菌,60% 氟吗锰锌对其抑制效果最佳。
关键词:荆条种子;无菌萌发;污染真菌;链格孢菌;氟吗锰锌
中图分类号:S793.7 文献标识码:A 文章编号:1002?2481(2023)03?0249?08
荆条(Vitex negundo L. var. heterophylla(Franch.)Rehd)为马鞭草科牡荆亚科的落叶灌木或小乔木,是黄荆的一个变种。荆条在我国分布较广,从北到南的13 个省份均有分布,如辽宁、甘肃、山西、安徽、贵州等;日本也有分布[1]。荆条常生长于山坡路旁,植株比较抗旱、耐寒,在恶劣的环境下也能生长。由于荆条的根能够分泌出将坚固的岩石腐蚀分解成土壤的一种植物酸,因此,可作为水土保持的优势树种,在山西可作为废弃煤矿矿区植被恢复的优选树种,具有一定的生态价值。荆条还可以制作盆景,荆条的幼枝被用来编篮筐,枝叶用来驱蚊。
荆条花芳香味浓,是优良的蜜源植物,荆条蜜含有益菌、活性酶、有机酸等,具有润肠通便、促进胃肠蠕动助消化等功能。荆条是重要的中草药,其根、茎、叶、果实均可入药,鲜叶治疗风寒感冒、急性胃肠炎等。其提取物在消炎[2]、镇痛[3]、治疗关节炎[4]、癌症[5]以及妇科疾病[6]等方面有疗效;还可用作抗氧化剂[7]、抗真菌剂[8]、驱虫剂[9],并具有抗病毒等作用[10],基于荆条广泛的生物学作用,研究人员对荆条的研究越来越广泛和深入。
目前,荆条主要依靠播种和移苗繁殖。对于荆条种子的萌发研究,大都采用种子浸种萌发法[11-13]。
关于荆条的组织培养研究,国内外尚属空白。由于落叶灌木自然繁殖率低,众多研究者关注于其种子萌发的研究,如郭丽等[14]研究了不同消毒程序对野生薄皮木种子萌发的影响。关于荆条种子的无菌萌发还未见报道。前期研究发现,荆条种子经常规消毒后,极易受到一种黄绿色真菌的污染,且污染率很高,致使荆条组织培养严重受阻。要进行荆条的组织培养,第一步是无菌材料的建立,而荆条种子试管中无菌萌发是获得无菌材料的有效途径。
本研究首先比较了不同消毒程序的消毒效果,并对该污染真菌进行分离、纯化与细胞学观察及分子生物鉴定,以确定污染菌的种类,并将百菌清、代森锰锌、多菌灵、氟吗锰锌等抑菌剂添加到PDA 平板上观察它们对污染真菌的抑制效果,最后挑选最佳的抑菌剂加进荆条种子萌发培养基中,观察其抑菌效果,旨在为荆条快速繁殖体系的建立打下良好的基础。
1材料和方法
1.1 试验材料
荆条种子于2017 年9、12 月采摘自山西省临汾市尧都区野生荆条树上。将种子在簸萁中反复揉搓,簸去宿存的花萼等杂物后,装入塑料瓶,于4 ℃存储。荆条种子千粒质量为5.845 0 g,种子长径与短径分别为3.000、2.563 mm。
1.2 培养基及试剂
真菌培养基为PDA 培养基,無菌种子萌发的培养基为MS(Murashige and skoog)培养基(无糖,琼脂8 g/L,pH 值5.8)。
真菌菌丝DNA 提取试剂为CTAB 改良液[15];供试药剂为75% 百菌清可湿性粉剂(利民化工股份有限公司)、80% 多菌灵可湿性粉剂(江苏速达农化科技有限公司)、80% 代森锰锌可湿性粉剂(北京中卫生物科技有限公司)、60% 氟吗锰锌可湿性粉剂(德国拜客(西安)作物保护股份有限公司)。
1.3 试验方法
1.3.1 荆条种子3 种消毒程序消毒效果的比较 将去皮去杂后的荆条种子分别用3 种程序进行消毒处理。
70% 乙醇消毒5 min→0.1% 升汞(吐温-20,4~5 滴/L)消毒10 min→ 无菌水冲洗3~5 次;0.25%(m/V)洗衣粉(奇强牌无磷洗衣粉)水浸泡5 min→自来水冲洗7 min →70% 乙醇消毒5 min→0.1% 升汞(吐温-20,4~5 滴/L)消毒10 min→无菌水冲洗3~5 次;0.25%(m/V)洗衣粉水浸泡5 min→自来水冲洗7 min→70% 乙醇消毒5 min→10% 的次氯酸钠分别消毒10、20、30 min→无菌水冲洗3~5 次。
1.3.2 荆条种子附着菌的分离培养与光学显微镜观察 将消毒处理后的荆条种子接种于含MS 培养基的100 mL 三角瓶中培养,每瓶接种15 粒,3 个重复,培养条件:25 ℃,光周期12 h/12 h(光照/黑暗)。7~10 d 后培养基上出现黄绿色的菌落,用接种针挑取边缘菌丝于PDA 培养基中,进行纯化培养,培养条件同上。7 d 时观察菌落、菌丝及孢子的形态、大小、颜色,并摄片(光学显微镜OLYMPUSB5X1型)。
1.3.3 荆条种子附着菌的分子生物学鉴定与进化发育树的构建1.3.3.1 菌丝DNA 的提取 在超净工作台中,用无菌接种针刮取约300 mg 菌丝,置于1.5 mL 无菌EP 管中,将EP 管放置在冰上,菌丝材料用塑料研磨杵快速捣碎至匀浆。采取改良的CTAB 法提取真菌基因组DNA[15]。
1.3.3.2 PCR 扩增 采用真菌rDNA 基因ITS(InternalTranscribed Spacer)序列的通用引物ITS1(5?-TCCGTAGGTGAACCTGCGG-3)? 和ITS2(5?-GCTGCGTTCTTCATCGATGC-3?)(北京奧科鼎盛生物技术有限公司合成)进行PCR 扩增。
PCR 反应体系(25 μL):Taq DNA polymerase0.5 μL(合肥博美生物科技有限公司);10×PCRbuffer 2.5 μL;dNTP mix(2.5 mmol/L) 2.0 μL(天根生物科技有限公司);ITS1(10 μmol/L)与ITS2(10 μmol/L)各1 μL;DNA 模板1~10 ng,补充ddH2O 至25 μL。
PCR 扩增程序:94 ℃ 预变性5 min;94 ℃ 变性30 s,54 ℃ 退火45 s,72 ℃ 延伸1 min,30 次循环;72 ℃延伸5 min。
1.3.3.3 测序及序列比对与分子鉴定及系统发育树的构建 将有目标条带的PCR 产物纯化,送北京天一辉远生物科技有限公司测序。测序后的序列经过人工校正后在NCBI 网站(http://www.ncbi.nlm.nih.gov/)进行BLAST 比对,寻找与其同源序列相似度达99% 的已知真菌的相关序列12 条,以鉴定污染真菌的分类地位。利用MEGA 7.0 软件进行多序列比对,然后采用最大简约法(Maximumparsimony,MP)构建系统发育树,以自检法(bootstrap)进行检测,共循环2 000 次,对污染荆条种子无菌萌发的真菌进行鉴定。
1.3.4 种子表面附着菌的洗脱液与干种子扫描电镜的观察 将荆条种子约150 粒放入20 mL 蒸馏水中,加入1 滴吐温-20,搅拌后,取1 滴溶液滴在干净的载玻片上,盖上盖玻片,镜检。同时,将干种子喷金后在扫描电镜(JSM-7500F 型日本电子株式会社(JEOL))下观察。
1.3.5 抑菌剂对链铬孢菌抑制效应的比较 将马铃薯洗净去皮,再称取200 g 马铃薯切成小块,加水煮烂,用2 层纱布过滤,加热,加15 g 琼脂,继续加热搅拌混匀,待琼脂溶解完后,加入20 g 蔗糖,搅拌均匀,稍冷却后再补足水分至1 000 mL,高压蒸汽灭菌20 min。将抑菌剂加入培养基中使其最终稀释倍数分别为:80% 代森锰锌700、800、900 倍;75%百菌清600、700、800 倍;80% 多菌灵800、1 200、1 600 倍;60% 氟吗锰锌1 200、1 400、1 600 倍,然后倒平板,待其冷却后挑取单一菌落边缘菌丝少许接菌,25~28 ℃培养7 d 后观察,利用十字交叉法测定菌落直径大小,求出各抑菌剂同一浓度下的菌落直径的平均值,并将抑菌剂处理的平均菌落直径和空白对照组对比,计算4 种抑菌剂的系列浓度对菌丝体的生长抑制率即抑菌率。
抑菌率=((对照菌落直径-原菌丝块直径)-(处理菌落直径- 原菌丝块直径))/(对照菌落直径-原菌丝块直径)×100% (1)
1.3.6 培养基中添加抑菌剂对荆条种子污染率的影响 采用第3 种消毒程序消毒后将种子接种于含稀释1 400 倍和1 600 倍的氟吗锰锌于1/2 MS 无糖培养基和水琼脂培养基上,置于(25±2)℃温室,光周期为12 h/12 h(光照/黑暗),相对湿度为60%的条件下培养,每瓶接种4 粒,5 个重复,7~8 d 后观察生长情况,计算污染率和种子萌发率。
1.4 数据分析
试验数据采用Excel 2013 和SPSS 26.0 软件进行统计与分析。
2结果与分析
2.1 荆条种子最佳消毒方法的选择
为了确保荆条种子的无菌培养,采用3 种消毒程序对荆条种子(图1-A)进行消毒处理,并接种到MS 培养基上培养,结果显示(表1),10% 次氯酸钠消毒剂处理程序3 随着消毒时间的延长(10~30 min),污染率由75.00% 下降到了58.69%,但不如相应地0.1% 升汞处理程序2;在0.1% 升汞消毒之前增加洗衣粉漂洗程序,可以显著降低污染率,洗衣粉漂洗后水呈现黄绿色(图2),说明种子表面的真菌孢子被洗脱了下来。总之,第2 种消毒程序最佳。
采用第1 种消毒程序对荆条种子消毒处理后,将种子接种培养7 d 后,发现锥形瓶内长出多个黄绿色菌落,菌落之间重叠严重,但采用第2 种消毒程序后,菌落数明显减少,一个锥形瓶只长出2~3 个污染菌的菌落,且该菌落也呈黄绿色,质地均匀绒状(图1-B)。
2.2 荆条种子无菌萌发过程中污染真菌的进一步分离纯化培养与细胞学观察
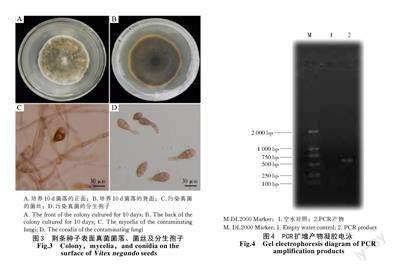
荆条种子表面真菌菌落、菌丝及分生孢子如图3 所示。
挑取2.1 中图1-B 荆条种子表面长出的黄绿色真菌菌落边缘的菌丝,经PDA 平板纯化培养,10 d后菌落直径长到6.3 cm×6.1 cm,菌落正面的颜色仍为黄绿色(图3-A),反面为黑灰色(图3-B)。菌落边缘平整,质地绒状。该菌的菌丝在光学显微镜下观察为有隔菌丝,褐色,菌丝直径为7~8 μm(图3-C),分生孢子呈橄榄棕色,有隔梭型,大小为35~40 μm×15~20 μm(图3-D)。
2.3 荆条种子附着菌的分子生物学鉴定
2.3.1 荆条种子附着菌DNA 的PCR 扩增 利用通用引物ITS1 和ITS2 序列扩增污染真菌rDNAITS 序列,产物经1% 琼脂糖凝胶电泳分析,凝胶成像结果显示,菌株ITS 序列的PCR 产物长约650 bp,条带清晰(图4)。
2.3.2 菌株ITS 的序列分析及系统发育树的构建 将2.3.1 中PCR 产物送至北京天一辉远生物科技有限公司测序,序列利用DNAMAN 软件进行人工校正比对后,递交NCBI 网站GenBank 数据库(http://www. ncbi. nlm. nih. gov/),登录号为MK229186,经BLAST 序列比对,选取相似度为99% 的序列12 条,并以同科即孢腔菌科(Pleosporaceae)不同属的枯叶格孢腔菌(Pleospora herbarum)作为外群构建系统进化树,结果表明(图5),本试验菌MK229186 与Alternaria alternata 最邻近,从而确定荆条种子无菌萌发过程中污染的真菌为半知菌纲链格孢属的链格孢菌(Alternaria alternata)。
2.4 荆条种子洗脱液及干种子扫描电镜观察
在光学显微镜下,观察荆条种子吐温-20 洗脱液,发现每滴洗脱液中有若干个手雷状的分生孢子,其形态与分离纯化的污染菌的分生孢子(图3-D)一致。扫描电镜下观察到干种子表面有梭形的分生孢子和分支状的菌丝(图6),再此证明链格孢菌确实是荆条种子表面的附着菌。
2.5 4 种抑菌剂对链铬孢菌的毒力测定结果
应用Excel 软件,将抑菌剂质量浓度转换成以10 为底的对数x,查抑菌率与概率值换算表,将抑菌率转换为抑菌概率值y。根据抑菌剂质量浓度x和抑菌概率值y,应用SPSS 软件,分析得出4 种抑菌剂的毒力回归方程y=ax+b,以及相关系数和抑菌剂有效抑制中浓度(EC50)[16],结果如表2 所示。
由表2 可知,4 种抑菌剂对荆条种子宿生菌链格孢菌的生长都具有一定的抑制作用,但抑菌效果有较明显的差异,药效各不相同。4 种抑菌剂的毒力效果具有明显差异,由强到弱排序依次为60%氟吗锰锌>80% 多菌灵>80% 代森锰锌>75% 百菌清,因此,初步筛选60% 氟吗锰锌为有效防控荆条种子宿生菌链格孢菌污染的最佳药剂。
2.6 培养基中添加抑菌剂对荆条种子污染率及萌发率的影响
为了进一步降低荆条种子萌发过程中的污染率和提高萌发率,试验将水引发2 d 回干1 d 的荆条种子经最佳消毒程序消毒后分别接种于含有稀释1 600 倍和1 400 倍氟吗锰锌的1/2 MS 无糖培养基和水琼脂培养基中,温度为(25±2)℃ ,光周期12 h/12 h 下培养,7 d 后统计污染率以及萌发率,结果如图7 所示。由图7 和表3 可知,对照组污染严重,培养基上种子周围有发黑的菌落,水琼脂培养基菌落颜色比1/2 MS 无糖培养基上的浅,污染率也低,添加氟吗锰锌的2 种培养基不仅表现为污染率显著降低,而且观察到种子萌发。表明添加氟吗锰锌不仅可以显著降低污染率,而且显著促进种子萌发,其中,添加60% 氟吗锰锌可湿性粉剂稀释1 400 倍在水琼脂培养基上的种子污染率能降低到5.5%。
3结论与讨论
3.1 洗衣粉水浸泡对荆条种子无菌萌发的影响
为了在试管中进行荊条种子的无菌萌发获得无菌苗,本研究采用了3 种外植体消毒程序,结果表明,第2 种消毒程序效果最佳,关键步骤是荆条种子消毒前先用0.25% 洗衣粉水浸泡5 min,然后流水冲洗7 min,接着用70% 乙醇浸泡5 min,0.1%升汞(吐温-20,4~5 滴/L)浸泡10 min,无菌水冲洗3~5 次进行消毒。结果表明,真菌污染率由75.57%下降到了47.14%。其原因可能是由于增加了0.25%洗衣粉水浸泡时间和流水冲洗的时间,洗衣粉中的去污剂有效成分SDS,能将包裹在荆条种子表面的霉菌孢子清除一大部分,有效降低培养过程中的真菌污染率。延长洗衣粉水处理时间可能效果会更佳,还有待进一步改进。此外,在试验中还发现,污染率与取材的时间和地点也有一定关系,如12 月取材比9 月采集的污染率高,这可能是荆条种子在树上多挂2~3 个月,期间雨淋次数增加,导致真菌孢子载量增加。此外,从山坳处生长的荆条树上采集的种子比开阔地带生长的荆条树上采集的种子污染率高,可能是由于山坳处的潮湿环境有利于霉菌的繁殖使荆条种子表面载有的真菌孢子量大的缘故。
3.2 链格孢菌对荆条种子无菌萌发及其他植物的影响
为了探明引起荆条种子无菌萌发污染的真菌种类,本研究挑取了荆条种子周围的黄绿色真菌菌丝对其进行了分离纯化培养,并提取其菌丝DNA,采用真菌rDNA 序列及ITS 序列的特异引物ITS1与ITS2,对其进行了PCR 扩增,产物经公司测序后,在NCBI 网站经同源序列比对并构建了该菌的系统发育树。经分子生物学鉴定和光学显微镜下的细胞形态学观察,确定了荆条种子表面附着菌为链格孢菌。同时,本研究将荆条种子用吐温-20 洗脱液置于光学显微镜下观察,以及扫描电镜下对干种子表面进行观察,结果表明,引起荆条种子无菌萌发极难去除的污染菌为链格孢菌。
链格孢菌通常是植物常见的致病菌,可引起多种农作物产生轮斑病、黑斑病、褐斑病等[17-20]。在组织培养过程中常见的污染菌分为2 类,一类为细菌,主要为芽孢杆菌属和假单胞菌属;另一类为真菌,有芽枝霉(Cladosporium spp.)、黑曲霉(Aspergillus niger)、青霉(Penicillum spp)和酵母等[21]。荆条种子无菌萌发中发现的链格孢菌在其他物种组培污染菌中还鲜有报道。
3.3 60% 氟吗锰锌对链格孢菌的抑制作用
为了进一步控制荆条种子无菌萌发过程中的污染,本研究进行了平板抑菌试验,结果表明,60%氟吗锰锌、75% 百菌清、80% 多菌灵、80% 代森锰锌分别稀释不同的倍数,对链格孢菌菌丝均有抑制效果,最高抑菌率分别为100%、82.88%、82.19%和47.95%。4 种抑菌剂中75% 百菌清抑菌效果最差,抑菌率在41.10%~47.95%;高树广等[22]测定了5 种杀菌剂对芝麻链格孢菌的抑制效果,张晓翔等[23]测定了8 种杀菌剂对牡丹花链格孢菌的毒力,结果均表明,百菌清对链格孢菌的抑制效果最差,与本研究所得结果相一致。75% 多菌灵较好,抑菌率在58.90%~82.88%,80% 代森锰锌抑菌率在60.96%~82.19%,抑菌效果较好。且75% 多菌灵和80% 代森锰锌的EC50大于80% 多菌灵的致死中浓度EC50,毒力较强,但蔺经等[24]、王春明等[25]的研究结果表明,链格孢菌对多菌灵的敏感性更低,与本研究结果相反,推测可能是因为链格孢菌的生理小种之间寄主不同,药剂的生产公司不同,测定结果出现差异。氟吗锰锌可湿性粉剂是氟吗啉与代森锰锌的复合制剂。已有研究表明,氟吗锰锌对葡萄、马铃薯和番茄上的卵菌纲,尤其是霜霉科和疫霉属菌有杀菌效力。水琼脂培养基上的荆条种子周围污染菌落颜色比1/2 MS 培养基上的菌落颜色浅,可能是1/2 MS 培养基中的无机营养有利于真菌的菌丝生长。本研究结果表明,60% 氟吗锰锌稀释1 400~1 600 倍对链铬孢菌的抑菌率为100%,且有利于荆条种子的试管萌发获得无菌苗。
综上所述,在分离、纯化荆条种子污染菌的基础上,经细胞学、分子生物学鉴定污染菌为链格孢属的一种真菌,通过抑菌试验筛选出最佳抑菌剂为培养基中添加60% 氟吗锰锌稀释倍数为1 400~1 600 倍,可有效降低荆条种子的污染率,并获得无菌试管苗,为荆条的无性快速繁殖体系的建立打下良好基础。
参考文献:
[1] 中国科学院中国植物志编辑委员会. 中国植物志:第四十二
卷,第一分册[M]. 北京:科学出版社,1993:145-146.
Editorial Committee of Chinese Flora,Chinese Academy of Sciences.
Flora of China[M]. Beijing:Science Press,1993:145-146.
[2] XU J M,HU B C,YUAN L,et al. Labdanes and megastigmanes
from Vitex negundo var. heterophylla[J]. Fitoterapia,
2019,137:104265.
[3] DHARMASIRI M G,JAYAKODY J C,GALHENA G,et al.
Anti-inflammatory and analgesic activities of mature fresh leaves
of Vitex negundo[J]. Journal of Ethnopharmacology,2003,87
(2/3):199-206.
[4] JING R,BAN Y,XU W,et al. Therapeutic effects of the total
lignans from Vitex negundo seeds on collagen-induced arthritis
in rats[J]. Phytomedicine,2019,58:152825.
[5] AWALE S,LINN T Z,LI F,et al. Identification of chrysoplenetin
from Vitex negundo as a potential cytotoxic agent against
PANC-1 and a panel of 39 human cancer cell lines(JFCR-39)
[J]. Phytotherapy Research,2011,25(12):1770-1775.
[6] VISHWANATHAN A S,BASAVARAJU R. A review on Vi?
tex negundo L.:a medicinally important plant[J]. Environmental
Science,2010,3(1):30-42.
[7] KULKARNI R R,VIRKAR A D,D?MELLO P. Antioxidant
and antiinflammatory activity of Vitex negundo[J]. Indian Journal
of Pharmaceutical Sciences,2008,70(6):838-840.
[8] SATHIAMOORTHY B,GUPTA P,KUMAR M,et al. New
antifungal flavonoid glycoside from Vitex negundo[J]. Bioorganic
& Medicinal Chemistry Letters,2007,17(1):239-242.
[9] KARUNAMOORTHI K,RAMANUJAM S,RATHINASAM
Y R. Evaluation of leaf extracts of Vitex negundo L.(Family:
Verbenaceae) against larvae of Culex tritaeniorhynchus and repellent
activity on adult vector mosquitoes[J]. Parasitology Research,
2008,103(3):545-550.
[10] SUNDARAM R,NARESH R,SHANTHI P,et al. Antihyperglycemic
effect of iridoid glucoside,isolated from the leaves
of Vitex negundo in streptozotocin-induced diabetic rats with
special reference to glycoprotein components[J]. Phytomedicine,
2012,19(3/4):211-216.
[11] 邱悦,李依蓉,张敏,等. 野生荆条种子休眠原因及两个采摘
时期萌发条件的探究[J]. 植物学研究,2019(5):416-423.
QIU Y,LI Y R,ZHANG M,et al. Study on the reasons of dormancy
of wild Vitex negundo var. heterophylla seeds and the
germination conditions of two picking periods[J]. Botanical Research,
2019(5):416-423.
[12] 李义强,宋桂龙,郭宇. 水浸与赤霉素处理对荆条种子萌发影
响研究[J]. 种子,2012,31(3):10-13.
LI Y Q,SONG G L,GUO Y. Study on effect of water immersion
and gibberellin treatments on seed germination of Vitex ne?
gundo var. heterophylla[J]. Seed,2012,31(3):10-13.
[13] 张宁,张壮,张玮康,等. 浓硫酸浸种对荆条种子发芽率的影
响[J]. 现代农业科技,2018(12):143-146.
ZHANG N,ZHANG Z,ZHANG W K,et al. Effects of soaking
seeds with concentrated sulfuric acid on seed germination
rate of vitex[J]. Modern Agricultural Science and Technology,
2018(12):143-146.
[14] 郭麗,索素敏,徐明辉. 组织培养中不同消毒处理对野生薄皮
木种子萌发的影响[J]. 分子植物育种,2022,20(4):1325-1330.
GUO L,SUO S M,XU M H. Effects of different disinfection
treatments on seed germination of wild Leptodermis oblonga
bge. in tissue culture[J]. Molecular Plant Breeding,2022,20
(4):1325-1330.
[15] 李焕宇,付婷婷,张云,等. 5 种方法提取真菌基因组DNA 作
为PCR 模板效果的比较[J]. 中国农学通报,2017,33(16):
28-35.
LI H Y,FU T T,ZHANG Y,et al. Effect comparison of five
methods to extract fungal genomic DNA as PCR templates[J].
Chinese Agricultural Science Bulletin,2017,33(16):28-35.
[16] 冯连荣,彭儒胜,周宏民,等. 杨树上一株链格孢菌的分离、鉴
定及室内防治药剂筛选[J]. 西部林业科学,2018,47(6):
106-111.
FENG L R,PENG R S,ZHOU H M,et al. Isolation and identification
of a strain of Alternaria alternata on Populus Russki
and screening of fungicides[J]. Journal of West China Forestry
Science,2018,47(6):106-111.
[17] DENG J X,LI M J,PAUL N C,et al. Alternaria brassicifolii
sp. nov. isolated from Brassica rapa subsp. pekinensis in Korea
[J]. Mycobiology,2018,46(2):172-176.
[18] DENG J X,CHO H S,PAUL N C,et al. A novel Alternaria
species isolated from Peucedanum japonicum in Korea[J]. Mycobiology,
2014,42(1):12-16.
[19] 常缨,王义权,强胜. 链格孢菌菌株致病性及其遗传差异性
[J]. 应用与环境生物学报,2005,11(4):486-489.
CHANG Y,WANG Y Q,QIANG S. Pathogenicity and genetic
diversity of Alternaria alternata strains[J]. Chinese Journal of
Applied and Environmental Biology,2005,11(4):486-489.
[20] 崔迪,王继华,陈捷,等. 链格孢属真菌对农作物的危害[J]. 哈
尔滨师范大学自然科学学报,2005,21(4):87-91.
CUI D,WANG J H,CHEN J,et al. The danger of alternaria
to the crops[J]. Natural Science Journal of Harbin Normal University,
2005,21(4):87-91.
[21] 方丽,王连平,茹水江,等. 植物组培过程中污染微生物种类
及其季节性的变化[J]. 浙江农业学报,2013,25(2):284-287.
FANG L,WANG L P,RU S J,et al. Varieties and seasonal
characters of pollution microflora in plant tissue culture[J].
Acta Agriculturae Zhejiangensis,2013,25(2):284-287.
[22] 高树广,徐博涵,李伟峰,等. 杀菌剂对芝麻链格孢的毒力测
定[J]. 农业科技通讯,2016(6):162-164.
GAO S G,XU B H,LI W F,et al. Toxicity determination of
fungicides to Alternaria sesame[J]. Bulletin of Agricultural Science
and Technology,2016(6):162-164.
[23] 张晓翔,刘微,范文忠. 不同药剂对牡丹花链格孢菌叶斑病病
菌的室内毒力[J]. 安徽农业科学,2013,41(12):5286,5301.
ZHANG X X,LIU W,FAN W Z. Laboratory toxicity of different
fungicides against Paeonia suffruticosa Alternaria leaf spot
[J]. Journal of Anhui Agricultural Sciences,2013,41(12):
5286,5301.
[24] 藺经,杨青松,李晓刚,等. 嘧霉胺对梨黑斑病菌(Alternaria
alternata)的毒力及其药效评价[J]. 植物保护,2009,35(4):
162-163,167.
LIN J,YANG Q S,LI X G,et al. Evaluation of the fungitoxicity
of pyrimethanil against Alternaria alternata on pears[J].
Plant Protection,2009,35(4):162-163,167.
[25] 王春明,韩青梅,黄丽丽,等. 3 种杀菌剂对小麦黑胚病菌的毒
力测定及病害防治作用[J]. 西北农林科技大学学报(自然科
学版),2006,34(7):55-60.
WANG C M,HAN Q M,HUANG L L,et al. Control of 3
fungicides against wheat black point in vitro and in vivo[J].
Journal of Northwest Sci-Tech University of Agriculture and
Forestry(Natural Science Edition),2006,34(7):55-60.
