实体瘤伴冷凝集现象两例并文献复习
2023-09-30解鸿翔潘茹会周斐斐王素梅陈素峰曹文静金嘉俊
解鸿翔 潘茹会 周斐斐 王素梅 陈素峰 曹文静 金嘉俊

摘要:冷凝集素是一种针对红细胞表面糖类抗原I或i的自身抗体,以IgM κ型为主,在体温降低时可引起红细胞凝集。它通常与感染、藥物反应、自身免疫性疾病和血液系统恶性肿瘤有关,在实体瘤中的报道罕见。本文报告2例实体瘤患者外周血出现的冷凝集现象。患者入院时血常规检测均显示红细胞计数和红细胞压积明显降低,红细胞计数和血红蛋白浓度不匹配,平均血红蛋白含量和平均血红蛋白浓度异常升高,血涂片显微镜检查显示红细胞聚集。标本在37 ℃孵育后,观察到冷凝集的可逆性,红细胞及其参数得到纠正。
关键词:实体瘤;乳腺癌;卵巢癌;冷凝集素
中图分类号: R555文献标志码: B文章编号:1000-503X(2023)04-0689-06
DOI:10.3881/j.issn.1000-503X.15320
Solid Tumors With Cold Agglutinins:Report of Two Cases and Literature Review
XIE Hongxiang1,2,PAN Ruhui3,ZHOU Feifei1,WANG Sumei1,
CHEN Sufeng1,CAO Wenjing2,JIN Jiajun4
1Laboratory Medicine Center,Department of Clinical Laboratory,Zhejiang Provincial Peoples Hospital
(Affiliated Peoples Hospital),Hangzhou Medical College,Hangzhou 310014,China
2Department of Clinical Laboratory Medicine,The First Affiliated Hospital of Shandong First Medical University &
Shandong Provincial Qianfoshan Hospital,Jinan 250013,China
3Department of Clinical Laboratory,Pingdu Peoples Hospital,Qingdao,Shandong 266700,China
4Department of Clinical Laboratory,Quzhou Hospital of Traditional Chinese Medicine,Quzhou,Zhejiang 324002,China
Corresponding authors:CAO Wenjing Tel:0571-85893268,E-mail:6073@sdhospital.com.cn;
JIN Jiajun Tel:0570-3086155,E-mail:jjj593656507@163.com
ABSTRACT:Cold agglutinins(CA),autoantibodies against the antigen I or i on the surface of red blood cells,are mainly of IgM class,and the majority have κ light chains.They can lead to red blood cell agglutination at decreased body temperature and are usually associated with infections,drug reactions,autoimmune diseases,and hematological malignancies.However,solid tumors with CA are rare.We reported two cases of CA in the peripheral blood of patients with solid tumors.Peripheral complete blood cell count of the patients at admission showed reduced erythrocyte count and hematocrit,mismatching between erythrocyte count and hemoglobin,abnormally elevated levels of mean corpuscular hemoglobin and mean cell hemoglobin concentration.Peripheral blood smear showed erythrocyte aggregation.After the sample was preheated at 37 ℃ for 30 min,the reversibility of red blood cell aggregation was observed,and the erythrocyte parameters were corrected.
Key words:solid tumors;breast cancer;ovarian cancer;cold agglutinins
Acta Acad Med Sin,2023,45(4):689-694
冷凝集素(cold agglutinins,CA)是一种针对红细胞表面糖类抗原I或i的自身抗体,以IgM κ型为主,少部分是IgG和IgA。这些抗体在低温下被激活,由此产生的抗原抗体复合物强烈激活经典的补体途径,导致网状内皮系统中红细胞的清除,以及血管内和血管外溶血[1]。冷凝集素介导的自身免疫性溶血性贫血(autoimmune hemolytic anemias,AIHA)可分为冷凝集素病(cold agglutinin disease,CAD)和继发性冷凝集素综合征(secondary cold agglutinin syndrome,CAS)[2]。CAD具有明确的临床病理特征,是一种克隆性淋巴组织增生性疾病。CAS则多见于感染(特别是传染性单核细胞增多症、巨细胞病毒、肺炎支原体、克雷伯氏菌)、药物(特别是奎尼丁、α-甲基多巴、青霉素、对氨基水杨酸、各种止痛药、磺脲类)、血液系统肿瘤(尤其是恶性淋巴瘤)和自身免疫疾病(特别是系统性红斑狼疮)[3]。冷凝集素在实体瘤中的报道非常罕见。本研究报告2例实体瘤患者外周血出现的冷凝集现象。
临床资料
病例1 女,74岁,因卵巢癌复发术后20余天,要求第1次化疗于2021年2月18日来浙江省人民医院住院治疗。患者16年前诊断为双侧卵巢交界性混合性乳头状囊腺瘤(浆液性上皮和黏液性上皮混合,以浆液性为主)并行切除手术,术后遵医嘱行3次卡铂+环磷酰胺化疗,无明显不适。1个月前外院盆腹腔CT增强示腹膜后占位性病变,考虑卵巢癌复发伴转移,2021年1月26日来浙江省人民医院行开腹探查术及肿瘤减瘤手术,术后病理提示淋巴结(45/61)转移性癌(符合低级别浆液性癌)。免疫组织化学染色结果:E4-1:Ki-67(+7%)、MLH1(+)、PMS2(+)、MSH6(+)、MSH2(+)、PAX-8(+)、β-连环素(膜+)、EMA(+)、P53(+40%,野生型)、WT1(+)、钙网膜蛋白(+)、CK5/6(-)、P16(斑片状+)、ER(+)、PR(-)。查体:子宫、附件术后缺如。
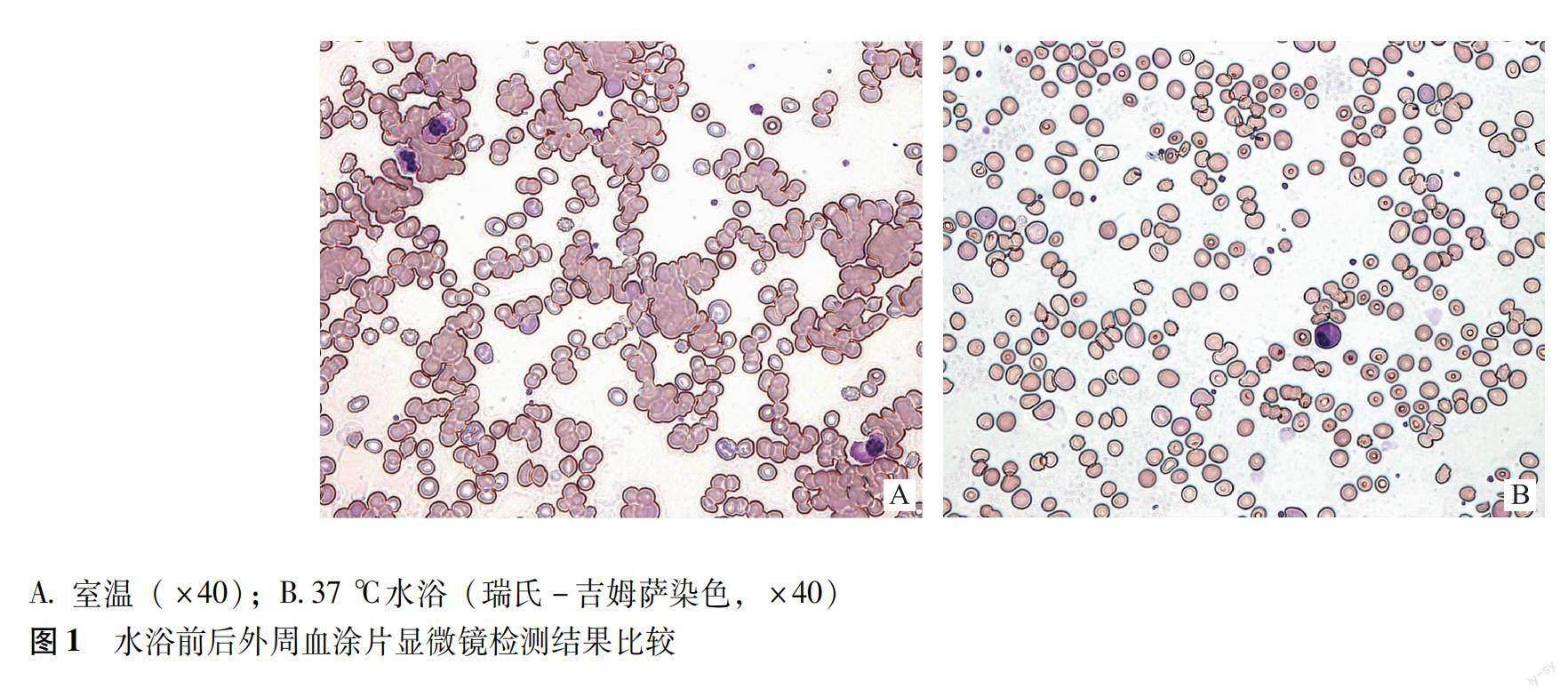
患者入院后(2021年2月19日)查血常规显示红细胞计数(red blood cell count,RBC)(0.67×1012/L)、红细胞压积(hematocrit,HCT)(7.3%)明显减低,平均血紅蛋白含量(mean corpuscular hemoglobin,MCH)(138.8 pg)和平均血红蛋白浓度(mean cell hemoglobin concentration,MCHC)(1274 g/L)异常增高,血红蛋白(93 g/L)与RBC比例严重失调,肉眼可见许多细沙状颗粒黏附于试管壁,血涂片镜下可见红细胞有凝集现象(图1 A)。该标本置于37 ℃常规水浴1 h后仍无法有效消除冷凝集素对RBC、HCT、MCH和MCHC的干扰。延长水浴时间至3 h后进行检查,结果显示RBC(2.19×1012/L)得到较好的纠正,HCT(28.0%)、MCH(32.9 pg)、MCHC(332 g/L)结果亦趋于正常,涂片染色镜检RBC分布均匀(图1 B)。白细胞计数、血小板计数和RBC相关结果见表1。
其他实验室检查:取O型红细胞与患者血清进行冷凝集试验,4 ℃时冷凝集素效价>512,Coombs试验阳性。CA-199 105.1 U/ml,CA-125 1674.0 U/ml,CA72-4 32.0 U/ml,白蛋白33 g/L,D-二聚体3960.0 μg/L,大便常规白细胞镜检++/高倍镜视野,乳酸脱氢酶 150 U/L,总胆红素8.4 μmol/L,直接胆红素2.4 μmol/L,肝功能、肾功能、电解质、免疫球蛋白(IgA、IgG、IgM)等检查正常,支原体、EB病毒、巨细胞病毒、抗核抗体检测均阴性。影像学检查:PET-CT检查提示肿瘤多发淋巴结转移。给予患者卡铂0.55 g联合多柔比星脂质40 mg化疗,同时予预防过敏、抑酸、护胃、止吐等对症治疗,患者好转于2021年2月21日出院,后转入当地医院继续治疗。随访中该患者外周血冷凝集现象持续存在。
病例2 女,40岁,因发现左侧乳腺癌1月余,为行第2次术前化疗于2020年11月10日来浙江省人民医院住院治疗。患者1个多月前无明显诱因下发现左侧乳房无痛肿块,约黄豆大小,遂于浙江省人民医院就诊,超声示:乳腺增生症,左乳结节,BIRADS分级Ⅴ级,左侧腋下多发异常淋巴结,右侧腋下淋巴结探及,部分实质偏厚。乳腺穿刺活检术,病理示:非特殊型浸润性癌(浸润性导管癌)伴导管原位癌(原位癌占比约为30%),高核级。免疫组织化学染色结果:A2-1(浸润性癌);ER(50%中等+)、PR(40%中等+)、HER-2(1+)、Ki-67(30%+)、AR(+)、EGFR(弱+)、P53(+)、CK5/6(-)、GATA3(+)、E-钙黏蛋白(+)、P120(膜+)、P63(-)、类肌钙蛋白(-)、CD31(血管+)、D2-40(-)。考虑浸润性导管癌,WHO 2级,部分为导管内癌(高核级)。给予患者EC方案(表柔比星145 mg+环磷酰胺0.95 g)化疗。现患者为行第2次术前化疗来浙江省人民医院就诊。查体:皮肤巩膜无黄染,左乳外上象限可及2.0 cm大小肿块,界清,质稍硬,活动可,右乳未及明显结节,双侧腋窝未及明显肿大淋巴结,余未见明显阳性体征。
患者入院后(2020年11月10日)血常规分析发现有冷凝集现象,该患者标本经37 ℃延长水浴时间3 h后再上机检测结果恢复正常,血常规检查结果见表1。
其他辅助检查:B超提示脂肪肝。实验室检查:冷凝集素效价>512,Coombs试验阳性(C3d型),谷氨酰转肽酶67 U/L,碱性磷酸酶124 U/L,甘油三酯5.37 mmol/L,非高密度脂蛋白胆固醇4.42 mmol/L,乳酸脱氢酶289 U/L,总胆红素12.1 μmol/L,直接胆红素2.2 μmol/L,支原体、EB病毒、巨细胞病毒、抗核抗体检测均阴性,肿瘤标志物、大便常规、肾功能、电解质、免疫球蛋白等检查未见明显异常。先后给予患者EC方案和T方案各4次化疗周期后,患者于2021年4月1日行单侧乳腺癌保乳根治术,分别于2021年4月21日和2021年5月13日术后复查,2021年5月13日复查时发现患者外周血冷凝集现象消失。
讨论
CA多见于老年患者,又以女性患者为主[4]。本文2例实体瘤患者出现的冷凝集现象均为女性,入院时血常规检测显示出不合理的结果,与血红蛋白相比,RBC和HCT非常低,导致MCH和MCHC异常升高,血涂片显微镜检查显示红细胞聚集,样本冷凝集实验阳性且冷凝集素效价较高。采用37 ℃水浴时间1 h难以完全纠正,延长水浴至3 h后冷凝集现象消失。排除感染性和自身免疫性因素后,该病例说明了实体瘤与冷凝集之间的罕见关联。
CA引起的AIHA,其诊断依赖于溶血性贫血的临床表现和CA抗体的实验室证据的结合。与CAD或CAS相关的典型实验室结果包括CA滴度至少为64,乳酸脱氢酶升高,结合珠蛋白降低,以及Coombs试验阳性等[5]。本文2例患者虽然均有冷凝集素,但缺乏溶血的临床和实验室证据,因此,尚不符合CAD或CAS的诊断标准。研究显示患者体内是否发生补体介导的溶血与冷凝集素的效价和热幅均有一定关系[3]。此外,气温和季节也可能是影响患者发病的重要因素之一[6-7]。高热幅和低气温很可能引发更多的CAD症状。然而,本文2例患者目前尚未出现AIHA相关的临床症状,主要叮嘱患者注意保暖等支持性治疗。同时,随访时密切关注患者是否出现遇冷或受凉后手足发绀等临床症状,监测乳酸脱氢酶及膽红素等反映是否溶血的实验室指标。
AIHA作为实体瘤的副肿瘤综合征目前可获得的信息较少,其中CA引起的更是罕见。Nenova等[8]对1083例实体瘤患者的研究显示,只有1.29%(14/1083)的患者出现副肿瘤综合征,其中21.4%(3/14)与AIHA相关。Puthenparambil等[9]对实体瘤合并AIHA的患者进行荟萃分析,共纳入52名受试者,年龄38~76岁,其中温抗体型70%、冷抗体型30%。AIHA几乎发生在所有类型的癌症中,最常见的癌症是肾细胞癌、卡波西肉瘤和非小细胞肺癌;此外,也与其他少见癌症有关,包括睾丸、卵巢、前列腺、乳腺癌和膀胱癌[9-10]。AIHA可能发生在癌症之前或同时发生,也可能发生在治疗结束后很久;或者是复发的迹象,或者是癌症完全缓解的迹象[9]。但由于数量太少,目前尚无法从统计学上检验是否特定器官或组织类型的肿瘤更倾向于自身抗体的形成[9,11]。
此外,也有观点认为,实体瘤可能是AIHA的并发病之一。1项856例AIHA患者的研究显示,55例患者伴有非血液系统恶性肿瘤(10%为卵巢肿瘤)[12]。Hirose等[13]曾以1995至2016年100例确诊为AIHA的患者为研究对象,就是否并发恶性肿瘤及确诊时间进行回顾性研究,该研究中位观察期为33个月,100例中共诊断出67例癌症,其中实体瘤22例,约2/3是温抗体型,1/3是冷抗体型;另外,以AIHA确诊时间为基准,同时分析恶性肿瘤的确诊时期,结果显示67例肿瘤中的28例集中在AIHA确诊前后的6个月内,特别是在冷凝集素病例中,所有病例均患有恶性肿瘤,且与温式AIHA相比,实体瘤发病率明显增多。AIHA是最常见的获得性溶血性贫血(acquired haemolytic anaemia,AHA),Kok等[14]进行了1项3902例东亚AHA患者的队列研究,以评估AHA相关的癌症风险,这项研究提供了AIHA患者未来发生实体瘤的风险估计,特别是发生肺、结肠、肝脏和乳腺以外恶性实体瘤的风险增加80%。因此,在某些情况下,AIHA可能是肿瘤活动性的标志物,其临床价值可能与其他常规标志物相似[15]。
目前,实体瘤患者体内出现冷凝集素的机制尚不十分清楚。癌组织中ABH血型抗原的异常表达和I抗原积累可能是实体瘤患者出现冷凝集素的重要原因[13]。ABH血型抗原可在红细胞以外的许多正常细胞表达,包括血小板、血管内皮细胞和上皮组织。I抗原是ABH抗原的前体,由于肿瘤细胞糖基转移酶缺失和/或糖酵解活性过高,导致I抗原不能转化完全并在肿瘤细胞中积聚[16]。Dube等[17]研究显示某些乳腺癌患者的血清红细胞冷凝集抗体水平升高,特别是Ⅲ期乳腺癌和各种产生黏蛋白的乳腺癌。Zouine等[18]研究显示乳腺肿瘤和肿瘤附近的正常组织中ABH抗原丢失,且肿瘤分级越高,ABH抗原丢失越多。Dube等[19]测定170例乳腺癌患者、97例良性乳腺疾病患者和37例年龄相仿的女性对照的冷凝集素抗I分数,并对乳腺癌患者的临床资料按病理分期和组织学分类进行分析,结果显示乳腺癌患者的抗I评分与病理分期之间存在相关性,并提示浸润性导管型乳腺癌的黏液细胞和顶质分泌细胞抗原性不同。Dube等[19]认为,乳腺癌细胞产生I抗原或I抗原样物质,可能影响血清抗I抗体的产生。
目前,临床治疗冷凝集素引起的AIHA,根据其溶血的严重程度分为多种药理学方案,包括利妥昔单抗、硼替佐米、细胞毒性药物、补体C1s抑制剂,以及血浆置换去除血浆中的冷凝集素抗体[20-23]。同时,应该教导患者避免低温,有些患者可能需要避免冷饮和冷食,通过支持性治疗大多数患者足以避免病情恶化。此外,最根本的治疗依然取决于对病因的治疗。由于实体瘤相关的AIHA非常罕见,治疗方案并不明确,效果也各不相同。肿瘤抗原引发的抗体与红细胞发生交叉反应是肿瘤相关AIHA的重要机制,它经常发生在较大的肿瘤和肿瘤发生转移的患者中[11]。因此,大多数患者需要接受潜在恶性肿瘤的治疗,如手术切除或化疗后才能有效地观察到血红蛋白的改善[24]。但是,即使在肿瘤存在广泛转移的情况下,原发肿瘤的切除对AIHA也是有益的,这一事实表明原发肿瘤和其转移瘤的抗原性不同,原发肿瘤可能比转移瘤更具抗原性[8]。在随访中笔者发现,其中1例乳腺癌患者在经历乳腺癌保乳根治术、淋巴结根治性切除术后,外周血冷凝集现象消失。相比之下,卵巢癌患者为肿瘤转移的晚期癌症患者,虽然经过减瘤手术,外周血冷凝集现象并未消失。
綜上,本文报告了2例实体瘤患者出现的冷凝集现象。冷凝集素与实体瘤的关联目前仅有相当少的科学证据。AIHA与实体瘤的相关性引起了血液学家和肿瘤学家的兴趣,对相关患者的研究或许可以为AIHA的发病机制提供一些新的见解。
参 考 文 献
[1]Berentsen S,Roth A,Randen U,et al.Cold agglutinin disease:current challenges and future prospects[J].J Blood Med,2019,10:93-103.DOI:10.2147/JBM.S177621.
[2]Berentsen S.New insights in the pathogenesis and therapy of cold agglutinin-mediated autoimmune hemolytic anemia[J].Front Immunol,2020,11:590.DOI:10.3389/fimmu.2020.00590.
[3]Berentsen S.Cold agglutinin disease[J].Hematology Am Soc Hematol Educ Program,2016,2016(1):226-231.DOI:10.1182/asheducation-2016.1.226.
[4]Su J,Bylsma LC,Jiang X,et al.Healthcare resource utilization among commercially insured patients with cold agglutinin disease in the United States[J].J Med Econ,2020,23(8):902-907.DOI:10.1080/13696998.2020.1764006.
[5]Wilen CB,Booth GS,Grossman BJ,et al.Using direct antiglobulin test results to reduce unnecessary cold agglutinin testing[J].Transfusion,2017,57(6):1480-1484.DOI:10.1111/trf.14059.
[6]Hansen DL,Berentsen S,Fattizzo B,et al.Seasonal variation in the incidence of cold agglutinin disease in Norway,Denmark,and Italy[J].Am J Hematol,2021,96(7):E262-E265.DOI:10.1002/ajh.26196.
[7]Roth A.Do temperature and time matter in cold agglutinin disease[J].Blood,2020,136(4):380-381.DOI:10.1182/blood.2020006566.
[8]Nenova IS,Valcheva MY,Beleva EA,et al.Autoimmune phenomena in patients with solid tumors[J].Folia Med(Plovdiv),2016,58(3):195-199.DOI:10.1515/folmed-2016-0026.
[9]Puthenparambil J,Lechner K,Kornek G.Autoimmune hemolytic anemia as a paraneoplastic phenomenon in solid tumors:a critical analysis of 52 cases reported in the literature[J].Wien Klin Wochenschr,2010,122(7-8):229-236.DOI:10.1007/s00508-010-1319-z.
[10]Li S,Zhang L,Wang W.Unusual co-occurrence of cold agglutinin disease in a bladder transitional cell carcinoma patient with unexplained anemia and cold-related symptoms[J].Chin Med J(Engl),2020,134(5):608-610.DOI:10.1097/CM9.0000000000001277.
[11]Sokol RJ,Booker DJ,Stamps R.Erythrocyte autoantibodies,autoimmune haemolysis,and carcinoma[J].J Clin Pathol,1994,47(4):340-343.DOI:10.1136/jcp.47.4.340.
[12]Teran Brage E,Fonseca Santos M,Lozano Mejorada R,et al.Autoimmune haemolytic anaemia due to cold antibodies in a renal cancer patient[J].Case Rep Oncol,2022,15(2):507-514.DOI:10.1159/000524592.
[13]Hirose T,Tokunaga H,Shimizu-Koresawa R,et al.Relationship between Coombs-positive autoimmune hemolytic anemia and development of malignant tumors:a retrospective study[J].Rinsho Ketsueki,2019,60(10):1418-1424.DOI:10.11406/rinketsu.60.1418.
[14]Kok VC,Sung FC,Kao CH,et al.Cancer risk in East Asian patients associated with acquired haemolytic anaemia:a nationwide population-based cohort study[J].BMC Cancer,2016,16:57.DOI:10.1186/s12885-016-2098-3.
[15]Gomez de la Torre R,Fernandez G,Suarez Cuetara P,et al.Cold agglutinin autoimmune hemolytic anemia associated with adenocarcinoma of the colon[J].Med Clin(Barc),2005,125(6):236-237.DOI:10.1157/13077394.
[16]Abegaz SB.Human ABO blood groups and their associations with different diseases[J].Biomed Res Int,2021,2021:6629060.DOI:10.1155/2021/6629060.
[17]Dube V,Iwaki Y,Anderson B,et al.Red blood cell cold agglutinins and B lymphocyte cytotoxins in breast cancer sera[J].Vox Sang,1982,43(3):113-121.DOI:10.1111/j.1423-0410.1982.tb00001.x.
[18]Zouine S,Marnissi F,Otmani N,et al.Expression of histo-blood group antigens in tumor and adjacent normal breast tissues as prognostic markers of breast carcinoma[J].J Breast Cancer,2020,23(1):69-79.DOI:10.4048/jbc.2020.23.e13.
[19]Dube VE,Haid M,Chmiel JS,et al.Serum cold agglutinin and IgM levels in breast carcinoma[J].Breast Cancer Res Treat,1984,4(2):105-108.DOI:10.1007/BF01806392.
[20]Berentsen S,Barcellini W,DSa S,et al.Cold agglutinin disease revisited:a multinational,observational study of 232 patients[J].Blood,2020,136(4):480-488.DOI:10.1182/blood.2020005674.
[21]Ahmed Y,Khandelwal A,Walker L.Cold agglutinin disease and COVID-19 requiring therapeutic plasma exchange[J].BMJ Case Rep,2021,14(7):e244227.DOI:10.1136/bcr-2021-244227.
[22]Gelbenegger G,Schoergenhofer C,Derhaschnig U,et al.Inhibition of complement C1s in patients with cold agglutinin disease:lessons learned from a named patient program[J].Blood Adv,2020,4(6):997-1005.DOI:10.1182/bloodadvances.2019001321.
[23]吳颜延,曹欣欣,蔡昊,等.17例原发性冷凝集素病患者的临床特征与转归[J].中华血液学杂志,2017,38(9):789-793.DOI:10.3760/cma.j.issn.0253-2727.2017.09.011.
[24]Barcellini W,Giannotta J,Fattizzo B.Autoimmune hemolytic anemia in adults:primary risk factors and diagnostic procedures[J].Expert Rev Hematol,2020,13(6):585-597.DOI:10.1080/17474086.2020.1754791.
(收稿日期:2022-09-26)
