咖啡酸分子烙印聚合物的制备及其在金银花抗炎作用评价中的应用研究△
2023-09-30陈腾飞古江勇高云航宋玲李晗侯红平彭博徐筱杰叶祖光张广平
陈腾飞,古江勇,高云航,宋玲,李晗,侯红平,彭博,徐筱杰,叶祖光,张广平*
1.中国中医科学院 中药研究所,北京 100700;
2.广州中医药大学 基础医学院,广东 广州 510006;
3.北京大学 化学与分子工程学院,北京 100871
分子烙印聚合物(MIP)也称为分子印迹聚合物,是通过模板分子与功能单体的共聚作用合成能够与模板分子特异性结合的一种有特定空间构型的高分子聚合物[1-2],具有识别性好、特异性高、物理和化学性质稳定的特点[3],可应用于生物传感器[4]、化合物的手性分离[5]、催化[6]、固相萃取[7-8]及样品中微量成分的分析[9-10]等多个领域。传统的MIP 制备是采用本体聚合、沉降聚合等方法,将模板分子、功能单体、交联剂和引发剂混合后,通过光或热来引发聚合[3],对合成条件要求较严格,制备过程也会消耗大量的模板分子,由于制备条件的限制,难以应用于大规模样品的制备与分离。表面烙印法为解决这一问题提供了方法。表面烙印法是将模板分子和功能单体通过预组装形成的复合物接枝到二氧化硅、聚苯乙烯等材料的表面,再由交联剂将其固定的一种方法[11]。这种聚合物制备过程消耗的模板分子较传统的方法少,且能在载体的表面形成一层与模板分子特异结合的薄膜,使模板分子与结合位点的吸附-解吸作用更为快速[12-15]。本课题组自2001 年将分子烙印技术应用于中药活性成分的分离以来[16],采用MIP 相继从不同中药材中分离到了微量活性成分[17-18]。
金银花(Lonicerae Japonicae Flos)别名双花、忍冬花等,为忍冬科植物忍冬Lonicera japonicaThunb.的干燥花蕾或带初开的花,具有清热解毒、疏散风热之功效[19]。其化学成分主要包括咖啡酸(CA)等有机酸[20]、环烯醚萜苷[21]、黄酮[20,22]等类成分。有机酸类作为金银花的一类主要活性成分,在其抗炎活性中发挥着重要的作用。有报道表明CA具有抗炎的活性[23-24],其衍生物也具有抗氧化和抗炎的活性[25-26]。但是中药作为一个复杂的体系,其药理活性不能简单以含有的1 个或者多个单体成分进行评价。因此,本研究以金银花为研究对象,以金银花中抗炎活性较强的CA 为模板分子,采用溶胶-凝胶法,制备了CA MIP,以此聚合物作为液相色谱的固定相,在保证金银花提取物完整性的前提下,从中去除了微量的CA,并通过脂多糖(LPS)诱导小鼠单核巨噬细胞RAW264.7 释放前列腺素E2(PGE2)的实验评价去除CA 前后金银花提取物的抗炎活性,为中药的药理活性和作用机制研究提供新的思路和方法。
1 材料
1.1 细胞
RAW264.7细胞由中国医学科学院提供。
1.2 样品
金银花药材购于北京同仁堂药店有限责任公司,经中国中医科学院中药研究所张广平研究员鉴定为忍冬科植物忍冬Lonicera japonicaThunb.的干燥花蕾或带初开的花。
1.3 试药
CA(纯度:98%,用于制备MIP,南京泽朗医药科技有限公司);对照品CA(批号:110885-201703,纯度:99.7%)、绿原酸(CGA,批号:110753-201817,纯度:96.87%)均购于中国食品药品检定研究院;62~105 μm 二氧化硅微珠(使用前经2.0 mol·L-1的盐酸水溶液于60 ℃活化6 h)、(3-氨丙基)三乙氧基硅烷(APTS)均购于阿法埃莎(天津)化学有限公司;四乙氧基硅烷(TEOS,北京百灵威科技有限公司);实验所用其他试剂为分析纯或色谱纯;胎牛血清(批号:111030,浙江天杭生物科技有限公司);DMEM 培养基(批号:8112037,美国Fisher公司);LPS(南京百康生物科技有限公司);PGE2检测试剂盒(批号:03121212,美国Enzo Life Science公司)。
1.4 仪器与耗材
UV-2550 型紫外-可见分光光度计(日本Shimadzu 公司);分析与半制备高效液相色谱仪(由322 型泵和152UV/Vis 型检测器组成,北京吉尔森科技有限公司);HP 1100 型高效液相色谱仪(美国Agilent 公司);3111 型CO2细胞培养箱(美国Thermo Fisher Scientific 公司);XDS-1B 型倒置显微镜(江苏科学仪器有限公司);500 目筛(上海丰行筛网制造有限公司);0.46 μm 注射器过滤器和不锈钢空柱(50 mm×4.6 mm)均购于北京迪马科技有限公司;不锈钢空柱(100 mm×10.0 mm,大连依利特分析仪器有限公司)。
2 方法
2.1 CA MIP 的合成及高效液相色谱法(HPLC)评价
以CA 为模板分子、APTS 为功能单体、TEOS为交联剂,采用溶胶-凝胶法制备MIP。MIP 的制备方法:取CA 0.2 mmol 溶于四氢呋喃7 mL,加入APTS 2.4 mmol,室温磁力搅拌2 h,加入已活化的62~105 μm 的二氧化硅微珠3.5 g,继续搅拌2 h,再加入TEOS 6 mmol,继续搅拌1 h,加入1 mol·L-1的乙酸水溶液1 mL,搅拌18 h 完成反应。反应完成后聚合物用甲醇冲洗2 次,抽滤,70 ℃烘干。过500 目筛去除小颗粒后,用甲醇-乙酸(9∶1)搅拌冲洗,以除去模板分子,最后用甲醇冲洗,抽滤后,70 ℃烘干即得。空白烙印聚合物(NIP)的制备方法除不加入模板分子外,其余步骤同MIP制备。
将一定量的MIP 或NIP 填入不锈钢空柱(50 mm×4.6 mm),将装好的色谱柱连接到高效液相色谱仪上,先后用甲醇-乙酸(9∶1)、甲醇冲洗至基线平稳。用丙酮测定死时间,每次进样5 μL,丙酮检测波长为254 nm;5 mmol·L-1CA 和5 mmol·L-1CGA 每次进样20 μL,检测波长为324 nm;流速为0.60 mL·min-1,流动相为甲醇-乙酸(500∶1)和甲醇-乙酸(9∶1)。容量因子(k)和烙印效率(IF)分别按照公式(1)和公式(2)计算。
式中,tR为样品的保留时间(min),t0为死时间(min);kMIP和kNIP分别为MIP和NIP的容量因子。
2.2 金银花提取物中CA的分离
取金银花药材粉碎成粗粉,取粗粉50 g,称定质量,置1000 mL 圆底烧瓶中,用75%乙醇回流提取3 次,每次600 mL,提取30 min[27],合并提取液,滤过浓缩后,冷冻干燥,得金银花提取物。取金银花提取物4.0 g,加50%甲醇20 mL超声处理30 min,经0.46 μm 过滤器滤过,得0.20 g·mL-1的金银花提取物溶液。
将CA MIP填充到不锈钢空柱(100 mm×10.0 mm)中,连接高效液相色谱仪,先后用甲醇-乙酸(9∶1)、甲醇洗柱到基线平稳。上样前,用甲醇-乙酸(500∶1)平衡,流速为2.4 mL·min-1,检测波长为324 nm,样品为上述金银花提取物溶液,每次进样1 mL,进样后,先用甲醇-乙酸(500∶1)洗脱50 min,再用甲醇-乙酸(9∶1)洗脱,分别收集洗脱液,减压回收有机溶剂后,冷冻干燥。按公式(3)计算CA 的回收率(R)。
式中,MCA为金银花中分离到CA的质量(mg);V为金银花提取物溶液的进样总体积(mL);C0为金银花提取物溶液的质量浓度(g·mL-1);Q为金银花提取物中CA的质量分数(mg·g-1)。
2.3 提取物指纹图谱及CGA、CA含量测定
2.3.1 色谱条件 Phenomenex Luna C18(2)色谱柱(250 mm×4.6 mm,5 μm),流速为1.0 mL·min-1,检测波长为324 nm;流动相为甲醇(A)-0.1%磷酸水溶液(B),梯度洗脱(0~20 min,12%~30%A;20~60 min,30%~50%A),进样体积10 μL[28]。
2.3.2 对照品储备液配制 取CA、CGA 对照品,精密称定,置10 mL 量瓶中,加适量的50%甲醇溶解后定容至刻度,配制成CA 和CGA 质量浓度分别为200、800 μg·mL-1的混合对照品储备液。
2.3.3 供试品溶液制备 取金银花提取物、去除CA 的金银花提取物、金银花提取物中分离的CA,精密称定,用50%甲醇10 mL 超声提取后测定CA含量,用50%甲醇100 mL 超声提取后测定CGA含量。
2.3.4 方法学考察 取CA和CGA 质量浓度分别为200、800 μg·mL-1的混合对照品储备液,用50%甲醇依次稀释成CA 质量浓度分别为100.0、40.0、20.0、10.0、5.0、2.5 μg·mL-1,CGA 质量浓度分别为400、160、80、40、20、10 μg·mL-1的系列混合标准曲线溶液,各精密吸取10 μL 进样,以峰面积为纵坐标(Y),待测物质量浓度为横坐标(X),采用加权(1/X2)最小二乘法进行线性回归,绘制回归方程并计算待测物质量浓度。取CA 质量浓度为10 μg·mL-1、CGA 质量浓度为40 μg·mL-1的混合对照品溶液,按照2.3.1 项下色谱条件连续进样6 次,计算峰面积的RSD,考察仪器精密度;取金银花提取物,按照2.3.3 项下方法制备供试品溶液,分别在0、2、4、8、12 h 测定CA 和CGA 的峰面积并计算RSD,考察稳定性;取金银花提取物6 份,按照2.3.3 项下方法制备供试品溶液,进样测定,计算金银花提取物中CA 和CGA 的平均含量和RSD,考察重复性;取CA 和CGA 对照品,精密称定,置50 mL 量瓶中,用50%甲醇定容至刻度,之后再用50%甲醇将其稀释成CA 质量浓度为6 μg·mL-1,CGA 质量浓度为500 μg·mL-1的溶液。精密称取金银花提取物12 份,置圆底烧瓶中,分别以CA质量浓度为6 μg·mL-1的50%甲醇溶液,CGA 质量浓度为500 μg·mL-1的50% 甲醇溶液,按照2.3.3 项下方法制备供试品溶液,测定,计算加样回收率。
2.4 对LPS刺激RAW264.7细胞释放PGE2的影响
将细胞以0.25%胰蛋白酶(含0.02%乙二胺四乙酸)消化,无血清的DMEM 培养基调整细胞密度为1×105个/mL,均匀接种至24 孔板,每孔400 μL,接种后放入培养箱培养24 h。加入含药的无血清培养基50 μL,同时设空白对照组,DMSO 组和模型组。样品为金银花提取物(100、200、400 μg·mL-1)和去除CA的金银花提取物(100、200、400 μg·mL-1)。药物作用1 h 后,除空白对照组和DMSO 组加入50 μL 的无血清培养基外,各孔分别加入LPS溶液(终质量浓度1 μg·mL-1)50 μL,终体积为500 μL,继续孵育18 h。18 h 后收集细胞培养液,以无血清DMEM 稀释5 倍,按ELISA 试剂盒说明书检测PGE2含量[29-30]。
3 结果与讨论
3.1 CA MIP的制备与评价
合成的CA MIP 为淡黄色的颗粒,NIP 为白色颗粒。丙酮和CA在MIP柱tR分别为1.0、16.8 min,在NIP柱的tR分别为1.1、2.9 min,按公式(1)和(2)计算得CA MIP 的IF 为9.7,表明用此方法制备的CA MIP 对CA 有较强的吸附能力。丙酮、CA 和CGA 经MIP 柱分离的色谱图见图1。CGA 在50 min内未能被500∶1的甲醇-乙酸系统洗脱(图1A)。经甲醇-乙酸(9∶1)洗脱,CA 和CGA 的tR分别为1.5、10.8 min,可以看出此MIP 对CGA 的吸附能力较CA 更强,推测可能是因为CGA 分子中的氢键供体和受体均比CA 多,所以在MIP 柱上的吸附能力也较CA 强。CA 和CGA 的分子结构式见图2。利用此性质,在分离样品中CA 时,先用甲醇-乙酸(500∶1)系统进行洗脱,等CA 被洗脱下来后,再用甲醇-乙酸(9∶1)洗脱CGA等其他有机酸类。

图1 CA MIP色谱柱洗脱色谱图
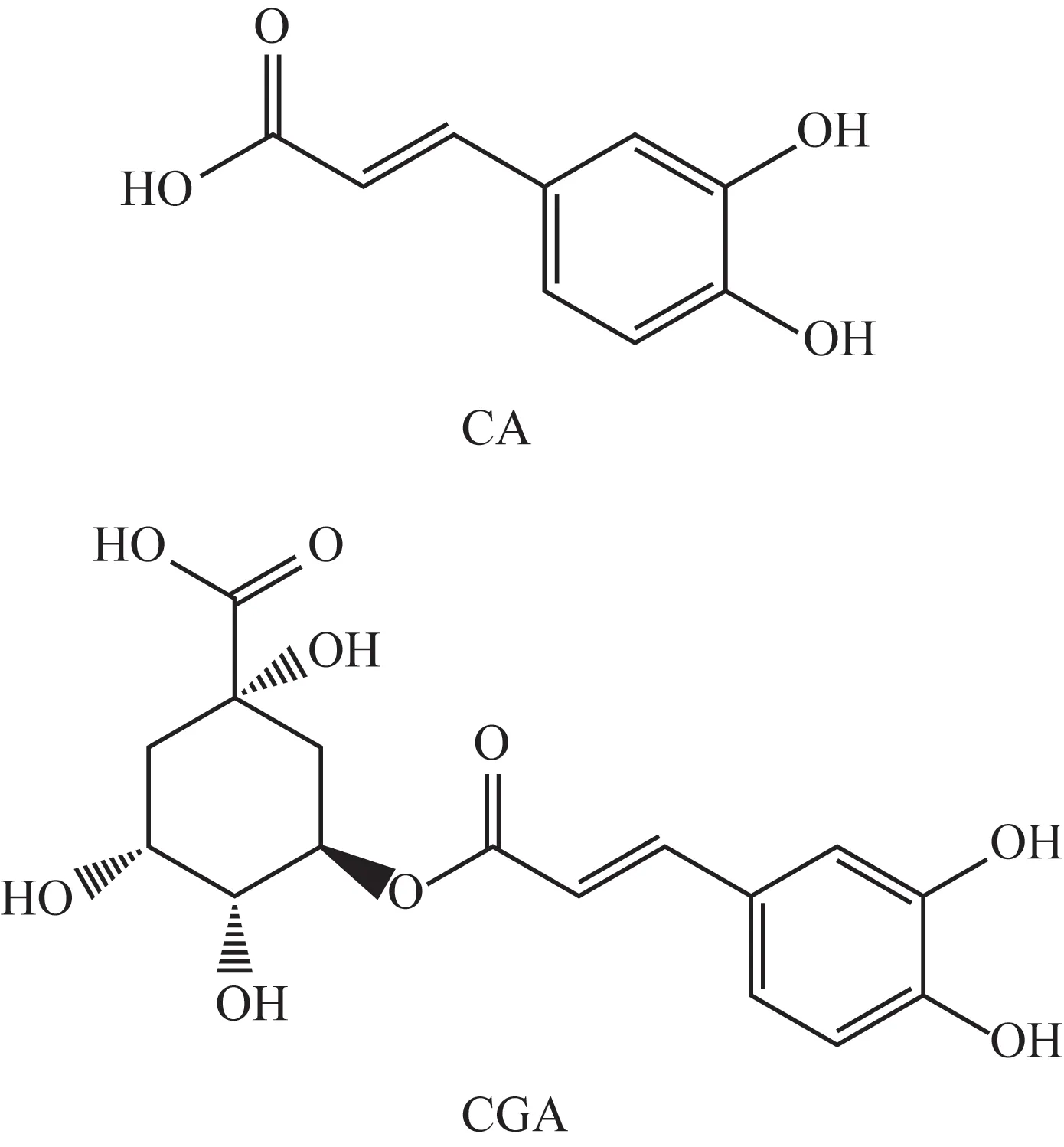
图2 CA和CGA的分子结构式
3.2 金银花提取物中CA的分离与富集及含量测定
金银花粗粉50.0 g 经过75%乙醇回流提取、减压干燥后,共得到金银花提取物21.9 g。金银花提取物及CA、CGA混合对照品溶液图谱见图3,CGA和CA 的tR分别为21.4、25.3 min。CA 的回归方程为Y=57.621X-79.256(r=0.999 9),线性范围为2.5~100.0 μg·mL-1;CGA 回归方程为Y=31.253X-193.381(r=1.000 0),线性范围为10~400 μg·mL-1。精密度试验结果显示连续进样6 次对照品溶液后,CA 和CGA 峰面积的RSD 分别为2.05%和1.59%,表明仪器精密度良好。稳定性试验测得5 个时间点内CA 和CGA 峰面积 的RSD 分别为0.99% 和3.58%,表明供试品溶液在12 h 内稳定。重复性试验结果显示,6 份金银花提取物中CA 和CGA 的平均质量分数分别为(0.006 6±0.000 3)%和(5.040 7±0.061 8)%,RSD 分别为1.15%和0.99%,表明该方法重复性良好。加样回收率试验结果显示,CA的回收率为96.33%~99.12%,RSD为4.17%,CGA的回收率为95.35%~98.97%,RSD 为2.36%。最后经回归方程计算提取物中CA 和CGA 质量分数分别为0.063、51.200 mg·g-1。

图3 金银花提取物和CA、CGA对照品溶液HPLC图
金银花提取物溶液经MIP 柱分离的色谱图见图4,3 d 时间内共进样金银花提取物溶液13 mL,通过收集不同tR色谱峰洗脱液,并进行冻干处理,最后制得去除CA 的金银花提取物2.28 g 和CA 146 μg,经过色谱分析与计算,分离得到的CA纯度为92%,用公式(3)计算CA的回收率为89%。

图4 金银花提取物中CA经MIP填充柱分离色谱图
去除CA 的金银花提取物和CA 的HPLC 图谱见图5,CA 的tR为25.3 min,与图3 中对照品的tR一致,在该tR时,去除CA 的金银花提取物中未出现CA的吸收峰,而其他主要成分的色谱峰及其相应强度仍然能够与金银花提取物的色谱峰(图3)保持一致,说明通过溶胶-凝胶法制备CA MIP 能够在不影响其他化合物的情况下,特异性地吸附并分离CA。

图5 金银花提取物中CA及去除CA后金银花提取物的HPLC图
3.3 金银花提取物及去除CA 的金银花提取物对LPS刺激RAW264.7释放PGE2的影响
质量浓度为100、200、400 μg·mL-1时,去除CA的金银花提取物对PGE2的抑制率为[(5.4±5.9)%、(13.3±8.3)%和(51.0±4.9)%]均低于金银花提取物对PGE2的抑制率 [(5.8±1.7)%、(35.6±10.8)%和(77.6±1.6)%],且在质量浓度为400 μg·mL-1时差异有统计学意义(P<0.05),实验结果更进一步明确了CA 是金银花抗炎活性的一个重要的成分。由于含有不同结构类型的化合物可以通过与通路中不同的靶蛋白结合而产生协同作用,而具有相似结构类型的化合物与通路中相同的靶蛋白竞争结合而产生拮抗作用[31]。可能是由于CA 与金银花提取物中其他结构类型化合物产生的协同作用大于其与CGA 等咖啡酰奎宁酸类化合物的拮抗作用,因此在去除掉微量的CA 后,抑制率有较明显的降低。去除CA 的提取物虽然对PGE2的抑制率明显降低,但是活性并未完全消失,提示金银花提取物中存在的CGA 等其他有机酸类[32]或其他类型的化合物[33-34]也发挥了抗炎活性,也证明了所制备的CA MIP在本实验条件下未对提取物中的其他化学成分产生影响。
4 结论
1 个或者几个单体成分无法体现中药治疗疾病的整体性,与传统有效成分提取物或者单体活性实验相比,分子烙印技术可以实现“减法”的操作。本研究采用溶胶-凝胶法制备了CA MIP,对CA 具有特异性吸附能力,此聚合物以二氧化硅微珠作为载体,可以实现半制备规模的制备,将制备的CA MIP作为液相色谱的固定相,以甲醇-乙酸梯度洗脱,从金银花提取物中分离了CA,分离到的CA 纯度为92%,回收率为89%,说明MIP 能够特异性地从中药复杂体系中提取/去除纯度较高的目标化合物。经MIP 特异性去除某个或多个单体成分后的中药提取物,再进行相应的药理药效学评价,可以为研究中药等复杂体系的药理作用提供一种思路。
