五倍子配方颗粒的位点特异性PCR鉴别△
2023-09-30胡力陈梓媛赵玉洋金艳张辉张恬仝一丹袁媛蒋超
胡力,陈梓媛,赵玉洋,金艳,张辉,张恬,仝一丹,袁媛*,蒋超*
1.安徽中医药大学 药学院,安徽 合肥 230012;
2.中国中医科学院 中药资源中心,北京 100700;
3.华润三九现代中药制药有限公司,广东 深圳 518029
五倍子是我国传统名贵中药,《中华人民共和国药典》(以下简称《中国药典》)2020 年版规定其为漆树科植物盐肤木Rhus chinensisMill.、青麸杨R.potaniniiMaxim.或红麸杨R.punjabensisStew.var.sinica(Diels)Rehd.et Wils.叶上的虫瘿,主要由五倍子蚜Melaphis chinensis(Bell)Baker 寄生而形成。秋季采摘,置沸水中略煮或蒸至表面呈灰色,杀死蚜虫,取出,干燥。按外形不同分为肚倍和角倍[1]。早期主要是依据直观的形态学分类、倍子形态及致瘿位置等对五倍子进行分类[2-4]。与传统鉴别方法主观性较强的特点相比,分子鉴定稳定、准确、特异性好、不受生物发展阶段与储藏加工影响,结果较为客观,受到研究者的广泛关注,已建立多种中药材及饮片的分子鉴定方法[5-15],也有中成药分子鉴定的报道[16-21]。特异性聚合酶链式反应(PCR)鉴定已广泛应用于中药材提取液、中成药、贵细药材、配方颗粒的基原鉴定中[22-25],为配方颗粒专属性鉴别提供了解决方法,也提高了临床用药的安全性。
五倍子经过水煎煮工艺加工为五倍子配方颗粒后,具有疗效稳定、规格统一、标准一致的优势,但因配方颗粒不再具备性状、显微等鉴别特征,导致基原鉴别更加困难[26],需要建立针对五倍子配方颗粒合理、科学、快速、简便的检验方法。本研究拟建立五倍子配方颗粒PCR 鉴别方法,为规范五倍子及其加工产品质量提供检测工具。
1 材料
1.1 仪器
Veriti ™型PCR 仪、GeneAmp 9700 型PCR 仪(Applied Biosystems 公 司);PTC-100 型PCR 仪、SYNGENE 型凝胶成像系统(Gene 公司);TC-512型PCR仪(上海Techne公司)。
1.2 试药
五倍子药材、标准汤剂冻干粉、配方颗粒由华润三九医药股份有限公司公司提供。17 批五倍子药材(批号为1901001~1904017)经安徽中医药大学刘守金教授鉴定为五倍子蚜Melaphis chinensis(Bell)Baker寄生而形成的虫瘿(表1)。将已鉴定的五倍子药材,按《中国药典》2020 年版中五倍子饮片炮制要求敲开外壳,刮净内部杂质,炮制成相应的17 批五倍子饮片(批号与药材一致),制备了17 批五倍子标准汤剂冻干粉(批号为1904001Y~1904017Y)、3 批配方颗粒成品(批号为1906001Y~1906003Y)。另收集了五倍子蚜同属倍蛋蚜寄生形成的5 批虫瘿(批号为DB2111005~DB2111009),经中国中医科学院蒋超副研究员鉴定为倍蛋蚜Schlechtendalia peitanTsai et Tang 寄生而成的虫瘿,用于检测所建立方法的专属性。五倍子对照药材购自中国食品药品检定研究院(批号:121078-201504)。

表1 17批五倍子药材信息
Wizard®SV Genomic DNA Purification System(美国Promega 生物公司,批号:A2361);2×M5 PCR Mix(北京聚合美生物科技公司,批号:MF164);2×TaqPCR Mix(金百特生物公司,批号:P0195);SpeedSTAR HSTaqDNA 聚合酶、LATaqHS DNA 聚合酶、6×loading buffer(日本Takara 公司,批号分别为RR070A、RR042A、9156);Trans2K DNA Marker(北京全式金生物技术有限公司,批号:BM101);GelRed 核酸染料(北京兰博利德公司,批号:CR001)。
2 方法
2.1 DNA提取
使 用Wizard®SV Genomic DNA Purification System 试剂盒依据说明书步骤提取。样品模板DNA溶液提取完成后,置4 ℃冰箱保存备用。
2.2 引物设计
通过对比五倍子蚜虫及同属近源种倍蛋蚜虫的细胞色素C氧化酶亚基Ⅰ(COⅠ)序列选择特异性片段设计五倍子特异性PCR鉴别引物,其中上游引物序列WBZ-F 为5ʹ-CCCCCTCAATTATTTGATCTAT AG-3ʹ,下游引物序列WBZ-R 为5ʹ-GGACATAATGAA AATGAGCAACTAC-3ʹ。PCR产物长度为138 bp。引物由生工生物工程(上海)股份有限公司合成。
2.3 PCR扩增条件
取五倍子饮片、标准汤剂冻干粉、配方颗粒及混伪品DNA,考察以下方面对PCR 鉴别结果稳定性的影响:1)退火温度分别为51、53、55、57 ℃;2)PCR 循环次数分别为36、38、40、42 个循环;3)Taq酶种类为2×TaqPCR Mix、SpeedSTAR HSTaq、2×M5 PCR Mix和LATaqHS;4)DNA 模板量分别为30、15、6、3 ng。筛选出最适鉴别条件,对五倍子配方颗粒进行位点特异性PCR 鉴别。PCR 产物使用1.5%琼脂糖凝胶进行电泳检测。
3 结果与分析
3.1 PCR鉴别条件的确定与耐用性考察
3.1.1 退火温度 使用五倍子特异性鉴别引物进行PCR 扩增,分别设置退火温度51、53、55、57 ℃,结果表明退火温度为51~55 ℃时,五倍子饮片、标准汤剂冻干粉、配方颗粒能扩增得约138 bp 的亮带(图1),混伪品在55~57 ℃时出现弱扩增与杂带,产生假阳性条带,57 ℃时出现配方颗粒条带缺失。选择PCR退火温度为53 ℃。

图1 退火温度对五倍子配方颗粒鉴别结果的影响
3.1.2 循环次数 分别选用36、38、40、42个循环进行考察,结果表明在36~42 个循环时五倍子(角倍)饮片、标准汤剂冻干粉、配方颗粒能扩增得约138 bp的亮带,均能得到正确鉴别结果,40~42个循环时混伪品和阴性对照出现扩增(图2)。为保证结果的稳定性和准确性,避免混伪品假阳性结果,选择36个循环进行PCR反应。

图2 PCR循环次数对五倍子配方颗粒鉴别结果的影响
3.1.3 不同Taq酶 为测试不同种类的Taq酶对五倍子及其混伪品鉴别结果的影响,分别使用2×M5 PCR Mix、2×TaqPCR Mix、SpeedSTAR HSTaqDNA、LATaqHS DNA 聚合酶进行实验,结果显示由于活力不同,不同Taq酶的扩增条带亮度存在差异,且使用SpeedSTAR HSTaqDNA 聚合酶的部分伪品产生了假阳性条带(图3,泳道7、8),使用LATaqHS 聚合酶也出现假阳性条带(图3,泳道4、5)。使用其他2 种DNA 聚合酶对扩增产物的条带强弱虽存在差别,但不影响对结果的判读,其中使用2×M5 PCR Mix 可获得更明亮条带,故选择2×M5 PCR Mix作为最优的Taq酶。
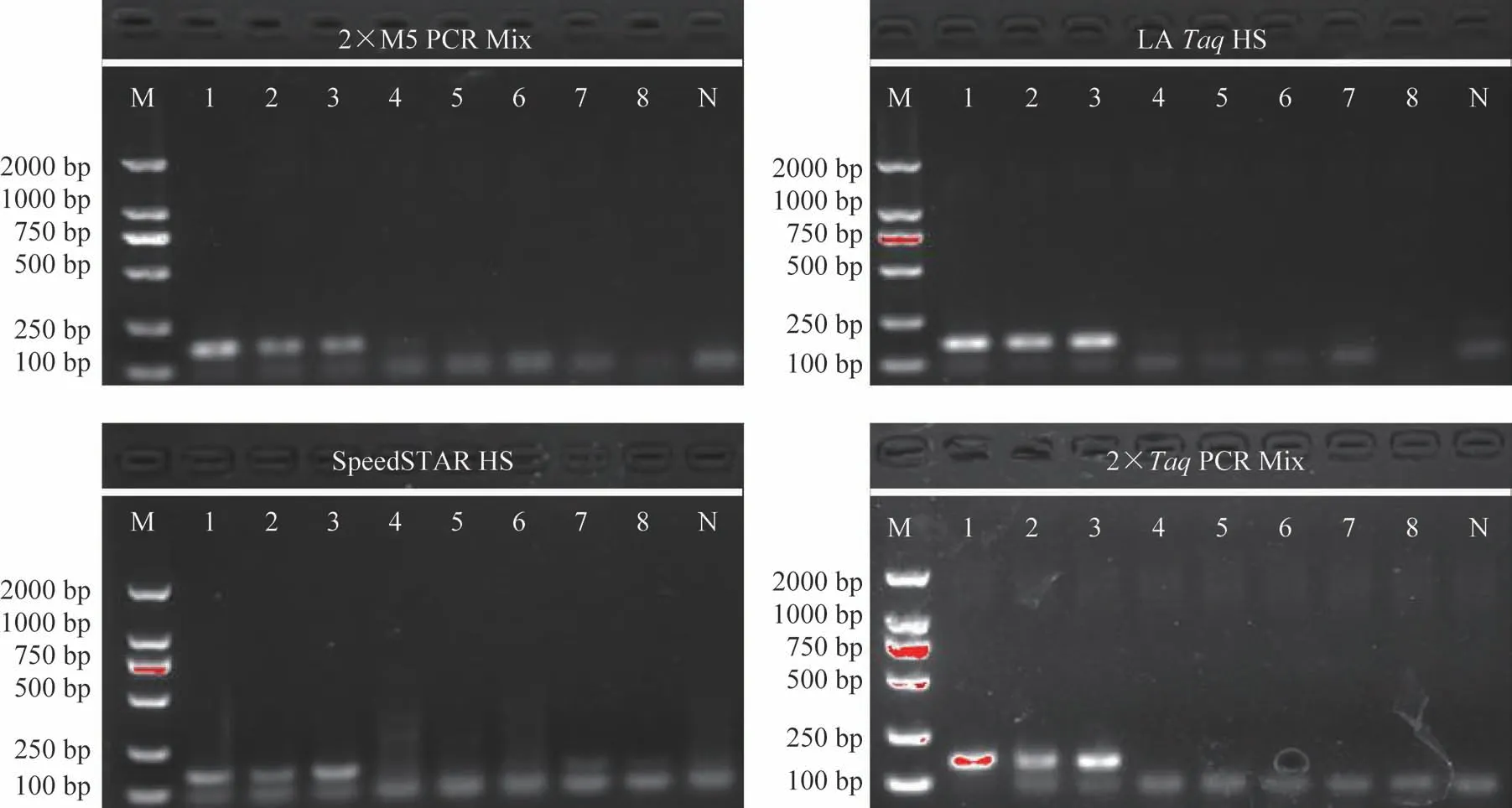
图3 不同Taq DNA聚合酶对五倍子配方颗粒鉴别结果的影响
3.1.4 DNA 模板量 对25 μL PCR 反应体系中的模板DNA 用量进行了考察,调整DNA 质量浓度为约6 ng·μL-1,分别设置3、6、15、30 ng 的DNA 模板(DNA 用量分别为0.5、1.0、2.5、5.0 μL),结果表明当模板量为1.0~5.0 μL 时均能获得扩增产物,而质量浓度过高会导致假阳性条带的出现,见图4。为防止模板质量浓度过高产生假阳性或过低产生假阴性的错误鉴别结果,选择在25 μL 的PCR体系中加入模板DNA 1 μL(6 ng·μL-1)。
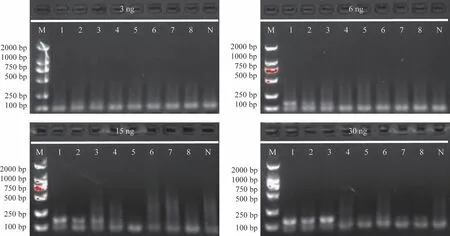
图4 DNA模板量对五倍子配方颗粒鉴别结果的影响
根据以上结果,确定五倍子配方颗粒PCR鉴别的条件为反应体系包括2×M5 PCR Mix 12.5 μL,五倍子配方颗粒鉴别引物(10 μmol·L-1)各0.4 μL,DNA模板2.5 μL,无菌双蒸水9.2 μL。PCR反应参数:95 ℃预变性5 min,循环反应36次(94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s),72 ℃延伸5 min。4~10 ℃保存。
3.1.5 不同PCR 仪 为测试不同PCR 仪对五倍子配方颗粒及其混伪品鉴别结果的影响,分别使用4 种PCR 仪进行扩增,结果表明Veriti ™型、GeneAmp 9700 型、TC-512 型、PTC-100 型PCR 仪均可获得正确的鉴定结果,而GeneAmp 9700 型PCR 仪部分伪品出现微弱扩增条带,表明进行五倍子配方颗粒PCR 鉴别时应对PCR 扩增温度进行微调,并进行方法确认(图5)。

图5 不同PCR仪对五倍子配方颗粒鉴别结果的影响
3.1.6 不同引物量 为测试不同引物浓度对五倍子配方颗粒及其混伪品鉴别结果的影响,分别使用4个引物浓度进行扩增,使用的引物浓度为10 μmol·L-1,结果表明引物量为0.6 μL 以下时均可获得正确的鉴定结果,而引物量为0.8 μL时伪品及空白出现假阳性条带,为了防止引物量过高导致假阳性条带产生,出现错误鉴别结果。选择五倍子配方颗粒PCR鉴别时引物量为0.4 μL(10 μmol·L-1),见图6。

图6 不同引物量对五倍子配方颗粒鉴别结果的影响
3.2 专属性考察
用本研究建立的五倍子配方颗粒PCR 鉴定方法对五倍子药材、标准汤剂冻干粉和配方颗粒及其混伪品进行鉴定,结果五倍子药材、标准汤剂冻干粉和配方颗粒均能扩增出与对照药材一致的特异性鉴别条带,混伪品及伪品标准汤剂冻干粉、配方颗粒均无条带(图7、图8)。

图7 使用五倍子配方颗粒鉴别方法鉴别五倍子及其混伪品

图8 使用五倍子配方颗粒鉴别方法鉴别五倍子及其加工混伪品
3.3 适用性考察
使用本方法对17 批固定五倍子药材、17 批五倍子标准汤剂冻干粉和3 批五倍子配方颗粒成品进行鉴定,以验证本方法的适用性,结果表明所有样本PCR 供试品与五倍子对照药材的电泳图谱相应的位置上均可扩增获得约138 bp 单一特异性鉴别条带,空白对照无条带(图9)。

图9 五倍子配方颗粒适用性考察
4 讨论
《中国药典》2020 年版收载了51 味动物药,其中五倍子和冬虫夏草都是通过寄生这一途径产生的。相比于冬虫夏草,五倍子是五倍子蚜虫在多个寄主植物上寄生而形成的虫瘿。《中国药典》2020 年版中对五倍子的鉴别主要是依靠传统性状鉴别及薄层色谱鉴别等方式,对于经加工处理后失去了性状特征的五倍子制品,如提取物、配方颗粒等,需要建立一个准确、简便、快速的鉴定方法,专属性鉴定五倍子中的五倍子蚜源性成分是建立五倍子配方颗粒鉴别方法的关键。
五倍子配方颗粒经过了高温水煮、干燥、制粒等一系列制备工艺,DNA 高度降解,成品中留存DNA 片段较短、含量较低。使用本研究建立的特异性PCR 方法对多批五倍子药材、标准汤剂冻干粉及配方颗粒等进行检验,结果显示,37 批样品均在100~250 bp 见单一特异性鉴别条带。以上结果表明本研究建立的五倍子特异性鉴别方法对配方颗粒具有良好的适用性,可为五倍子药材及其配方颗粒等加工产品提供相应的检测工具,完善了五倍子的质量控制体系,为其临床应用提供了保障,也可为其他中药品种的配方颗粒鉴别提供参考。
