单体C反应蛋白介导的hedgehog通路对急性心肌梗死心功能的影响
2023-09-27董彬昌岳佳敏刘长梅徐会圃
董彬昌 岳佳敏 刘长梅 徐会圃
滨州医学院附属医院心血管内科 山东 滨州 256600
急性心肌梗死后导致心肌组织缺血缺氧,低氧状态下心肌组织中C反应蛋白(C-recative protein,CRP)增多[1]。目前CRP作为炎症标示因子广泛应用于临床检测, 其用来反映急性炎症过程。CRP存在五聚体pCRP和单体mCRP 2种天然异构体形式,而CRP 发挥其炎症调控作用时很大程度上依赖其单体形式。近期研究发现,mCRP对微血管内皮细胞具有生成作用。mCRP是一种生物活性构象,在发挥促炎作用的同时,越来越多证据表明,mCRP在体内促进迁移、伤口修复和管状结构形成,触发血管生成效应。mCRP是炎症反应的表达产物,有促进血管再生的作用[2],进而抵抗心肌局部的缺血缺氧,保护心功能,是一种缓慢的自我保护机制。hedgehog信号通路在很多器官可以促进血管再生及发挥组织修复作用,在成人心血管系统,hedgehog信号通路主要参与动脉血管的形成并且促进血管再生[3],另一方面在心肌梗死后,该信号通路可以在缺氧条件下引起细胞自噬,并且能够延长心肌细胞存活时间[4]。近年来研究表明,hedgehog信号通路在缺血与氧化应激条件下被激活,并且在心血管再生及保护心肌细胞中起到关键作用,但其对心肌梗死后血管再生及心功能的影响尚不清楚。本研究旨在通过建立兔急性心肌梗死模型,观察正常心肌和急性心肌梗死血液中mCRP及心肌组织中hedgehog蛋白的表达情况,探讨mCRP对hedgehog通路的影响及该蛋白对急性心肌梗死心功能的影响,为临床治疗心肌梗死寻找新的靶点。
1 材料与方法
1.1 急性心肌梗死模型的建立 健康普通级雄性新西兰白兔 2~2.5 Kg 40只,随机分为4组,分别为对照组、手术组(结扎左前降支)、手术+mCRP稳定组、手术+hedgehog激动组,每组10只,并编号。
5%水合氯醛(3 mL/Kg)耳缘静脉注射麻醉,气管插管,接呼吸机(DW-3000B,安徽淮华),呼吸频率为60次/分,潮气量30 mL,呼吸比为1∶1。四个心电图肢导电极分别植入兔四肢皮下,术前记录肢体导联心电图。3个手术组给予剔除毛发及消毒后,沿胸骨左缘,从剑突切口至胸骨中断,钝性分离组织,充分暴露心脏,用5-0缝线在左冠状动脉前降支距离开口约1 cm处结扎。对照组只用缝线穿过前降支,不结扎。2 min后可见左室前壁苍白,再次记录兔肢体导联心电图,II、III、aVF导联ST段抬高可判断模型建立成功,缝合关闭胸腔。术后将1 mL 1,6-双磷酸胆碱-己烷5%生理盐水2 mL混匀,给予10只兔静脉注射,以建立手术+mCRP稳定剂干预组。将1 mg purmorphamine 5%生理盐水2 mL混匀,给予另外10只兔静脉注射,以建立手术+hedgehog激动剂干预组。操作完成后给予每只兔注射40万单位青霉素以预防感染。
模型建立12 h后各组兔均取血液标本,碘伏消毒耳缘静脉,于耳缘静脉抽取静脉血液1 mL置于EP管中,3 000转/min离心机离心10 min,将上清液取出放置于-80℃冰箱保存。同时各组随机选取5只兔留取心脏组织,打开手术切口,取出部分梗死心肌组织,用生理盐水灌洗,置于4℃冰箱保存。各组剩余5只兔待8 w后检测其心功能指标。
1.2 ELISA检测血液中mCRP水平 将原标准品(300 μg/mL)以及标准品与稀释缓冲液以相同容量混匀,依次配置300、150、75、37.5、18.75 μg/mL的测试标准溶液。加入待检测mCRP标准品及待测血液标本,对照孔只加底物A、底物B两种显色剂以及终止液,标准品孔各加入HRP及标准品50 μL,待检测孔加入40 μL待测血液标本+50 μL HRP+10 μL抗mCRP抗体。温育、洗涤、显色,调零空白孔,在450 nm波长处测量酶标板孔OD值。
1.3 Western blot检测心肌组织中hedgehog水平 梗死心肌组织研磨至看不见颗粒,加入细胞裂解液,离心后取上清液即为蛋白样本。按5×上样缓冲液的比例加入蛋白样品及缓冲液充分混匀,99℃加热变性10 min,再以10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后,将蛋白电转仪至PVDF膜上。使用blocking buffer封闭后,滴加SHH单克隆抗体(稀释比例为1∶1 000)后4℃封闭过夜,再加辣根过氧化物酶标记山羊兔二抗(稀释比例为1∶20 000),37℃温育2 h,经Super-GL ECL超敏发光液进行化学发光检测并对其光片曝光,经显影定影处理后,晾干的胶片最后用凝胶成像分析系统拍照,本实验采用Gel-Pro Analyzer软件来分析处理。
1.4 超声心动图检测心功能 各组剩余5只兔于术后8 w后耳缘静脉注射水合氯醛(3 mL/Kg)麻醉,固定后剔除兔胸毛,充分暴露胸部。采用VividE9型彩色多普勒超声诊断仪,高频探头(12 MHz),设置深度4 cm,取兔胸骨旁左室短轴切面分别测量各组兔心脏左室舒张末期内径(left ventricular end diastolic diameter,LVIDd)、射血分数(ejection fraction,EF)、缩短分数(short axis shortening rate,FS)及心输出量(cardiac output,CO)。
1.5 ELISA检测血清中NT-proBNP水平 各组剩余5只兔给予耳缘静脉采血3 mL,ELISA检测各组中NT-pro-BNP含量,步骤同1.3,严格按照试剂盒说明书进行操作。
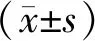
2 结果
2.1 ELISA检测各组中mCRP的表达 手术组兔造模4 h后死亡1只,手术组及手术+hedgehog激动剂干预组的mCRP水平明显高于对照组及手术+mCRP稳定剂干预组mCRP水平,P<0.01(表1)。
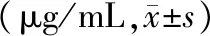
表1 各组兔在手术后12 h mCRP的水平
2.2 Western blot检测各组中hedgehog蛋白表达 hedgehog蛋白在手术组及对照组均表达,手术组中hedgehog蛋白表达水平明显高于对照组,手术+mCRP稳定剂干预组中hedgehog通路表达同对照组表达相当,手术+hedgehog激动剂干预组中其表达水平高于其他组,P<0.05。各组心肌组织中hedgehog通路表达条带见图1、2。

图1 各组心肌组织中hedgehog通路蛋白Western blot条带
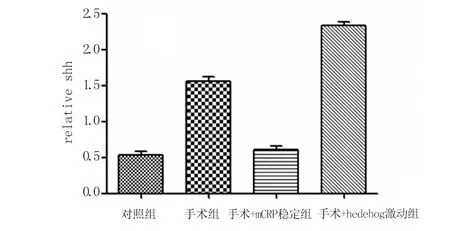
图2 各组hedgehog蛋白表达量的比较
2.3 8 w后兔心功能指标情况对比 手术+mCRP稳定组兔在第21 d时死亡1只,与对照组比较,手术组兔的LVIDd增大,EF、FS及CO降低,P<0.05。与手术组及手术+mCRP稳定组比较,手术+hedgehog激动剂干预组兔的LVIDd减小,EF、FS及CO增加,P<0.05。手术+mCRP稳定剂干预组兔的心功能指标与手术组比较,差异均无统计学意义(表2)。

表2 各组兔在手术8 w后心功能指标结果
2.4 兔血清中NT-proBNP含量变化 与对照组比较,手术组、mCRP稳定剂干预组的NT-proBNP含量明显增高,P<0.01。与手术组和手术+mCRP稳定剂干预组比较,手术+hedgehog激动剂干预组的NT-proBNP含量显著降低,P<0.01。各组兔的心功能指标见表3。

表3 各组兔血清中NT-proBNP含量测定结果
2.5 急性心肌梗死后mCRP与hedgehog信号通路的相关性 心肌梗死后心肌组织中hedgehog信号通路与血液中mCRP表达水平呈正相关(r2=0.94,P<0.05)。见图3。

图3 心肌梗死后hedgehog通路与mCRP的相关性
3 讨论
随着对急性心肌梗死发病机制的深入研究,发现有多种炎症因子参与心肌梗死病理生理过程[5],这些炎症因子包括肿瘤坏死因子(tumor necrosis factor,TNF)、CRP、趋化因子(chemotactic factor,CK)、白介素(interleukin,IL)、缺氧诱导因子1(hypoxia-inducible factor 1,HIF1)等[6]。这些因子除了发挥炎症作用,也有其积极作用,譬如mCRP及HIF1均是炎症反应的表达产物,有促进微循环血管再生及介导细胞保护的作用[2],能够在一定程度上改善心肌预后。急性心肌梗死后mCRP是否通过上调hedgehog信号通路表达改善急性心肌梗死的预后,目前国内外尚未见相关报道。
mCRP是由CRP解聚而来,CRP是多种炎症反应的标志物,同时其本身也参与炎症反应[7]。CRP由5个非共价键连接的亚单位组成,在人血浆中,CRP均以环状或圆盘状的五聚体(pCRP,分子量115 kDa)形式存在,pCRP可通过酸、脲变性、热处理或聚苯乙烯板诱导解离出mCRP[8]。通常mCRP被认为有动脉粥样硬化和致血栓作用,与心血管事件风险增加密切相关。本研究发现,手术组患者血浆中mCRP水平较对照组明显升高。mCRP是一种生物活性构象,mCRP在发挥促炎作用的同时,还能促进细胞迁移、伤口修复和管状结构形成,触发血管生成效应[7]。Khreiss[9]等研究表明,mCRP通过细胞内过亚硝酸根信号、NF-κB及AP-1引发中性粒细胞IL-8分泌,进而介导一系列的病理生理进展过程。有研究也发现mCRP的促炎作用不只局限于白细胞,在体外培养的冠状动脉内皮细胞中,ICAM-1、VCAM-1、IL-8及单核细胞趋化蛋白-1的表达上调[10]。F3基因编码的蛋白质是一种跨膜信号受体,参与炎症和血管生成,是动脉壁重塑的重要参与者。Pea等[2]表明F3基因沉默时mCRP不表现出促血管生成效应,mCRP在微血管内皮细胞(microvascular endothelial cells,mECs)中的促血管生成效应依赖于活化的F3基因。Wu等人观察了在CRP-转基因小鼠颈动脉的组织因子表达,发现CRP可诱导平滑肌细胞内活性氧生成[11]。并且Cirillo等[12]发现CRP不仅在血管平滑肌细胞中,在微血管内皮细胞也可介导血管生成。种种研究发现mCRP与心血管疾病的发生发展有密切关系,不仅仅是心血管疾病的危险因素,还可以作为心血管事件的预测因子,在急性心肌梗死后对梗死区域血管再生及细胞保护作用也值得我们探索,因此对CRP更加深入的研究具有重大意义。
hedgehog信号通路在很多器官可以促进血管再生及发挥组织修复作用[3],在成人心血管系统里,hedgehog信号通路主要参与动脉血管的形成并且促进血管再生,多个心梗造模试验研究证明,Shh通路在急性心肌梗死后表达增加,并且在hedgehog信号通路激活情况下会增加心肌细胞的存活率[13],激活hedgehog通路可以减少心肌缺血造成的细胞凋亡。hedgehog基因于1980年首次在果蝇体内发现,该基因被归类为分节基因,是一种编码过度保守的糖蛋白,实验中果蝇胚胎在该基因突变后成多毛团状,形似受惊吓的刺猬因而得名。hedgehog信号通路通常以惰性状态存在于脊椎动物和非脊椎动物中,在表达上有高度保守的特点,但在许多生物体生长发育过程中起着不可或缺的作用[14]。hedgehog信号通路在很多器官可以促进血管再生及发挥组织修复作用[15]。在成人心血管系统里,hedgehog信号通路主要参与动脉血管的形成并且促进血管再生[3],心肌梗死后,该信号通路可以在缺氧条件下引起细胞自噬,并且能够延长心肌细胞存活时间。
hedgehog信号通路由配体hedgehog、膜蛋白受体Patched与 Smoothened、胶质母细胞瘤转录因子及下游靶基因组成。配体hedgehog属于分泌型糖蛋白,在脊椎动物中hedgehog家族由Indian hedgehog、Sonic hedgehog和Desert hedgehog3种配体组成[16],其中Ihh表达于内脏及软骨细胞,Dhh表达于间质细胞,而Shh广泛表达于多个发育过程,是最具典型特征的一个分支。
本研究发现,手术组心肌组织中hedgehog蛋白水平明显高于对照组。hedgehog通路能够促进血管再生和改善血流灌注,这得益于缺血缺氧后hedgehog通路上调,其下游基因的上调也十分明显,此过程伴有F3、TF、Ang-1及VEGF等促进血管生成因子的表达,与mCRP在促进微血管生成过程中有相同环节,心脏组织缺血、缺氧时,在hedgehog和 Ptc表达水平增加的基础上[17],不仅能够促进骨髓来源的内皮祖细胞诱发血管生成[18],而且促进心脏微血管内皮细胞中血管生成因子,包括血管生成素和血管内皮细胞生长因子的表达。
在兔急性心肌梗死后发现mCRP及hedgehog均有明显升高,猜想两者是否存在上下游因子之间关系和调节转化作用。本研究发现,心梗后当应用CRP稳定剂后,hedgehog表达明显减少,本组中兔心功能指标出现下降,结合Pearson相关性分析说明hedgehog信号通路表达与mCRP呈正相关,其原因可能为mCRP可诱导平滑肌细胞内活性氧生成,通过逐级链式反应激活hedgehog信号通路。
氨基末端脑钠尿肽(N-terminal pro-B-type natriuretic peptide,NT-proBNP)是国内外(ECS/ACC/AHA/HFSA/CSC)心力衰竭指南均推荐的心力衰竭首选血清标志物,NT-proBNP在早期或轻度心衰的检测中具有较高敏感性,同时NT-proBNP也具备定量性,其数值越高则代表心功能越差。当应用hedgehog通路激活剂激活该通路后,本组模型中NT-proBNP产生含量较低,反映该组兔心功能优于其他手术组,一方面为该蛋白大量表达后促进心脏微血管再生,进而保护心肌细胞,另一方面也可能为hedgehog通路激活可以诱导自噬[19],通过细胞自噬能够维持细胞结构、功能和代谢的需要[20]。
综上所述,急性心肌梗死后mCRP和hedgehog通路表达上调,可能有利于梗死区域微血管的生成及诱导自噬作用增强,从而有利于急性心肌梗死心功能的改善。而这种作用可能是通过mCRP激活hedgehog通路表达来实现,但是两者之间的关系和调节转化作用尚不清楚,有待于对其具体机制的进一步研究。
