地黄饮子对缺血性脑卒中的血管新生作用及机制研究
2023-09-27王欣宇孟维然徐晓艳李丽娅宫健伟
王欣宇 孟维然 徐晓艳 李丽娅 闫 超 叶 蕾 宫健伟
1 滨州医学院康复医学院 山东 烟台 264003;2 潍坊市中医院 山东 潍坊 261000
脑卒中是临床中老年人常见的一种脑血管疾病,同时也是当前患者死亡的首要原因。脑卒中包括缺血性脑卒中和出血性脑卒中两种,其中缺血性脑卒中患者数占脑卒中总数的80%[1]。缺血性脑卒中,又名脑梗死,其最基本的病理过程是局部缺血导致的脑组织供氧严重不足,常由与脑组织供血的相关动脉血管发生闭塞引起。对于该病的临床治疗,西医主要采取血管再通、改善脑循环、促进血管及神经再生以及置入动脉支架等措施。其中药物溶栓是目前最有效的治疗方法,然而药物溶栓受到缺血/再灌注损伤潜在损害的限制[2-3]。地黄饮子,为民间名方,其有效成分主要为熟地黄、山茱萸、巴戟天、肉苁蓉、炮附子、石斛、肉桂、五味子、茯苓、麦冬、远志、石菖蒲、 生姜、大枣等。研究表明,地黄饮子具有抗炎、抗氧化应激、抗凋亡、促脑血管组织重构等作用,为脑卒中的治疗提供了新方法[4-6]。
血管新生在恢复脑组织的氧供方面具有明确的作用[7]。血管新生是毛细血管网再生的一种,它是在原血管的解剖结构基础上进行的,其主要实现方式是血管内皮细胞的分裂与再生,使其功能与局部需要相适应的生物学过程[8-9]。因此,血管新生与缺血性脑卒中之间联系的分子机制值得更为深入的研究。在脑缺血再灌注损伤机制中炎症反应与血管新生都属于为抵抗损伤所形成的防御机制,两者在脑缺血再灌注生理病理过程中关系密切。课题组前期从多角度验证了地黄饮子对脑缺血的脑保护作用[10]。实验研究证实在脑缺血模型大鼠脑组织中,应用地黄饮子可以促进血管内皮生长因子(vascular endothelial growth factor,VEGF)的释放和表达,并且可以有效地促进脑缺血再灌注模型大鼠脑组织缺血区域的血管新生[11]。然而地黄饮子促进脑缺血血管新生的作用机制尚不明确。本研究采用氧糖剥离再灌注(oxygen glucose stripping reperfusion,OGD/R)细胞损伤模型和缺血/再灌注损伤大鼠模型,观察地黄饮子促进细胞增殖和对血管新生的作用,探讨其对大脑保护作用的机制,为临床应用地黄饮子治疗脑缺血疾病提供理论基础。
1 材料与方法
1.1 实验细胞 PC12细胞由武汉普诺赛生命科技有限公司提供。
1.2 实验动物 购买实验性SPF级雄性SD大鼠50只,8周龄,体质量控制在(250±50)g,由济南朋悦实验动物繁育有限公司提供,动物质量合格证号为1107261911003054,许可证号为SCXK(鲁)20190003。
1.3 实验药物及试剂 地黄饮子按原方比例(熟地黄、山茱萸、巴戟天、肉苁蓉、炮附子、石斛、肉桂、五味子、茯苓各30 g,麦冬、远志、石菖蒲各15 g, 生姜3片、大枣2枚)配伍(山东省滨州医学院附属医院门诊部中药房)提供,药物用10倍量和8倍量的水煎煮2次,每次1 h,合并水煎液,用旋转蒸发仪浓缩,于 4 ℃恒温冰箱保存。水合三氯乙醛(北京百灵威科技有限公司),用生理盐水配置为10%水合氯醛、高效RIPA组织/细胞裂解液(上海碧云天生物公司)、Western blot凝胶试剂盒、彩虹marker(北京索莱宝科技有限公司)、鼠抗β-actin多克隆抗体(上海远慕生物科技有限公司)、兔抗PI3K单克隆抗体、兔抗p-PI3K多克隆抗体、兔抗AKT多克隆抗体、兔抗p-AKT多克隆抗体、兔抗eNOS多克隆抗体、兔抗p-eNOS单克隆抗体(艾博抗(上海)贸易有限公司)、兔抗VEGF多克隆抗体(武汉三鹰生物技术有限公司)、高糖DMEM细胞培养基、青-链霉素混合液(100×)、无糖DMEM细胞培养基(美国HyClone公司)、胎牛血清(美国GIBCO公司)、胰蛋白酶-EDTA消化液(南京康成生物园)、二甲基亚砜(永力学试剂有限公司)、EdU试剂盒 (北京全式金生物技术有限公司)、MTT试剂盒(上海炎熙生物科技有限公司)。
1.4 实验仪器 超净工作台(西班牙TELSTAR公司)、CO2培养箱、三气培养箱(美国THERMO公司)、荧光倒置显微镜(德国Leica公司)、高内涵(美谷分子仪器(上海)有限公司)、电子天平(上海良平仪器仪表有限公司)、电热恒温水浴锅(南京建成仪器公司)、离心机(上海博翎精锐设备有限公司)、高压蒸汽灭菌器(松下健康医疗器械株式会社)、低温离心机(德国Eppendorf公司)、倒置荧光显微镜(德国Leica公司)、多功能酶标仪(德国BMG Labtech)蛋白电泳转移系统购于美国 Bio-Rad 公司。
1.5 造模方法
1.5.1 PC12细胞OGD造模方法 先用胰蛋白酶消化收集PC12细胞,根据种板所需总液体量,将细胞浓度稀释至5×104/mL。在96孔板最外围一周每孔加入200 μL PBS防止边际效应,其余实验孔中加入细胞悬液,每孔100 μL,于细胞工作超净台中静置稳定10 min,种板后于正常培养箱培养24 h,贴壁结束后每孔换为无糖无血清培养液100 μL,于三气培养箱培养4 h,制备细胞OGD模型。
1.5.2 大鼠双侧颈总动脉夹闭再灌注损伤(bilateral common carotid artery occlusion reperfusion ischemic injury,BCCAO/R)模型的制备 SD大鼠术前禁食12 h。用10%水合氯醛腹腔注射麻醉大鼠后,仰卧位固定,备皮后切开颈前皮肤,暴露两侧颈总动脉,并将其与迷走神经分离,用无创动脉夹夹闭两侧颈总动脉30 min,造成大鼠急性脑缺血。30 min后松开动脉夹再灌注30 min,30 min后再次用无创动脉夹夹闭两侧颈总动脉30 min,松开后缝合结束模型制备。整个手术造模过程,均用浸有温热生理盐水的纱布覆盖切口表面。
1.6 分组及给药 PC12细胞设定组别为正常组(对照组和地黄饮子80 μg/mL组)和模型组(OGD/R模型组和OGD/R模型+地黄饮子80 μg/mL组)。雄性SD大鼠50只,饲养于滨州医学院实验动物中心,适应性喂养一周,根据体质量随机分为5组,分别为假手术组,模型组,地黄饮子低、中、高剂量(8、16、32 g·kg-1)组,每组10只。
1.7 实验方法
1.7.1 MTT法检测各组细胞存活率 分组处理结束后,将96孔板取出,给药组每孔加入200 uL PBS润洗1遍以防止药物着色的影响,然后加入新鲜的完全培养液200 μL 。在避光条件下所有实验孔每孔加入20 μL MTT液体,于37℃培养箱中孵育3 h。孵育结束后,在避光情况下,用移液器轻轻吸除各孔内的液体,然后150 μL/孔DMSO排枪加入,振荡器震荡10 min,酶标仪490 nm波长检测吸光度值。

按照如上公式计算PC12细胞的增殖率,以地黄饮子的浓度为X轴,PC12细胞的增殖率为Y轴画出线性回归曲线。
1.7.2 倒置显微镜下观察细胞形态 消化离心收集细胞,在两组6孔板中加入细胞悬液。24 h贴壁完成后,正常组于正常培养箱培养4 h。模型组换为无糖无血清培养液于三气培养箱培养4 h,建立细胞OGD/R模型。加药完成后,静置稳定15 min,然后放回正常培养箱24 h。最后,于倒置显微镜下观察,并用高内涵拍照记录。
1.7.3 EdU染色检测阳性细胞率 按照不同实验组处理细胞,完成后进行EdU染色。EdU工作液发挥作用后,PBS 1 mL润洗细胞2遍,再固定15 min。固定结束,用配比好的细胞通透液于室温环境通透时间15 min。向两组6孔板中每孔加入染色工作液1.2 mL,于室温环境避光条件处理30 min。再向两组6孔板每孔加入1.2 mL Hoechst反应液,于室温环境避光条件处理15 min。最后,将6孔板放于荧光倒置显微镜下观察,并用高内涵拍照记录。
1.7.4 Western blot法检测蛋白水平 用含有蛋白酶抑制剂的裂解液提取总蛋白,采用BCA法测量蛋白浓度。蛋白变性后,恒压 SDS-PAGE,半干法转膜PVDF膜。5%脱脂牛奶封闭1 h,Ⅰ抗4℃孵育过夜,Ⅱ抗室温孵育1 h,每一步孵育后均使用TBST洗膜15 min×3 次。ECL发光检测,用Image J软件测量图像灰度值进行分析。
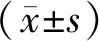
2 结果
2.1 地黄饮子对PC12细胞活力的影响 MTT法通过增殖率的计算,结果显示,在正常培养条件下,与对照组相比,不同浓度的地黄饮子(10、20、40、80、160、320、640 μg/mL)剂量组增殖率显著升高(P<0.05 或P<0.01)。根据实验结果的稳定性,筛选出给药浓度为80 μg/mL,用于后续实验。见图1。
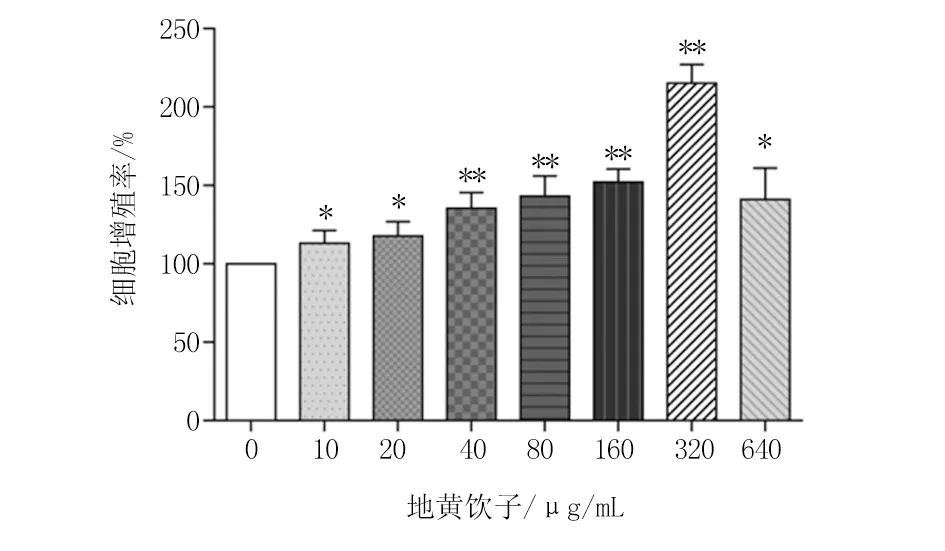
图1 不同浓度地黄饮子处理24 h后PC12细胞活力的变化(n=3)
2.2 OGD/R模型对PC12细胞活力的影响 MTT法检测细胞OGD/R模型增殖率,结果显示,与对照组相比,2、4、6、8 h模型组增殖率显著降低(P<0.05或P<0.01)。OGD损伤时间与细胞增殖率呈反比,OGD损伤时间延长,细胞增殖率逐渐降低,OGD/R模型损伤了细胞的活力。根据实验结果的稳定性,最终筛选OGD损伤时间为4 h,用于后续实验。见图2。
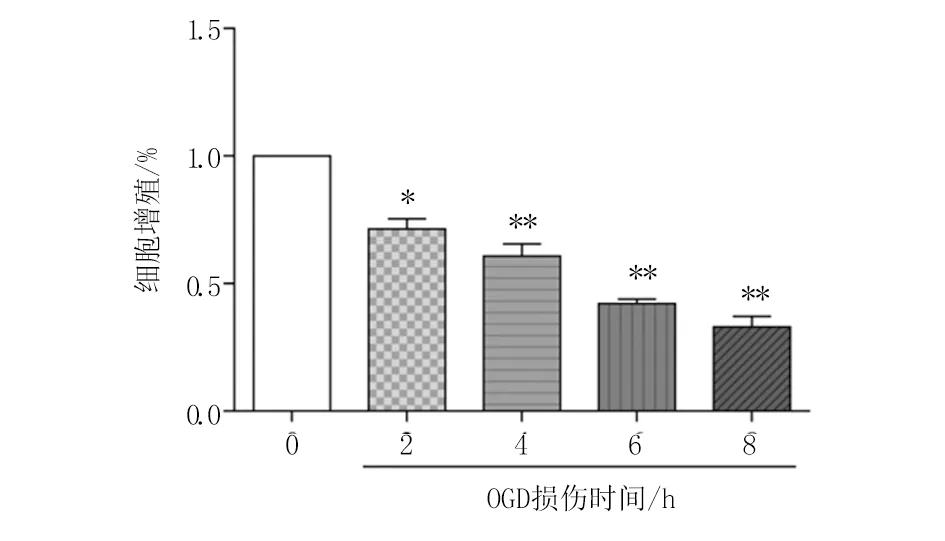
图2 不同OGD损伤时间对PC12细胞细胞活力的变化(n=3)
2.3 地黄饮子对PC12细胞形态学的影响 荧光倒置显微镜下观察发现:正常组细胞形态呈梭型,与对照组比较,地黄饮子80 μg/mL组细胞数量增多;与正常组比较,模型组细胞形态皱缩,细胞数量减少,其中OGD/R模型组细胞形态明显皱缩,细胞数量明显减少。见图3。

图3 显微镜下观察地黄饮子对PC12细胞形态的影响
2.4 地黄饮子对PC12细胞增殖的影响 EdU染色显示细胞增殖能力。与对照组比较,地黄饮子80 μg/mL组蓝色、黄色荧光数量增加,EdU阳性率占比增加(P<0.05,P<0.01)。与正常组比较,模型组蓝色荧光、黄色荧光减少,EdU阳性率占比减少(P<0.05,P<0.01),与OGD/R模型组比较,OGD/R模型+地黄饮子80 μg/mL组蓝色、黄色荧光明显减少,EdU阳性率占比减少明显,P<0.01。见图4。

A. PC12细胞EdU染色荧光图像;B. PC12细胞EdU染色荧光定量图(n=3)。
2.5 地黄饮子对PC12细胞通路相关蛋白的影响 Western blot结果显示,与对照组比较,地黄饮子80 μg/mL组PI3K、AKT、eNOS蛋白表达无明显变化,p-PI3K、p-AKT、p-eNOS蛋白表达升高(P<0.05);与对照组比较,OGD/R模型组PI3K、AKT、eNOS蛋白表达无明显变化,p-AKT蛋白表达降低(P<0.05),p-PI3K、p-eNOS蛋白表达明显降低(P<0.01)。与OGD/R模型组比较,OGD模型组+地黄饮子80 μg/mL组PI3K、AKT、eNOS蛋白表达无明显变化,p-PI3K、p-AKT、p-eNOS蛋白表达升高(P<0.05)。见图5。
A. PI3K和p-PI3K、AKT和p-AKT、eNOS和p-eNOS蛋白条带;B.PI3K和p-PI3K蛋白检测结果定量分析;C. AKT和p-AKT蛋白检测结果定量分析;D. eNOS和p-eNOS蛋白检测结果定量分析。
2.6 地黄饮子对大鼠脑组织通路相关蛋白及VEGF表达的影响 Western blot结果显示,地黄饮子中剂量组p-PI3K蛋白表达明显升高(P<0.01),p-AKT、p-eNOS蛋白表达升高(P<0.05),地黄饮子低、高剂量组p-PI3K、p-AKT、p-eNOS蛋白表达明显升高(P<0.01)。与假手术组比较,模型组大鼠脑组织VEGF表达明显升高(P<0.01)。与模型组比较,地黄饮子各剂量组大鼠脑组织VEGF表达升高(P<0.05)。见图6。
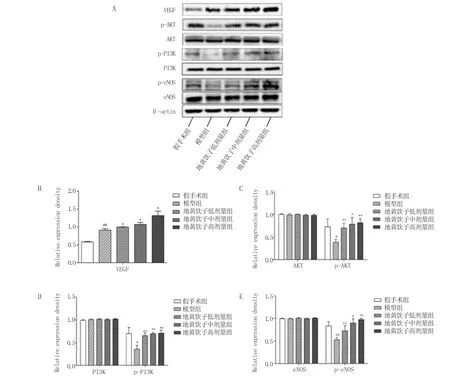
A.PI3K和p-PI3K、AKT和p-AKT、eNOS和p-eNOS、VEGF蛋白条带;B.VEGF蛋白检测结果定量分析;C.AKT和p-AKT蛋白检测结果定量分析;D.PI3K和p-PI3KT蛋白检测结果定量分析;E.eNOS和p-eNOS蛋白检测结果定量分析。
3 讨论
缺血性脑卒中因致残率高且发病急,已然成为现代社会中老年人不可避免的健康隐患。脑卒中的发病机制复杂,且影响因素众多,治疗效果也不理想。通过药物溶栓或者手术取栓实现局部血管再灌注,可以减缓阻塞程度,但由于再通时间短暂且不能根治,导致再灌注损伤,造成更严重的后果。采用地黄饮子从脑卒中的病理机制出发,从根本上解决脑卒中的危害。从促血管新生的角度出发,构建血液循环通路,从而减轻脑卒中局部血流受阻的影响。
血管新生是指根据血管内皮细胞的各项运动方式形成新的血管的一种生物学过程[12]。血管新生的调控因子与通路多种多样,其中胞内磷脂酰肌醇激酶(phosphatidylinositol3-kinase,PI3K) /丝氨酸苏氨酸蛋白激酶(amino acid threonine protein kinase,AKT)[13]通路是目前研究较明确的缺血后促进血管新生的机制之一。PI3K 可以使肌醇环第三位羟基磷酸化[14]。PI3K细胞外活化信号来源于多种生长因子和信号传导复合物,如VEGF等[15]。PI3K与AKT之间的链接涉及磷脂酰肌醇-4,5-二磷酸(Phosphatidylinositol 4,5-diphosphate,PIP2)和磷脂酰肌醇-3,4,5-二磷酸(Phosphatidylinositol 3,4,5-diphosphate,PIP3)2个代谢物。首先PI3K加一个3位磷酸基团后使PIP2磷酸化为PIP3,PIP3充当第二信使将磷酸肌醇依赖性蛋白激酶-1(phosphoinositidedependen tkinase-1,PDK1)和AKT聚集到细胞膜上[16]。AKT被认为是PI3K/AKT信号通路的中枢介质,是PI3K的下游靶点。接下来PDK1、PDK2分别磷酸化AKT蛋白上的不同位点Thr308和Ser473,AKT激活启动发挥效益[17]。AKT进一步通过磷酸化最终导致一些下游靶标如内皮型一氧化氮合酶(endotheLiaL nitric oxidesynthase,eNOS)的磷酸化的发生,进而参与血管新生[18]。另一方面,PI3K/AKT通路的激活又刺激VEGF的表达升高。地黄饮子对PC12细胞内的PI3K、AKT和eNOS总蛋白的表达并没有明显的影响。但是研究发现OGD/R细胞模型损伤下p-PI3K、p-AKT和p-eNOS蛋白表达降低,同时正常组地黄饮子给药处理以及OGD/R模型组地黄饮子给药处理后p-PI3K、p-AKT和p-eNOS蛋白表达升高,地黄饮子促进了PI3K、AKT和eNOS磷酸化蛋白的表达。与细胞实验相同,地黄饮子对大鼠脑组织中的PI3K、AKT和eNOS总蛋白的表达并没有明显的影响,但是在脑缺血再灌注模型损伤下p-PI3K、p-AKT和p-eNOS蛋白表达降低,同时地黄饮子低、中高剂量给药处理后p-PI3K、p-AKT、p-eNOS蛋白以及VEGF表达逐渐升高,这提示地黄饮子促进了PI3K、AKT和eNOS磷酸化以及VEGF的表达。综上所述,地黄饮子发挥促脑缺血再灌注血管新生的作用。
本研究运用了大鼠模型模拟疾病的发生。大鼠脑缺血再灌注模型一直是人脑卒中损伤模型研究中的常用疾病模型[19-23]。在体实验脑缺血再灌注模型的制备中,齐磊等[24]使用改良线栓法研究丙泊酚对脑缺血再灌注大鼠的神经保护作用以及PKA/CREB通路进行了验证。方晓艳等[25]使用结扎法进行实验观察。但是由于老鼠品系、个人解剖手法等的影响[26],模型制备的灵活度、成功率以及稳定性存在较大的差异。本研究在令狐艳等[27]夹闭两侧颈总动脉方法的基础上调整了动脉夹闭、再灌注时间为30 min进行大鼠脑缺血再灌注模型的制备。该方式灵活高效的同时又保证较高的成功率与大鼠存活率,为进一步观察地黄饮子对大鼠脑缺血再灌注的干预作用奠定基础。在细胞实验中,本研究通过改变细胞的培养条件,将高糖完全培养基换为无糖基础培养基,正常培养箱换为三气培养箱对PC12细胞进行OGD细胞缺氧缺糖模型的制备。氧糖剥夺OGD模型近年来被用于细胞水平的人脑卒中损伤模型研究中[28]。李丽丽等[29]通过对PC12细胞建立OGD损伤模型发现知母须根总皂苷对OGD损伤下PC12细胞的保护作用。本研究中首先进行了不同OGD造模时间的研究。研究发现2 h OGD造模时间下细胞基本无损伤,恢复正常培养条件后,细胞迅速恢复;8 h及以上OGD造模时间下细胞损伤严重,恢复正常培养条件后,细胞难以进行进一步实验研究。根据数据的稳定性,选择地黄饮子给药浓度为80 μg/mL与4 h OGD造模时间进行实验。
本研究从促血管新生层面对地黄饮子治疗缺血性脑卒中及脑保护作用机制进行了初步探讨,取得了较为满意的结果。下一步将在此研究基础上,从构建血管和神经细胞再生等相关信号通路等更深层次开展研究,以期揭示地黄饮子治疗缺血性中风的深刻内涵,为临床上合理应用地黄饮子提供实验依据。
