Er:YAG激光处理牙本质对粘接强度影响的研究进展
2023-09-27孙广迪柏婷婷
陈 雪 孙广迪 魏 飞 柏婷婷 朱 松
铒钇铝石榴石(erbium-doped: yttrium-alu minum-garnet,Er:YAG)激光自1989 年起应用于牙体硬组织的实验研究[1],到1997年,美国食品和药物管理局确认Er:YAG 激光用于口腔内硬组织是一种有效和安全的技术[2]。目前,大量的实验室和临床研究表明,Er:YAG 激光能有效地熔融牙本质,对牙髓及周围结构的损伤较小,并且不会引起严重的热副作用[3]。相较于传统临床操作,Er:YAG 激光能保留更多的健康牙体组织、诱导牙髓组织再生[4],且具有抑菌、无震动、少噪音等优势,因此,在牙本质预备中得到日益广泛的应用。本文就牙本质粘接机制、Er:YAG 激光处理牙本质的作用机制和效果以及激光照射牙本质后对粘接强度影响的相关因素作一综述。
一、牙本质粘接的机制
牙本质经机械预备后表面形成一层由有机和无机物质组成的玷污层,玷污层的低表面能阻止了粘接剂成分渗入牙本质,酸蚀-冲洗粘接剂可溶解去除玷污层,使牙本质表面5~8 μm 脱矿,粘接剂成分渗入脱矿的牙本质中形成混合层和树脂突,从而发挥微机械固位[5]。自酸蚀粘接剂可部分溶解玷污层,使牙本质表面部分脱矿,留下的大量羟基磷灰石微晶可与粘接剂中的酸性功能单体发生化学反应,形成树脂渗透且富含钙的混合层,同时发挥微机械固位和化学结合作用[6]。尽管上述技术在牙本质表面处理方面取得了良好效果,但仍存在不足之处,如自酸蚀形成的混合层较薄,酸蚀-冲洗后脱矿层未被粘接剂完全渗入。此外,酸蚀使牙本质脱矿区域抵抗口腔微环境的能力下降,易导致龋坏[7]。
二、Er:YAG激光处理牙本质的机制及效果
当激光光束照射到组织上时,激光能量被吸收、转移、反射和散射,而激光作用于组织的主要机制是吸收,且吸收程度与激光发射的特定波长和目标组织的光学特性有关。Er:YAG 激光是一种以铒、钇、铝石榴石为介质的固体激光,对牙体硬组织预备原理为热消融,其波长为2940 nm,与牙体硬组织中水(3000 nm)和羟基磷灰石的羟基基团(2800 nm)的主吸收峰接近。当激光作用于牙体硬组织时,产生的能量一部分被牙体硬组织中的水和羟基磷灰石大量吸收,水分子汽化,组织内部压力急剧增加,导致牙体硬组织体积膨胀、结构破裂,发生微爆破反应[8],而另一部分能量使牙本质表面发生物理特性和化学成分的改变[9]。由于激光释放的能量主要在浅层牙本质中被吸收和水汽化消耗,因此在很大程度上降低了对牙髓和周围组织造成的热损伤[3],从而实现精准且有选择性的无创切割牙本质。
有研究[10]证明,使用低能量Er:YAG 激光预处理的牙本质呈现典型的粗糙表面,无玷污层,牙本质小管开放,管周牙本质突出,粘接效果较酸蚀组更好。Nahas 等[11]研究证实,使用低能量的Er:YAG 激光预处理牙本质与传统方法相比较,牙本质的粘接强度显著增加。由于激光照射后能去除玷污层,打开牙本质小管,有利于树脂渗入形成树脂突,且聚合后的树脂突可部分封闭牙本质小管,减少微渗漏,最终有利于修复体粘接的稳定和持久[12]。此外,激光预处理牙本质后形成的混合层较传统机械预备厚,对咬合负载下修复体边缘密封性的保持发挥重要作用[13],且修复体在12 个月的评估期内展现出较佳的的临床表现[14]。
然而,有部分学者认为使用Er:YAG 激光预处理牙本质后粘接强度下降。Alaghehmand 等[8]研究证实Er:YAG激光照射后牙本质表面下方出现微裂纹,受损区域的厚度可能超过混合层厚度,导致牙本质的力学性能下降。也有学者证实激光处理后牙本质表面下方5~10 μm 处存在激光改性层,影响与树脂的粘接质量,进而导致临床粘接失败[9]。此外,有研究者使用拉曼光谱证实激光照射后,牙本质中胶原纤维间的交联键被破坏,且酰胺Ⅰ、酰胺Ⅲ和蛋白强度均降低[15]。这种变化导致胶原纤维变性且互相粘连,纤维间隙减少,限制了树脂的渗入,从而导致粘接强度降低[16]。有学者对比研究了Er:YAG 激光与传统机械预备牙本质使用不同粘接系统后粘接性能的变化,发现激光预备后牙本质粘接机制发生了改变,粘接界面没有形成混合层,而是粘接剂直接与牙本质接触,对照组的粘接强度为53.2 MPa,而激光组粘接强度降至41.4 MPa[17]。Mirzaee 等[18]研究表明Er:YAG 激光照射牙本质可以降低碳酸盐和磷酸盐的比,形成更稳定和更不酸溶的化合物,故对粘接剂中酸性单体不敏感,脱矿作用不明显,但是在临床上,更稳定的化合物可能对抑制修复体周围的脱矿和龋坏有一定作用[14]。
笔者认为,不同学者报告的粘接强度的差异与激光的可变参数、牙本质条件不同及粘接剂种类的选择等有关(图1),针对不同条件牙本质使用合适的参数和水冷时,Er:YAG 激光预处理牙本质后能够有效避免胶原纤维变性、产生微裂纹等不利结构,且能提供更大的粘接面积。
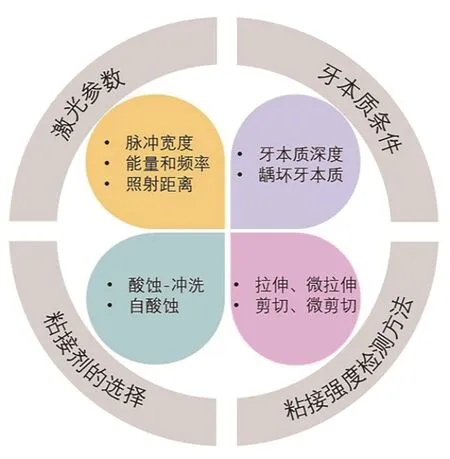
图1 影响Er:YAG激光预处理后牙本质粘接强度相关因素
三、影响Er:YAG激光处理牙本质的因素
1.激光参数:①脉冲持续时间:又称为脉冲宽度,代表激光发射能量的时间段,它直接关系到激光处理牙本质的热效应、消融率和组织形态。Trevelin等[19]在固定参数为80 mJ、2 Hz条件下,分别使用的脉冲宽度为50、300、600 μs激光处理牙本质表面,结果50 μs组得到的牙本质表面形态较其他组更粗糙且不规则,能够更好的保持胶原纤维结构和维持牙本质有机层次的完整性。如果Er:YAG 激光照射的热量过多会导致胶原纤维中稳定多肽链的氢键断裂,胶原纤维发生不可逆的热变性。Trevelin 等[20]也测试了50、300、600 μs 脉冲宽度下Er:YAG 激光预处理后牙本质改性层的厚度,结果显示三组牙本质改性层厚度分别为4.5、5.11、6 μm。此外,使用较短脉冲宽度时,能量用于消融牙体组织的消融率高于热量扩散到组织中的速率,且激光工作时间短,间歇时间长,组织有足够的时间冷却,而使用长脉冲宽度时组织没有足够热量扩散时间,从而导致更深的热损伤[21]。Jiang 等[22]在参数为45 mJ、20 Hz 条件下,测试了激光脉冲宽度分别为20、30、40、50 μs时牙本质消融量和牙髓腔温度的变化,结果显示相同处理时间内,脉冲宽度为20 μs时,牙本质消融量为90 mg,而50 μs 时消融量为62 mg,且20 μs 时髓腔温度的升高速率较低。因此,相同脉冲能量的Er:YAG 激光,与长脉冲宽度相比,短脉冲宽度更有利于牙本质的粘接修复。②脉冲能量和重复频率:脉冲能量表示一次激光脉冲辐射能量,激光的脉冲在一个重复频率下呈周期性发射。Wang 等[23]研究发现能量在50~200 mJ,重复频率在2~20 Hz 时Er:YAG 激光能够更好的打开牙本质小管,且使管周牙本质更突出于表面,形成鳞状和板层状结构。此外,Paryab[24]等研究结果表明,频率为10 Hz 条件下,能量为300 mJ 时所获得的的粘接强度较400 mJ 时增加了14.2%。可能是因为在较高的能量和频率下,激光产生过多的能量和热量,导致牙本质表面形成裂纹以及结构发生崩解,引起有机物的分解使胶原纤维变性,形成热变性层[25],从而阻碍了粘接剂和牙本质相互作用后混合层的形成,影响牙本质强度和生物化学特性。虽然有很多学者研究了不同脉冲能量激光对牙本质粘接强度的影响,但很少有人将两种能量水平的Er:YAG 激光结合使用。在最近的一项研究中,学者使用200 mJ、20 Hz 的激光制备洞型,随后使用80 mJ、10 Hz 的激光进行牙本质表面改性,结果显示自酸蚀模式下使用两种能量水平激光改性较单纯使用高能量水平激光组粘接强度高10.72 MPa[26]。这表明低能量的激光有助于减少或消除热变性层,从而促进树脂的渗透[26]。③照射距离:激光去除牙体组织的量和对周围组织的影响受光纤头与牙本质表面距离的影响。Shirani等[27]研究显示,在其他参数固定条件下,分别使用0.5、2、4、11 mm 的距离照射牙本质,结果无论在酸蚀-冲洗还是自酸蚀组,0.5 mm 组粘接强度最低。此外,Almojaly 等[28]研究发现,照射距离为1 mm 时粘接强度为13.52 MPa,而2 mm 组为23.41 MPa。由此可见,照射距离相对越近,激光释放的热量越大,会干扰牙本质与粘接剂的粘接性能。照射距离相对越远,激光束变为散焦模式,激光的消融作用越温和。
2.牙本质条件:①龋坏牙本质:目前大多数研究都集中在Er:YAG 激光与健康牙本质间相互作用,只有少数研究龋坏牙本质。Cersosimo 等[29]评估了80 mJ、2 Hz、50 μs的Er:YAG激光处理健康和龋坏牙本质后的粘接强度,结果显示激光处理可以改善两种牙本质的粘接强度,但是龋坏牙本质较健康牙本质的粘接强度低5.15 MPa。这是因为与健康牙本质相比,龋坏牙本质较软且管间牙本质孔隙度高,树脂在龋坏牙本质中的渗透率较低,粘接后形成较薄且含有孔隙的混合层[30],对牙本质粘接的稳定性和持久性都会产生负面影响。de Azevedo 等[31]使用了50 mJ、10 Hz、50 μs 的Er:YAG 激光处理健康和龋感染的牙本质,结果证实龋感染牙本质的粘接强度较健康牙本质低。此外,Baraba[32]使用逆转录聚合酶链式反应检测经激光处理后的龋坏牙本质,结果显示龋坏牙本质均无细菌感染。这表明经Er:YAG 激光处理后牙本质化学成分发生改变且机械性能得到了提高,能够有效减少发生继发龋的风险[3]。②不同深度的牙本质:粘接剂和牙本质之间混合层的形成质量受牙本质成分、形态等影响。不同深度牙本质微观结构和化学成分存在差异,导致粘接强度不同[33]。在相同激光参数照射下,Alaghehmand 等[8]研究结果显示深层牙本质较浅层牙本质粘接强度下降了0.21 MPa;Karadas[34]研究结果表明较浅层深1.5 mm的牙本质所得粘接强度降低了12.42 MPa。这可能是因为深层牙本质中的小管直径和密度较大,含水量高,这增加了粘接界面水污染风险,干扰粘接剂单体渗透和聚合,导致纳米渗漏且影响机械性能[34]。此外,深层牙本质中基质金属蛋白酶含量较高,老化后混合层中胶原纤维发生降解[33]。多项研究证明深层牙本质的粘接修复较浅层牙本质更具有挑战性。
3.粘接剂的选择:目前,关于激光照射后牙本质粘接使用何种粘接剂没有明确建议和标准。大量研究表明,在相同条件下,Er:YAG 激光处理后自酸蚀粘接系统能提供更高的粘接强度[16,35]。Comba 等[16]研究参数为30 Hz、250 mJ 的Er:YAG 激光照射后的牙本质与3 种不同粘接系统的粘接强度时发现,自酸蚀粘接系统Clearfil SE Bond 2 的粘接强度为36.8 MPa,而酸蚀-冲洗粘接系统Optibond FL 的粘接强度则为17.2 MPa。Portillo 等[35]研究也证实,两步法自酸蚀粘接剂所获得粘接强度较酸蚀-冲洗粘接剂高42.3%。这可能是因为自酸蚀粘接剂中含有的10-甲基丙烯酰氧基癸基磷酸二氢盐(10-methacryloyloxydecyl dihydrogen phosphate, 10-MDP),可与残留的磷灰石晶体中的钙离子发生化学反应[6],且能够在牙本质的羟基磷灰石周围形成低水溶解度的纳米层结构,通过包裹脱矿的胶原纤维以获得额外的微机械嵌合。相反,酸蚀-冲洗粘接系统中使用的磷酸不仅增加牙本质基质中的能够降解裸露胶原纤维的基质金属蛋白酶(Matrix metalloproteinases, MMPs)的活性,而且还改变了胶原纤维分子的排列,从而促进了胶原纤维与MMPs 之间相互反应[36]。而自酸蚀粘接剂中酸性单体pH 较高,粘接处理后MMPs 活性较小,对胶原纤维的降解也相对较小[33]。
相反,也有研究表明,使用酸蚀-冲洗粘接系统可以消除激光照射牙本质后形成热变性层、裂缝以及鳞状牙本质表面的应力集中等负面影响,提高复合树脂与牙本质的粘接强度[26,37,38]。Elsahn 等[26]将相同参数(200 mJ、20 Hz、50 μs)的Er:YAG 激光与通用粘接剂的自酸蚀和酸蚀-冲洗模式结合使用,结果显示酸蚀-冲洗模式下获得的粘接强度为17.73 MPa,而自酸蚀模式则为12.22 MPa。Vermelho 等[17]研究显示,激光处理后XP Bond 粘接剂所得粘接强度较Clearfil SE Bond 粘接剂高30.6%。可能是由于激光处理后牙本质表面胶原纤维发生变性、凝固[9],而磷酸处理可以增大塌陷胶原纤维间的空隙,在一定程度上恢复胶原纤维的网状结构。此外,激光处理后牙本质再经磷酸酸蚀,开放的牙本质小管口增宽[39],更有利于粘接成分的渗入。因此,可通过辅助使用磷酸酸蚀以弥补激光对牙本质胶原纤维的损伤,提高牙本质的粘接效果[40]。
上述研究的相互矛盾可能与使用的Er:YAG 激光各项参数、粘接剂的不同以及牙本质表面状况有关。虽然有观点认为激光处理后的牙本质再使用酸蚀-冲洗技术可以消除界面下方改性层的负面影响,有利于粘接。但是笔者认为,激光处理再加酸蚀-冲洗技术,对牙本质和牙髓组织的影响较大,技术敏感性和术后敏感性等影响因素较多,而使用自酸蚀粘接技术,无论是在机械固位还是化学结合等方面都可以发挥重要作用,有利于提高粘接界面的耐久性。
4.评价粘接强度的方法:树脂-牙本质粘接修复的持久性可通过合适的粘接强度测试来预测。粘接强度检测方法有宏观的拉伸、剪切强度测试,微观的微拉伸、微剪切强度测试。有学者证实使用相同粘接剂时,宏观测试比微观测试得到的粘接强度值低[41]。因为宏观测试产生的内聚破坏较多,对测试结果有一定的影响。此外,由于剪切强度测试易产生弯矩,界面断裂模式多为混合或内聚断裂,此时所测得的粘接强度没有意义。而微拉伸强度测试是使用约1 mm2的表面测量拉伸粘接强度,能有效控制区域差异,断裂模式更倾向于界面断裂;且因样本较小,有在同一离体牙上产生多个样本的优势,能有效避免牙本质表面出现局部缺陷。目前,微拉伸粘接强度测试是牙本质粘接测试中使用最多的方式[42],且多数学者研究激光处理牙本质后粘接强度时也采用此方法。
综上,Er:YAG 激光作为牙本质表面改性的一种新手段,可以有效去牙本质表面玷污层,打开牙本质小管,形成有利于牙本质粘接的表面形态。虽然已有众多国内外学者对其展开相关研究,但由于Er:YAG 激光处理对牙本质的粘接效果受激光参数、粘接剂种类、牙本质条件、实验条件、评价粘接强度的方法等多因素的影响,且存在个体差异和缺乏临床实践,Er:YAG 激光处理牙本质后粘接效果尚未得出统一定论,因此还需要深入研究确定适合预处理牙本质的各项参数,为其能在临床工作中发挥最佳治疗效果提供参考。此外,Er:YAG 激光处理牙本质后使用酸蚀-冲洗或自酸蚀粘接剂的相关研究较多,但是在激光处理后联合其他牙本质表面改性方法的相关研究较少,因此与激光处理后的牙本质有更好相互作用的新型粘接系统将会是未来的研究热点。
