18F-FDG PET/CT扩散参数联合肿瘤代谢体积评估弥漫大B细胞淋巴瘤患者预后
2023-09-27李佳苗曹小梅李冬菊马小伟杨吉琴
李佳苗,曹小梅,李冬菊,马小伟,王 蓉,王 莹,杨吉琴*
(1.宁夏医科大学总医院核医学科,宁夏 银川 750000;2.宁夏医科大学研究生院,宁夏 银川 750000)
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是恶性程度较高的侵袭性淋巴瘤[1],约1/3经标准方案治疗后仍将进展或复发,且对解救性治疗反应不佳[2-4]。近年来,PET定量代谢参数评估恶性肿瘤预后的价值得到肯定,但无法以之观察肿瘤空间分布[5-7];新的PET扩散参数能反映淋巴瘤播散特性,但可否将其用于评估DLBCL预后的研究较少。本研究观察18F-FDG PET/CT扩散参数联合代谢参数肿瘤代谢体积(metabolic tumor volume, MTV)评估DLBCL患者预后的价值。
1 资料与方法
1.1 研究对象 回顾性分析2017年12月—2021年12月98例于宁夏医科大学总医院接受全身18F-FDG PET/CT检查的DLBCL患者,男44例、女54例,年龄21~87岁、平均(56.2±8.4)岁。纳入标准:①经病理确诊DLBCL;②治疗前18F-FDG PET/CT检查显示至少2个可测量病灶;③临床、影像学及随访资料完整。排除患其他恶性肿瘤或可能影响参数测量疾病患者。
1.2 仪器与方法 采用GE Discovery VCT型PET/CT扫描仪。18F-FDG由日本住友HM-10回旋加速器及All in one自动化合成系统制备,放射化学纯度≥95%。经静脉注射18F-FDG显像剂(3.70~5.5 MBq/kg体质量)后,嘱患者休息60 min,之后排空膀胱、除去金属物品仰卧于检查床,行颅顶至股骨中段PET/CT显像。参数:CT管电压120 kV,管电流25~210 mAs,层厚5.0 mm;采用三维时间飞跃法(time of flight, TOF)采集PET图像,约5~7个床位,每个床位2.5 min,必要时行延迟显像。采用迭代法重建图像,于麦迪克斯工作站行图像融合及后处理。
1.3 图像分析 将PET/CT图像以DICOM格式导入LIFEx 7.0软件[8],由至少2名具有3年以上工作经验的核医学医师判读PET/CT图像。软件以41%最大标准摄取值(maximum standard uptake value, SUVmax)为阈值自动勾画ROI,经医师手动剔除良性病灶及生理性摄取后,自动输出所有病灶的SUVmax、MTV和病灶糖酵解总量(total lesion glycolysis, TLG),MTV及TLG均指全身DLBCL病灶的总和;同时自动测算4个PET扩散参数,即相离最远2个病灶间距(Dmaxpatient)、全身最大病灶与其相离最远病灶间距(Dmaxbulk)、全身最大病灶与其他所有病灶间距的总和(SPREADbulk)及全身所有病灶与其他所有病灶间距的总和(SPREADpatient),测量起止点均为各病灶中心。以上参数每名医师测量1次,计算平均值作为最终结果。
1.4 临床资料 记录患者一般资料、临床资料及后续治疗方案等。随访至2022年5月1日,记录无进展生存期(progression free survival, PFS),即确诊至首次发现疾病进展、复发、死亡或随访截止的时间间隔。
1.5 统计学分析 采用SPSS 26.0统计分析软件。以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示非正态分布的计量资料。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评价各参数预测DLBCL患者预后的效能,将AUC>0.6的参数纳入Kaplan-Meier生存分析。采用Log-Rank检验进行组间比较,以Cox回归模型进行多因素分析,筛选影响DLBCL患者预后的独立因素。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 所有患者均接受类R-CHOP化疗方案治疗,其中83.67%(82/98)接受6~8个化疗周期,6.12%(6/98)接受<6个周期,10.20%(10/98)因肿瘤复发或进展调整为4个周期ICE化疗方案。中位随访时间为23.7(11,35)个月,中位PFS为17.2(8,24)个月。详见表1。
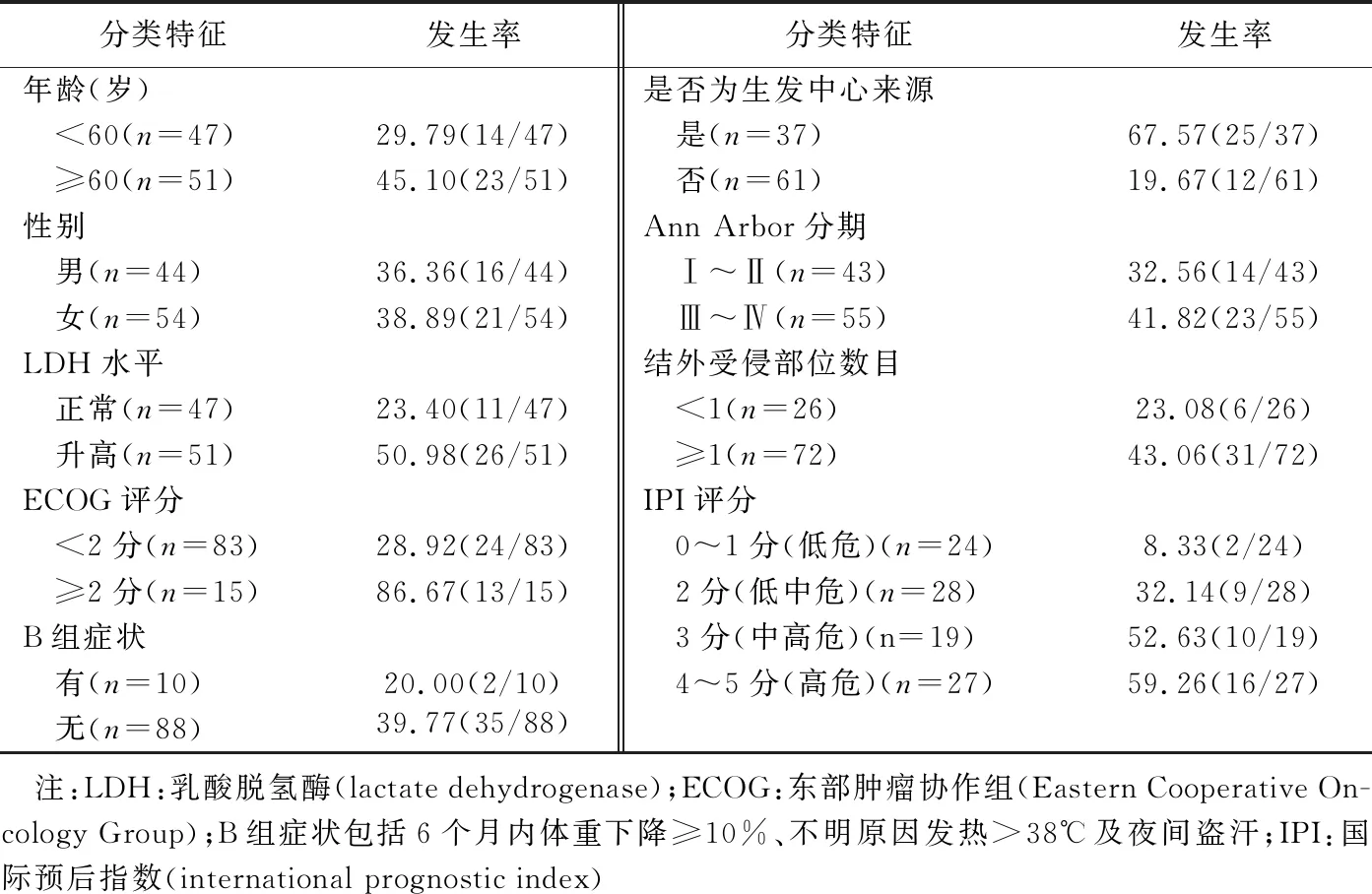
表1 98例DLBCL疾病进展发生率[%(例)]
2.2 PET定量参数 98例DLBCL的中位SUVmax为20.45(16.70,25.73),MTV为525.50(165.25,941.25)cm3,TLG为3 367.00(708.25,8 180.75)cm3,Dmaxpatient为52.25(27.30,73.72)cm,Dmaxbulk为48.05(21.23,66.48)cm,SPREADbulk为172.85(64.80,441.20)cm,SPREADpatient为618.45(122.20,1 772.60)cm。
2.3 生存分析 ROC曲线分析显示,代谢参数中,MTV预测PFS效能最高(AUC=0.69),截断值取347.00 cm3时,其敏感度为0.87,特异度为0.69;扩散参数中,Dmaxpatient预测PFS效能最高(AUC=0.67),截断值取50.10 cm时,其敏感度为0.65,特异度为0.61,见表2及图1。
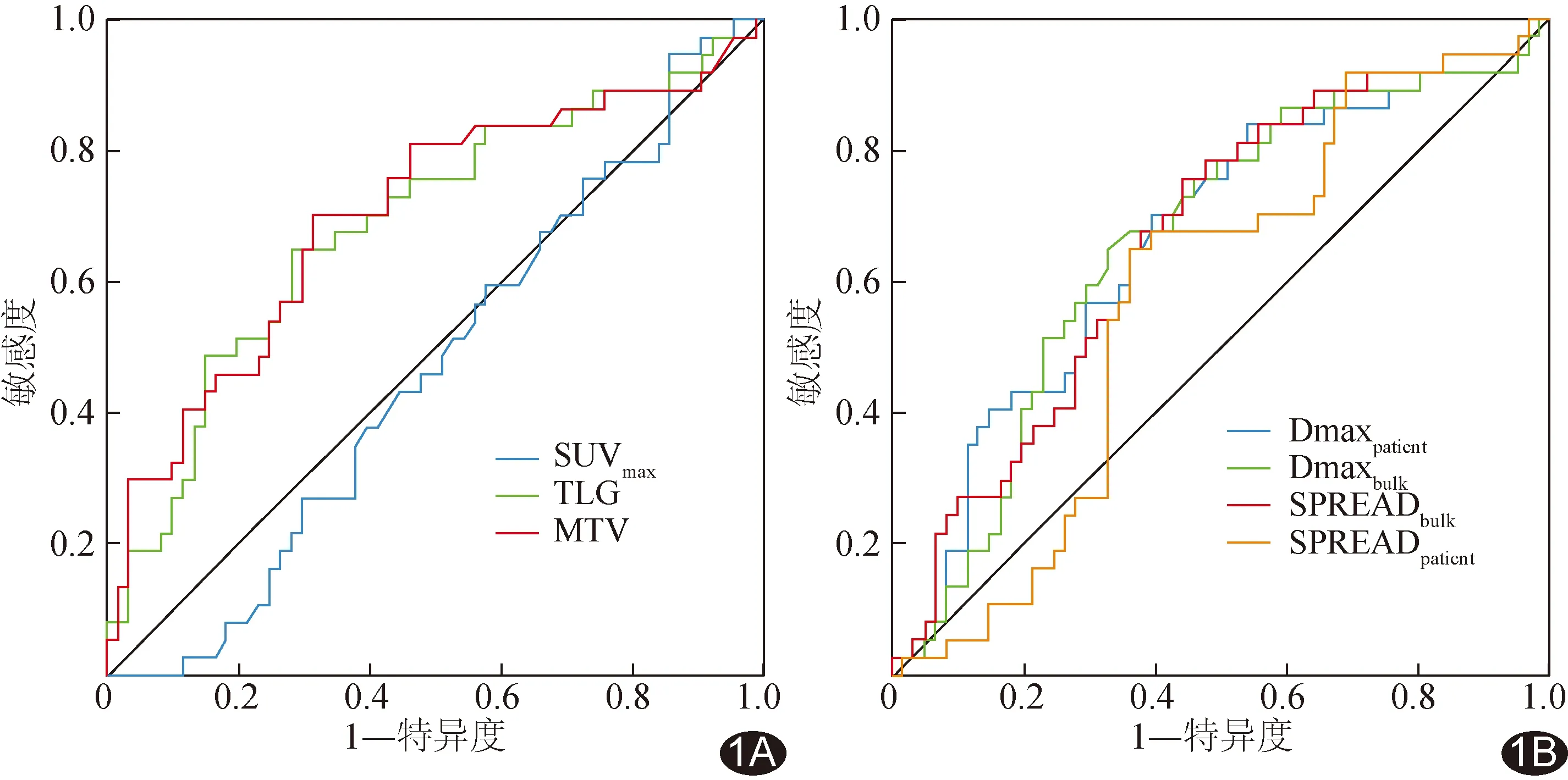
图1 PET定量参数预测DLBCL患者PFS的ROC曲线 A.代谢参数; B.扩散参数
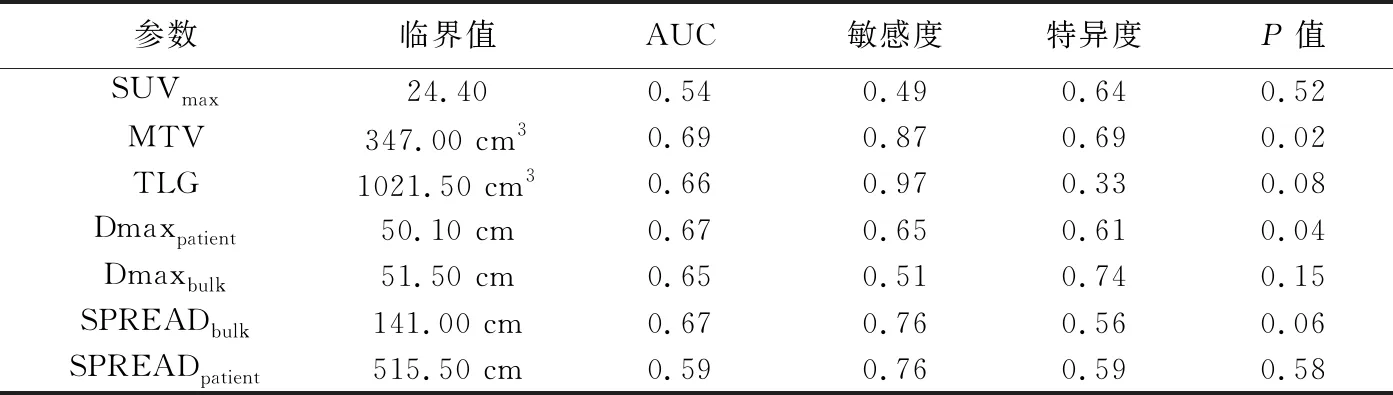
表2 PET定量参数预测DLBCL患者PFS的效能
2.4 预后影响因素 Log-Rank检验显示,年龄、LDH、ECOG评分、是否为生发中心来源、Ann Arbor分期、MTV、TLG、Dmaxpatient、Dmaxbulk及SPREADbulk均是PFS的影响因素(χ2=4.89~9.88,P=0.002~0.03)。Cox回归模型显示,LDH[风险比(hazard ratio, HR)=3.16,95%CI(1.07,9.34),P=0.03]、ECOG评分[HR=2.95,95%CI(1.87,44.30),P=0.02]、MTV[HR=1.81,95%CI(1.36,27.26),P=0.01]、Dmaxpatient[HR=3.22,95%CI(0.90,10.96),P=0.01]和SPREADbulk[HR=1.18,95%CI(0.31,4.90),P=0.03]均为影响PFS的独立因素。
2.5 早期危险分层 以Dmaxpatient≥50.10 cm与MTV≥347.00 cm3作为危险因素对患者进行分组分析,高危组(n=38)Dmaxpatient≥50.10 cm且MTV≥347.00 cm3,患者2年无进展生存率为44.74%(17/38);中危组(n=35)Dmaxpatient≥50.10 cm或MTV≥347.00 cm3,2年无进展生存率为57.14%(20/35);低危组(n=25)Dmaxpatient<50.10 cm且MTV<347.00 cm3,2年无进展生存率为84.00%(21/25)。高、中危组2年无进展生存率均明显低于低危组(χ2=6.88、5.34,P均<0.01)而高危组与中危组间差异无统计学意义(χ2=0.14,P=0.70)。见图2~4。不同危险分组生存曲线见图5。

图2 患者女,57岁,DLBCL(ⅣA期) A.治疗前全身最大密度投影(maximum intensity projection, MIP)图示全身多处18F-FDG代谢增高灶,Dmaxpatient和MTV分别为68.70 cm和1 146.20 cm3,属高危患者; B.经1个周期miniR-CHOP方案、4个周期R-CHOP方案化疗后复查MIP图示纵隔新发高代谢病灶(箭),Deauville评分5分,提示肿瘤进展,PFS 8个月 图3 患者男,57岁,DLBCL(ⅢB期) A.治疗前MIP图示纵隔、腹部多发18F-FDG代谢增高灶(圈),Dmaxpatient和MTV分别为63.70 cm和336.30 cm3,属中危患者; B.6个周期R-CHOP方案化疗后腹部代谢增高灶(圈)代谢活性较前增高,Deauville评分4分,提示肿瘤进展,PFS 11个月 图4 患者男,62岁,DLBCL(ⅡA期) A.治疗前MIP图示腹部18F-FDG代谢增高(箭),Dmaxpatient和MTV分别为10.60 cm和302.80 cm3,为低危患者; B.经6个周期R-CHOP方案化疗后腹部代谢增高灶(箭)较前略缩小,PFS 23个月

图5 不同危险等级DLBCL患者生存曲线
3 讨论
淋巴细胞的阿米巴样运动使其能灵活地向不同组织迁移[9],故淋巴瘤更易发生扩散转移[10]。 DLBCL起源于淋巴造血组织,常累及全身多组淋巴结及结外器官并具有高度异质性,且这种异质性直接影响患者预后,故量化DLBCL肿瘤细胞扩散能力对预测预后极具价值。
MTV和Dmaxpatient均系为量化DLBCL肿瘤负荷程度而引入的PET定量参数。与复杂的放射组学特征不同,Dmaxpatient易于理解和计算,能直观反映疾病在不同部位的空间扩散程度。EERTINK等[11]对比观察DLBCL的常规PET特征和全部490个放射组学特征,发现相比简单的PET扩散参数Dmaxpatient,更为复杂的放射组学特征并未能进一步提高预测患者预后的效能;且针对317例DLBCL,Dmaxpatient与Dmaxbulk预测预后效能相似,而Dmaxbulk的鉴别能力更高。COTTEREAU等[12]报道,MTV和Dmaxpatient预测DLBCL患者PFS时的截断值分别为394.00 cm3和58.00 cm。本研究MTV和Dmaxpatient预测DLBCL患者PFS的截断值分别为347.00 cm3和50.10 cm,低于COTTEREAU等[12]的结果,可能与样本差异有关: COTTEREAU等[12]纳入病例均为Ann Arbor Ⅲ~Ⅳ期的晚期患者,肿瘤负荷较重,导致PET定量代谢及扩散参数阈值偏高;本研究纳入患者IPI评分危险分层分布较均匀,有利于更好地观察Dmaxpatient的预测价值。
Dmaxpatient为基于病灶中心的测值,其结果受PET/CT设备性能影响有限,且单个病灶中心不受其体积改变影响,更有利于临床应用。测量与计算PET扩散参数需使用的LIFEx[8]软件为开源、非商业性工具,主要用于在多模态成像中提取和分析放射组学特征,目前已用于非小细胞肺癌[13]、胰腺癌[14]、宫颈癌[15]及前列腺癌[16]等。利用基线Dmaxpatient结合MTV早期进行危险分组可及时、准确识别不同危险程度DLBCL患者。高危DLBCL患者具有更高的死亡率、复发率,可能需要更高强度、高密度化疗或进行自体造血干细胞移植及应用新的靶向药物试验性治疗;低危患者预后较好,应避免过度治疗、及时调整治疗方案,以减少不必要的治疗相关不良反应。
综上,利用18F-FDG PET/CT扩散参数Dmaxpatient联合MTV可早期对DLBCL患者进行危险分层。但本研究为单中心回顾性研究,样本量较小,且仅采用单一方法测量扩散参数,有待进一步完善。
