基于体素形态学测量评估帕金森病伴抑郁患者脑灰质体积变化及其与抑郁程度的关系
2023-09-27曹家骏屈明睿高冰冰蒋玉涵刘杨颖秋宋清伟苗延巍
曹家骏,屈明睿,高冰冰,蒋玉涵,刘杨颖秋,宋清伟,苗延巍
(大连医科大学附属第一医院放射科,辽宁 大连 116011)
帕金森病(Parkinson's disease, PD)是最常见的中枢神经系统退行性疾病之一,以进行性黑质致密部多巴胺能神经元变性和α-突触核蛋白聚集形成路易小体沉积为特征[1-2],临床表现除运动迟缓、静止性震颤等运动症状外,还包括情绪调节障碍和睡眠障碍等非运动症状[3]。抑郁是PD最常见的非运动症状之一,PD患者抑郁患病率约35%~40%[4-5],增加了患者残疾和功能障碍发生率[6],但早期难以准确识别[7]。PD及重度抑郁症均可致灰质体积减小[8-9]。PD伴抑郁(PD depression, PDD)患者灰质体积亦可出现特异性改变,涉及额叶、颞叶、海马、杏仁核等区域[10-11]。本研究采用基于体素的形态学测量(voxel-based morphometry, VBM)方法观察PDD患者灰质体积异常区域及其分布特征,探讨其与抑郁程度的关系。
1 资料与方法
1.1 研究对象 回顾性分析2014年10月—2022年10月60例于大连医科大学附属第一医院就诊的PD患者,男31例、女29例,年龄54~76岁、平均(63.0±6.05)岁。纳入标准:①符合《中国帕金森病治疗指南(第四版)》[12]原发性PD诊断标准;②相关临床资料完整。排除标准:①简易精神状态检查(mini-mental state examination, MMSE)<24分;②双相情感障碍、精神分裂症等其他精神类疾病,或精神疾病家族史;③严重躯体性疾病或其他脑部器质性疾病、脑外伤史或手术史;④酗酒、药物成瘾及药物滥用。根据汉密尔顿抑郁量表(Hamilton depression scale, HAMD)评估结果将PD患者分为PDD组(n=35,HAMD评分>7分)及PD非抑郁(PD non-depression, PDND)组(n=55,HAMD评分≤7分),记录其改良Hoeh-Yahr(H-Y)分级结果。纳入同期31名基本资料相匹配的健康受试者作为健康对照(healthy controls, HC)组,男15名、女16名,年龄51~75岁、平均(62.8±7.3)岁。记录全部受试者汉密尔顿焦虑量表(Hamilton anxiety scale, HAMA)及MMSE评估结果。
1.2 仪器与方法 采用GE Signa HDXT 3.0T超导MR扫描仪,8通道相控阵头部线圈,采集全脑高分辨率3D-T1WI结构像,参数:TR 10.2 ms,TE 4.2 ms,FA 13°,FOV 256 mm×256 mm,矩阵256×256,体素1.0 mm×1.0 mm×1.0 mm;以Matlab R2013b和SPM 8软件对数据进行预处理,标准化后进行图像分割,以半高全宽均为8 mm的高斯核进行平滑处理;通过VBM8软件运算获得灰质体积及颅内总体积估测值(estimated total intracranial volume, eTIV)。
1.3 统计学分析 采用SPSS 27.0统计分析软件。以频数表示计数资料,行χ2检验。以±s表示符合正态分布的计量资料,行单因素方差分析或独立样本t检验;以中位数(上下四分位数)表示不符合者,行Mann-WhitneyU检验。P<0.05为差异有统计学意义。基于SPM8自带统计学软件处理3组数据,以年龄、性别、受教育年限及eTIV作为协变量,行两样本t检验,以P<0.05(经FWE或FDR校正)、体素>50作为组间灰质体积有差异的脑区,获得统计参数图;每个团块(Cluster)中仅报告最大激活脑区的蒙特利尔神经研究所(Montreal Neurological Institute, MNI)坐标及t值。仍以上述各项作为协变量,采用偏相关分析评价各脑区灰质体积与HAMD评分的相关性;P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 3组受试者性别、年龄、受教育年限及MMSE评分差异均无统计学意义(P均>0.05);PDD组与PDND组改良H-Y分级差异无统计学意义(P>0.05)。PDD组病程长于PDND组(P<0.05),其HAMD评分及HAMA评分均高于PDND组及HC组(P均<0.05);PDND组HAMA评分高于HC组(P<0.05)。见表1。

表1 PD患者与健康受试者基本资料比较
2.2 VBM分析结果 PDD组、PDND组及HC组eTIV分别为(1 392.84±148.65)cm3、(1 474.22±98.83)cm3及(1 447.63±133.48)cm3,组间差异无统计学意义(F=3.05,P>0.05)。
相比HC组,PDD组双侧中央沟盖、双侧颞上回、双侧颞中回、双侧中央后回、右侧内侧扣带回、右侧旁扣带回、右侧中央前回、右侧缘上回、右侧补充运动区及左侧丘脑(FWE校正,P均<0.05,表2及图1),以及PDND组右侧颞上回、右侧缘上回、右侧前扣带回、右侧内侧扣带回、右侧旁扣带回及右侧中央后回(FWE校正,P均<0.05,表3及图2)灰质体积缩小;相比PDND组,PDD组右侧额下回眶部、右侧角回、右侧内侧扣带回、右侧旁扣带回及右侧杏仁核(FWE校正,P均<0.05)灰质体积缩小,见表4及图3。
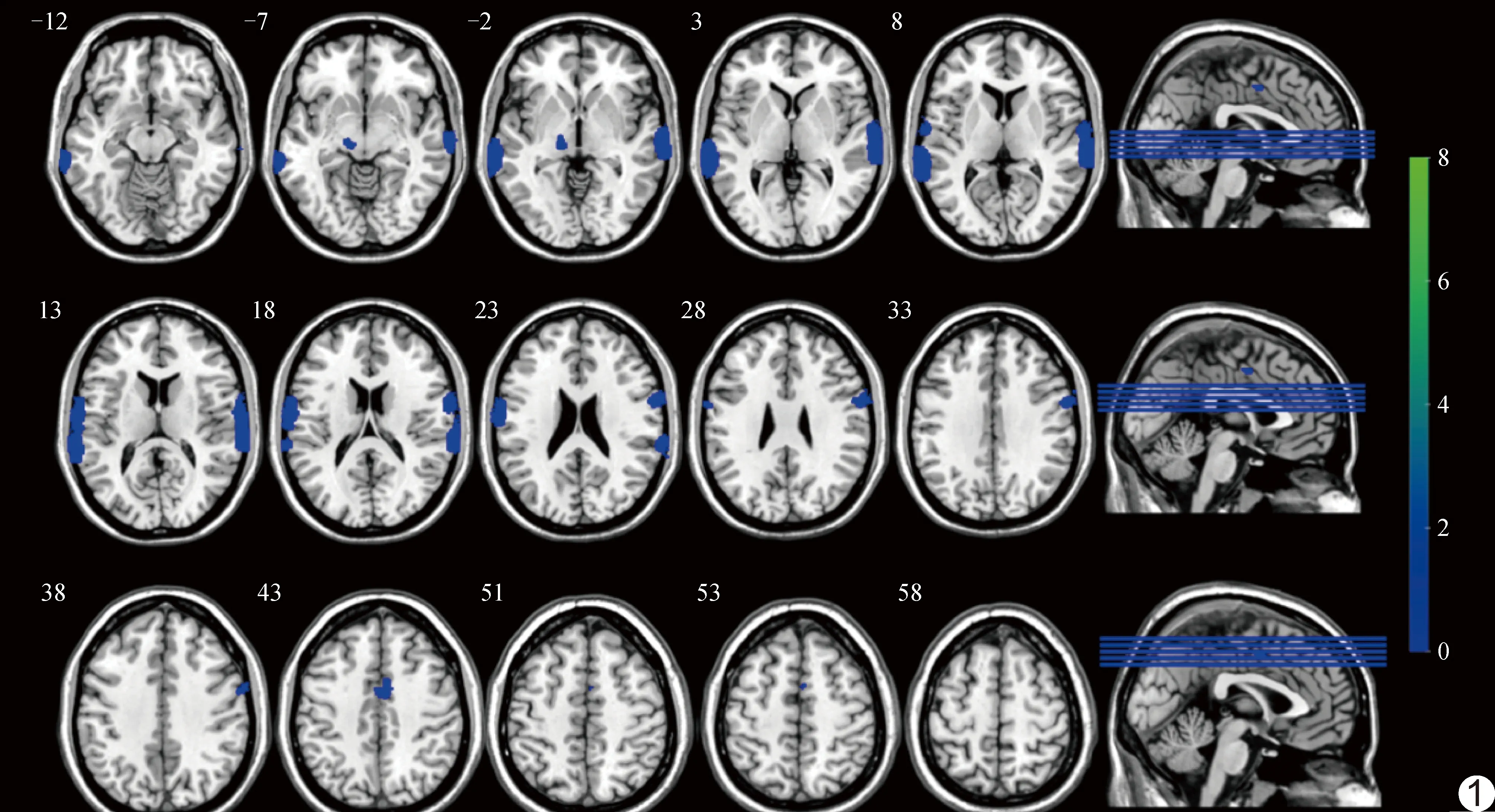
图1 PDD组相比HC组灰质体积明显缩小脑区 (色带代表t值)

表2 PDD组较HC组脑灰质体积缩小脑区

表3 PDND组较HC组脑灰质体积缩小脑区
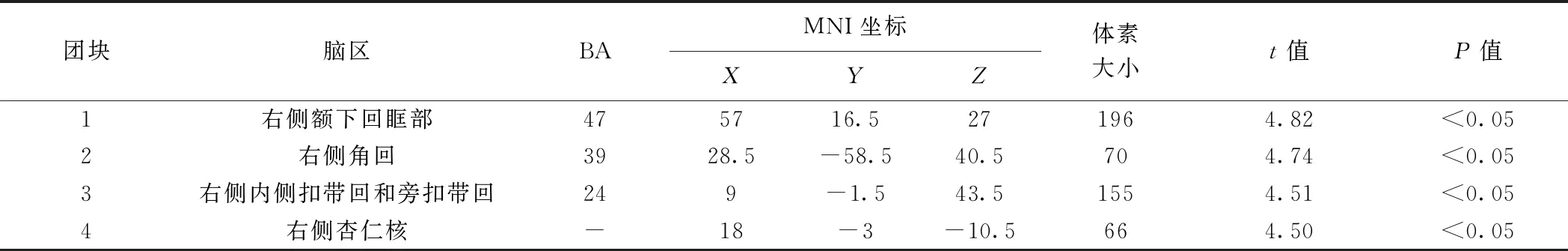
表4 PDD组较PDND组灰质体积缩小脑区
2.3 偏相关分析 PDD组右侧直回(r=-0.550,P=0.001)、左侧额中回(r=-0.615,P<0.001)灰质体积与HAMD评分呈负相关,见图4。

图4 PDD组灰质体积与HAMD评分偏相关分析
3 讨论
本研究利用VBM分析PD患者脑灰质异常区域及其分布特征,发现相比HC组,PDD组与PDND组灰质体积均显著缩小,且PDD组灰质萎缩范围更广,基本符合BRAAK等[13]提出的PD神经病理学分期改变。PD Braak病理第4期,路易小体病理沉积逐渐蔓延至多个脑区,累及边缘系统及颞叶皮质;至第5、6期,在原有累及区域病变加重的同时,广泛新皮质区域受累,可能导致认知功能受损及情绪调节障碍[14]。α-突触核蛋白异常堆积形成的路易小体可使局部皮质淀粉样蛋白负荷过重而致脑灰质萎缩[15]。本研究中,PDND组灰质体积萎缩主要集中在右侧颞叶、右侧顶叶及右侧边缘系统,而PDD组脑灰质萎缩则出现于广泛的新皮质区域、运动区及躯体感觉区。
相比PDND组,本研究PDD组右侧杏仁核、右侧额下回眶部、右侧角回、右侧内侧扣带回和右侧旁扣带回灰质体积缩小,提示局部区域结构改变与PD患者出现抑郁症状有关。边缘-皮质-纹状体-苍白球-丘脑神经环路与情绪调节存在重要联系[16],其功能改变与抑郁症病理生理学密切相关[17];PRANGE等[18]认为PDD的神经病理学基础在于边缘网络和单胺能系统功能障碍。边缘系统由杏仁核、扣带回及海马等组成[19];海马及杏仁核容积异常和神经化学改变可能是抑郁症的神经生物学基础[20]。本研究亦发现PDD组右侧杏仁核体积萎缩。扣带回与杏仁核、眶额皮质等在功能上高度相关[21],共同参与情绪和认知功能调节。 PDD患者扣带回和眶额皮质局部一致性(regional homogeneity, ReHo)异常,即上述脑区与抑郁相关[22];额下回眶部自发神经活动异常可致情绪调节受损并破坏脑奖赏机制[23];角回涉及记忆检索与回忆功能[24]。直回灰质体积缩小可致嗅觉障碍[25];嗅觉受损为PD前期症状之一,且预示认知能力下降[26]。YIN等[27]发现,相比PDND,PDD患者额中回皮质厚度变薄。本研究中,相比PDND组,PDD组右侧额下回眶部、右侧角回、右侧内侧扣带回、右侧旁扣带回及右侧杏仁核灰质体积缩小,且PDD组右侧直回、左侧额中回灰质体积与HAMD评分呈负相关,提示其与患者抑郁程度相关。
本研究的主要局限性:①样本量较小;②为回顾性研究,且未考虑服用抗抑郁药物的影响;③缺乏原发性抑郁症患者作为对比。
综上,PDD患者边缘系统-皮质-纹状体-苍白球-丘脑神经环路脑灰质体积萎缩,右侧直回、左侧额中回灰质体积与其抑郁程度相关。
