植物组培抗菌剂PPM对萝卜种子消毒及无菌苗生长的影响
2023-09-27孙亚玲刘辰刘贤娴牛蕴华何启伟霍雨猛徐文玲
孙亚玲 刘辰 刘贤娴 牛蕴华 何启伟 霍雨猛 徐文玲
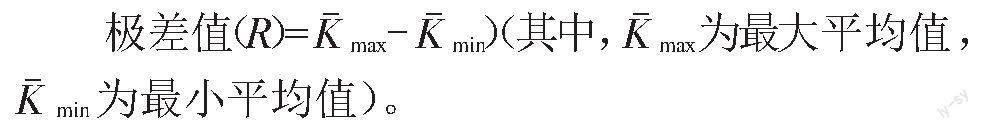
摘 要:為了建立萝卜组培过程中种子消毒及培养的简单有效方法,以萝卜种子为试材,采用L16(43)正交设计,开展了植物组培抗菌剂PPM浸泡浓度(1.0%、1.5%、2.0%和3.0%)、浸泡时间(0.0、0.5、2.0和4.0 h)及培养基中PPM浓度(0.0、0.1%、0.3%和0.6%)对萝卜种子消毒效果及无菌苗生长的研究。结果表明,PPM浸泡浓度对污染率有显著影响,对发芽率、根长、株高和下胚轴长的影响不显著;PPM浸泡时间对发芽率、污染率、根长、株高和下胚轴长均有显著影响;培养基中PPM浓度对污染率、根长、株高和下胚轴长具有显著影响,对发芽率无显著影响。主次效应分析表明,培养基中PPM浓度是影响污染率、根长、株高和下胚轴长的最主要因素,PPM浸泡时间影响次之,PPM浸泡浓度影响最小,最优组合A2B3C2可使发芽率达到96.67%,污染率为2.22%,根长为7.00 cm,株高为8.60 cm,下胚轴长为0.73 cm。探索开发了一套操作简便、无需冲洗的萝卜种子消毒方法以及高发芽率、低污染率的无菌苗培养方法。
关键词:萝卜;种子消毒;植物组培抗菌剂;无菌苗
中图分类号:S631.1 文献标志码:A 文章编号:1673-2871(2023)09-116-07
Effects of plant preservative mixture (PPM) on seed disinfection and aseptic seedling growth of radish
SUN Yaling1, LIU Chen1, LIU Xianxian1, NIU Yunhua2, HE Qiwei1, HUO Yumeng1, XU Wenling1
(1. Shandong Key Laboratory of Greenhouse Vegetable Biology/Shandong Branch of National Vegetable Improvement Center/Vegetable Science Observation and Experimental Station in Huang-Huai District of the Ministry of Agriculture and Rural Affairs/Vegetable Institute of Shandong Academy of Agricultural Sciences, Jinan 250100, Shandong, China; 2. Laizhou Agricultural Comprehensive Development Service Center, Laizhou 261400, Shandong, China)
Abstract: In order to establish a simple and efficient method for seed disinfection and aseptic seedling culture in radish tissue culture, L16 (43) orthogonal design, which including soaking concentration(1.0%、1.5%、2.0% and 3.0%), soaking time(0.0、0.5、2.0 and 4.0 h) and PPM (plant preservative mixture) concentration(0.0、0.1%、0.3% and 0.6%) in the culture medium, was used to study the disinfection effect of PPM on radish seeds and the growth of steriled seedlings. The results showed that the soaking concentration of PPM exhibited a significant effect on the contamination rate, but was not significant on the germination rate, root length, plant height and hypocotyl length; the soaking time of PPM had significant effect on germination rate, contamination rate, root length, plant height and hypocotyl length; the concentration of PPM added in the medium had a significant effect on the contamination rate, root length, plant height and hypocotyl length, but was not significant on the germination rate. The analysis of primary and secondary effects showed that the PPM concentration in culture medium was the most important factor affecting the contamination rate, root length, plant height and hypocotyl length, followed by the soaking time of PPM, and the soaking concentration of PPM was the smallest. The optimal combination A2B3C2 achieved a germination rate of 96.67%, a contamination rate of only 2.22%, a root length of 7.00 cm, a plant height of 8.60 cm, and a hypocotyl lenth of 0.73 cm. In summary, a set of simple and efficent methods with high germination rate and low contamination rate for radish seed disinfection and aseptic seedling culture are explored and developed.
Key words: Radish; Seed sterilization; Plant preservative mixture; Aseptic seedling
萝卜(Raphanus sativus L.)为十字花科萝卜属一、二年生草本植物,是我国重要的根菜类蔬菜作物,因其具有较高的营养价值和医疗价值,在世界各地广泛种植[1-2]。近年来,国内学者相继开展了萝卜重要性状的分子生物学研究,显著提升了我国萝卜遗传育种水平。萝卜是典型的再生顽拗型植物,遗传转化十分困难,关于萝卜遗传转化体系和基因功能实质性验证的研究鲜见报道[1,3-4]。遗传转化体系的建立离不开组织培养,相对于其他十字花科蔬菜,由于萝卜小孢子培养诱导率较低,目前萝卜组织培养所用的外植体主要来源于种子发芽后生长4 d左右的无菌苗[5-6]。然而萝卜种子种皮较薄,在脱粒、晾晒过程中易受伤,且种荚收获后雨水较多,晒种过程中易受潮发霉进而使种子内部受到微生物(内生菌或其他有害微生物)污染,普通的表面消毒方法无法彻底消除污染,从而导致组培过程中污染严重,影响后续试验。
在以往的研究报道中,萝卜种子采用的常规消毒剂多为酒精、次氯酸钠和氯化汞[7-13]。次氯酸钠和HgCl2消毒后均需无菌水反复冲洗3~4遍,否则残留的消毒剂影响无菌苗的正常生长,其步骤繁琐,且对种子内部微生物的消毒效果不佳。因此,建立简单、高效的无菌苗培养体系是萝卜遗传转化体系中的重要环节。
植物组培抗菌剂PPM(plant preservative mixture)是一种广谱抗微生物制剂,能有效抑制植物组织培养中的微生物污染,且在一定浓度和时间内不会影响种子发芽、愈伤组织增殖和再生。同时,它具有极高的热稳定性,能与培养基一起高压灭菌,无需反复冲洗,极大地避免了二次污染,应用领域及前景非常广泛[14-21]。目前采用PPM抗菌剂对种子消毒的研究鲜见报道[22],更未见该抗菌剂用于萝卜种子消毒的报道。为此,笔者开展了PPM用于萝卜种子消毒及无菌苗生长的研究,采用正交试验优化筛选获得了PPM浸泡浓度、浸泡时间及培养基PPM浓度的最佳组合,以期在此环节为萝卜遗传转化及开放式组培体系的建立提供参考。
1 材料與方法
1.1 材料
试验于2022年6—9月在山东省农业科学院蔬菜研究所进行。所用萝卜编号为2022-198,由玉娘红(武汉莱福健农业科技有限公司)选育获得,该品系早熟、耐热、红皮、白肉。植物组培抗菌剂PPM购于北京酷来搏科技有限公司。
1.2 方法
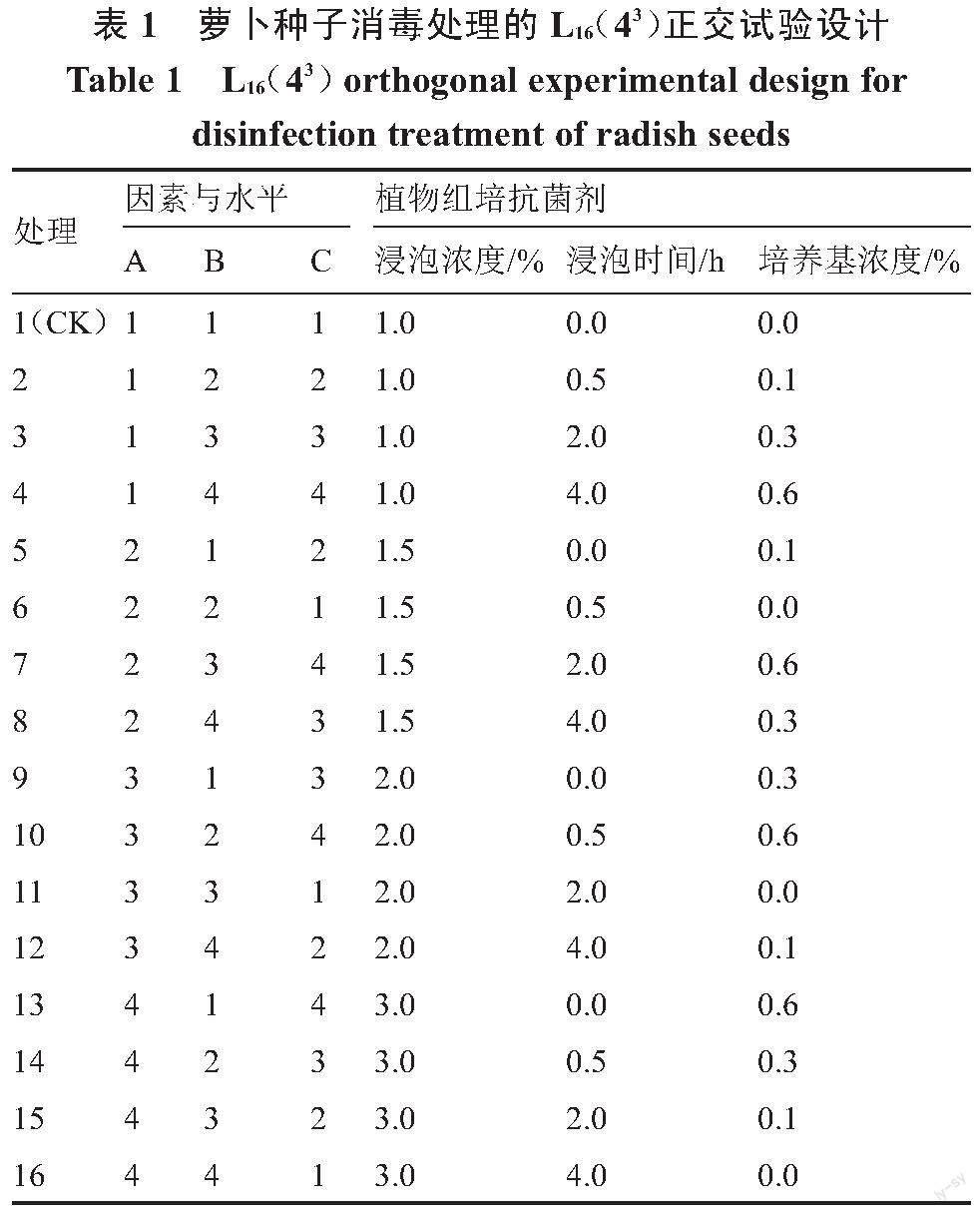
1.2.1 试验设计 以PPM浸泡浓度(A)、浸泡时间(B)、培养基PPM浓度(C)为因素,每个因素4个水平,按L16(43)正交表(表1)进行正交试验设计。共16个处理(处理1为对照组,即浸泡时间为0 h,且培养基未添加PPM),每个处理30粒种子,3次重复,播于90 mm培养皿上。
无菌苗的获得:选取颗粒饱满的萝卜种子,按照表1的正交设计,将种子分别浸泡0、0.5、2、4 h后,直接播于1/2 MS培养基(含20 g·L-1蔗糖+10 g·L-1琼脂粉,pH 5.8)上,培养基按表1处理添加不同浓度的PPM。于温度为25 ℃、光照时间为16 h·d-1、光照度为2000 lx条件下培养,获得无菌苗。
1.2.2 测定指标及方法 播种5 d后,统计发芽种子数、污染种子数,并用直尺(精度为1 mm)测量根长、株高和下胚轴长度,计算发芽率和污染率。
发芽率/%=发芽种子数/播种种子数×100;
污染率/%=污染种子数/播种种子数×100;
1.3 数据处理
试验数据采用Excel 2016进行统计,以SPSS 19.0进行差异显著性分析,并采用极差分析各因素的主次效应及优选组合。
2 结果与分析
2.1 PPM对萝卜种子消毒效果和无菌苗生长的影响
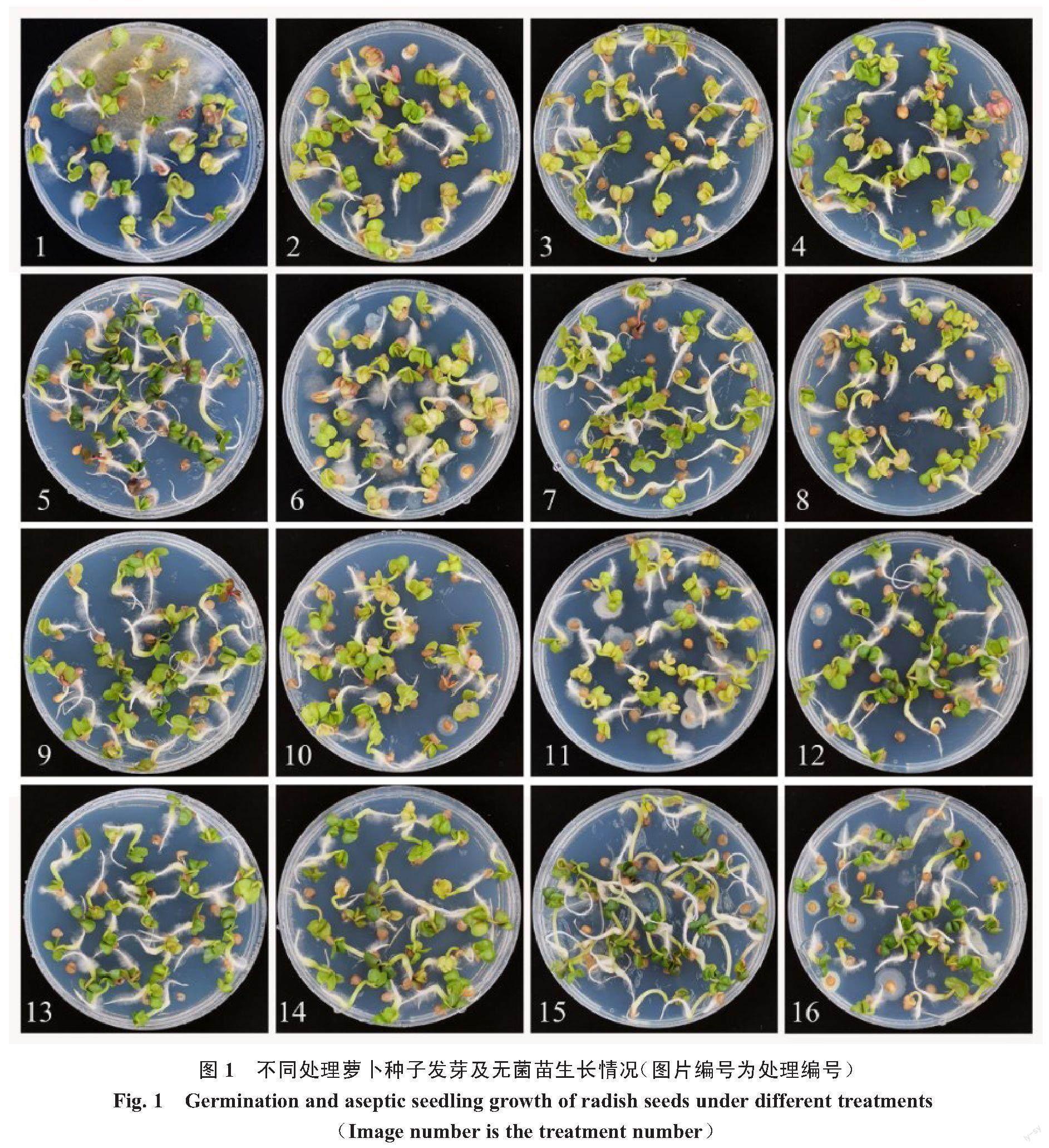
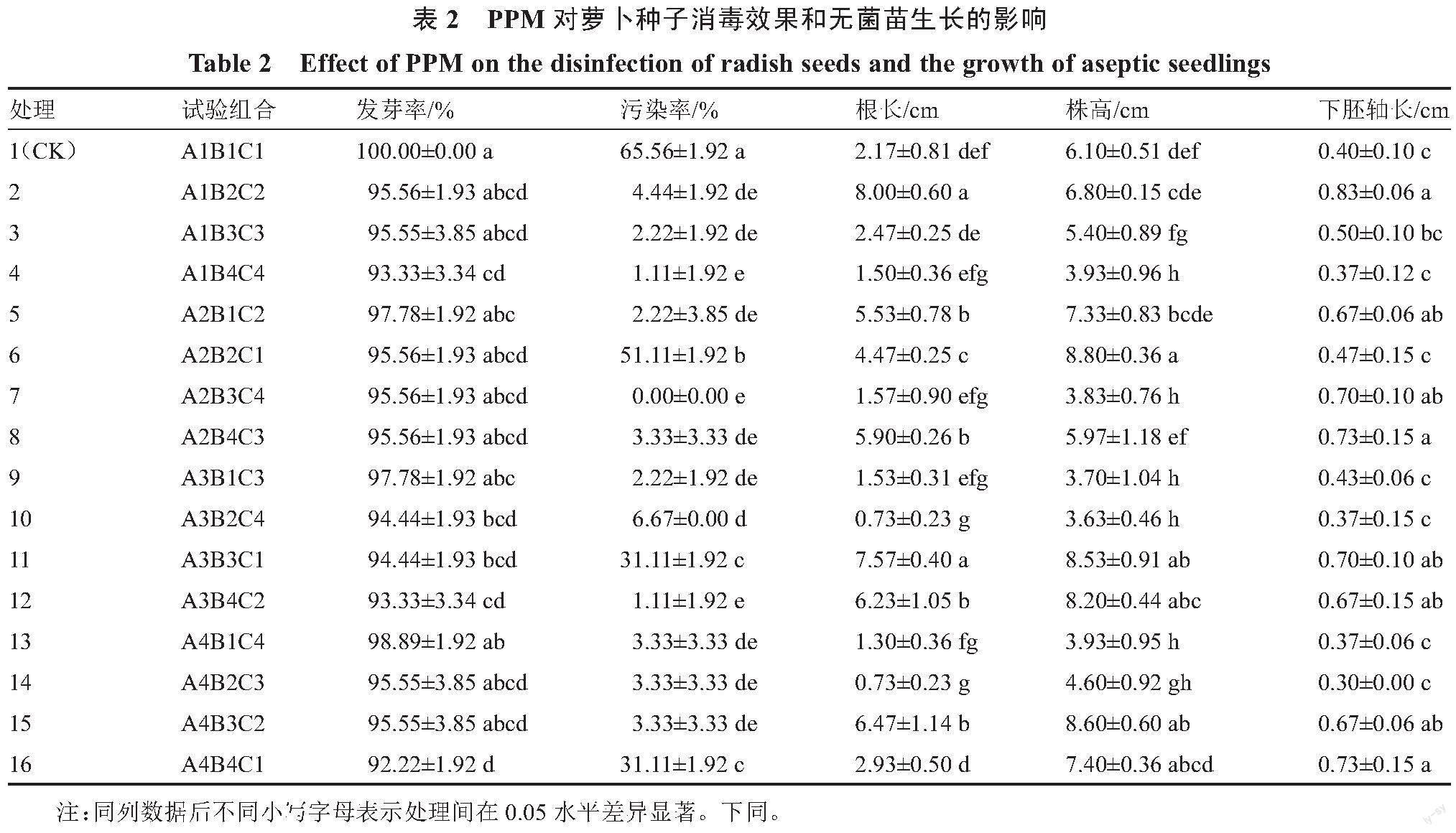
图1和表2为萝卜种子16个不同处理的发芽及无菌苗生长情况。在所有处理中,处理7的污染率最低,为0,且显著低于处理1、6、10、11和16,其中处理6、11和16仅进行了PPM浸种处理,无菌苗生长的培养基中均未添加PPM,污染率在30.00%以上,但与培养基中未添加PPM的处理1(污染率65.56%)相比,污染率显著降低。而处理5、9和13均未进行浸种消毒,仅在培养基中添加了PPM,污染率在2.00%~4.00%。浸种与培养基中同时使用PPM的处理2、3、4、7、8、10、12、14、15,其污染率在0~6.67%。由以上结果可知,萝卜种子单独采用PPM浸种处理,其污染率最高可达51.11%,无法满足组培的需求,而在培养基中同时使用PPM,处理7、4和12可以使污染率降低至小于2.00%。从发芽率来看,未使用PPM的处理1最高,为100.00%,且处理1、2、3、5、6、7、8、9、13、14、15之间差异不显著,发芽率均高于95.55%,处理1发芽率仅显著高于4、10、11、12、16处理。上述低污染率且高发芽率的PPM处理组合2、3、5、7、8、9、13、14、15均可用于萝卜种子消毒培养且不影响种子的萌发。
萝卜幼苗的生长发育根据根长、株高、下胚轴长3个指标进行统计分析,其对照均为处理1。由表2可知,处理2、5、6、8、11、12、15的根长均显著长于对照,处理2的根最长,为8.00 cm;处理6、11、12、15的株高显著高于对照,处理6的株高最高,为8.80 cm。处理2、5、7、8、11、12、15、16的下胚轴长均显著长于对照,处理2下胚轴最长,为0.83 cm。以上结果表明,处理11、12、15的根长、株高和下胚轴长均显著高于对照。
因此,萝卜种子在适宜浓度的PPM溶液中浸泡后,直接播种于含合适浓度的PPM培养基中萌发生长,可获得高发芽率、低污染率,且生长指标最优的无菌苗。综合发芽率、污染率、根长、株高和下胚轴长,从处理11、12、15中初步筛选出发芽率最高的处理15,即3.0% PPM浸泡2 h后播种于PPM浓度为0.1%的1/2 MS培养基中,作为萝卜种子消毒及无菌苗培养的初筛最优组合(表2)。
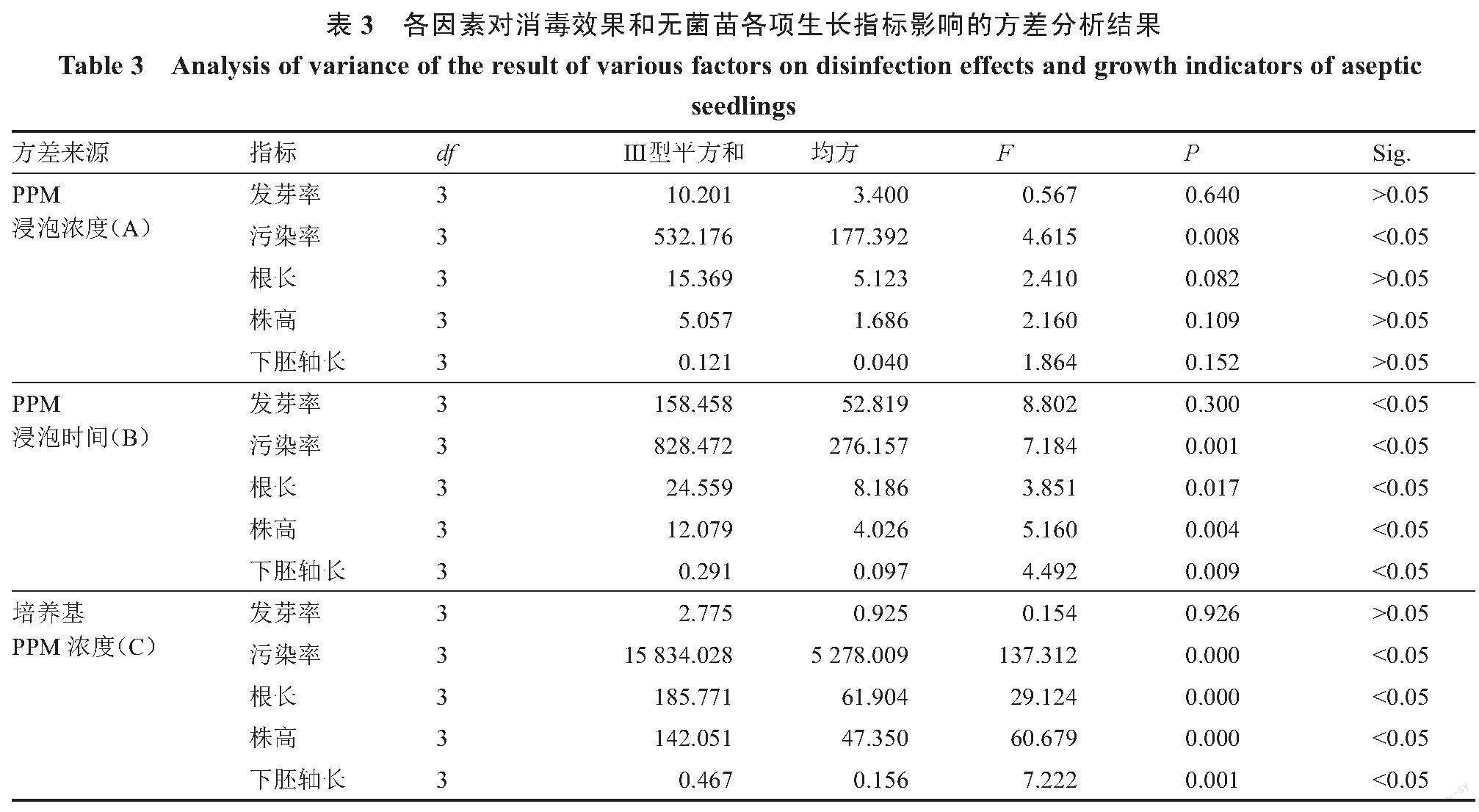
2.2 各因素对消毒效果和无菌苗生长指标的影响
从表3方差分析结果可知,PPM浸泡浓度仅对污染率有显著影响,对发芽率、根长、株高和下胚轴长的影响不显著;浸泡时间对发芽率、污染率、根长、株高和下胚轴长均具有显著影响;培养基PPM浓度对污染率、根长、株高和下胚轴长有显著影响,对发芽率的影响不显著。
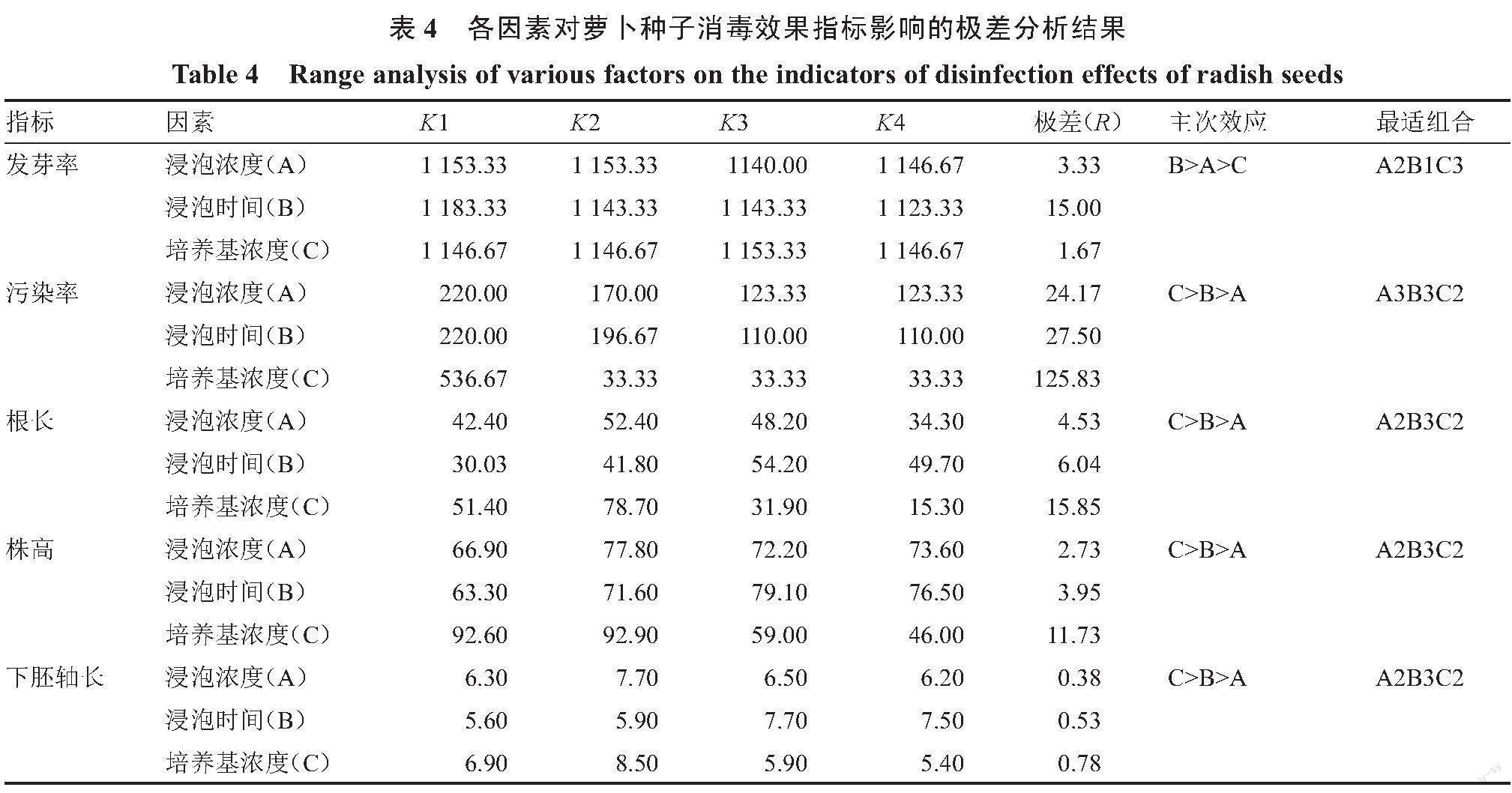
2.3 各因素主次效应分析
极差(R)可反映各因素对指标所产生的主次效应,极差值越大,即该因素越重要,因此通过极差分析可推断最优处理组合。由表4可知,影响萝卜种子发芽率的3个因素极差排序为B(15.00)>A(3.33)>C(1.67),即浸泡时间是影响萝卜种子发芽的最主要因素,PPM浸泡浓度的影响次之,培养基PPM浓度的影响最小。影响污染率、根长、株高和下胚轴长3个因素的极差排序均为C>B>A,即培养基PPM浓度是影响萝卜污染率、根长、株高和下胚轴长的最主要因素,浸泡时间的影响次之,PPM浸泡浓度的影响最小。
根据主次分析结果及K值确定了各因素的最优组合。发芽率最优组合为A2B1C3,即将干种子直接点播于含PPM为0.3%的1/2MS培养基中。污染率最优组合为A3B3C2,即2% PPM浸泡2 h,培养基PPM浓度为0.1%。根长、株高和下胚轴长最优组合为A2B3C2,即1.5% PPM浸泡2 h,培养基PPM浓度为0.1%。在萝卜种子组织培养过程中,污染率和发芽率满足试验需求的情况下,应选择对根长、株高和下胚轴长等各指标影响差异不显著的处理作为最优处理。按照此标准,综合主次效应结果并根据K值获得本研究中萝卜种子消毒、发芽及无菌苗生长的理论最优处理为A2B3C2,即1.5% PPM浸泡2 h,培养基PPM浓度为0.1%。
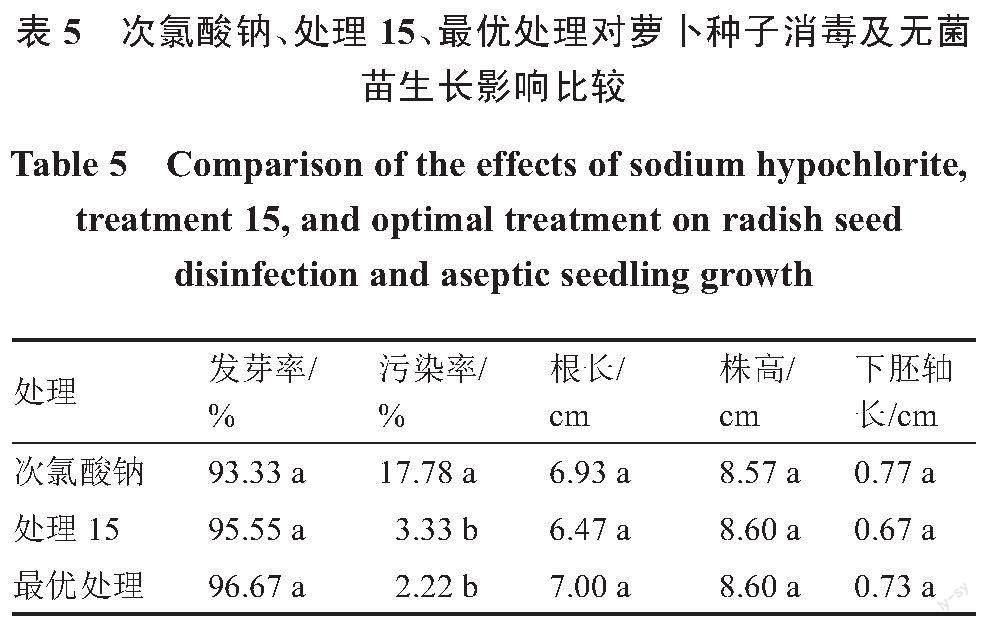
为进一步验证理论最优处理A2B3C2对萝卜种子消毒和无菌苗生长的影响,处理A2B3C2、初筛处理15和次氯酸钠处理(1%NaClO消毒10 min,无菌水冲洗4次)进行比较试验。结果发现,次氯酸钠处理的污染率显著高于处理15和理论最优处理A2B3C2,3个处理间的发芽率、根长、株高和下胚軸长无显著差异(表5)。最终确定1.5% PPM对萝卜种子浸泡2 h后,播于含0.1% PPM的1/2MS培养基上可获得最优效果,其发芽率为96.67%,污染率为2.22%,根长7.00 cm,株高8.60 cm,下胚轴0.73 cm。
3 讨论与结论
研究表明,PPM活性成分可以渗透真菌或细菌细胞壁,抑制柠檬酸循环和电子传递链等中心代谢循环中的关键酶活性,并有效抑制培养基中单糖和氨基酸向真菌细胞壁的运输[18,21],但关于单独将PPM抗菌溶液用于萝卜种子消毒及无菌苗培养的研究未见报道。笔者综合研究了PPM浸泡浓度、浸泡时间和培养基中PPM浓度3个因素对萝卜种子消毒及无菌苗生长发育的影响。
PPM浸泡浓度对发芽率、根长、株高和下胚轴长的影响无显著差异,表明萝卜种子对PPM耐受性较强;但其对污染率的影响显著,表明了浸种液中高浓度的PPM可以有效抑制微生物生长[18]。由于高浓度的PPM抗菌溶液浸种2 h不影响萝卜幼苗的生长发育,因此针对不同批次及来源的原始污染未知的萝卜种子,高浓度的PPM浸种可以尽可能地为防止污染提供保障,最终在最优组合的筛选中,仍然选择了同时进行PPM浸种和培养基中添加PPM的试验设计。
浸泡时间对消毒效果和无菌苗的生长均具有显著影响,特别是对污染率的影响,表明PPM需要较长的时间才能渗入组织内部,进而达到消毒和抑制污染的目的。上述结果与孙亚玲等[22]在洋葱种子消毒培养上的研究相似。但本试验浸种时间的设计不同于孙亚玲等[22]对洋葱种子长达24~48 h的浸种时间,这与萝卜种子长时间浸种会导致种苗腐烂和死亡的发芽特性有关[22-23]。因此,利用PPM浸种消毒不同作物的种子,要根据作物种子的特性,选择合适的浸种时间,否则会造成窒息烂种。
研究表明,在离体培养的培养基中添加一定浓度的PPM可以有效控制污染,如果浓度过高,在抑制污染的同时也会对外植体的生长发育产生抑制,因此在应用于不同的作物时需要进行PPM合适浓度的筛选,前人已对甜瓜、烟草、矮牵牛、积雪草(Centella asiatica)、芸香科枸橘(Poncirus trifoliata)和粗皮柠檬(Citrus jambhiri)、洋葱、橡胶树进行了相关的研究[14,17-18,22,24]。本研究结果表明,培养基中添加PPM显著影响根长、株高和下胚轴长,理论最优组合A2B3C2的测试结果显示,PPM浓度为0.1%时可有效抑制污染,且其发芽和生长指标与次氯酸钠处理相比无显著差异。
关于培养基中适宜浓度的PPM对外植体的促生作用也有相关的文献报道。孙亚玲等[22]的研究表明,用pH值为2的PPM溶液浸泡洋葱种子可以显著提高洋葱种子4 d的发芽势至75.83%,其发芽率在8 d内即可达最大,为92.65%。成镜等[24]的研究表明,0.65 mL·L-1的PPM对橡胶树次生体细胞胚发生有促进作用,出胚率增加18.1%。笔者研究中的最优组合A2B3C2萝卜种子的发芽率与次氯酸钠处理相比无显著差异,而PPM是否对萝卜组培苗的再生以及遗传转化具有促进作用,仍需进一步的试验验证。
笔者通过正交试验获得了萝卜种子消毒培养的简单有效方法,即1.5% PPM浸泡萝卜种子2 h,播于含PPM浓度为0.1%的1/2MS培养基上,这为种子作物的无菌苗培养,以及开放式组培体系的建立提供了技术支持。
参考文献
[1] 胡海娇,汪精磊,胡天华,等.“十三五”我国萝卜遗传育种研究进展[J].中国蔬菜,2022(10):20-26.
[2] 柳李旺,李冰霜,董俊辉,等.萝卜细胞质雄性不育性遗传机制及其利用研究进展[J].南京农业大学学报,2022,45(5):883-897.
[3] KIM N R,AN G,PARK M C.High-frequency regeneration and transformation of Raphanus savus[J].Journal of Plant Biology,2001,44:231-235.
[4] 王冰林,李媛媛,韩太利.我国萝卜分子生物学研究现状与前景展望[J].长江蔬菜,2009(8):1-3.
[5] 牛刘静,赵艳艳,原玉香,等.十字花科蔬菜小孢子培养研究进展[J].中国蔬菜,2022(12):20-29.
[6] 袁子鸿,刘思正.几类常见蔬菜种子的休眠及发芽特性[J].当代蔬菜,2005(4):18.
[7] 黄俊豪,徐文玲,刘贤娴,等.萝卜离体再生体系的建立[J].山东农业科学,2016,48(4):21-23.
[8] 李海萍,张鲁刚,胥宇建,等.萝卜遗传转化体系的建立[J].中国瓜菜,2011,24(4):18-21.
[9] 李海萍,张鲁刚,张静,等.萝卜带柄子叶高频再生体系的建立[J].植物学报,2011,46(3):331-337.
[10] 李媛媛,王冰林,韓佳,等.萝卜下胚轴高效再生体系的建立[J].江苏农业科学,2014,42(1):58-60.
[11] 武剑,龚义勤,邓波,等.萝卜离体再生的影响因素[J].中国蔬菜,2003(6):6-8.
[12] 熊秋芳,张雪清,骆海波,等.萝卜组织培养的研究与应用[J].长江蔬菜,2006(5):36-38.
[13] 徐文玲,王淑芬,何启伟,等.萝卜高频再生体系的建立[J].山东农业科学,2006(6):7-10.
[14] COMPTON M E,KOCH J M.Influence of plant preservative mixture (PPM)TM on adventitious organogenesis in melon, petunia,and tobacco[J].In Vitro Cellular & Developmental Biology-Plant,2001,37(2):259-261.
[15] DIGONZELLI P A,DIAZ L.Use of PPM(Plant Preservative Mixture)to control bacterial contaminants in the multiplication in vitro of sugarcane[J].Revista De La Facultad Agronomia Universidad Del Zulia,2005,22(1):23-33.
[16] MIYAZAKI J,TAN B H,ERRINGTON S G.Eradication of endophytic bacteria via treatment for axillary buds of Petunia hybrida using Plant Preservative Mixture (PPMTM)[J].Plant Cell Tissue and Organ Culture,2010,102(3):365-372.
[17] MOGHADDAM S S,JAAFAR H B,AZIZ M A,et al.Optimization of an efficient semi-solid culture protocol for sterilization and plant regeneration of Centella asiatica (L.) as a medicinal herb[J].Molecules,2011,16(11):8981-8991.
[18] NIEDZ R P.Using isothiazolone biocides to control microbial and fungal contaminants in plant tissue cultures[J].HortTechnology,1998,8(4):598-601.
[19] PENA-RAMIREZ Y J,GARCIA-SHESENA I,HERNANDEZ-ESPINOZA Á,et al.Induction of somatic embryogenesis and plant regeneration in the tropical timber tree Spanish red cedar [Cedrela odorata L. (Meliaceae)][J].Plant Cell Tissue and Organ Culture,2011,105(2):203-209.
[20] POUVREAU J B,GAUDIN Z,AUGER B,et al.A high-throughput seed germination assay for root parasitic plants[J].Plant Methods,2013,9:32.
[21] RIHAN H Z,AL-ISSAWI M,AL-SWEDI F,et al.The effect of using PPM (Plant Preservative Mixture) on the development of cauliflower microshoots and the quality of artificial seed produced[J].Scientia Horticulturae,2012,141:47-52.
[22] 孙亚玲,李瑞平,王振宝,等.洋葱种子消毒和无菌苗培养新方法[J].生物技术通报,2023,39(4):212-220.
[23] 颜启传.蔬菜种子发芽特性和发芽技术(一)[J].中国蔬菜,1989(3):48-51.
[24] 成镜,李季,戴雪梅,等.PTC_3和PPM抑菌剂对橡胶树组培中常见污染菌的抑菌效果及对橡胶树次生体胚发生效率的影响[J].热带农业科学,2021,41(3):68-73.
