佛手瓜茎段组培快繁技术研究
2023-09-27王兰兰李裕荣陈之林张朝君杜致辉文林宏
王兰兰 李裕荣 陈之林 张朝君 杜致辉 文林宏

摘 要:为建立佛手瓜完整的组培快繁体系,以佛手瓜茎段为外植体,探究外植体的最佳消毒条件;以筛选的MS为基本培养基,添加3%的蔗糖和0.7%的琼脂,探究不同的激素配比对腋芽诱导、不定芽增殖和生根培养的影响。结果表明,佛手瓜茎段最佳消毒条件为75%酒精20 s + 0.1%氯化汞8 min;腋芽诱导适宜培养基为MS+1.0 g·L-1 AC+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA和MS+1.0 g·L-1 AC+1.0 mg·L-1 6-BA+0.1 mg·L-1 IAA,最佳增殖培养基为MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA,平均增殖系数达4.01,最佳生根培养基为1/2MS+0.2 mg·L-1 NAA,生根率为93.33%,最适的瓶外扦插生根条件为0.5 mg·L-1 NAA浸泡处理30 min。研究建立的佛手瓜组培快繁体系,为优质佛手瓜种质资源的保存提供了技术参考。
关键词:佛手瓜;组织培养;瓶外生根
中图分类号:S652.9 文献标志码:A 文章编号:1673-2871(2023)09-030-06
Study on tissue culture and rapid propagation via stem section of Schium edule
WANG Lanlan1, LI Yurong1, 2, CHEN Zhilin1, 2, ZHANG Chaojun1, 2, DU Zhihui1, 2, WEN Linhong1, 2
(1.Horticulture Institute, Guizhou Academy of Agricultural Sciences, Guiyang 550025, Guizhou, China; 2. Guizhou Horticulture Engineering Technology Research Center, Guiyang 550025, Guizhou, China)
Abstract: In order to establish a complete tissue culture and rapid propagation system of stem section of Schium edule as explants, exploring the best disinfection condition, MS was used as the basic medium, 3% sucrose and 0.7% agar are added to explore the effect of different hormone ratios on axillary bud induction, adventitious bud proliferation and rooting culture. The results showed that the best disinfection conditions for stem segment of Schium edule was 75% alcohol for 20 s + 0.1% HgCl2 for 8 min, The suitable medium for axillary bud induction was MS+1.0 g·L -1AC+1.0 mg·L -1 6-BA+0.1 mg·L -1 NAA and MS+1.0 g·L -1AC+1.0 mg·L -1 6-BA+0.1 mg·L -1IAA, the best proliferation medium was MS+0.1 mg·L -1 NAA+1.0 mg·L -1 6-BA, and the average proliferation coefficient could reach 4.01, and the best medium for rooting was 1/2MS+0.2 mg·L -1 NAA, and the rooting rate was 93.33%, the optimum conditions of ex vitro cutting rooting was 0.5 mg·L -1 NAA soaking for 30 min. The tissue culture and rapid propagation system of Schium edule established in this study provides a technical reference for the preservation of succulent germplasm resources.
Key words: Schium edule; Tissue culture; Ex vitro rooting
佛手瓜(Schium edule)為葫芦科佛手瓜属多年生植物,是重要的瓜类蔬菜之一,原产于西印度群岛、中美洲及墨西哥,在19世纪初传入中国,全国大部分地区均有种植,以贵州、云南、福建、广东等地种植最多[1-2]。佛手瓜的果实富含维生素、胡萝卜素、碳水化合物、脂肪等物质成分,具有较高的营养价值[3-4];此外,佛手瓜的提取物还有抗氧化、抗炎[5-7]、降血压和调节血糖[8]等功效,具有较高的药用价值。种植佛手瓜经济效益显著,助推多数地区农业的经济发展,例如贵州省惠水、紫云等地[9],因此受到广大农户和消费者喜爱。
佛手瓜常用扦插法和整瓜育苗法繁殖。扦插法繁育的佛手瓜苗长势较弱,整瓜育苗也存在一定的缺陷,通常是将整个瓜埋入土中,烂瓜率高,且每个瓜只含有1粒种子,种子和果皮紧密贴合不易分离,种子离瓜后无法发芽,存在繁殖率低、成本高及生长过程中易受到病虫害影响等问题,产业发展受到限制[10-11]。因此,加大对佛手瓜育苗相关技术的研究力度,特别是对种质资源的保存、新品种选育和种质创新意义重大,而以组织培养为基础的现代生物技术在育苗方面具有巨大的优势和潜力,可以在短时间内获得大量优质的无病虫害种苗。在瓜类蔬菜的相关研究过程中,建立高效的组织培养和再生体系是种质资源保存和新品种选育成功的关键性基础。近年来,组织培养技术已经在瓜类蔬菜中得到广泛应用,目前,多种瓜类蔬菜已经能够通过器官发生途径获得再生植株,有的还建立了比较高效的再生体系[12],但有关佛手瓜组织培养的研究报道较少,因此,笔者以佛手瓜带腋芽茎段作为外植体,建立高效快速的快繁体系,为后续佛手瓜种质资源保存和新品种选育奠定基础。
1 材料与方法
1.1 材料
笔者以贵州省农业科学院园艺研究所蔬菜保育大棚种植的优良绿皮佛手瓜苗为试验材料,选取带腋芽的茎段作为外植体。该品种收集自贵州省黔南布依族苗族自治州惠水县好花红镇。试验于2021年11月至2022年7月在贵州省农业科学院园艺研究所园艺植物组织培养技术实验室进行。
1.2 方法
试验采用完全随机区组设计。
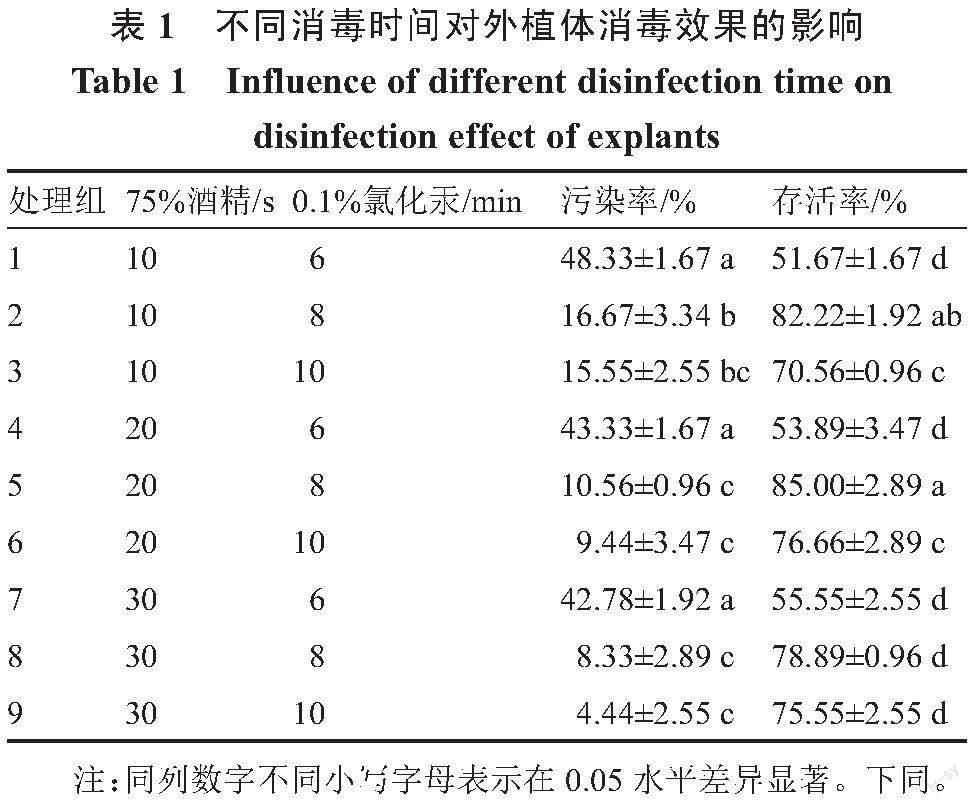
1.2.1 佛手瓜外植体的选取和消毒 选取长势良好的佛手瓜茎段作为外植体,剪成2 cm左右的1叶1节茎段,去除茎段叶片,加入洗洁精放置于流水下冲洗30~45 min,用软毛刷刷掉表面残留的灰尘,将冲洗后的茎段放入无菌超净工作台进行消毒处理,采用75%酒精(10、20、30 s)进行消毒,无菌水清洗3~5次,0.1%的氯化汞消毒(6、8、10 min),无菌水清洗5~6次,共计9个处理(表1),用无菌吸水纸吸掉茎段上多余的水分,接种至培养基中,放置于光照度2000 lx、温度24 ℃、光照12 h条件下培养,每瓶接种3个带腋芽茎段,每个处理接种20瓶,3次重复,15 d后统计外植体的污染率和存活率。污染率/%=(污染外植体数/总接种外植体数)×100,存活率/%=(存活的外植体数/总接种外植体数)×100。
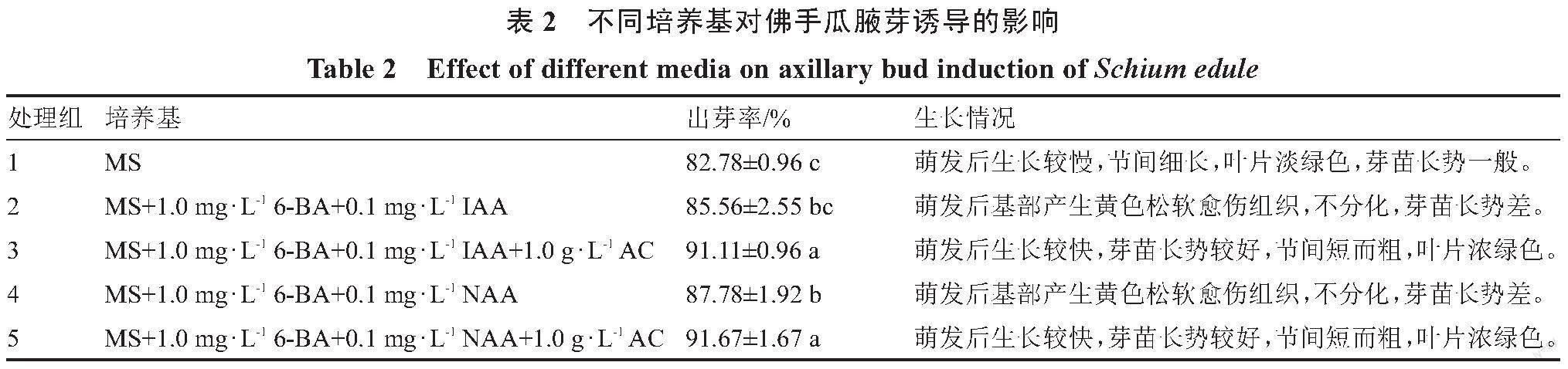
1.2.2 佛手瓜腋芽萌发诱导 将消毒处理后的佛手瓜茎段接种于5种不同的培养基(表2)上培养,放置于光照度2000 lx、温度24 ℃、光照12 h条件下培养,每个处理接种60个外植体,3次重复,15 d左右观察腋芽萌发情况。腋芽出芽率/%=(萌发带腋芽茎段数/总接种带腋芽茎段数)×100。
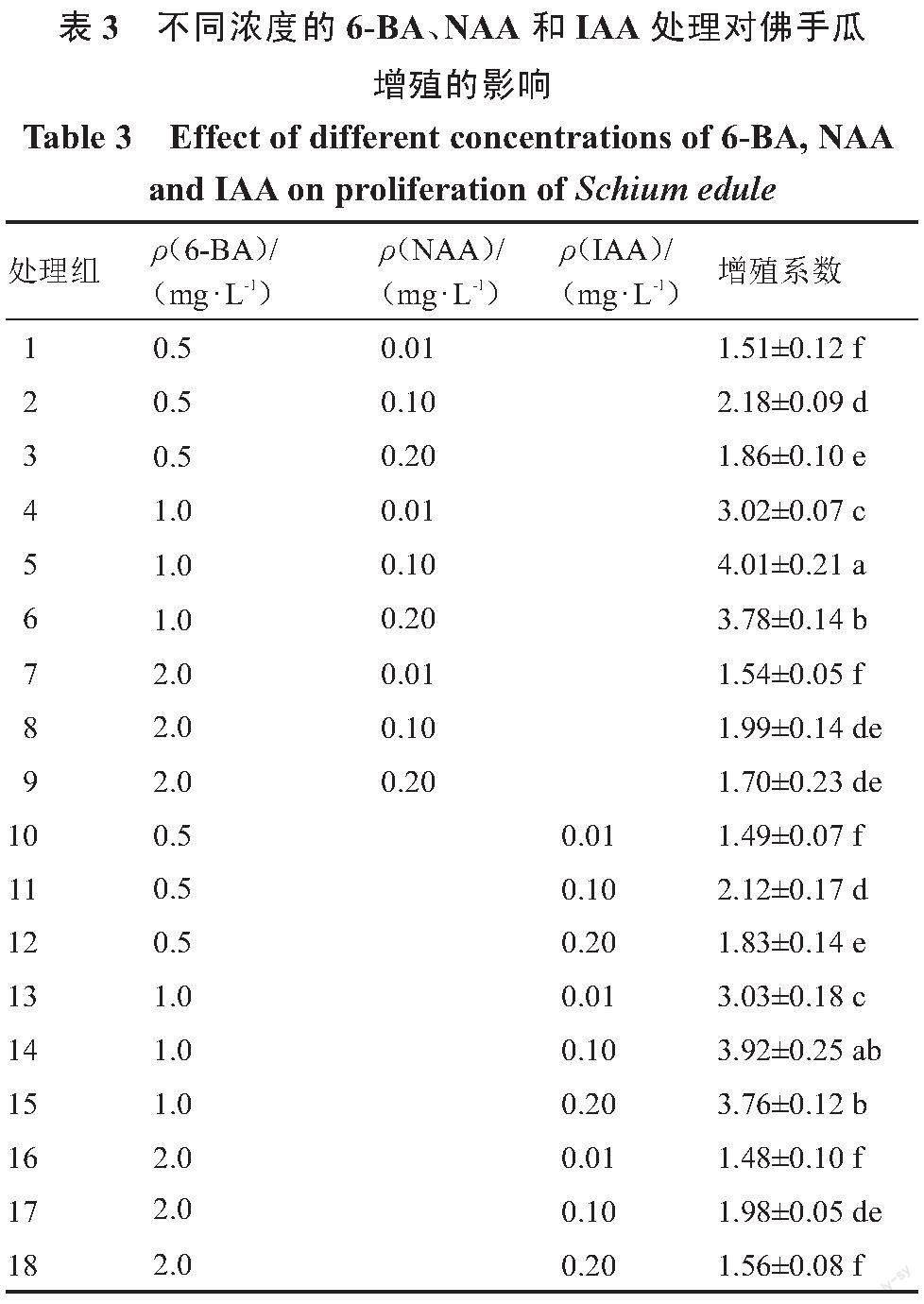
1.2.3 佛手瓜继代增殖培养基的筛选 将上一步诱导出的长到3~5 cm的腋芽无菌苗切成带有1叶1节的茎段,接种到以MS为基础培养基,分别添加不同激素质量浓度6-BA(0.5、1.0、2.0 mg·L-1)、NAA(0.01、0.1、0.2 mg·L-1)和IAA(0.01、0.1、0.2 mg·L-1)的培养基(表3)上进行增殖培养,每个处理接种30个外植体,3次重复,20 d后观察并统计丛生芽增殖情况。丛生芽增殖系数=萌发的丛生芽数/接种总外植体株数。
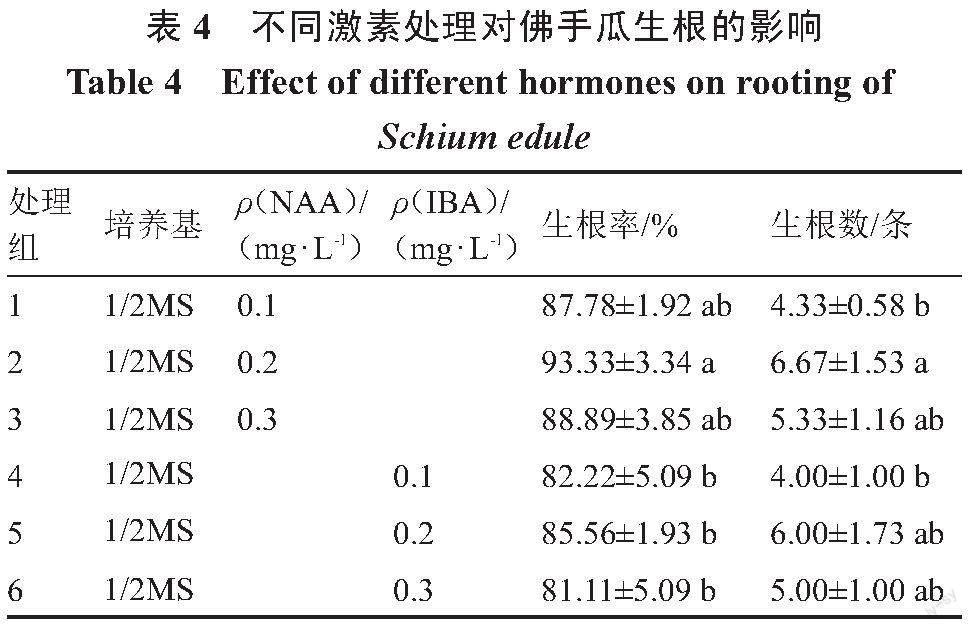
1.2.4 佛手瓜生根诱导 待腋芽长到3~5 cm长时,在无菌条件下切下腋芽转接到不同激素浓度IBA或NAA的1/2MS生根培养基中进行诱导,每个处理接种25个外植体,3次重复,15 d后观察并统计植株生根情况(表4)。生根率/%=(生根组培苗数/接种组培苗数)×100;生根数=生根总条数/生根的外植体个数。
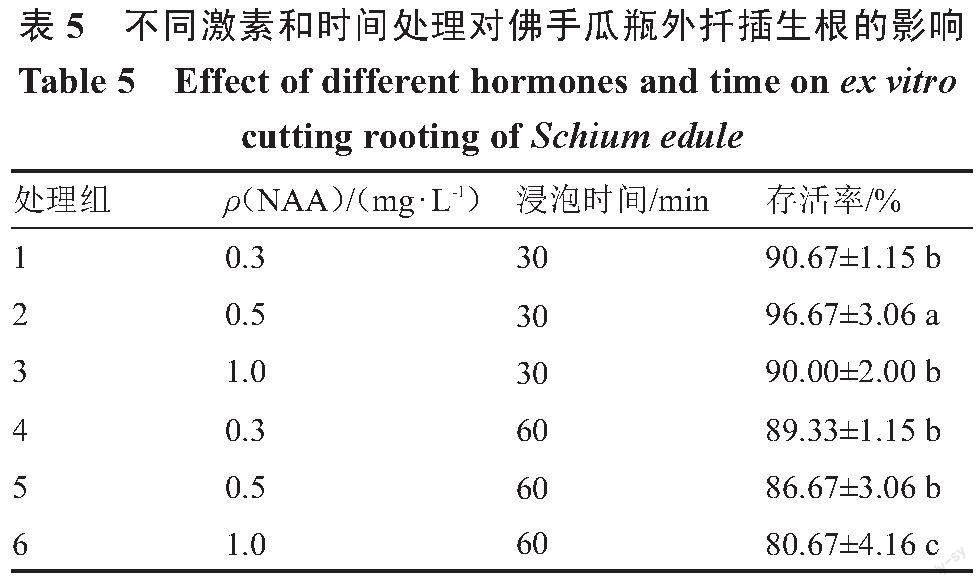
为建立佛手瓜瓶外生根繁育技术体系,采取另一种生根方法诱导生根。将3~5 cm长度的腋芽切下作为瓶外生根材料,研究NAA不同质量浓度(0.3、0.5、1.0 mg·L-1)和不同浸泡时间(30、60 min)对佛手瓜组培苗瓶外生根的影响情况(表5)。将腋芽切下浸泡处理后扦插到基质中进行生根诱导,每个处理接种50个外植体,3次重复,15 d后统计生长情况。扦插存活率/%=(扦插存活植株总数/总扦插植株数)×100。
1.2.5 佛手瓜炼苗和移栽 当佛手瓜植株生根或者根系发育基本稳定后,将培养瓶转移至室外开盖进行炼苗2~3 d,接着将植株根部的培养基洗净,移栽到基质营养土中,进行常规水肥管理。同时将稳定后的佛手瓜瓶外生根扦插苗移栽至大棚中进行常规管理。
1.2.6 数据处理 使用Microsoft Excel 2010和SPSS 24进行数据统计处理和显著性分析。
2 结果与分析
2.1 不同消毒时间对佛手瓜污染率和存活率的影响
在佛手瓜茎段的消毒处理中发现,选取佛手瓜茎段材料时,选择茎粗较小且半木质化的材料较为合适,不同的消毒方式对茎段的污染率和存活率有一定影响(表1),茎段的污染率随着0.1%氯化汞浸泡时间的延长逐渐下降,存活率呈先升高后降低的变化趋势。其中利用75%酒精处理20 s、0.1%氯化汞处理8 min,存活率最高,达85.00%,污染率为10.56%。当0.1%氯化汞处理时间为10 min时,污染率降低,但对茎段产生的伤害较大,存活率降低,因此选择75%酒精处理20 s、0.1%氯化汞处理8 min作为佛手瓜茎段的最佳消毒方式。
2.2 不同培养基对佛手瓜腋芽诱导的影响
将消毒好的佛手瓜茎段分别接种到不同的培养基中诱导(表2),发现带腋芽的佛手瓜茎段在3个基础培养基上都能够进一步萌发和生长,在添加了6-BA结合NAA或IAA的培养基上,腋芽的萌发速度较快,出芽率相当,但是在基部易产生黄色松软的愈伤组织且不能分化,影响腋芽的进一步生长,同时还发现与不添加活性炭(AC)的培养基相比,添加活性炭的培养基在佛手瓜基部產生的愈伤组织较少甚至不产生愈伤组织,叶色比较浓绿,茎秆粗壮、叶片大、节间短(图1A~C),且MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 IAA+1.0 g·L-1 AC和MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA+1.0 g·L-1 AC出芽率高,分别为91.11%、91.67%,与其他处理呈显著差异;MS出芽率最低,仅为82.78%。因此选择MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 IAA+1.0 g·L-1 AC和MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA+1.0 g·L-1 AC作为佛手瓜腋芽诱导的基础培养基。
2.3 不同激素处理对佛手瓜丛生芽增殖的影响
为了探究不同的激素处理对佛手瓜丛生芽增殖的影响,将诱导出的腋芽切下接种到不同激素处理的培养基中,合适的激素组合和浓度对芽的增殖培养有促进作用(表3)。随着6-BA质量浓度从0.5 mg·L-1增加到2 mg·L-1,佛手瓜丛生芽增殖系数呈先升高后下降的趋势,其中添加NAA的培养基丛生芽的增殖系数高于添加相同质量浓度IAA的培养基,因此选择NAA作为佛手瓜丛生芽增殖的诱导激素。在MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA培养基中,佛手瓜丛生芽增殖系数达到4.01,植株长势最好,叶片嫩绿,植株也较高,表现出良好的生长状态(图1-D)。随着6-BA质量浓度增加到2.0 mg·L-1,植株基部出现大量愈伤组织,在培养过程中逐渐褐化,且抑制植株的生长和分化,增殖系数降低,因此选择MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA作为佛手瓜丛生芽增殖培养的最佳培养基。
2.4 不同激素处理对佛手瓜生根的影响
为了探究不同的激素处理对佛手瓜生根的影响,将长到3~5 cm长的佛手瓜苗切下,转入到不同激素处理的培养基中,发现10 d左右即可观察到部分植株已经开始生根,15 d左右部分植株的根系长度可达3 cm,植株长势较好。从表4可以看出,选择NAA和IBA作为添加剂进行生根诱导,随着浓度升高,生根率和生根条数都呈先升高后降低的变化趋势,NAA与IBA相比,前者的生根率高于后者,因此NAA作为添加剂更适合佛手瓜的生根诱導,在NAA质量浓度为0.2 mg·L-1时生根率最高,达到93.33%,且生根条数也是最多的,平均生根数为6.67条,且在1/2MS+0.2 mg·L-1 NAA条件下根粗而多、叶片大小中等、植株健壮、长势较好(图1 E~F),因此选择该培养基作为佛手瓜生根诱导的最佳培养基。
2.5 不同激素处理对佛手瓜瓶外扦插生根的影响
为建立佛手瓜瓶外生根繁育技术体系,探究一种方便和节约时间的生根方式,待佛手瓜腋芽长到3~5 cm,直接将其剪下,采用激素浸泡处理后直接扦插。研究发现,NAA浸泡时间和浓度对佛手瓜扦插苗的存活率都有一定的影响,其中,浸泡60 min的存活率低于30 min(表5),在浸泡30 min条件下,存活率随着NAA质量浓度的增加呈先上升后下降的趋势,在0.5 mg·L-1时存活率达到96.67%,与其他处理相比呈显著差异,长势较好,10 d左右可以有新根长出(图1 G~H)。利用瓶外扦插有效避免了在瓶内生根后炼苗移栽对苗产生的损伤,因此选择0.5 mg·L-1 NAA浸泡处理30 min作为最佳的佛手瓜瓶外扦插处理方式。
2.6 驯化移栽和管理
打开瓶盖室温炼苗2 d后,将佛手瓜幼苗取出,用自来水将根部的培养基洗净,将多余水分晾干后移栽至基质中,进行常规的水肥管理(图1-I),存活率在95%以上。同时将生根后的佛手瓜瓶外扦插苗移栽至大棚中,进行常规管理,长势良好。
3 讨论与结论
在植物组织培养过程中,外植体材料的消毒是否成功是建立无性系的第一步,消毒不彻底会导致外植体细菌和真菌的滋生,进而导致接种外植体死亡。佛手瓜茎段中空常常易残留细菌,因此茎段的选取非常关键,经过多次试验,发现选择茎段较细且半木质化的外植体消毒后存活率更高。在对佛手瓜的消毒方面,前人的研究常采用次氯酸钠和氯化汞[10,13-14],但是都未进行系统的筛选,消毒效果未知。笔者的试验采用75%酒精20 s结合0.1%氯化汞8 min的消毒效果较好,存活率在85.00%以上。
佛手瓜的组织培养过程中外植体的选择也非常关键,前人的研究常用的外植体有幼叶、下胚轴及顶芽。赵建萍等[15]以佛手瓜幼叶为外植体诱导愈伤,但没有进行愈伤分化成芽的研究,王小素[16]以佛手瓜下胚轴为外植体诱导愈伤分化成芽,但在后期的重复试验中未能成功分化,可能是由环境或者品种不同引起的,后期会继续探索。笔者的研究采用带腋芽茎段作为外植体,取材较容易且能够保持亲本遗传物质的稳定性,采用顶芽作为外植体时,消毒后褐化和死亡现象比较严重,这可能是因为顶芽部分材料较嫩,消毒时间不易把控。
在佛手瓜的组培快繁过程中,腋芽诱导分化和丛生芽的增殖需要细胞分裂素和生长素的共同作用,与6-BA、NAA和IAA的使用量密切相关。高浓度6-BA会使基部分化愈伤,但愈伤质量较差,一段时间后直接褐化,且还会抑制腋芽的诱导。在植物的初代培养中,加入适量的活性炭可防止褐变、促进新芽的形成和伸长[17],笔者的研究表明,添加一定浓度的活性炭会有效抑制愈伤组织的分化,促进腋芽诱导,这与前人的研究结果相似[18]。在佛手瓜的增殖培养阶段,添加1.0 mg·L-1 6-BA和0.1 mg·L-1 NAA都可以促进佛手瓜丛生芽的增殖,但2种激素的比例与前人的报道不一致[13,19],可能与植物内源激素的含量有关。在生根阶段,常选择的激素有NAA、IBA和IAA等,其在瓶内或瓶外均有较好的生根诱导效果。瓶外生根有成本低、育苗周期短、简单易行等特点,在获得无菌苗较多的情况下此方法可作为生根诱导的首选[20-21]。笔者研究了不同的激素浓度和浸泡时间对佛手瓜瓶外生根的影响,结果表明,以0.5 mg·L-1 NAA浸泡30 min佛手瓜的存活率最高且长势最好,利用此方法可节约成本和时间,缩短育苗周期,为佛手瓜的良种推广提供参考。
笔者的研究结果表明,不同的消毒方式影响佛手瓜的污染率和存活率,佛手瓜茎段最佳消毒条件为75%酒精20 s + 0.1%氯化汞8 min;加入适量活性炭可有效抑制愈伤组织分化和促进芽的形成伸长,腋芽诱导适宜培养基为MS+1.0 g·L-1 AC+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA和MS+1.0 g·L-1 AC+1.0 mg·L-1 6-BA+0.1 mg·L-1 IAA;NAA更适合佛手瓜的增殖培养,最佳增殖培养基为MS+1.0 mg·L-1 6-BA+0.1 mg·L-1 NAA,平均增殖系数可达4.01;最佳生根培养基为1/2MS+0.2 mg·L-1 NAA,生根率为93.33%;最适的瓶外扦插生根条件为0.5 mg·L-1 NAA浸泡处理30 min。笔者建立的佛手瓜组培快繁体系为优质佛手瓜种质资源的保存提供了技术参考。
参考文献
[1] 胡玉红,王素梅,王肖锋,等.无公害佛手瓜生产技术[J].中国瓜菜,2006,19(1):42-43.
[2] 朱瑛.佛手瓜采后生理及种子休眠特性研究[D].陕西杨凌:西北农林科技大学,2007.
[3] CUI H N,ZHU Z C,LU Z K,et al.The complete chloroplast genome sequence of the Sechium edule (Jacq.) Swartz.(Cucurbitaceae)[J].Mitochondrial DNA B Resour,2021,6(1):97-98.
[4] 李玉.基于多变量分析的不同保鲜方法对采后佛手瓜品质变化的影响[D].四川雅安:四川农业大学,2016.
[5] ROSADO-PÉREZ J,AGUIÑIGA I,SANTIAGO-OSORIO E,et al.Effect of Sechium edule var.nigrum spinosum (Chayote)on oxidative stress and Pro-inflammatory markers in older adults with metabolic syndrome:An exploratory study[J].Antioxidants,2019,8(5):146.
[6] KE J X,JIANG G Y,SHEN G H,et al.Optimization,characterization and rheological behavior study of pectin extracted from chayote(Sechium edule)using ultrasound assisted method[J].International Journal Biological Macromolecules,2020,147:688-698.
[7] VIEIRA E F,PINHO O,FERREIRA I,et al.Chayote (Sechium edule):A review of nutritional composition,bioactivities and potential applications[J].Food Chemistry,2019,275:557-568.
[8] GAVIA-GARCÍA G,ROSADO-PÉREZ J,AGUIÑIGA I,et al.Effect of Sechium edule var.nigrum spinosum (Chayote)on telomerase levels and antioxidant capacity in older adults with metabolic syndrome[J].Antioxidants-Basel,2020,9(7):634.
[9] 譚国飞,吴小玉,罗庆,等.瓜表皮有刺毛和无刺毛佛手瓜转录因子SeTTG1的分离及表达分析[J].上海农业学报,2022,38(2):10-16.
[10] 吴涛,朱玉灵,赵红,等.佛手瓜组培快繁技术[J].北方园艺,2000(4):48.
[11] 雷军.佛手瓜绿茎扦插快繁试验研究[J].农业科技与信息,2012(1):26-27.
[12] 穆丁郁,张卫华.瓜类蔬菜组织培养研究综述[J].现代农业科技,2020(21):81-84.
[13] 亓增军.佛手瓜茎尖的快速繁殖技术[J].山东农业大学学报,1999,30(4):448-450.
[14] 林纬,黎起秦,卢继英,等.佛手瓜离体繁殖的研究[J].广西农业科学,2002(6):301-302.
[15] 赵建萍,徐丽丽.盐分胁迫对佛手瓜愈伤组织诱导的影响[J].烟台师范学院学报(自然科学版),1994(1):72-74.
[16] 王小素,李步勋,王广东.佛手瓜下胚轴离体培养及再生植株[J].西北农业大学学报,1997(1):83-87.
[17] 王红梅.活性炭在植物组织培养中的应用[J].上海农业科技,2011(4):19.
[18] 胡漪,王子怡,王依嘉,等.活性炭颗粒对黄芩组织培养快速繁殖的影响[J].北京农学院学报,2022,37(3):14-19.
[19] 柏新付,赵建萍,宋永军.佛手瓜幼苗对盐渍环境的反应[J].烟台师范学院学报(自然科学版),1995(1):57-60.
[20] 徐航,赵英,韩晓燕,等.沙棘组培苗瓶外生根技术研究[J].经济林研究,2018,36(3):182-186.
[21] 李黎,陈菲,曲彦婷.蔓越莓组培苗瓶外生根技术研究[J].国土与自然资源研究,2016(5):95-96.
