基于网络药理学和分子对接技术探讨黄芩治疗糖尿病心肌病的作用机制
2023-09-26孙玉凤葛卓琦李银洛白雪林淑娴陈琦
孙玉凤,葛卓琦,李银洛,白雪,林淑娴, ,陈琦*
1.贵州中医药大学,贵州 贵阳 550025
2.贵州医科大学,贵州 贵阳 550025
3.贵州省人民医院,贵州 贵阳 550002
据2021 年国际糖尿病联合会数据统计,目前世界上有5.37 亿20~79 岁的成年人患有糖尿病,而我国患病人数高达1.4 亿,居世界首位,预计2045年将达到1.74 亿[1]。糖尿病作为代谢性疾病之一,可导致多器官损伤,糖尿病心脏病变则是糖尿病患者死亡的主要原因[2-3]。而糖尿病心肌病是多种病因导致的一种疾病,其发病机制复杂,且在糖尿病心脏病变中,具有较高的发病率和严重的不良预后,备受人们关注[4]。目前临床上还未有针对该病的治疗及预防的药物,故寻求新的治疗技术和方法迫在眉睫。
近年来,随着中医药的发展,中药及其单体成分在糖尿病心肌病的治疗中发挥了重要作用,特别是中药及活性成分新靶点的发现很有可能成为治疗糖尿病引起心肌病变的重要靶标。黄芩是唇形科植物黄芩ScutellariabaicalensisGeorgi 干燥根,具有泻火燥湿、解毒宁心等功效,据2021 年版《糖尿病心肌病病症结合诊疗指南》强烈推荐其用于治疗中度糖尿病心肌病及热毒炽盛引起的心律失常[5-6]。黄芩中含有黄芩素、黄芩新素、黄芩苷、汉黄芩素、汉黄芩苷等黄酮类化合物,具有降低血糖、抗炎、抗氧化和抑制细胞凋亡等作用[7-11]。黄芩有效成分被广泛应用于糖尿病及其并发症的防治中,能有效改善糖尿病并发的心肌缺血和抑制心肌纤维化[12]。因此,黄芩有效成分在糖尿病心肌病防治方面有着广阔的空间,需要进一步开发和探索。
网络药理学是从整体角度预测药物与疾病之间的相互作用,揭示药物成分、靶点、疾病之间复杂的生物网络关系[13],分子对接则通过受体蛋白与配体药物分子之间的相互作用来分析、预测其结合模式和亲合力的一种理论模拟方法[14]。本研究基于网络药理学方法和分子对接技术,挖掘黄芩活性成分及治疗糖尿病心肌病的主要靶点、相关通路,阐明黄芩治疗糖尿病心肌病潜在的作用机制,为黄芩治疗糖尿病心肌病提供细胞分子层面的参考。
1 材料与方法
1.1 黄芩潜在活性成分及作用靶点的筛选
借助中药系统药理学分析平台(TCMSP,https://tcmsp-e.com)以“黄芩”为关键词检索黄芩中的化学成分及对应靶点,并以口服生物利用度(OB)≥30%和类药性(DL)≥0.18 筛选该药的活性成分,并获取各成分相应的靶点[15]。对于无法获得的靶点则通过SwissTargetPrediction(http://www.swisstargetprediction.ch)数据库对其进行补充。
1.2 疾病靶点的筛选
通过人类孟德尔遗传数据库OMIM(http://www.omim.org/)、疾病相关联数据库GeneCards(https://www.genecards.org/)以“diabetic cardiomyopathy”为关键词,进行人类基因检索。合并2 个数据库糖尿病心肌病疾病靶点,剔除重复靶点后,得到糖尿病心肌病疾病靶点。
1.3 靶标蛋白基因名的确定及活性成分-靶点网络图的构建
在蛋白数据库 UniProt(https://www.uniprot.org/)中下载人类全基因名称与黄芩成分对应靶点进行匹配,得到相应靶点标准化的基因名称。与SwissTargetPrediction 数据库检索到的靶点进行综合,去重得到成分靶点。将成分靶点与疾病靶点输入 Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/index.html)在线平台,得到交集靶点,即黄芩抗糖尿病心肌病的作用靶点。将黄芩活性成分及交集靶点对应导入Cytoscape 3.9.0 软件(http://www.cytoscape.org/)构建“活性成分-靶点”网络图。
1.4 构建蛋白相互作用(PPI)网络
将1.3 项下得到的交集靶点导入String(https://cn.string-db.org/)数据库中,选择“Multiple proteins”,设置物种为“Homo sapiens”,选择最小交互打分值为0.4 隐藏离散蛋白,导出PPI 网络分析“TSV”格式文件。将该文件导入Cytoscape 3.9.0软件中,并借助软件分析工具对网络进行拓扑参数分析,根据degree 值调节节点大小和颜色深浅,绘制PPI 网络关系图,并筛选degree 值靠前的靶点为核心靶点。
1.5 基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)信号通路分析
将1.3 项下的交集靶点导入DAVID(https://david.ncifcrf.gov/home.jsp)数据库,通过输入靶基因名称列表并限定物种为人,进行GO 富集分析及KEGG 代谢通路富集分析,其中GO 分析包括生物学过程(BP)、细胞组分(CC)、分子功能(MF),并用微生信在线工具(http://www.bioinformatics.com.cn/)将其结果可视化。最后利用Cytoscape 3.9.0软件构建其“活性成分-靶点-通路”网络图。
1.6 分子对接
选取Cytoscape 3.9.0 软件分析结果degree 值前10 位的黄芩有效成分与潜在作用靶点,在TCMSP数据库检索下载小分子“mol2”格式文件和在PDB(https://www.rcsb.org/)数据库下载大分子分辨率高的3D 结构,并保存分析“pdb”格式文件,导入PyMOL 2.4.1 软件对蛋白配体移除水分子、小分子配体,再将其导入AutoDockTools 1.5.7 软件对大分子蛋白进行加氢、计算电荷并设置为原子类型。最后选中所有活性位点,通过AutoDock Tools 1.5.7 设置对接盒子进行分子对接,最后采用PyMOL 2.4.1软件对结合位点进行可视化处理。
2 结果
2.1 黄芩活性成分及靶点的筛选
利用检索TCMSP 数据库以OB≥30%和DL≥0.18 进行筛选,共得到36 个活性成分,见表1。通过TCMSP 和SwissTargetPrediction 数据库共收集到2 828 成分靶点进行综合,剔除重复及无标准靶点后得到513 个黄芩活性成分相关的靶点。

表1 黄芩活性成分Table 1 Active ingredients of Scutellaria baicalensis
2.2 糖尿病心肌病潜在靶点预测
以“diabetic cardiomyopathy”为关键词,通过GeneCards 和OMIM 数据库分别检索糖尿病心肌病的相关靶点,并采用微生信在线绘图,分别获得474、1 131 个疾病靶点。去除92 个重复靶点,合并去重得到1 513 个潜在靶点。
2.3 黄芩活性成分-靶点网络的构建
将筛选出的活性成分与该成分对应的靶点导入Cytoscape 3.9.0 软件中,分析得到活性成分-靶点网络,见图1。该网络包含171 节点,2 180 条边,其中形状越大表示其degree值越高,相互作用越强。表明该成分所对应的靶点越多、靶点与成分之间的相互作用越强、成分越核心,体现了黄芩多成分、多靶点的特点。
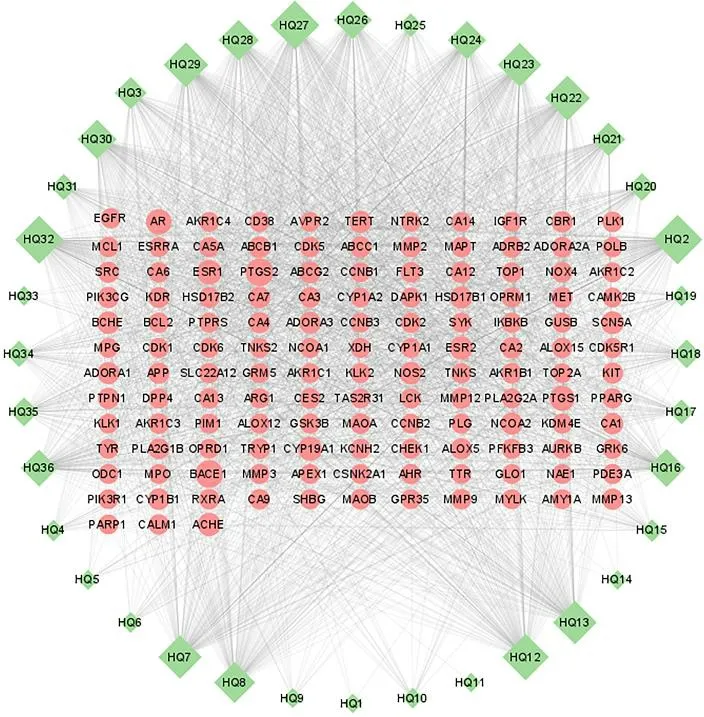
图1 活性成分-靶点网络Fig.1 Active component-target network
2.4 关键作用靶点筛选与靶点PPI 网络构建
利用Venny 2.1.0 绘制黄芩活性成分靶点与糖尿病心肌病靶点的交集,得到151 个共同靶点,见图2。并将共同靶点导入String 在线网络平台,设置置信度>0.4,进行分析,下载TSV 格式文件,导入Cytoscape 3.9.0,得到PPI 网络图,见图3,该图包括151 个节点,2 300 条边,其中节点越大,颜色越深,代表其degree 值越大,连线越粗代表蛋白间的相互作用越强。根据degree 值、中介系数中心性、接近度中心性得到蛋白激酶B1(Akt1)、肿瘤坏死因子(TNF)、甘油醛-3-磷酸脱氢酶(GAPDH)等10 个靶点为核心靶点,见表2。

图2 活性成分-糖尿病心肌病靶点韦恩图Fig.2 Venn diagram of active component-diabetic cardiomyopathy targets

图3 PPI 网络图Fig.3 PPI network
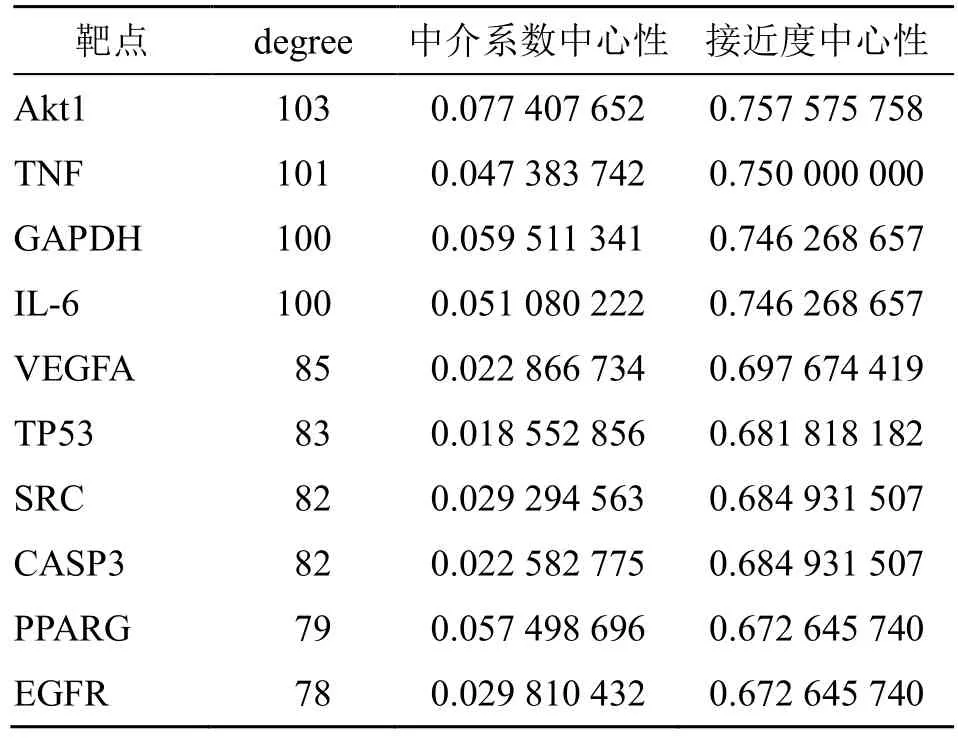
表2 核心靶点信息Table 2 Information of key targets
2.5 GO 功能及KEGG 通路富集分析
运用DAVID 在线数据库,对共同靶点进行GO功能富集分析,得到775 条BP 条目、86 条CC 条目和167 条MF 条目,根据分析将各类GO 功能富集按P值进行排序,取排名前10 位的条目进行作图,见图4。其柱状图越高,则靶点在该通路上所富集的靶标蛋白越多,说明这条通路更重要。

图4 GO 富集分析Fig.4 GO enrichment analysis
结果可见,BP 主要涉及对丝裂原活化蛋白激酶级联正调节、基因表达的正向调控、药物反应、丝裂原活化蛋白激酶活性的正向调节等;CC 主要集中受体复合物、质膜、膜筏、高分子配合物及胞外区等;MF 主要体现酶结合位点、相同蛋白的结合、RNA 聚合酶II 转录因子活性及蛋白丝氨酸/苏氨酸激酶活性等。
KEGG 通路分析得到169 条信号通路,以P值大小为筛选标准,取排名前30 位的信号通路,运用微生信在线绘制气泡图,见图5。可见该基因主要涉及癌症(基因数48)、脂质与动脉粥样硬化(基因数34)、癌症中的蛋白多糖(基因数29)、晚期糖基化终末产物及其受体(AGE-RAGE,基因数28)、磷脂酰肌醇-3-激酶(PI3K)/Akt(基因数31)、丝裂原活化蛋白激酶(MAPK,基因数28)等相关通路。其中有10 条与糖尿病心肌细胞损伤有关。图中横坐标代表基因比率,纵坐标代表通路;气泡越大表示在该通路上富集的基因数量越多,颜色越深表示P值越小、富集的显著性越高。将筛选出的主要成分、作用靶点、信号通路与疾病,导入Cytoscape 3.9.0,得到“活性成分-交集靶点-信号通路-疾病”网络路,见图6,图中共有162 节点、1 326 条边,由图可知,黄芩治疗糖尿病心肌病是通过该药中的36 个活性成分作用30 条主要通路和94 个靶点基因的结果。
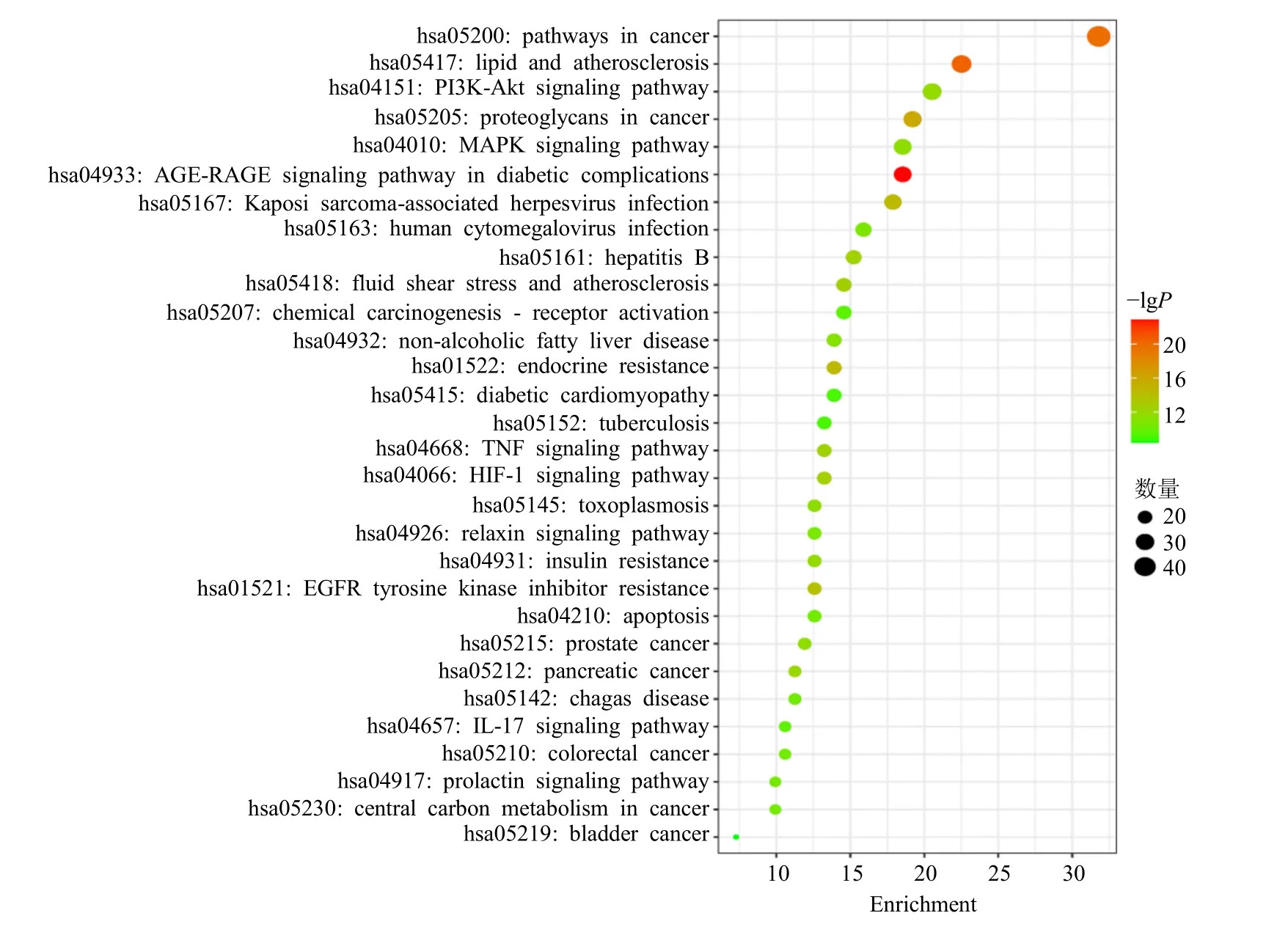
图5 KEGG 通路富集分析(前30 位)Fig.5 KEGG pathway enrichment analysis(top 30)

图6 黄芩成分-靶点-通路-疾病相互作用网络图Fig.6 Compounds-targets-pathways network of Scutellaria baicalensis
2.6 分子对接
选择degree 值前10 位的黄芩活性成分(表3)与degree 值排名前4 位的作用靶点,即Akt1、TNF、GAPDH、白细胞介素-6(IL-6)。利用AutoDock 1.5.7软件进行分子对接并打分,见图7。一般认为,若结合能在-5.0 kcal/mol(1 cal=4.4 J)以下时,说明此成分与对接靶点蛋白结合性较好,若结合能在-7.0 kcal/mol 以下时,则表明对接的两则具有强烈的结合活性[16],是与疾病靶点结合较好的活性成分。结果显示,40 组配体化合物-受体蛋白对接结合能均小于-5.0 kcal/mol,其中小于-8.0 kcal/mol 的有19 组,约占48%,表明本研究中所预测的活性成分可与关键靶点蛋白稳定结合并发挥治疗糖尿病心肌病的作用。将上述对接结果用PyMOL 2.4.1软件对其进行可视化分析,见图8。如图所示,活性成分黄芩素与关键靶点Akt1、TNF、GAPDH、IL-6 等的结合能均小于-8 kcal/mol,表明结合能力较强、结合构象较稳定。

图7 黄芩核心成分与核心靶点结合能热图Fig.7 Thermal map of binding energy between core components and core targets of Scutellaria baicalensis

图8 黄芩素分子对接图Fig.8 Molecular docking diagram of baicalein

表3 黄芩10 种核心成分网络节点特征参数Table 3 Characteristic parameters of network nodes of 10 core components of Scutellaria baicalensis
3 讨论
本研究采用网络药理学方法对黄芩活性成分、作用靶点、相关信号通路及其抗糖尿病心肌病作用机制等进行探讨,并对其活性成分与相关核心靶点进行分子对接。根据OB≥30%、DL≥0.18 及符合类药性五原则筛选,共筛选出36 种活性化合物和151 个潜在黄芩治疗糖尿病心肌病的疾病靶点。通过“活性成分-靶点”网络分析发现:汉黄芩素(wogonin)、黄芩素(baicalein)、表小檗碱(epiberberine)、黄芩新素(skullcapflavone II)等化合物可能在黄芩治疗糖尿病心肌病中发挥着关键作用。其中汉黄芩素和黄芩素,分别对应48、44 个靶基因。有研究表明,黄酮类化合物汉黄芩素和黄芩素均具有降血糖的作用[17]。汉黄芩素可以抑制葡萄糖吸收、肝脏中糖的生成及调节糖代谢过程中限速酶的表达等途径,降低血糖,并改善氧化应激和炎症反应,从而抑制高血糖导致的损伤[18-19]。黄芩素能抑制NF-κB 信号通路和游离脂肪酸释放,减少炎症因子的产生和释放,调节糖代谢,增强胰岛素敏感性信号激活,改善胰岛素抵抗状态,对高脂导致肝细胞损伤起到保护作用[20]。
本研究共获得黄芩活性成分作用靶点与糖尿病心肌病疾病靶点的交集靶点151 个,这151 个靶点可能是黄芩抗糖尿病心肌病的潜在靶点。PPI 网络及分子对接结果发现,黄芩抗糖尿病心肌病的核心靶点有Akt1、TNF、GAPDH、IL-6 等,主要参与细胞的增殖、凋亡、炎症、分化等BP,可能是黄芩抗糖尿病心肌病主要靶点。Akt1 与葡萄糖转运蛋白4 信号传递密切相关,可通过控制葡萄糖的摄取发挥调控血糖的作用[21]。TNF 可通过促进胰岛素受体底物1(ISR-1)的丝氨酸磷酸化来降低胰岛素所涉及信号的传导,进而诱导胰岛素抵抗的产生[22]。TNF-α 是TNF 通路中最关键的效应分子,TNF-α 可通过调控位于脂肪以及肌肉细胞的胰岛素受体,减少葡萄糖转运蛋白的合成[23]。GAPDH 是一种非常丰富的糖酵解酶,它是介导凋亡细胞死亡的主要细胞内信使。研究表明,氧化GAPDH 将S-谷胱甘肽基化转移到核蛋白Sirtuin-1 上,导致细胞凋亡[24]。IL-6 在病程早期可通过促进胰岛素产生,导致高胰岛素血症;晚期则可通过抑制细胞表面葡萄糖转运体4(GLUT-4)活性及诱导细胞转导信号抑制因子(SOCS-3)蛋白表达增多,干扰胰岛素信号传导通路,从而促进糖尿病的发生和发展[25]。有研究表明,黄芩素能减少高糖诱导 HK-2 细胞中活性氧(ROS)、丙二醛(MDA)含量及TNF-αmRNA 和p-Akt、TNF-α 蛋白等的表达,对肾小管上皮细胞起到保护作用[26]。黄芩素还可以通过抑制IL-6、TNF-α、IL-1β 等炎症因子表达,改善肥胖小鼠体脂及胰岛素抵抗的作用,调节异常糖脂代谢[27]。因此,以上靶点可能在黄芩及其活性成分治疗糖尿病心肌病中发挥同等重要的作用。
随后,本研究对黄芩抗糖尿病心肌病病变作用靶点进行GO 富集和KEGG 富集分析。结果表明,其BP 主要涉及MAPK 级联正调节、基因表达的正向调控、药物应答、丝裂原活化蛋白激酶活性的正向调节、PI3K 信号的阳性调控反应等;CC 主要集中受体复合物、细胞膜、膜筏等;MF 主要体现酶结合位点、相同蛋白的结合及配RNA 聚合酶Ⅱ特异性DNA 结合转录因子结合等。KEGG 富集通路表明,黄芩抗糖尿病心肌病信号通路涉及AGERAGE 信号通路、内分泌抵抗、低氧诱导因子-1(HIF-1)信号通路、TNF 信号通路等。其中排名最前的AGE-RAGE 信号通路在糖尿病及其并发症联系十分密切,主要与细胞膜上的受体结合,能激活Janus 激酶-信号转导子与转录激活子(JaK-STAT)、PI3K-Akt、MAPK 等信号通路,并促进炎性反应和氧化应激的发生[28]。炎症在糖尿病心肌病的发病中起着至关重要的作用,糖尿病患者体内的炎症因子(TNF-α、IL-1、IL-6)和细胞因子及趋化因子的升高,促进炎症联级的发生,加重了胰岛素的抵抗作用,导致糖尿病患者代谢紊乱[29],使心细胞肥大、线粒体功能障碍、内质网应激增加、成纤维细胞增殖和胶原的生成[23],最终导致心肌细胞凋亡,左心室收缩、舒张功能障碍。TNF-α 是TNF 通路中最关键的效应分子,参与诱发炎症反应、细胞凋亡及免疫调节等过程[23,25,27]。近年研究表明,HIF-1α 及其下游的其他靶分子如内皮型一氧化氮合酶、基质细胞衍生因子-1 等,均可促进血管内皮细胞数量增多,调节糖尿病患者血管生成,参与VEGF 的调控紊乱共同导致糖尿病心肌I/R 时侧支循环血管生成障碍[30-31]。因此,结合分子对接和KEGG 代谢通路富集分析结果发现,黄芩活性成分可能通过参与调控葡萄糖的获取、减少炎症因子分泌、改善胰岛素信号通络,发挥抗糖尿病心肌病作用。
综上所述,本研究采用网络药理学与分子对接相结合的方法来探讨黄芩抗糖尿病心肌病的活性成分、靶点及其作用机制,证明了黄芩通过多靶点、多成分和多途径的相互作用治疗糖尿病心肌病。
利益冲突所有作者均声明不存在利益冲突
