千里光化学成分及抗烟草花叶病毒活性研究
2023-09-25李雅丽吴江梅罗新香闫晓慧胡世俊
符 滔,李雅丽,张 威,吴江梅,刘 洋,罗新香,闫晓慧*,胡世俊
1西南林业大学生物多样性保护学院 云南省森林灾害预警与控制重点实验室;2西南林业大学林学院,昆明 650233
植物病毒病被称为“植物癌症”,是仅次于植物真菌病害的第二大植物病害,由于缺乏理想的防治措施,对农业生产造成了巨大的损失,每年由植物病毒造成的经济损失超过100亿美元[1,2]。烟草花叶病毒(tobacco mosaic virus,TMV)是最早发现的单链RNA植物病毒,其寄主范围广泛,涉及有65个科的885种植物,烟草及其他农作物感染TMV后,被感染的植株叶片叶绿素会遭到破坏,继而使其光合作用减弱,出现生长困难、矮化等症状,甚至死亡[3-5]。烟草是我国重要的经济作物,而TMV每年都会造成烟草产量和质量的严重损失,据有关数据统计,每年因为烟草花叶病毒造成的经济损失达到一亿美元,且防治TMV较为困难,虽已投入使用了几种抗TMV的商业抗病毒剂,但有效和实用的品种很少[6,7]。因此开发高效、低毒的新型抗TMV药剂迫在眉睫。
千里光属(Senecio)作为菊科(Asteraceae)植物中最大的属,共包括1 500多个种,在我国分布的有160多种[8]。千里光(Senecioscandens)是千里光属多年生植物,茎多曲折呈攀援状,上部多分枝,头状花序,花黄色,叶片呈卵状三角形或椭圆状披针形,主要分布于我国华东、中南及西南各地,多生于丘陵山地林边,灌丛、草丛和路边[9,10]。千里光是我国传统的中药材,具有清热解毒、明目、利湿的功效,有较好的抗炎、抗菌、抗病毒的作用[11,12]。
本研究旨对千里光进行抗TMV活性筛选,研究其中具有抗烟草花叶病毒活性的化学成分。从中优选出活性最强的化合物,以此为烟草花叶病的防治提供理论依据,也为千里光植物的资源化利用提供科学依据。
1 材料与方法
1.1 材料、仪器与试剂
1.1.1 植物材料
样品采自云南昆明,经西南林业大学胡世俊副教授鉴定为千里光(SenecioscandensBuch.-Ham),标本(QLG2018~11)存放于西南林业大学森林灾害预警与控制重点实验室。
1.1.2 供试病毒及寄主
TMV(U1)普通株系,由云南省农业科学院生物技术与种质资源研究所提供。繁殖于普通烟K326(Nicotianatabacumcv.K326)上,采用Gooding[13]的方法进行提纯,置于-70 ℃冰箱中保存备用。心叶烟(Nicotianaglutinosa)为枯斑寄主,在无虫温室中培育,待烟苗长至4~6片真叶时进行活性测定。
1.1.3 仪器
Bruker AM-500,Bruker AV-600 MHz核磁共振仪(德国布鲁克公司);Bruker HTC/Esquire质谱仪(德国布鲁克公司);LC3000型半制备高效液相色谱仪(北京赛普锐思科技有限公司)。
1.1.4 试剂
柱层析硅胶及GF254薄层层析硅胶板(青岛海洋化工厂);葡聚糖凝胶Sephadex LH-20(瑞典Amersham Pharmacia Biotech AB公司);C-18反向硅胶(日本YMC公司);色谱纯溶剂甲醇和乙腈(上海星可高纯溶剂有限公司);工业乙醇、甲醇、石油醚、乙酸乙酯、氯仿和丙酮经重蒸后使用;以碘和5%的硫酸乙醇溶液为显色剂;二甲基亚砜(DMSO)为分析纯、8%宁南霉素水剂购自德强生物股份有限公司。
1.2 实验方法
1.2.1 植物提取物的制备
千里光地上部分12.00 kg干燥后粉碎,采用95%乙醇回流提取3次,每次3~4 h,合并三次提取液,减压浓缩至浸膏状;将乙醇提取物用蒸馏水溶解后,依次用石油醚、乙酸乙酯、正丁醇各萃取3次,得相应溶剂萃取物。
1.2.2 化合物的分离
乙酸乙酯萃取物(414.16 g)经硅胶(100~200目)柱色谱分离,以石油醚-乙酸乙酯(50∶1→1∶1)进行梯度洗脱,经薄层层析检测,合并相同组分,共获得7个流分(Fr.1~Fr.7)。
Fr.1(2.07 g)采用葡聚糖凝胶色谱(氯仿-甲醇=1∶1),得到5个亚流分(Fr.1-1~Fr.1-5),Fr.1-4(0.75 g)经正相硅胶柱层析,以正己烷-石油醚(0∶1→100∶1)梯度洗脱,得到化合物1(12.7 mg)。Fr.4(6.56 g)采用MCI小孔树脂除色素,甲醇-水(20%→100%)梯度洗脱,20%(0.11 g)经硅胶柱层析,以石油醚-丙酮(30∶1→5∶1)梯度洗脱,得到化合物3(8.10 mg);80%(0.10 g)采用葡聚糖凝胶色谱(氯仿-甲醇=1∶1),经硅胶柱层析,以石油醚-乙酸乙酯(30∶1→6∶1)梯度洗脱,得到化合物4(5.90 mg);90%(0.80 g)经硅胶柱层析,以石油醚-乙酸乙酯(1∶0→5∶1)梯度洗脱后采用葡聚糖凝胶色谱柱(氯仿-甲醇=1∶1)划段,通过半制备液相色谱分析,得到化合物6(10.00 mg);100%(0.39 g)经硅胶柱层析,以石油醚-丙酮(100∶1→5∶1)梯度洗脱,得到化合物2(3.40 mg)、化合物5(2.70 mg)。Fr.5(13.30 g)采用MCI小孔树脂除色素,甲醇-水(20%→100%)梯度洗脱,90%部分采用葡聚糖凝胶色谱(甲醇)划段,经硅胶柱层析,以石油醚-乙酸乙酯(100∶1→5∶1)梯度洗脱,得到化合物13(13.40 mg)。Fr.6(21.60 g)经硅胶柱层析,以石油醚-乙酸乙酯(30∶1→2∶1)梯度洗脱,得到Fr.6-1~Fr.6-19,Fr.6-19采用葡聚糖凝胶色谱(氯仿-甲醇=1∶1)划段,采用葡聚糖凝胶色谱(甲醇)纯化得到化合物7(4.00 mg);Fr.6-17采用葡聚糖凝胶色谱(氯仿-甲醇=1∶1)划段,通过半制备液相色谱分析后用葡聚糖凝胶色谱(甲醇)纯化得到化合物8(18.70 mg)。Fr.7(24.60 g)采用MCI小孔树脂除色素,甲醇-水(20%→100%)梯度洗脱,80%部分(6.70 g)采用葡聚糖凝胶色谱(甲醇)分离得到化合物9(2.10 mg)和10(65.70 mg);90%部分(4.30 g)采用葡聚糖凝胶色谱(甲醇)划段后,经硅胶柱层析,以石油醚-乙酸乙酯(10∶1→5∶1)梯度洗脱,得到化合物11(4.50 mg)、12(2.30 mg)。
1.2.3 抗TMV活性测定
将供试化合物用DMSO配置成10 mg/mL的母液,置于4 ℃冰箱中备用,采用活体半叶枯斑法测定[14],用纯净水将化合物母液稀释到50 μg/mL备用。挑选健康长势一致的心叶烟,每株选取3片叶龄和叶片大小相近的上部叶片,测定其保护作用:在左半叶涂抹化合物,右半叶涂抹相同浓度的DMSO溶液作对照;阳性对照植株左半叶涂抹50 μg/mL的宁南霉素,右半叶涂抹相同浓度的DMSO溶液;6 h后摩擦接种TMV。治疗作用:叶片摩擦接种TMV。6 h后,左半叶涂抹化合物,右半叶涂抹相同浓度的DMSO溶液作为对照;阳性对照设置同上。钝化作用:将TMV 400倍稀释液与化合物充分混合后静置30 min;左半叶摩擦接种TMV与化合物混合溶液作为处理,右半叶摩擦接种相同浓度的DMSO与TMV混合溶液作为对照。以上处理均在无虫温室中培养,2~3 d后叶片出现明显的枯斑症状时,统计枯斑的数量并由公式“抑制率=[(对照平均枯斑数-处理平均枯斑数)/对照平均枯斑数]×100%”计算抑制率。
1.2.4 数据处理
采用SPSS 20.0统计软件,运用Duncan检验比较不同处理间的差异,P<0.05表示差异具有统计学意义,不同药物处理的组别以变异数分析(ANOVA)计算,采用多重比较(LSD)。
2 实验结果
2.1 化合物结构鉴定
化合物1白色针晶(氯仿);ESI-MS:m/z425[M+H]+;分子式为C30H48O;1H NMR(500 MHz,CDCl3)δ:5.09(1H,s,H-24),1.70(3H,s,H-27),1.60(3H,s,H-26),1.10(3H,s,H-29),1.09(3H,s,H-30),1.05(3H,s,H-18),0.90(3H,s,H-28),0.89(3H,s,H-21),0.78(1H,d,J= 4.2 Hz,H-19β),0.56(1H,d,J= 4.3 Hz,H-19α);13C NMR(125 MHz,CDCl3)δ:33.4(C-1),37.5(C-2),216.7(C-3),50.3(C-4),48.5(C-5),21.5(C-6),25.9(C-7),47.2(C-8),21.1(C-9),26.0(C-10),26.7(C-11),32.8(C-12),45.3(C-13),48.7(C-14),35.6(C-15),28.2(C-16),52.3(C-17),18.2(C-18),29.6(C-19),35.9(C-20),18.1(C-21),36.3(C-22),24.9(C-23),125.2(C-24),131.0(C-25),17.0(C-26),25.7(C-27),22.2(C-28),20.8(C-29),19.0(C-30)。以上数据与文献[15]报道一致,故确定化合物为24-烯-环阿尔廷酮。
化合物2无色针状结晶(氯仿);ESI-MS:m/z467[M + Na]+;分子式为C30H52O2;1H NMR(500 MHz,CDCl3)δ:5.74(1H,s,H-6),3.60(1H,m,H-3),3.35(3H,s,7-CH3),3.28(1H,s,H-7),1.50(3H,m,H-26),1.25(3H,m,H-27),0.98(3H,s,H-19),0.92(3H,d,J= 6.5 Hz,H-21),0.86(3H,m,H-29),0.65(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:37.2(C-1),31.5(C-2),71.4(C-3),42.3(C-4),146.1(C-5),120.8(C-6),73.9(C-7),37.5(C-8),42.7(C-9),36.2(C-10),20.8(C-11),39.1(C-12),42.1(C-13),49.1(C-14),24.3(C-15),28.3(C-16),55.7(C-17),11.5(C-18),18.3(C-19),36.7(C-20),18.8(C-21),34.0(C-22),26.0(C-23),45.9(C-24),29.2(C-25),19.8(C-26),19.0(C-27),23.1(C-28),12.0(C-29),56.8(7-OCH3)。以上数据与文献[16,17]报道一致,故确定化合物为3β-羟基-7β-甲氧基-5-豆甾烯。
化合物3白色片状结晶(氯仿);ESI-MS:m/z473[M + Na]+,分子式为C32H66;1H NMR(500 MHz3,CDCl3)δ:1.25(30×CH2),0.86(6H,m,2×CH3);13C NMR(125 MHz,CDCl3)δ:31.9(2×CH2),29.7(24×CH2),29.4(2×CH2),22.7(2×CH2),14.1(2×CH3)。数据与文献[18]报道一致,故确定化合物为正三十二烷。
化合物4无色针状结晶(氯仿);ESI-MS:m/z455[M-H]-,分子式为C30H48O3;1H NMR(500 MHz,CDCl3)δ:5.18(1H,s,H-12),3.60(1H,m,H-3),1.27(3H,s,H-27),1.04(3H,s,H-25),0.95(3H,s,H-23),0.91(3H,s,H-24),0.85(3H,m,H-29),0.81(3H,m,H-30),0.74(3H,s,H-26);13C NMR(125 MHz,CDCl3)δ:38.7(C-1),28.1(C-2),78.9(C-3),39.0(C-4),55.2(C-5),18.5(C-6),33.1(C-7),39.4(C-8),47.6(C-9),36.9(C-10),23.5(C-11),124.9(C-12),138.8(C-13),42.2(C-14),28.1(C-15),24.5(C-16),49.2(C-17),53.2(C-18),39.3(C-19),39.4(C-20),30.9(C-21),37.2(C-22),29.3(C-23),16.5(C-24),14.0(C-25),17.0(C-26),22.7(C-27),182.7(C-28),17.0(C-29),21.2(C-30)。以上数据与文献[19]报道一致,故确定化合物为乌索酸。
化合物5无色针状结晶(氯仿);ESI-MS:m/z431[M + H]+,分子式为C29H48O2;1H NMR(150 MHz,CDCl3)δ:5.34(1H,t,J= 4.6 Hz,H-6),5.15(1H,dd,J= 15.1,8.5 Hz,H-22),5.01(1H,dd,J= 15.1,8.5 Hz,H-23),3.52(1H,m,H-3),2.27(1H,m,H-20),1.01(3H,s,H-19),0.92(3H,d,J= 6.4 Hz,H-21),0.84(3H,t,J= 6.3 Hz,H-29),0.80(6H,d,J= 6.7 Hz,26,H-27),0.70(3H,s,H-18);13C NMR(600 MHz,CDCl3)δ:37.2(C-1),31.7(C-2),71.8(C-3),42.3(C-4),140.7(C-5),121.7(C-6),31.9(C-7),31.7(C-8),50.1(C-9),36.1(C-10),21.1(C-11),39.8(C-12),42.3(C-13),56.8(C-14),24.3(C-15),28.2(C-16),56.0(C-17),11.9(C-18),19.0(C-19),36.1(C-20),19.4(C-21),138.3(C-22),129.3(C-23),45.8(C-24),29.1(C-25),19.8(C-26),18.8(C-27),23.0(C-28),11.9(C-29)。以上数据与文献[20]报道一致,故确定化合物为豆甾醇。
化合物6黄色无定形粉末;ESI-MS:m/z453[M+Na]+,分子式为C28H46O3;1H NMR(500 MHz,(CD3)2CO)δ:6.47(1H,d,J= 8.4 Hz,H-7),6.21(3H,d,J= 8.4 Hz,H-6),5.24(1H,dd,J= 15.4,7.3 Hz,H-23),5.18(1H,dd,J= 15.4,8.1 Hz,H-22),3.78(1H,m,H-3),1.01(3H,d,J= 7.2 Hz,H-28),0.93(3H,d,J= 6.4 Hz,H-21),0.88(3H,H-19),0.84(3H,d,J= 6.4 Hz,H-26),0.83(3H,s,H-18),0.81(3H,d,J= 6.4 Hz,H-27);13C NMR(125 MHz,(CD3)2CO)δ:35.7(C-1),31.1(C-2),66.2(C-3),37.7(C-4),82.3(C-5),136.5(C-6),131.1(C-7),79.4(C-8),38.0(C-10),21.3(C-11),40.3(C-12),45.1(C-13),52.7(C-14),29.3(C-15),24.0(C-16),57.0(C-17),13.2(C-18),18.5(C-19),40.5(C-20),20.0(C-21),132.8(C-22),136.4(C-23),43.7(C-24),33.8(C-25),20.3(C-26),18.0(C-27),21.3(C-28)。以上数据与文献[21]报道一致,故确定化合物为(22E)-ergosta-6,22-diene-3β,5β,8α-triol。
化合物7黄色针状结晶(甲醇);ESI-MS:m/z285[M-H]-,分子式为C15H10O6;1H NMR(600 MHz,CD3OD)δ:8.08(2H,d,J= 8.8 Hz,H-2′,6′),6.89(2H,d,J= 8.9 Hz,H-3′,5′),6.38(1H,d,J= 2.0 Hz,H-8),6.17(1H,d,J= 2.0 Hz,H-6);13C NMR(150 MHz,CD3OD)δ:148.0(C-2),137.1(C-3),177.4(C-4),162.5(C-5),99.34(C-6),165.9(C-7),94.5(C-8),158.3(C-9),104.5(C-10),123.75(C-1′),160.6(C-4′),130.7(C-2′,C-6′),116.3(C-3′,C-5′)。以上数据与文献[22]报道一致,故确定化合物为山柰酚。
化合物8无色针状结晶(甲醇);ESI-MS:m/z144[M-H]-,分子式为C9H7NO;1H NMR(500 MHz,CD3OD)δ:9.87(1H,s,H-8),8.15(1H,t,H-4),8.08(1H,s,H-2),7.47(1H,d,J= 8.9 Hz,H-7),7.27(1H,m,H-6),7.22(1H,m,H-5);13C NMR(125 MHz,CD3OD)δ:139.7(C-2),120.1(C-3),125.7(C-3a),125.0(C-4),122.4(C-5),123.6(C-6),113.1(C-7),138.9(C-7a),187.4(C-8)。以上数据与文献[23]报道一致,故确定化合物为3-吲哚甲醛。
化合物9淡黄色粉末;ESI-MS:m/z315[M-H]-,分子式为C16H12O7;1H NMR(500 MHz,CD3OD)δ:7.38(1H,d,J=2.2 Hz,H-6′),7.36(1H,s,H-2′),6.88(1H,d,J= 7.9 Hz,H-5′),6.55(1H,s,H-8),6.53(1H,s,H-3),3.86(3H,s,OCH3);13C NMR(125 MHz,CD3OD)δ:166.5(C-2),103.4(C-3),184.2(C-4),154.0(C-5),132.9(C-6),158.9(C-7),95.3(C-8),154.7(C-9),105.7(C-10),123.7(C-1′),114.1(C-2′),147.0(C-3′),151.0(C-4′),116.8(C-5′),120.3(C-6′),60.9(6-OCH3)。以上数据与文献[24]报道一致,故确定化合物为泽兰黄酮。
化合物10黄色针状结晶(甲醇);ESI-MS:m/z301[M-H]-,分子式为C15H10O7;1H NMR(500 MHz,CD3OD)δ:7.72(1H,d,J= 2.0 Hz,H-2′),7.62(1H,dd,J= 8.5,2.0 Hz,H-6′),6.87(1H,d,J= 8.5 Hz,H-5),6.37(1H,d,J= 1.9 Hz,H-8),6.17(1H,d,J= 2.0 Hz,H-6);13C NMR(125 MHz,CD3OD)δ:148.8(C-2),137.2(C-3),177.3(C-4),158.2(C-5),99.2(C-6),165.6(C-7),94.4(C-8),162.5(C-9),104.5(C-10),124.1(C-1′),116.0(C-2′),146.2(C-3′),148.0(C-4′),116.2(C-5′),121.7(C-6′)。以上数据与文献[25]报道一致,故确定化合物为槲皮素。
化合物11黄色无定形粉末;ESI-MS:m/z303[M-H]-,分子式为C15H12O7;1H NMR(500 MHz,CD3OD)δ:6.95(1H,d,J= 1.8 Hz,H-2′),6.83(1H,dd,J= 8.1,1.9 Hz,H-6′),6.78(1H,d,J= 8.1 Hz,H-5′),5.77(1H,s,H-6,H-8),4.89(1H,d,J= 11.5 Hz,H-2),4.43(1H,d,J= 11.3 Hz,H-3);13C NMR(125 MHz,CD3OD)δ:82.8(C-2),73.6(C-3),196.9(C-4),165.3(C-5),97.7(C-6),173.5(C-7),84.9(C-8),164.4(C-9),100.6(C-10),130.2(C-1′),116.0(C-2′),146.3(C-3′),147.0(C-4′),115.8(C-5′),120.8(C-6′)。以上数据与文献[26]报道一致,故确定化合物为紫杉叶素。
化合物12黄色无定形粉末;ESI-MS:m/z223[M+Na]+,分子式为C9H10O4;1H NMR(600 MHz,CD3OD)δ:7.05(1H,d,J= 10.1 Hz,H-5),6.13(1H,d,J= 10.1 Hz,H-6),3.64(3H,s,H-9),2.75(2H,s,H-7);13C NMR(150 MHz,CD3OD)δ:68.0(C-1),152.8(C-2),128.3(C-3),187.4(C-4),128.3(C-5),152.8(C-6),45.7(C-7),170.9(C-8),52.2(C-9)。以上数据与文献[27]报道一致,故确定化合物jacaranone。
化合物13无色油状;ESI-MS:m/z319[M+Na]+,分子式为C20H40O;1H NMR(500 MHz,CDCl3)δ:5.40(1H,t,J= 6.9 Hz,H-2),4.14(2H,d,J= 6.9 Hz,H-1),1.98(2H,m,H-15),1.67(3H,s,H-17),1.52(1H,m,H-15),0.87(3H,d,J= 6.4 Hz,H-16),0.87(3H,d,J= 6.4 Hz,H-20),0.84(3H,d,J= 6.2 Hz,H-18),0.83(3H,d,J= 6.6 Hz,H-19);13C NMR(125 MHz,CDCl3)δ:59.4(C-1),123.1(C-2),140.3(C-3),39.9(C-4),25.1(C-5),36.7(C-6),32.8(C-7),37.4(C-8),24.5(C-9),37.4(C-10),32.7(C-11),37.4(C-12),24.8(C-13),39.4(C-14),28.0(C-15),22.7(C-16),22.6(C-17),19.8(C-18),19.7(C-19),16.2(C-20)。数据与文献[28]数据报道一致,故确定化合物为叶绿醇。
从千里光乙酸乙酯萃取物中分离的13个化合物的结构式见图1。
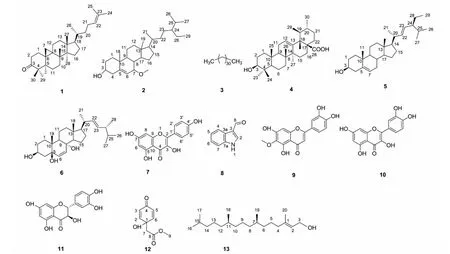
图1 化合物1~13的化学结构Fig.1 Chemical structures of compounds 1-13
2.2 化合物抗TMV活性实验结果
分离得到的化合物1~13的抗TMV活性结果由表1所示。化合物8对心叶烟的保护作用显著高于宁南霉素(见图2);化合物1、4、9~13与宁南霉素无显著差异,表明化合物1、4、8~13能诱导烟草获得植物系统抗性抵抗病毒;化合物2、3、6、7低于宁南霉素,化合物5对TMV的侵染没有抑制作用。化合物13对TMV侵染心叶烟的治疗作用高于宁南霉素(见图2),化合物9与宁南霉素无显著差异。除化合物8外其余化合物对接种TMV的心叶烟均有一定的治疗作用,能明显减轻枯斑症状。化合物8、9对TMV初侵染的体外钝化作用与宁南霉素均无显著差异;除化合物13无钝化作用外,其余化合物均能在体外作用于病毒。
表1 化合物1~13的抗TMV活性结果

图2 化合物8和13半叶枯斑法部分实验结果Fig.2 Partial experimental results of compound 8 and 13 through half-leaf method注:A.化合物8的保护作用;B.化合物13的治疗作用。图中左半叶施用化合物进行处理,右半叶为对照。Note:A.Protective effect of compound 8;B.Therapeutic effect of compound 13.The left halves were processed with compounds and the right halves were control groups.
3 讨论与结论
植物界产生超过40万种次生代谢物[29],其中包括可抵抗植物病毒的有效成分,并且植物自身产生的化学防御物质,对植物本身有较低的自毒性,对环境友好。因此从植物中寻找抗TMV活性物质是一条十分可行的路线,近年来,已有较多报道[30-32]。
本研究通过运用现代高效的植物化学分离研究方法,从千里光乙酸乙酯萃取物中分离得到13个单体化合物,除化合物7和10外,其余化合物均为首次从千里光中分离得到。抗烟草花叶病毒活性测试结果发现,化合物8对TMV侵染的心叶烟的保护作用抑制率显著高于宁南霉素;化合物1、4、9~13对心叶烟的保护作用均与宁南霉素无显著差异,表明这些化合物均可以诱导烟草获得植物系统抗性抵御病毒。化合物13对烟草感染TMV的治疗作用抑制率高于宁南霉素;化合物9的抑制率与宁南霉素无显著差异。化合物8、9对TMV的体外钝化作用与宁南霉素的抑制率差异不显著,表明这两个化合物可以直接作用于病毒发挥抗TMV作用。
综上所述,千里光化学成分对TMV具有显著的抑制作用,其中生物碱类、萜类和部分黄酮类化合物显示了较强的抗TMV活性,这类成分是否为主要的抗病毒活性成分,值得进一步探究,本研究丰富了千里光化学成分和生物活性的范畴,为今后烟草花叶病的绿色防控提供了一定的科学依据。
