磁性生物炭吸附水中甲基橙的作用机制——基于密度泛函理论与实验研究
2023-09-25王诗生张梦梦盛广宏田勇攀刘轶鋆章慧娟刘永兴
王诗生,张梦梦,盛广宏,2,田勇攀,刘轶鋆,2,章慧娟,2,刘永兴
磁性生物炭吸附水中甲基橙的作用机制——基于密度泛函理论与实验研究
王诗生1,2*,张梦梦1,盛广宏1,2,田勇攀3,刘轶鋆1,2,章慧娟1,2,刘永兴1
(1.安徽工业大学能源与环境学院,安徽 马鞍山 243002;2.安徽工业大学生物膜法水质净化及利用技术教育部工程研究中心,安徽 马鞍山 243032;3.安徽工业大学冶金工程学院,安徽 马鞍山 243032)
以磁性生物炭(Fe3O4@C-NH2)为吸附剂,甲基橙(MO)为目标污染物,考察了浓度、温度和pH对吸附性能的影响,通过光谱学与密度泛函理论研究MO的去除机制.结果表明,吸附反应符合准二级动力学及Freundlich模型,是自发吸热且熵增的过程.平衡吸附量随着pH(3~10)升高而降低.光谱学分析结果表明,吸附作用力包括氢键、π-π堆积、π-π电子供体-受体(EDA)和静电力.静电势分布与前线轨道理论分析可知,羧基结构与MO分子间的结合能(ads)与能隙(gap)分别为-139.08kJ/mol, 3.07eV,吸附能力高于羟基结构(ads= -94.47kJ/mol,gap= 3.16eV)、氨基结构(ads= -76.10kJ/mol,gap= 3.17eV)和芳香环结构(ads=-41.99kJ/mol,gap= 3.18eV).基于赫什菲尔德划分的独立梯度模型-AIM拓扑分析图( IGMH-AIM)结果表明,吸附过程存在疏水作用,且氢键和π-π EDA为主要作用力.
密度泛函理论;磁性生物炭;吸附机理;甲基橙
有机染料的分子结构复杂,难生物降解,具有“三致”效应,未经处理或处理不达标排放会对生态环境和人体健康造成严重威胁[1].常用处理方法包括膜分离、吸附、离子交换、高级氧化和生物降解等[2].其中,吸附法由于操作简单、低能耗和无有害副产物等优势,被广泛用于废水处理[1,3-4].
生物炭具有来源广、易获取和价格低等优势,常用于去除废水中有机染料[3,5-6].目前,研究人员多采用吸附模型与光谱学分析相结合的方法研究吸附剂性能与相互作用机制[4,7-8].如通过准一级、准二级动力学模型计算吸附速率常数;利用Langmuir、Freundlich模型拟合结果,计算最大吸附容量;结合傅里叶红外光谱(FTIR)和X射线光电子能谱(XPS)推测吸附过程中活性位点与污染物间的成键方式.然而,上述分析手段难以从原子角度揭示吸附剂与污染物之间的作用机制.
近年来,密度泛函理论(Density Functional Theory, DFT)已经成为研究分子结构与性质的重要工具[9].通过静电势、前线轨道理论和Fukui函数等分析得到能量分布、电子密度和化学键能等参数,从原子水平上阐明吸附作用机制[9-10].如Achour等[11]利用DFT研究了刚果红染料在生物炭表面的吸附机理,计算染料的最高占据轨道(HOMO)、最低未占据轨道(LUMO)和分子静电势.结果表明活性位点集中在含氮(—NH2、—N=N—)和磺酸(—SO3)基团附近.Li等[12]通过DFT探讨了氨苄西林与改性蒙脱石表面间的静电吸附作用,基于原子电荷绘制两者的分子表面静电势图.研究发现各活性位点对静电作用贡献顺序依次为羰基氧(—C=O)>氨基氮(—NH2)>氮杂环氧(O)>羧基氧(—C=OOH).Zhang等[13]利用DFT模拟了环丙沙星与蒙脱石间的相互作用,通过独立梯度模型(IGM)方法计算出各活性位点之间的作用类型和强度,分析可知氢键和络合为主要作用机制.
生物炭吸附后难以回收制约了其广泛应用.本课题组前期通过一步水热碳化法合成磁性生物炭(Fe3O4@C-NH2),具有较强的顺磁性,在外加磁场条件下可快速磁分离,解决生物炭使用后难回收的问题[14].研究指出[30],吸附剂表面活性位点在污染物的去除过程中起重要作用,Fe3O4@C-NH2表面富含氨基基团(—NH2)、含氧基团(—OH、—COOH)和芳香环等,理论上分析可与有机染料分子相结合.然而,以Fe3O4@C-NH2为吸附剂实现对水中有机染料的研究有限,尤其从原子角度揭示其对甲基橙(Methyl Orange, MO)的去除机制未见报道.
鉴于此,以Fe3O4@C-NH2为吸附剂,MO为目标污染物,通过吸附动力学与热力学实验,评价Fe3O4@C-NH2的吸附性能;利用FTIR和XPS光谱学测试手段,结合DFT理论计算结果,揭示Fe3O4@C-NH2吸附MO的作用机制,阐明各活性基团的活性程度.以期为磁性生物炭吸附有机染料废水提供参考.
1 材料与方法
1.1 材料与仪器
主要化学试剂:甲基橙购自天津市北辰方正试剂厂;壳聚糖、六水合三氯化铁、乙二醇、无水乙醇、氢氧化钠、硝酸和甲醇均购自国药集团化学试剂公司.实验所用的化学试剂均为分析纯.
吸附剂(Fe3O4@C-NH2]:采用一步水热碳化法制备,具体制备步骤见参考文献[14].其基本理化性质如下:呈微球状,表面凹凸不平;具有超顺磁性,饱和磁化强度12.7emu/g;比表面积12.8m2/g,以中孔为主,平均孔径46.9nm,孔体积0.16m3/g;pHzpc为4.9[14]. Fe3O4@C-NH2是以Fe3O4为内核、炭层为外壳的核壳结构[15].
1.2 试验方法
取(30 ± 0.5)mgFe3O4@C-NH2加入100mL一定浓度的MO溶液中,置于恒温水浴振荡器内振荡(298K, 150r/min).在设定时间点(0、5、10、15、30、45、60、75和90min)取样,磁分离后采用分光光度法测定上清液中剩余MO的浓度.文中数据均为3次平行样的平均值.吸附量通过式(1)计算:

式中:t为时刻对应MO的吸附量,mg/g;0为MO的初始浓度,mg/L;t为时刻MO的剩余浓度, mg/L;为MO的体积,L;为Fe3O4@C-NH2的质量,g.
1.3 光谱学分析
利用傅里叶红外变换光谱仪(FTIR, Nicolet 6700型,美国)对比分析反应前后Fe3O4@C-NH2表面官能团变化;采用 X-射线光电子能谱仪(XPS, Thermo Scientific K-Alpha型,英国)测定吸附前后Fe3O4@C-NH2表面元素组成及化学态变化.
1.4 DFT计算
使用 Gaussian 09W软件中的DFT模拟计算方法,对分子进行几何优化和频率计算.选用B3LYP 杂化密度泛函方法,采用 6-31+G(d)基组进行结构优化与能量计算.通过吸附能与前线轨道理论,计算各活性基团与MO分子间的反应活性,用Multiwfn[15]波函数程序对基于赫什菲尔德划分的独立梯度模型(IGMH)进行了拓扑分析[16].吸附能(ads)与能隙(gap)的计算方法如式(2)和(3)所示:
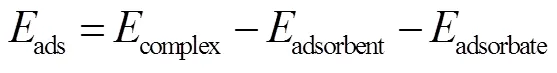
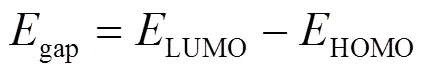
式中:ads为分子间的吸附能,kJ/mol;comple为吸附剂与吸附剂所形成复合物的总能量,kJ/mol;adsorbent为吸附剂能量,kJ/mol;adsorbate为吸附质的能量,kJ/mol;gap为能隙,eV;HOMO为HOMO轨道能量,eV;LUMO为LUMO轨道能量,eV.
2 结果与讨论
2.1 吸附动力学
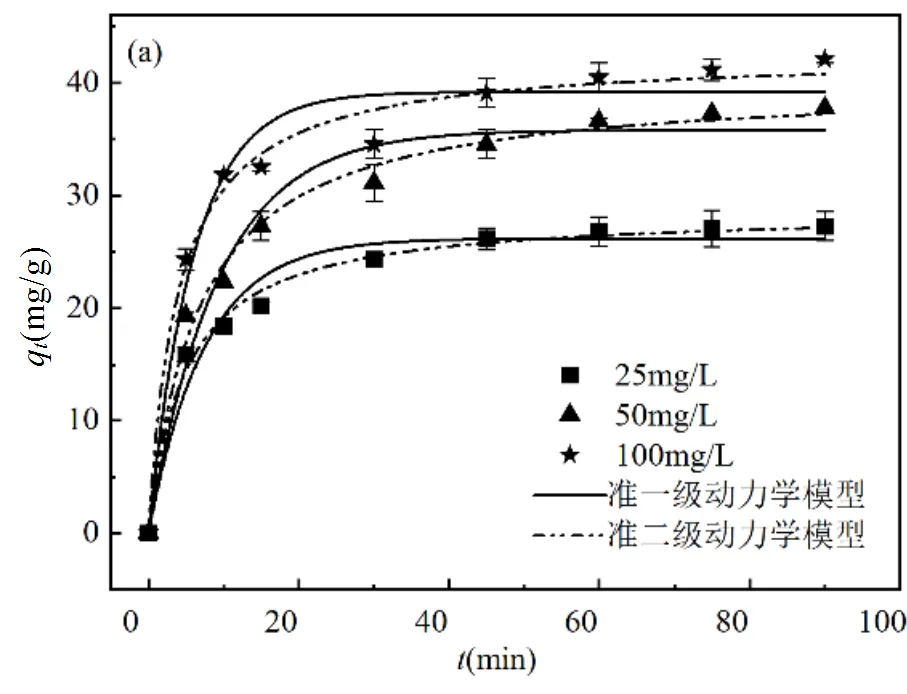
配制浓度为25、50、100mg/L的MO溶液,加入(30 ± 0.5)mg 吸附剂,恒温振荡(298K, 150r/min),在设定时间取样(0、5、10、15、30、45、60、75和90min).采用准一级和准二级动力学模型拟合实验数据,相关公式如(4)和(5),结果见表1与图1(a).
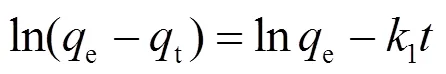

式中:e为吸附达到平衡时的吸附量,mg/g;1为准一级速率常数;为吸附时间,min;2为准二级速率常数.
由表1可知,准二级动力学模型拟合出的相关系数2高于准一级动力学模型,表明化学吸附为主要限速步骤,吸附剂与污染物之间可能有电子转移和共价键形成.由图1(a)可知,吸附量在前30min内显著增加,随后增速缓慢,60min左右时达到吸附平衡.平衡吸附量随MO初始浓度的增加而增大,这是由于固-液界面浓度差增加导致传质驱动力增强.
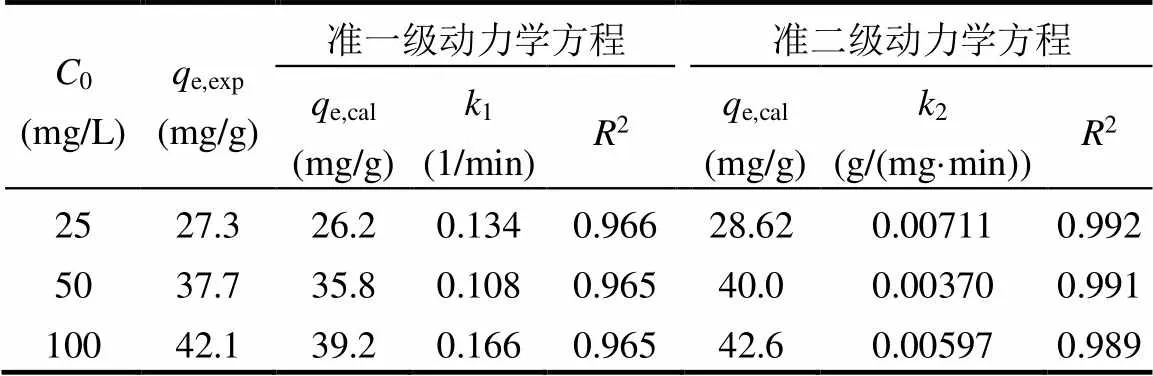
表1 MO的准一级、准二级动力学模型参数
注:e,exp为实验值;e,cal为理论值.
2.2 吸附热力学
称取吸附剂(30 ± 0.5)mg,分别加入浓度为10、25、50、75、100和150mg/L的MO溶液,于不同温度(288、298 、308和318K)下振荡(150r/min)至吸附平衡状态.采用Langmuir和Freundlich模型拟合吸附等温线,模型公式见(6)和(7),拟合结果见图1(b),拟合参数见表2.
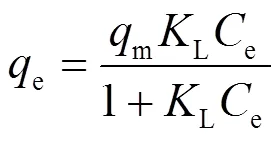

式中:m为最大吸附量,mg/g;e为平衡浓度,mg/L;L为Langmuir常数;F为Freundlich常数;为吸附特征常数.
由图1(b)可知,平衡吸附量随着温度升高而增加.由表2可知,Freundlich模型的相关系数2(0.85~ 0.98)更高,可以更好地描述吸附平衡规律.1/的值(0.203~0.213)小于1,表明吸附易于发生[4].288、298、308和318K下最大吸附量分别为37.1、43.2、54.2和58.4mg/g.
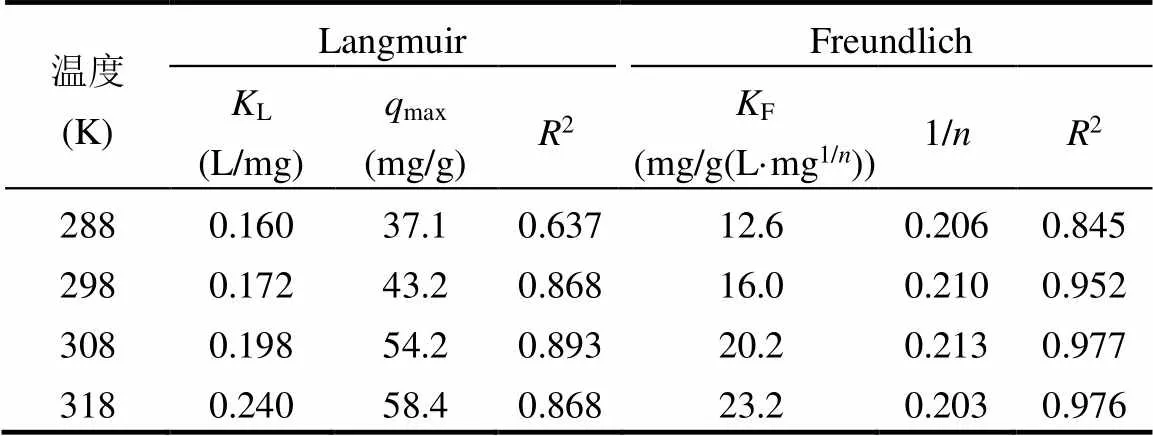
表2 MO的吸附等温模型参数
通过计算热力学参数,分析吸附反应的自发性以及判断吸附过程是否为吸热反应.热力学参数可由式(8)~(10)计算:
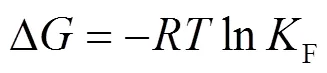
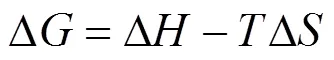
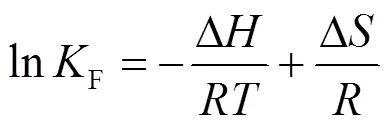
式中:∆为吉布斯自由能变,kJ/mol;∆为焓变,kJ/ mol;∆为熵变,kJ/(mol·K);为理想气体摩尔常数,8.314J/(mol·K);为反应温度,K.由式(6)做lnF和1/关系图,拟合结果用于计算∆、∆和∆,见表3.

表3 MO的吸附热力学参数
由表3可知,四种温度下∆均为负,表明该吸附是自发的;随着温度升高∆减小,说明升高温度利于吸附;∆值为正,说明此吸附反应为吸热反应;∆>0,表明体系混乱度增加,主要原因是MO的体积大于水分子,吸附一个MO分子的同时,吸附剂表面会释放出多个水分子[17].
2.3 pH值影响
pH值变化会改变吸附剂表面电荷以及吸附剂在水中化学形态,影响吸附剂与染料分子间的作用力,因此有必要研究pH值对吸附的影响.将30mg 吸附剂加入100mL浓度为50mg/L的MO溶液中,利用NaOH和HNO3调节溶液初始pH(3.0、4.0、5.0、5.9、7.0、8.0、9.0和10.0),恒温振荡(298K,150r/min)至吸附平衡.结果如图2所示

图2 pH 值对MO吸附量的影响
Fe3O4@C-NH2的pHzpc为4.9,溶液pH<4.9时,其表面带正电荷,反之带负电荷[14].MO的pKa为3.46,当溶液pH<3.46时,MO分子在溶液中以电偶极子存在(正、负电荷基团分别为—N(CH3)2+和—SO3-);pH>3.46时,其主要以一价阴离子形式存在[18].
pH值在3.0~4.9时,MO的吸附效果较好,主要原因是吸附剂表面含氧官能团与含氮官能团质子化带正电,与MO分子间存在较强的静电吸引[7].pH值在4.9~10.0时,Fe3O4@C-NH2表面带负电荷,与MO分子中—SO3-之间产生静电斥力,且随着pH升高,碱性溶液中的OH-浓度增大,与MO分子竞争吸附剂表面的反应位点导致吸附能力下降[4,18].
pH<4时,MO分子在溶液中以电偶极子存在,MO分子(—NH、—S=O)与Fe3O4@C-NH2(—OH、—COOH)形成氢键[19].pH>4时,MO以一价阴离子形态存在,可发生氢键作用的基团为—S=O,氢键作用减弱,吸附量下降[20].
此外,MO与Fe3O4@C-NH2芳香结构之间存在EDA相互作用.反应过程中MO分子的—N=N—、—N(CH3)2均可作为强供电子基团,—SO3是吸电子基团,考虑到三个基团共存,MO在吸附过程中作为电子供体,Fe3O4@C-NH2作为电子受体[21].pH>4.9时,随着溶液pH值的增加,Fe3O4@C-NH2表面—COOH、—OH和—NH2脱质子化,芳香体系中的电子密度逐渐增加,从而逐渐减弱Fe3O4@C-NH2与MO之间的EDA相互作用[22].
2.4 吸附机理
2.4.1 光谱学分析 MO和吸附前后Fe3O4@C- NH2的FTIR谱图如图3所示.
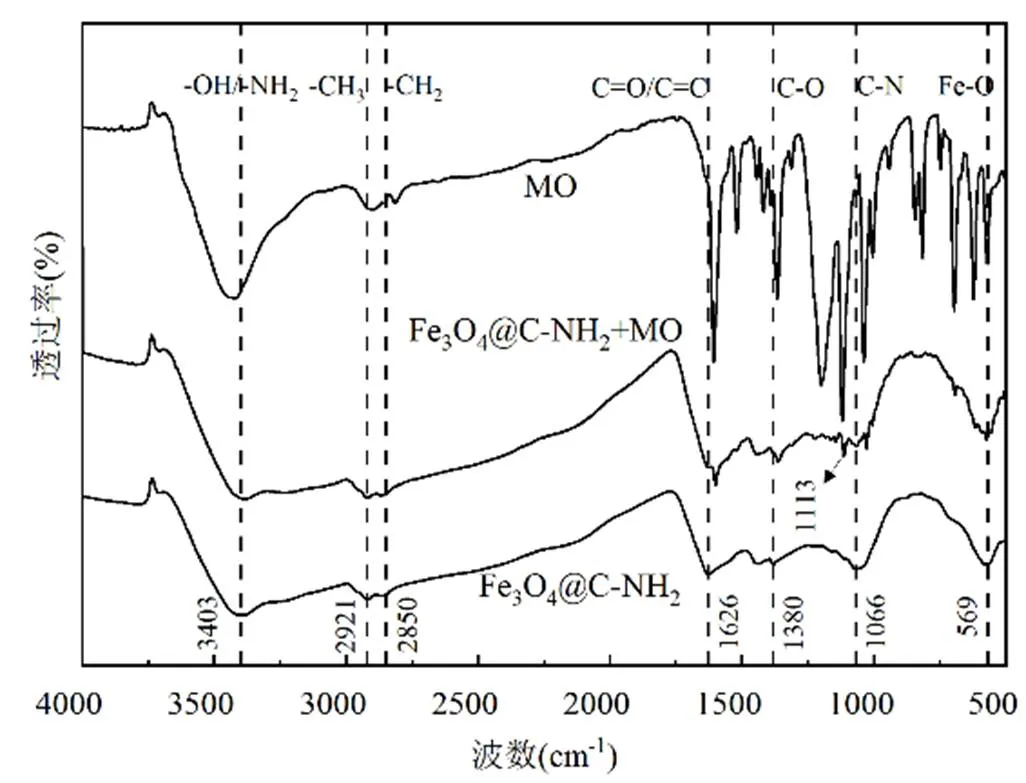
图3 红外光谱图
由图3可知,3403cm-1处的峰由—OH和—NH2伸缩振动产生;2921cm-1处对应—CH3中C-H的吸收振动峰;2850cm-1处所对应吸收峰为—CH2;1626cm-1处为C=O和芳香环(C=C)振动引起;1380cm-1处的吸收峰对应—COOH中C-O振动;1066cm-1处的吸收峰为C-N的伸缩振动;569cm-1处的吸收峰由Fe-O弯曲振动[14,23-24].
吸附MO后,在1113cm-1处出现新的吸收峰,对应MO的磺酸基团.—OH/—NH2吸收峰由3403cm-1红移至3389cm-1,且峰强降低,这是由于—OH或—NH2与MO形成氢键[1,6].C=O/C=C所在吸收峰由1626cm-1红移至1600cm-1处,且强度增强.分析原因为两点,一是Fe3O4@C-NH2与MO分子的芳香结构之间π-π堆积会引起C=C的红移,二是C=O和C=C均可作为π-电子供体与MO分子中的S=O/N=N发生π-π电子供体-受体(electron donor-acceptor, EDA)作用,导致峰强变化[7,24].1380cm-1处C-O吸收峰红移至1363cm-1,主要原因是C-O中O原子与 MO分子的N/O之间形成π-π EDA作用力;此外C-O也可与MO分子上的N/O形成氢键[24].
Fe3O4@C-NH2吸附MO前后XPS图谱如图4所示.由图4(a)可知,Fe3O4@C-NH2由C、O、N和Fe元素构成.吸附后168.06eV处出现新的吸收峰,对应MO分子中S 2p所在值,表明MO被成功吸附在Fe3O4@C-NH2表面.
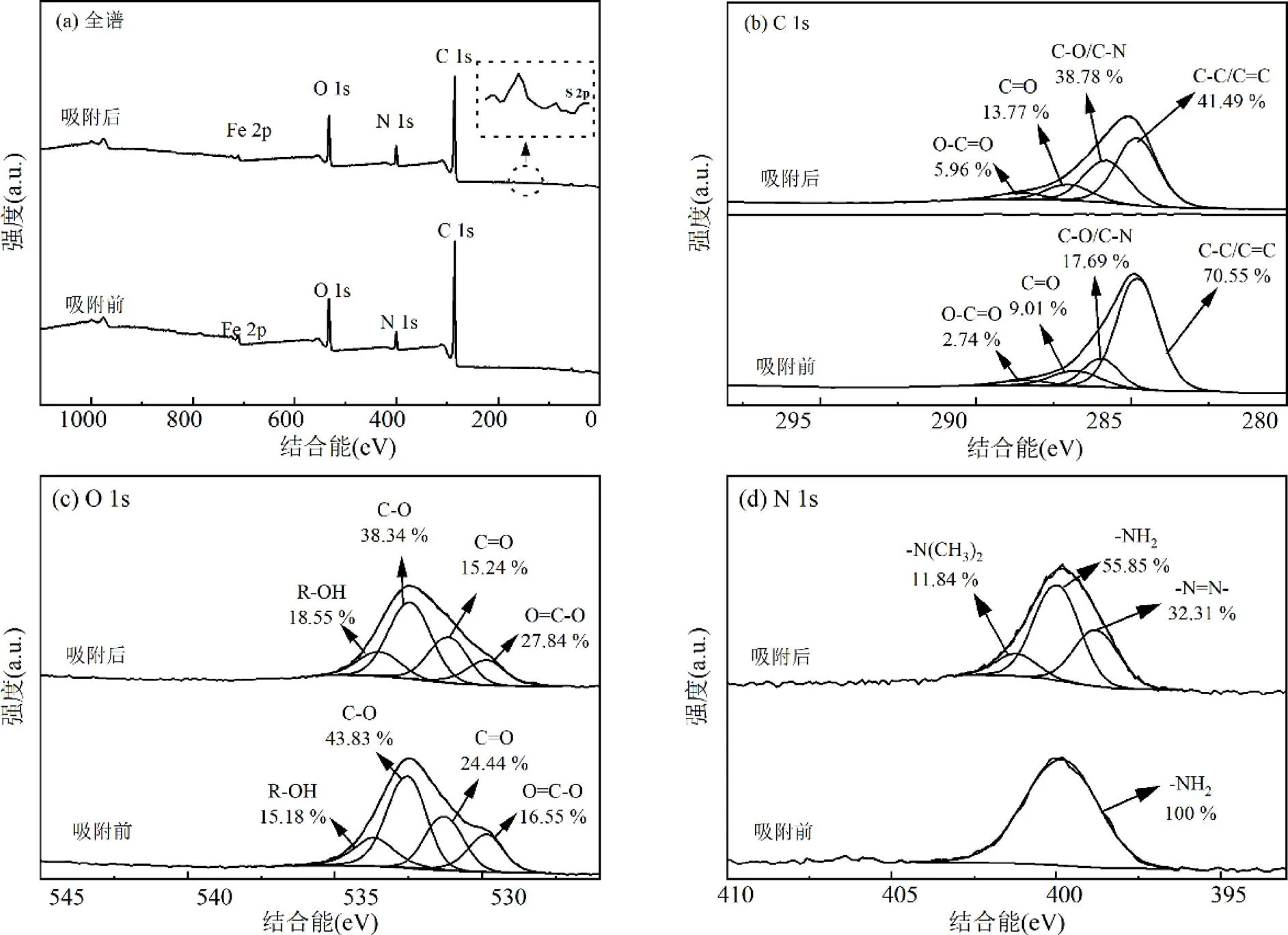
图4 Fe3O4@C-NH2及吸附MO后Fe3O4@C-NH2的XPS图
图4(b)为吸附前后C 1s高分辨谱图.吸附前,C 1s分为4个峰,结合能在284.80、286.00、287.08和288.63eV的峰值分别对应芳香碳骨架(C=C/C-C)、C-N/C-O、C=O/C-O-C和O=C-O中的碳[4,6].吸附后,C=C/C-C相对含量由70.55 %减少至41.49 %.这是由于吸附剂中C=C与MO分子中芳香环之间存在π-π堆积作用[6,8].
O 1s高分辨谱图如图4(c)所示.吸附前,O 1s可分为4个峰,结合能529.79eV对应O=C-O中的氧,531.22eV的结合能对应C=O中的O原子,532.48和533.63eV处的结合能分别对应C-O和R-OH中的O原子[5,25].吸附后,529.79eV处的O=C-O含量下降,是由于Fe3O4@C-NH2表面羧基与MO分子中N或O原子之间形成氢键[3,6].C=O中O原子的结合能由531.22eV下降至531.12eV,相对含量略有升高,主要原因是Fe3O4@C-NH2的O原子在吸附过程中作为电子供体,与MO之间发生π-π EDA作用[25].C-O和R-OH中O原子分别与MO分子中N原子形成氢键,导致其结合能分别减小至532.44eV和533.48eV[6,8]
吸附前后N1s的高分辨谱图见图4(d).吸附前,N 1s谱仅为一个峰, 399.8eV的—NH2.吸附后,出现新的吸收峰398.8eV和401.2eV,分别对应MO分子的—N=N—和—N(CH3)2,表明MO分子被吸附[13].—NH2的结合能降低为399.11eV,原因是N-H作为电子供体/受体参与MO间形成氢键[22].
2.4.2 DFT分析 为了解Fe3O4@C-NH2与MO间相互作用位点,绘制了静电势分布(Electrostatic potential, ESP),见图5.图中,蓝色表示低电子密度代表亲电位点,红色表示高电子密度代表亲核位点,ESP极大值和极小值分别为青色和橙色表示.

图5 静电势分布图与前线轨道等值面图
C-青色;H-白色;O-红色;N-蓝色;S-黄色;Na-紫色
如图5(a)所示,Fe3O4@C-NH2表面存在光滑的离域电子密度,其ESP范围为-35.2~55.4kcal/mol,负静电势集中在—COOH(C=O)附近,表示C=O中氧原子是亲电攻击可能位点;而正静电势则集中在—OH和—NH2上.由图5(b)可知,MO的ESP范围分别为-51.8~128.6kcal/mol,正静电势与负静电势均集中于磺酸基(—SO3)附近.图5(c)为Fe3O4@C-NH2与MO的复合结构,极大值点在Fe3O4@C-NH2的-NH2附近,表示其作为亲核位点提供电子;极小值点出现在MO分子的-SO3(O原子)附近,代表一个亲电位点接收电子[26].图5(d)和(e)为前线轨道理论等值面图,用于分析吸附MO后复合结构Fe3O4@C-NH2-MO表面HOMO和LUMO值.HOMO和LUMO分别表示分子的亲核反应位点与亲电反应位点[23].由图5(d)和(e)可知, Fe3O4@C-NH2-MO的HOMO主要集中在Fe3O4@C-NH2的—NH2、—OH和芳香环上;LUMO主要集中在MO分子的—SO3、—N=N—和芳香环部分.结果表明,—NH2、—OH和芳香环是Fe3O4@C-NH2的亲核位点,提供电子;MO分子中—SO3、—N=N—和芳香环是亲电位点,接收电子.
吸附能(ads)与能隙(gap)是评价吸附过程的重要参数,ads用于评判吸附剂对污染物的吸附能力,gap反映电子从被占轨道过渡到空轨道的能力,能隙越高意味着发生电子跃迁的可能性越低[10].为了进一步分析各活性基团在吸附过程中作用机制,构建了羧基炭结构(C-COOH)、羟基炭结构(C-OH)、氨基炭结构(C-NH2)和碳环结构(BC)模型,计算各结构与MO分子间吸附能与能隙,结果见图6与表4.
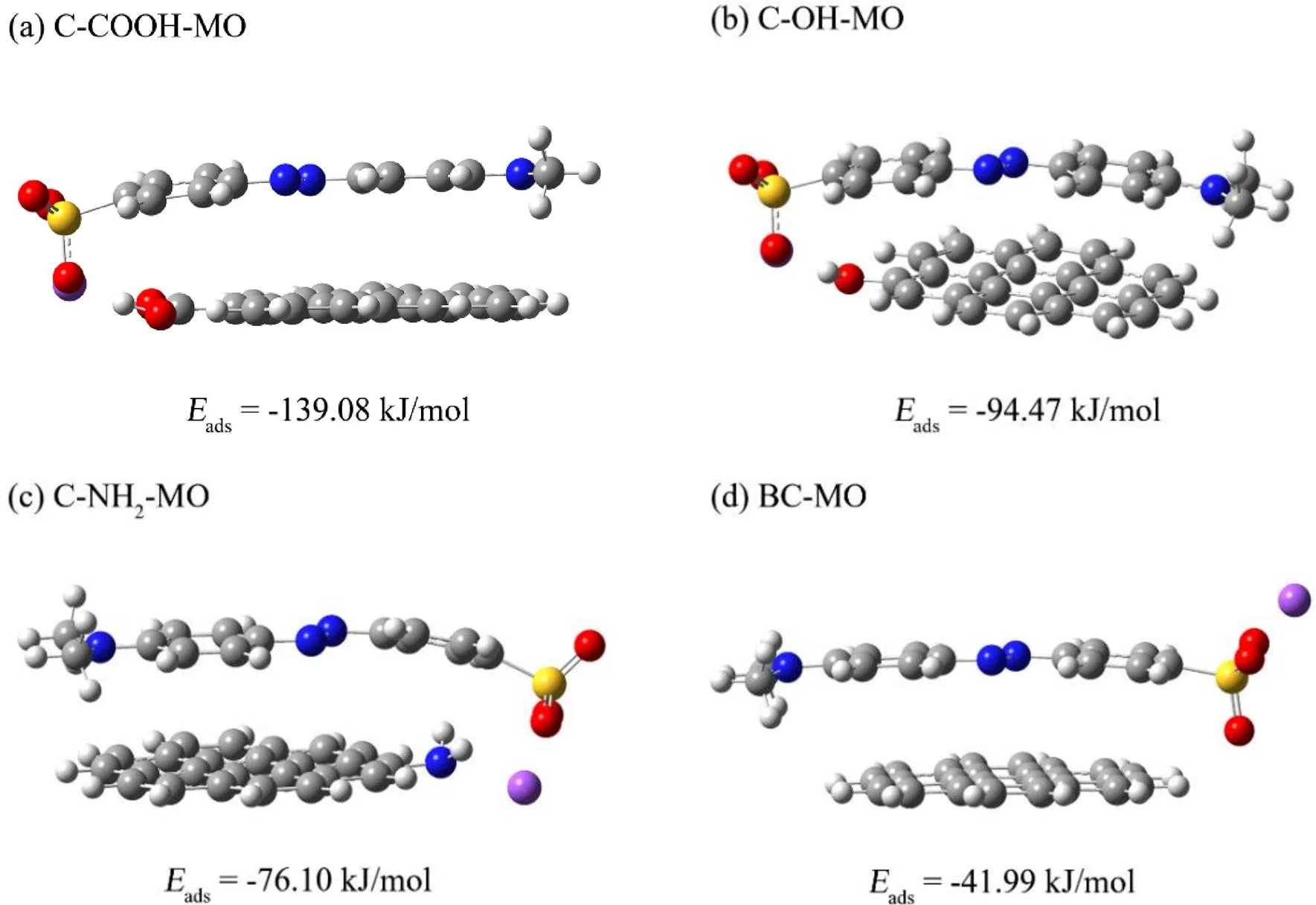
图6 MO与各活性位点形成的稳定构型与吸附能
图6显示优化后的几何形状,结合表4可知,C-COOH-MO、C-OH-MO、C-NH2-MO和BC- MO的ads分别为-139.08、-94.47、-76.10和-41.99kJ/mol,所得ads均为负值,证实MO与Fe3O4@C-NH2间吸附是自发的[27].其中,C-COOH与MO间的ads值绝对值最大,其次为C-OH、C-NH2和BC,主要原因为MO与Fe3O4@C-NH2分子(—COOH、—OH)之间形成氢键[28].
由表4可知C-COOH-MO、C-OH-MO、C-NH2-MO和BC-MO的gap分别为3.07、3.26、3.17和3.18eV. C-COOH与MO之间的gap最小,代表其反应活性更高[29].
通过独立梯度模型-AIM拓扑分析图(IGMH- AIM),可视化呈现原子间相互作用,如图7所示.AIM主要根据相应键临界点(BCPs)的性质定量研究相互作用,通过电子密度与能量密度定量解释形成化学键强度[29].BCPs处的>0表明两原子之间的相互作用应视为闭壳相互作用,图7可知与值均在-0.06~0.06a.u.范围内,表明各原子间成对相互作用的强度较弱[16].IGMH侧重于视觉揭示弱相互作用区域和作用类型.深蓝色区域表明具有很强的吸引力,一般是氢键和强卤键等;绿色区域吸引力较弱,如范德华和π-π相互作用;红色区域显示强互斥,一般是环或笼中的位阻效应[30].
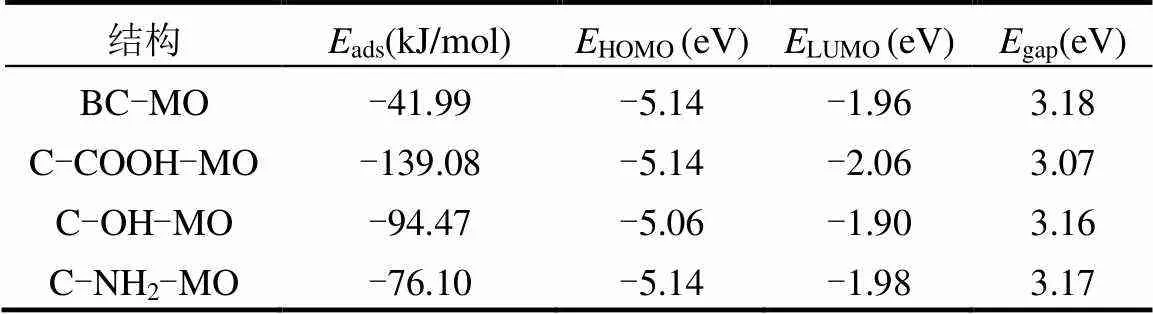
表4 Fe3O4@C-NH2表面各官能团与MO间的吸附参数
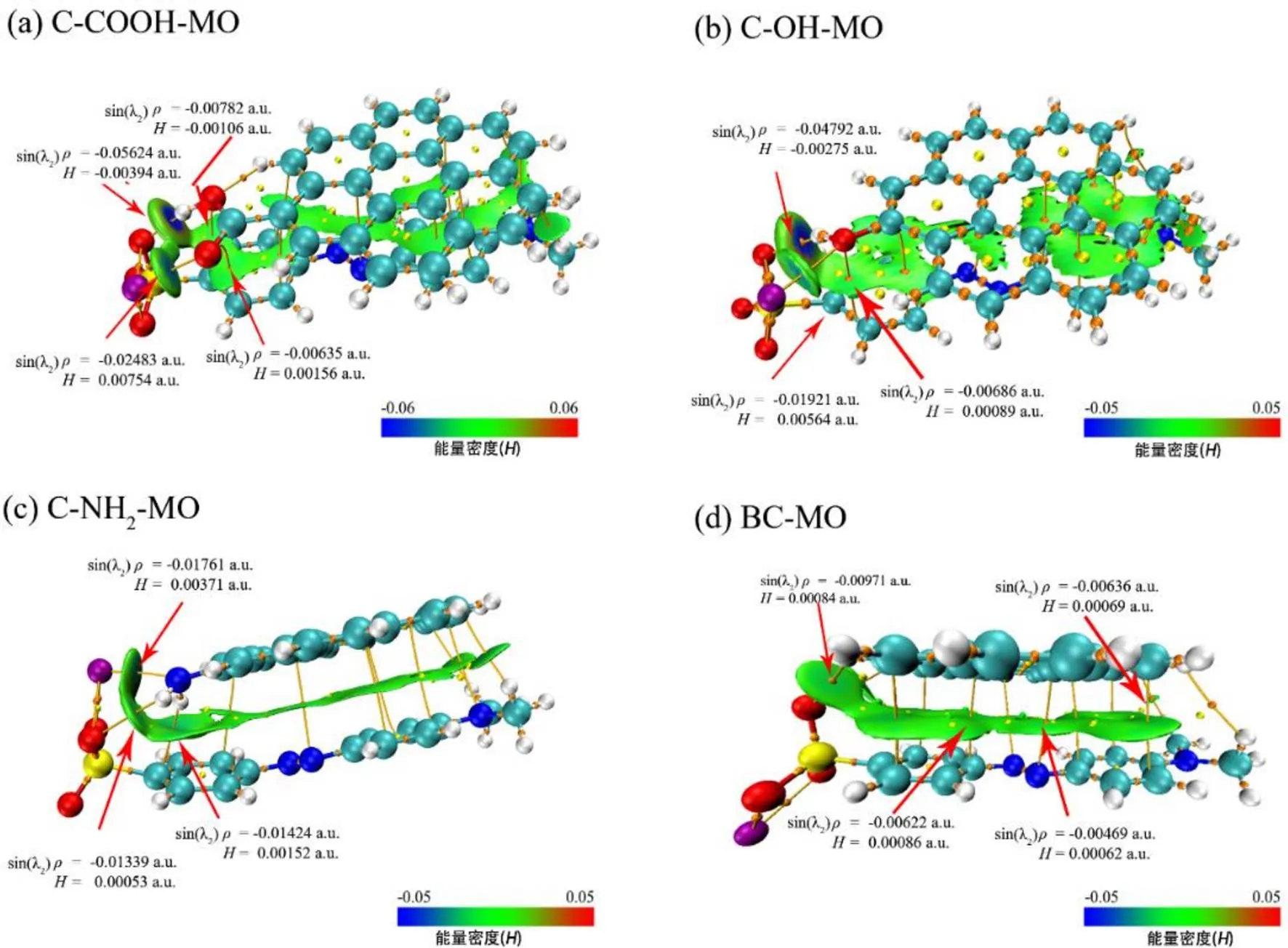
图7 AIM-IGMH图
由图7(a)为C-COOH与MO复合结构,羧基与磺酸基之间发生氢键作用(—COOH…O=S);羧基(C=O)与MO间存在静电力作用;芳香环和C=O作为电子供体,MO分子中的芳香环和—N=N—可提供π轨道,形成π-π EDA作用力;C-COOH与MO(芳香环)之间存在π-π堆积作用[26].C-OH与MO间作用力如图7(b)所示,羟基与磺酸基可发生氢键(—OH…O=S)和静电力作用;羟基氧与芳香环结构之间的作用力为π-π EDA;此外,C-O与MO分子之间还存在π-π堆积作用[31].图7(c)表示C-NH2与MO间的作用力,氨基与MO间的作用力还包括氢键(—NH—H…O=S)、静电力(氨基与磺酸基基团)、π-π EDA(氨基与MO的芳香结构和-N=N-的π体系)和π-π堆积(芳香环之间),Cheng等人指出,孤对电子可形成sp2共轭系统并与芳香环结构形成π-π分散作用力(疏水作用),以此推测图中氨基与MO分子(芳香环)之间形成的作用力为疏水作用[16,32].由图7(d)可知,BC的芳香环与MO分子磺酸氧、偶氮键生成了π-π EDA作用;与MO的芳香环之间存在π-π堆积作用.
综上所述,Fe3O4@C-NH2吸附MO的作用机制包括氢键、π-π 堆积、π-π EDA、静电力和疏水作用,且以氢键和π-π EDA作用为主导,作用机理如图8所示.
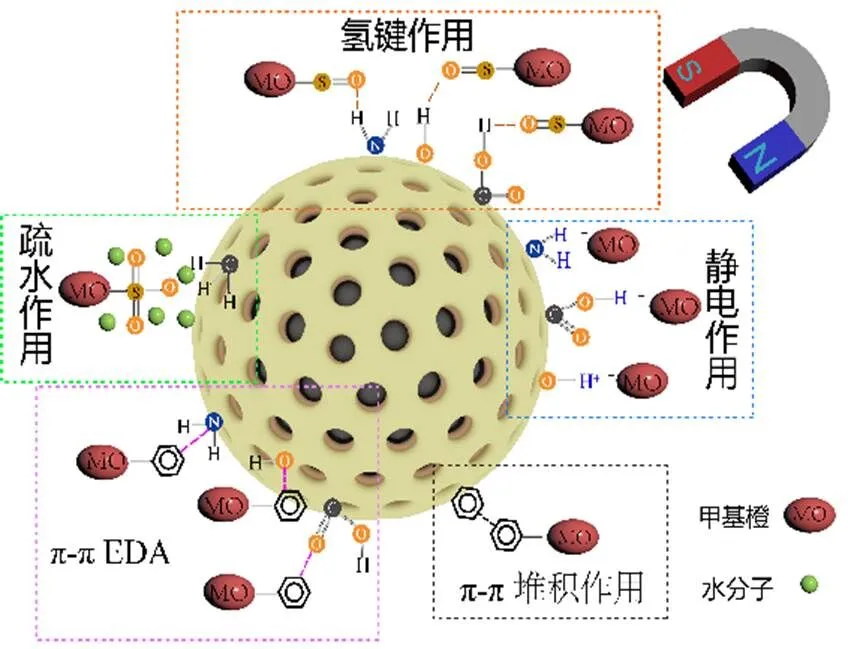
图8 Fe3O4@C-NH2吸附MO机理
2.5 重复利用率
吸附剂的可重复使用性作为评价吸附性能的重要标准之一.选用甲醇作为洗脱试剂.将吸附MO后的Fe3O4@C-NH2加入到20mL甲醇溶液中振荡(298K ,150r/min,1h),磁分离后倒去上清液,置于烘箱内烘干,再生的Fe3O4@C-NH2用于下一个循环实验,每个循环后测定其吸附量.
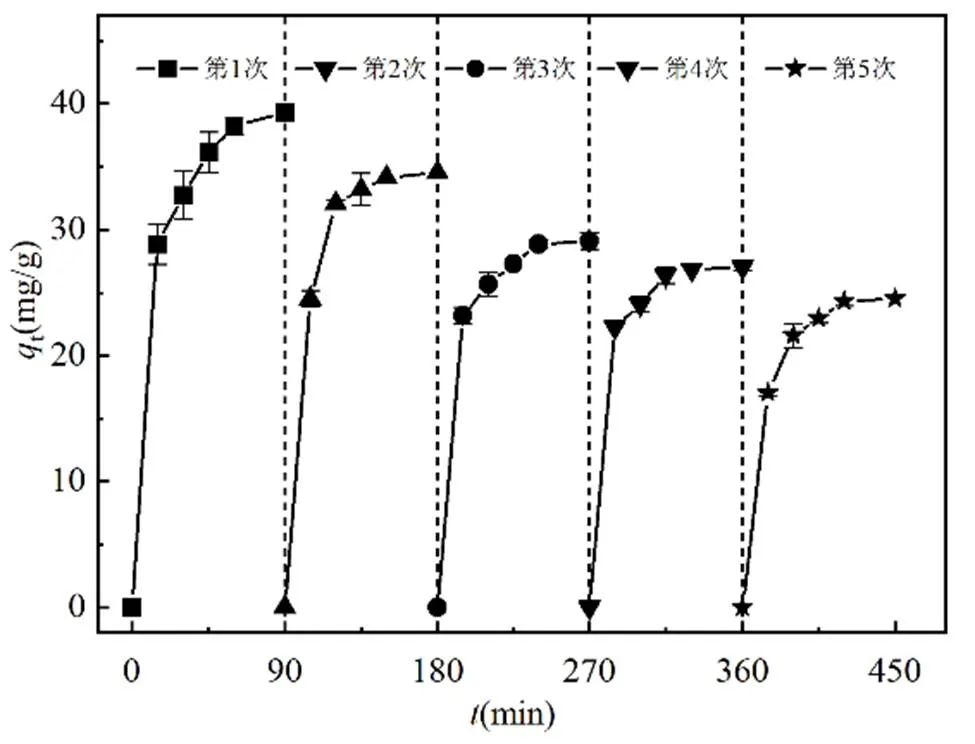
图9 Fe3O4@C-NH2循环吸附 MO 的性能
如图9所示,Fe3O4@C-NH2经过4次循环使用之后, 吸附量依次下降了13.5 %、27.1%、32.2%和38.5%.随着循环次数增加,Fe3O4@C-NH2对MO吸附性能下降归因于吸附剂表面存在残留的MO分子,阻止了新的MO分子与吸附剂的结合[32].此外,由于Fe3O4@C-NH2微观结构和官能团被破坏或被占据,也可能导致吸附量下降[33].
3 结论
3.1 Fe3O4@C-NH2对MO的去除过程符合准二级动力学模型,Freundlich等温模型可以更好地拟合其等温吸附平衡规律,最大吸附量为43.2mg/g.热力学结果显示Fe3O4@C-NH2对MO的吸附是一个自发吸热且熵增的过程.
3.2 在研究的pH范围内,MO的平衡吸附量随pH值的升高而下降,pH 3时最大,即酸性条件利于MO的吸附.
3.3 通过FTIR和XPS分析可知,Fe3O4@C-NH2对MO的去除机制包括氢键、π-π堆积、π-π EDA和静电力作用.由DFT结果进一步分析可知,吸附过程中还存在疏水作用力.吸附能与能隙计算结果表明,含羧基的炭结构对MO的吸附能力最强,其次为羟基、氨基和芳香环结构.结合IGMH-AIM分析可知,主要的作用力为氢键与π-π EDA.
[1] 苏 龙,张海波,程红艳,等.木耳菌糠生物炭对阳离子染料的吸附性能研究[J]. 中国环境科学, 2021,41(2):693-703.Su L, Zhang H B, Cheng H Y, et al. Study on adsorption properties of biochar derived from spent Auricularia auricula substrate for cationic dyes [J]. China Environmental Science, 2021,41(2):693-703.
[2] Zhou Y B, Lu J, Zhou Y, et al. Recent advances for dyes removal using novel adsorbents: A review [J]. Environmental Pollution, 2019,252:352-365.
[3] Zhao Y J, Zhu L, Li W H, et al. Insights into enhanced adsorptive removal of Rhodamine B by different chemically modified garlic peels: Comparison, kinetics, isotherms, thermodynamics and mechanism [J]. Journal of Molecular Liquids, 2019,293:111516.
[4] Chen B, Long F X, Chen S J, et al. Magnetic chitosan biopolymer as a versatile adsorbent for simultaneous and synergistic removal of different sorts of dyestuffs from simulated wastewater [J]. Chemical Engineering Journal, 2020,385:123926.
[5] Zhang H, Li R H, Zhang Z Q. A versatile EDTA and chitosan bi-functionalized magnetic bamboo biochar for simultaneous removal of methyl orange and heavy metals from complex wastewater [J]. Environmental Pollution, 2022,293:118517.
[6] Gurav R, Bhatia S K, Choi T R, et al. Adsorptive removal of synthetic plastic components bisphenol-A and solvent black-3dye from single and binary solutions using pristine pinecone biochar [J]. Chemosphere, 2022,296:134034.
[7] Chen X Y, Li H P, Liu W Y, et al. Effective removal of methyl orange and rhodamine B from aqueous solution using furfural industrial processing waste: furfural residue as an eco-friendly biosorbent [J]. Colloids and Surfaces A,2019,583:123976.
[8] Saini K, Sahoo A, Biswas B, et al. Preparation and characterization of lignin-derived hard templated carbon(s): Statistical optimization and methyl orange adsorption isotherm studies [J]. Bioresource Technology, 2021,342:125924.
[9] Zhao H X, Yang Y, Shu X, et al. Adsorption of organic molecules on mineral surfaces studied by first-principle calculations: A review [J]. Advances in Colloid and Interface Science, 2018,256:230-241.
[10] Yin Q Q, Si L H, Wang R K, et al. DFT study on the effect of functional groups of carbonaceous surface on ammonium adsorption from water [J]. Chemosphere, 2022,287:132294.
[11] Achour Y, Bahsis L, Ablouh E-H, et al. Insight into adsorption mechanism of Congo red dye onto Bombax Buonopozense bark Activated-carbon using Central composite design and DFT studies [J]. Surfaces and Interfaces, 2021,23:100977.
[12] Li Y, Shi M X, Xia M Z, et al. The enhanced adsorption of Ampicillin and Amoxicillin on modified montmorillonite with dodecyl dimethyl benzyl ammonium chloride: Experimental study and density functional theory calculation [J]. Advanced Powder Technology, 2021,32:3465-3475.
[13] Zhang H L, Zhao F, Xia M Z, et al. Microscopic adsorption mechanism of montmorillonite for common ciprofloxacin emerging contaminant: Molecular dynamics simulation and Multiwfn wave function analysis [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2021,614:126186.
[14] 王诗生,赵大唯,章慧娟,等.磁性氮掺杂碳材料活化过硫酸盐降解酸性橙7 [J]. 环境科学学报, 2022,42(4):1-10. Wang S S, Zhao D W, Zhang H J, et al. Magnetic N-doped carbonaceous materials activated persulfate for degradation of Acid Orange 7 [J]. Acta Scientiae Circumstantiae, 2022,42(4):1-10.
[15] 王诗生,刘玉虎,盛广宏,等.磁性氨基功能化生物炭对水中Cr(Ⅵ)的吸附去除特性及机制 [J]. 环境科学学报, 2023,43(4):289-297. Wang S S, Liu Y H, Sheng G H, et al.Adsorption performance and mechanism of Cr(Ⅵ) from aqueous solution by magnetic amino-functionalized biochar [J]. Acta Scientiae Circumstantiae, 2023, 43(3):289-297.
[16] Lu T, Chen F. Multiwfn: a multifunctional wavefunction analyzer [J]. Computational Chemistry, 2012,33(5):580-92.
[17] Lu T, Chen Q X. Independent gradient model based on Hirshfeld partition: A new method for visual study of interactions in chemical systems [J]. Computational Chemistry, 2022,43:539-555.
[18] 余 剑,丁 恒,张智霖,等.改性菱角壳生物炭吸附水中土霉素性能与机理[J]. 中国环境科学, 2021,41(12):5688-5700. Yu J, Ding H, Zhang Z L, et al. Sorption characteristics and mechanism of oxytetracycline in water by modified biochar derived from chestnut shell [J]. China Environmental Science, 2021,41(12): 5688-5700.
[19] Subbaiah M V, Kim D S. Adsorption of methyl orange from aqueous solution by aminated pumpkin seed powder: Kinetics, isotherms, and thermodynamic studies [J]. Ecotoxicology and Environmental Safety, 2016,128:109-117.
[20] Jiang T, Liang Y D, He Y J, et al. Activated carbon NiFe2O4magnetic composite a magnetic adsorbent for the adsorptionof methyl orange [J]. Journal of Environmental Chemical Engineering, 2015,3:1740- 1751.
[21] Bhowmik K L, Debnath A, Nath R K, et al. Synthesis and characterization of mixed phase manganese ferrite and hausmannite magnetic nanoparticle as potential adsorbent for methyl orange from aqueous media: Artificial neural network modeling [J]. Journal of Molecular Liquids, 2016,219:1010-1022.
[22] Shi Y W, Song G B, Li A Q, et al. Graphene oxide-chitosan composite aerogel for adsorption of methyl orange and methylene blue: Effect of pH in single and binary systems [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022,641:129595.
[23] Morais da Silva P M, Camparotto N G, Figueiredo Neves T D, et al. Effective removal of basic dye onto sustainable chitosan beads Batch and fixed-bed column adsorption, beads stability and mechanism [J]. Sustainable Chemistry and Pharmacy, 2020,18:100348.
[24] Pan X M, Zhang M M, Liu H L, et al. Adsorption behavior and mechanism of acid orange 7and methylene blue on self-assembled three-dimensional MgAl layered double hydroxide: Experimental and DFT investigation [J]. Applied Surface Science, 2020,522:146370.
[25] Tang J Y, Ma Y F, Cui S, et al. Insights on ball milling enhanced iron magnesium layered double oxides bagasse biochar composite for ciprofloxacin adsorptive removal from water [J]. Bioresource Technology, 2022,359:127468.
[26] Wang Z R, Jang H M. Comparative study on characteristics and mechanism of levofloxacin adsorption on swine manure biochar [J]. Bioresource Technology, 2022,351:127025.
[27] Cheng L, Jia Y H, Liu X M, et al. Insights into interfacial interaction mechanism of dyes sorption on a novel hydrochar: Experimental and DFT study [J]. Chemical Engineering Science, 2021,233:116432.
[28] Feng Z Y, Chen N, Liu T, et al. KHCO3activated biochar supporting MgO for Pb (II) and Cd (II) adsorption from water: Experimental study and DFT calculation analysis [J]. Journal of Hazardous Materials, 2022,426:128059.
[29] Huang J, Cao S R, Liu Z H, et al. High-efficiency removal of methcathinone from water using a novel DES modified magnetic biochar nanocomposite [J]. Journal of Environmental Chemical Engineering, 2022,10(5):108456.
[30] Peng X, Chen L, Liu S J, et al. Insights into the interfacial interaction mechanisms of p-arsanilic acid adsorption on ionic liquid modified porous cellulose [J]. Journal of Environmental Chemical Engineering, 2021,9:105225.
[31] Sun Y, Gu Y P, Zhang H R, et al. Adsorption properties of macroporous exchangers functionalized with various weak-base groups for aromatic acids: Coupling DFT simulation with batch experiments [J]. Journal of Environmental Chemical Engineering, 2021,9:106026.
[32] Cheng Y Z, Wang B Y, Shen J M, et al. The enhanced adsorption of Ampicillin and Amoxicillin on modified montmorillonite with dodecyl dimethyl benzyl ammonium chloride: Experimental study and density functional theory calculation [J]. Advanced Powder Technology, 2022,432:128757.
[33] Abo El Naga A O, Shaban S A, El Kady F Y A. Metal organic framework-derived nitrogen-doped nanoporous carbon as an efficient adsorbent for methyl orange removal from aqueous solution [J]. Journal of the Taiwan Institute of Chemical Engineers, 2018,93:363-373.
[34] Hu Z T, Ding Y, Shao Y C, et al. Banana peel biochar with nanoflake- assembled structure for cross contamination treatment in water: Interaction behaviors between lead and tetracycline [J]. Chemical Engineering Journal, 2021,420:129807.
Adsorption mechanism of methyl orange by using the magnetic biochar—Based on density functional theory and batch adsorption experiment study.
WANG Shi-sheng1,2*, ZHANG Meng-meng1, SHENG Guang-hong1,2, TIAN Yong-pan3, LIU Yi-yun1,2, ZHANG Hui-juan1,2, LIU Yong-xin1
(1.School of Energy and Environment, Anhui University of Technology, Ma'anshan 243002, China;2.Engineering Research Center of Biofilm Water Purification and Utilization Technology of Ministry of Education, Anhui University of Technology, Ma'anshan 243032, China;3.School of Metallurgical Engineering, Anhui University of Technology, Ma’anshan 243032, China)., 2023,43(9):4596~4605
Magnetic biochar (Fe3O4@C-NH2) was used as the adsorbent for removal of Methyl Orange (MO) in this study. The effects of concentration, temperature and pH on the adsorption performance were investigated, and then the Spectroscopic analysis and density functional theory were used to reveal the adsorption mechanism. The results demonstrated that the adsorption kinetics followed the pseudo-second-order model and the Freundlich model, and the process owned the characteristics of spontaneity, endothermic and entropy increasing. The equilibrium adsorption capacity decreased with the increment of pH (3~10). Spectroscopic analysis showed that the adsorption forces contain the hydrogen bonding, π-π bond accumulation,π-π electron donor-acceptor (EDA) and electrostatic interaction. According to the analysis of electrostatic potential and frontier orbit, the binding energy and energy gap of carboxyl group wereads= -139.08kJ/mol,gap= 3.07eV respectively, which were higher than those of hydroxyl group (ads-94.47kJ/mol,gap= 3.16eV), amino group (ads= -76.10kJ/mol,gap= 3.17eV) and aromatic ring (ads= -41.99kJ/mol,gap= 3.18eV). It was found that the hydrophobic action existed in the adsorption process; besides, the hydrogen bond and π-π EDA were the main forces in the process based on the results integrating theindependent gradient model and Hirshfeld partition and Atoms in molecules (IGMH-AIM).
density functional theory;magnetic biochar;adsorption mechanism;methyl orange
X703
A
1000-6923(2023)09-4596-10
王诗生(1975-),男,安徽巢湖人,副教授,博士,主要从事环境功能材料的设计、制备和应用;污水处理与资源化.发表论文40余篇.ahutsswang@163.com.
王诗生,张梦梦,盛广宏,等.磁性生物炭吸附水中甲基橙的作用机制—基于密度泛函理论与实验研究 [J]. 中国环境科学, 2023,43(9):4596-4605.
Wang S S, Zhang M M, Sheng G H, et al. Adsorption mechanism of methyl orange by using the magnetic biochar —Based on density functional theory and batch adsorption experiment study [J]. China Environmental Science, 2023,43(9):4596-4605.
2023-02-11
生物膜法水质净化及利用技术教育部工程研究中心开放基金资助项目(BWPU2021KF07,BWPU2021ZY02);2022年安徽工业大学省级大学生创新创业训练项目(S202210360415)
* 责任作者, 副教授, ahutsswang@163.com
