电化学法处理养殖场臭气吸收剂及其循环利用的研究
2023-09-25黄俪欣曾祥健谭杰潘湛昌胡光辉许燕滨伍尚权
黄俪欣,曾祥健,谭杰,潘湛昌,胡光辉,许燕滨,伍尚权
(1.广东工业大学轻工化工学院,广东广州 510006; 2.广东工业大学环境科学与工程学院,广东广州 510006; 3.广东益康生环保科技有限公司,广东云浮 527400)
据2017年的《中国空气质量管理评估报告》统计数据显示,养殖场的含氨臭气排放量占我国农业氨排放量的70%以上,是导致我国氨的总排放量超过欧洲与美国排放量总和的主要原因。因此开展养殖场氨源绿色化处理的工作尤为重要,是促进我国农业气体污染防治的关键〔1-3〕。
目前,养殖场为了解决圈舍氨气排放的问题,一般会通过生物滴滤塔或生物滤池来吸收并降解氨气。微生物的培育要求很高,需要精准调节温度、pH、营养条件和溶解氧等条件〔4〕。有不少养殖场会把臭气通进吸收塔中接受稀酸的喷淋〔5〕,由于氨易溶于水并具有碱性,能根据式(1)与酸性吸收剂进行反应,故该方法对空气的净化效率也很高。为减少使用酸的安全隐患,目前有研究采用草酸作为吸收剂〔6〕。但是吸收法对试剂的需求量大,成本高昂。并且到目前为止,氨饱和的酸溶液尚未得到环保化的处理,只能当作废水。本研究拟解决氨的吸收剂无法循环利用问题,降低吸收法的成本。
最近几年,高级氧化技术中的电化学氧化法被广泛应用于含氨氮废水的处理中,该技术具有去除氨氮效果好、药剂使用量少等优点。氨氮的电化学氧化一般有两种途径:1)直接氧化。氨氮在阳极上直接被降解为氮气;2)间接氧化。氯离子在阳极上被氧化为活性氯,溶于水生成具有强氧化性的HClO,将溶液中的NH4+氧化为氮气、硝酸根或者亚硝酸根〔7-9〕。氨氮的间接氧化过程见式(2)~式(4)。
NH3被溶剂吸收后以NH4+的形式存在,经过电化学降解,脱去酸提供的H+,被氧化为高价态形式。电化学稳定性高的吸收剂能在该过程中再次夺回H+,恢复酸性。
故寻找能稳定存在于电化学反应的氨气吸收剂尤为关键。本研究利用线性扫描伏安法LSV图比较各种吸收剂的电化学稳定性能,结合电化学氧化法,分别以氨氮去除率衡量氨氮的去除效果,以出水pH衡量吸收剂恢复吸收容量的能力。根据酸碱度与体系氨氮关系拟合出线性方程,为监测反应进程和确定反应终点提供新途径。
近年来不少文献报道〔10-11〕碱性或中性条件有利于提高氨氮去除效果,但考虑到酸性条件下有利于含氨臭气的吸收,可以防止氨气溢出电解装置,活性氯在酸中是以氧化性更强的HClO形式存在,故本研究首次在氨氮去除反应中应用弱酸性条件。
1 材料和方法
1.1 实验材料和方法
电化学测试所用的仪器是CHI660A 型电化学工作站(美国CHI),测试工作在三电极体系中进行,工作电极是钛基氧化物涂层电极(RuO2、IrO2、TiO2/Ti),工作面积为1 cm2;以铂片为对电极,工作面积为4 cm2;参比电极为饱和甘汞电极(SCE),所有的电化学测试都在25 ℃的恒温下测定。不同吸收剂组成的电解液体系均含等量NaCl和氨氮,LSV的电位窗口为+0.6~+1.5 V,扫描速度为1 mV/s。
电解实验所用的电源由ZHDY智能恒电位仪控制,正极为钛基氧化物涂层电极(RuO2、IrO2、TiO2/Ti),负极为纯钛板,电解质体系采用NH3、NaCl和柠檬酸混合溶液,氨氮约为130 mg/L,pH约为6.46。其中,单因素分析中各因素的实验水平:NaCl分别为0.7、1.3、2.7、4.0、5.3、6.7 g/L;实验温度分别为15、20、25、30、40、50 ℃;电流密度分别为25、50、75、100、125 mA/cm2。电解过程中定时抽样并使用pH计测定体系酸碱度。
1.2 分析方法
电解液体系的氨氮采用纳氏试剂分光光度法(GB 7479—1987)在425 nm波长下测定,硝酸根与亚硝酸根浓度采用离子色谱测定。pH采用pHS-25C型酸度计测定。
电解过程氨氮去除率可通过式(5)计算:
式中:φ——氨氮去除率,%;
C0——氨氮初始质量浓度,mg/L;
Ct——氨氮在t时刻的质量浓度,mg/L。
2 结果与讨论
2.1 不同吸收剂的电化学稳定性
不同吸收剂体系中的准稳态极化曲线见图1。
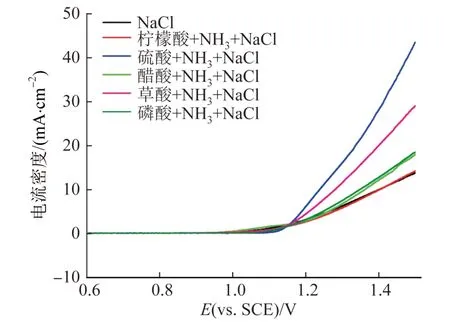
图1 不同的吸收剂体系中的准稳态极化曲线Fig. 1 LSV polarization curve under different absorbent type
由图1可知,氯化钠溶液体系,当电位正移到1.05 V时,电流密度迅速提高,电极表面有大量气泡析出,打开电解池盖能闻到刺鼻性氯气味道。由于钌钛电极的析氧电位远远大于氯气析出电位〔12〕,故认为电位在1.05 V时,阳极表面发生析氯反应。柠檬酸、硫酸、醋酸、草酸和磷酸的体系均添加了等量NH3和NaCl。对以上曲线进行处理,发现只有柠檬酸体系是在电位正移到1.05 V位置发生析氯,其余酸的存在都影响了析氯电位,甚至可能发生吸收剂分解。例如醋酸体系,当电位正移到0.94 V时,电流密度迅速提高,并在电位为1.05 V时曲线出现转折,分析原因为醋酸先于氯气析出而分解。磷酸、草酸、硫酸体系出现电流密度提高的电位分别为1.12、1.14、1.15 V,与氯化钠体系相比,这3种酸存在抑制氯气析出的可能性。
对比之下,柠檬酸不存在参与电化学氧化反应以及抑制析氯反应发生的行为。这也同时表明柠檬酸的电化学稳定性较高,具有再生可能性和安全性等特点,是合适的氨气吸收剂。
2.2 单因素分析氨氮去除效率与吸收剂pH变化的影响因素
2.2.1 氯化钠浓度的影响
常见的去除污水中低浓度氨氮的方法是折点加氯法,该方法每消耗1 mg氨氮需要消耗7.6 mg氯〔13〕,氯氮质量比约为8∶1。考虑到养殖场的吸收剂中氨氮偏高,且成分复杂,可能含有比氨氮更加倾向于参加电化学氧化的物质,故NaCl浓度需比折点加氯法中的理论值高。根据模拟废水中氨氮浓度对氯离子浓度进行推算,并在折点加氯法基础上适当提高氯离子质量浓度,得出相应的氯离子质量浓度分别为0.7、1.3、2.7、4.0、5.3、6.7 g/L。在反应温度为20 ℃的条件下,保持电流密度为30 mA/cm2,反应120 min,考察NaCl浓度对氨氮去除效果以及吸收剂pH的影响,结果见图2。
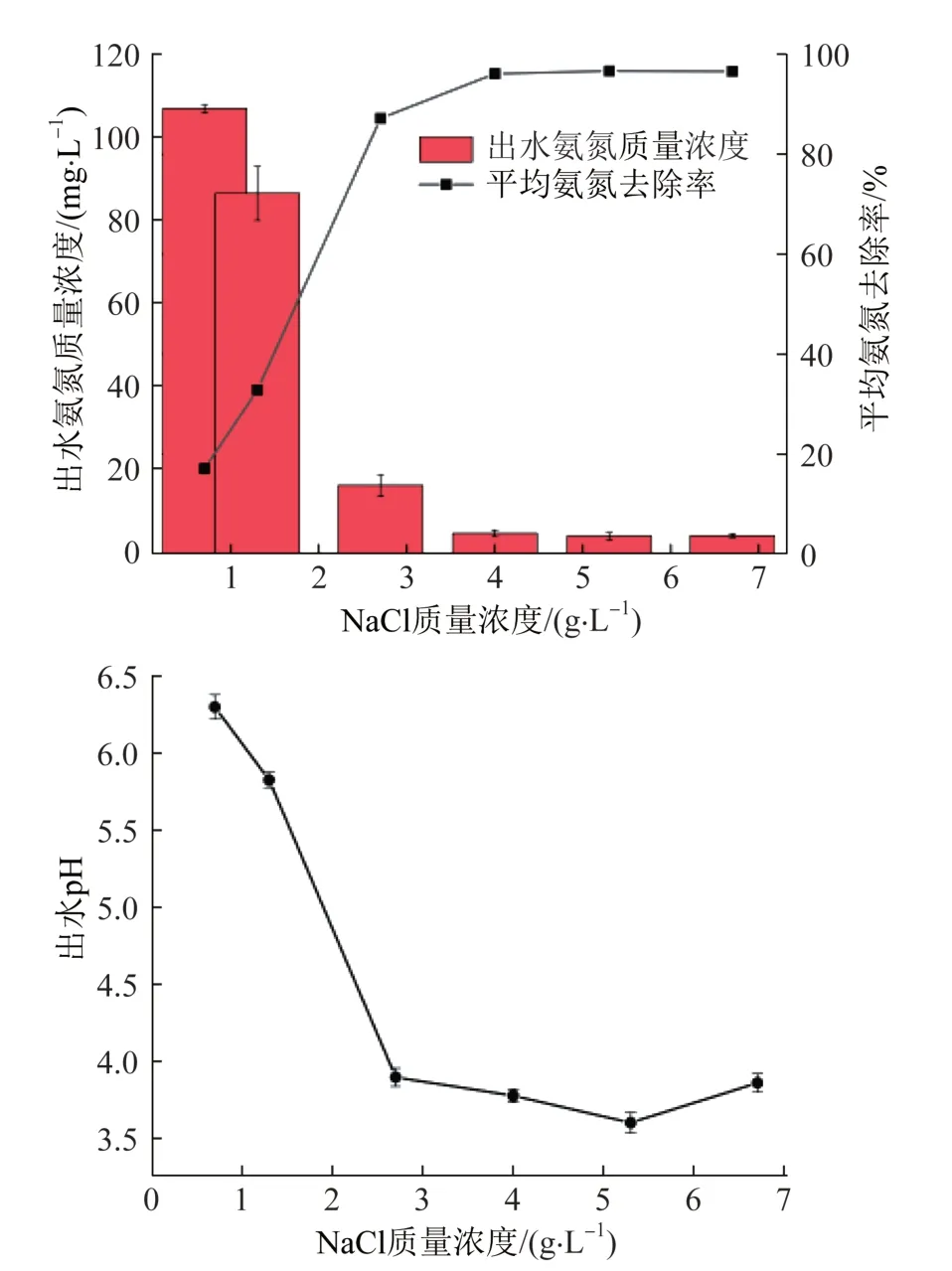
图2 NaCl浓度对氨氮出水浓度和平均氨氮去除率与出水pH的影响Fig.2 Effects of NaCl concentration on ammonia effluent concentration,average ammonia removal rate and effluent pH
由图2可知,当NaCl质量浓度由1.3 g/L提高至2.7 g/L时,平均氨氮去除率提高了54.80%,pH降低了75.39%。在实验时间内,NaCl质量浓度分别为4.0、5.3、6.7 g/L的体系对氨氮的去除率达95%以上。
同时,分别用零级、一级和二级动力学方程处理氨氮去除效果的数据,结果见表1。
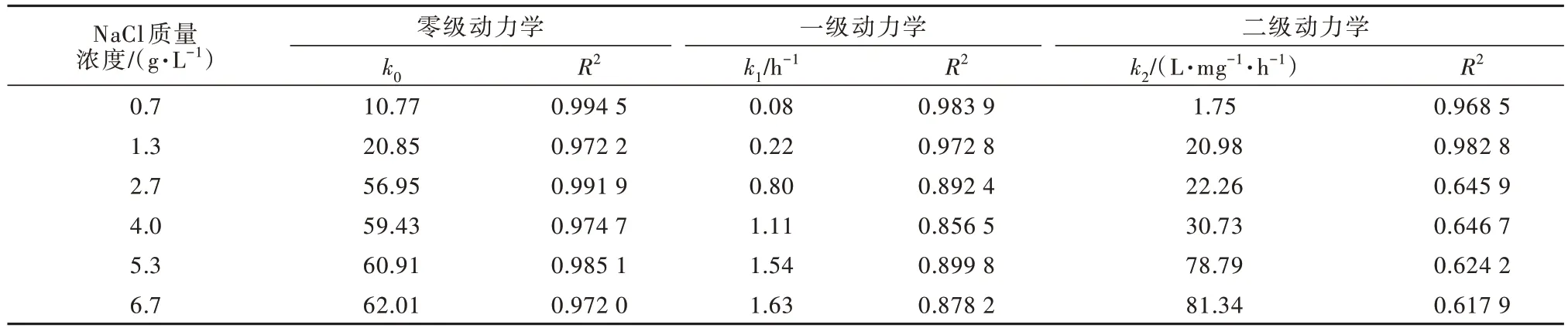
表1 不同NaCl浓度下氨氮的各级降解速率常数Table 1 Degradation rate constants of ammonia nitrogen at different concentrations of sodium chloride
由表1可知,零级动力学方程相关线性最好,拟合度均在0.97以上,与Liang LI等〔14〕关于电化学氧化氨氮是表观零级反应的研究结论一致,其认为活性氯在这个过程中起催化作用,反应的效率取决于HClO或ClO-的生成速率。NaCl浓度在一定范围内提高,能促进氨氮氧化反应正向进行。
2.2.2 温度的影响
夏季和冬季的水温相差可达10 ℃或以上,因此研究温度变化带来的影响有助于补充电化学氧化氨氮的工艺参数,并为是否选择恒温条件提供参考。控制NaCl质量浓度为2.7 g/L,保持电流密度为75 mA/cm2,反应120 min,观察反应温度对氨氮去除效果以及出水pH的影响,结果见图3。
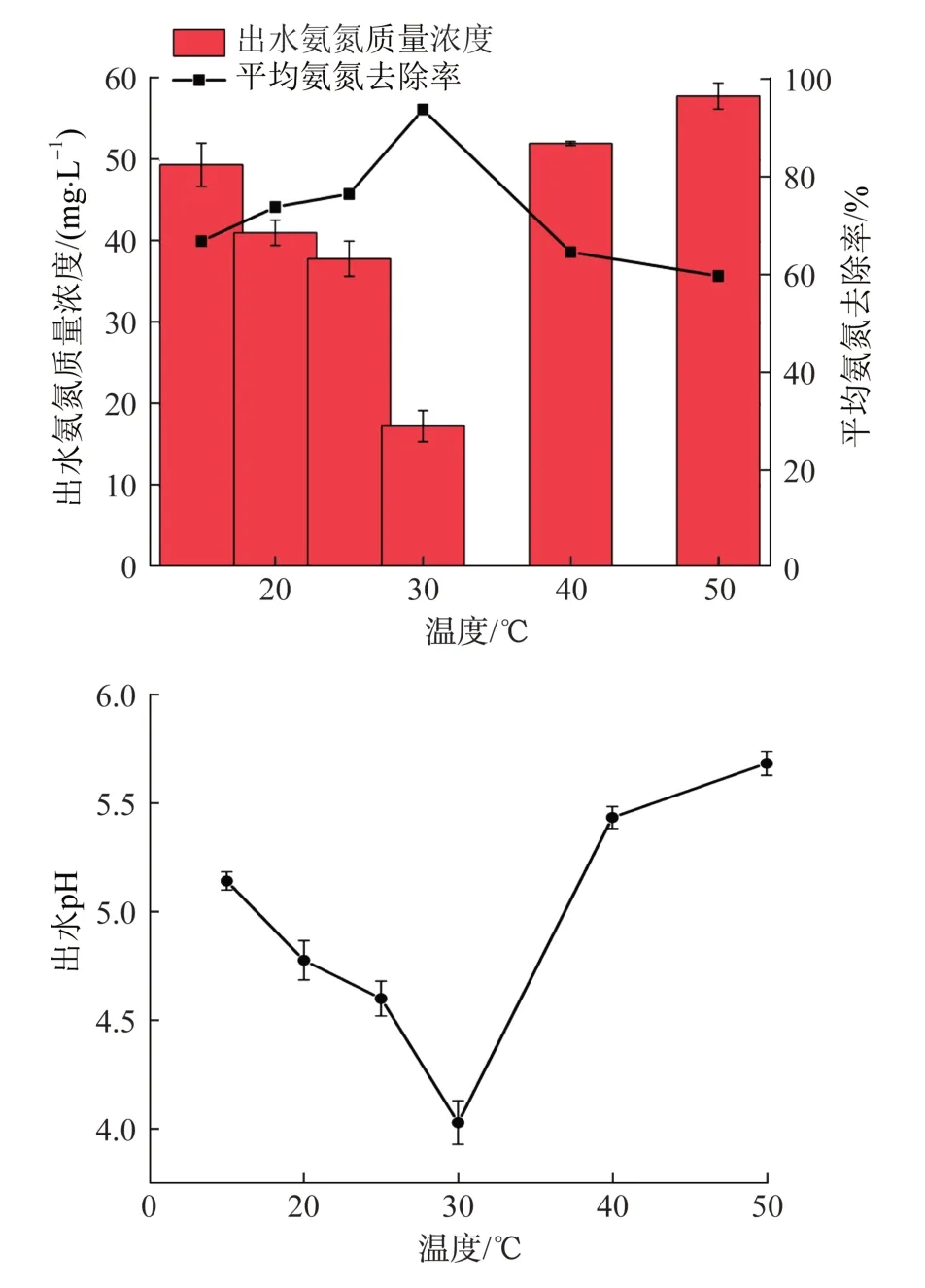
图3 温度对氨氮出水浓度、平均氨氮去除率与出水pH的影响Fig.3 Effect of temperature on ammonia effluent concentration,average ammonia removal rate and effluent pH
由图3可知,当温度由15 ℃提高至30 ℃时,氨氮去除率提高了29.94%,出水pH降幅提高了45%。根据能斯特方程,由于在溶液中氯气的平衡分压很低,故方程中的对数项为负值。随着温度的升高,对数项数值会随之变得更小,有利于析氯反应发生。温度还会影响氯离子的扩散速度,当温度升高时,离子扩散速度加快,扩散层厚度会随之减薄,氯气生成变得更加容易〔15〕。
但是当温度超过30 ℃后,氨氮去除效果变差。分析认为,本反应主要依靠间接氧化达到效果,而氯气溶于水所生成的HClO是主要的氧化剂。当温度升高时,HClO的分解速度会迅速提高,削弱活性氯的氧化能力。
2.2.3 电流密度的影响
氨氮氧化反应效率主要由活性氯的产率决定,而活性氯的生成与电流密度有密切关系〔16〕,故探究电流密度的影响可以优化工艺条件,并保证在氨氮去除效果较好的情况下达到节能减耗的目的。控制NaCl质量浓度为2.7 g/L,恒温30 ℃,反应120 min,观察电流密度对氨氮去除效果以及吸收剂pH的影响,结果见图4。
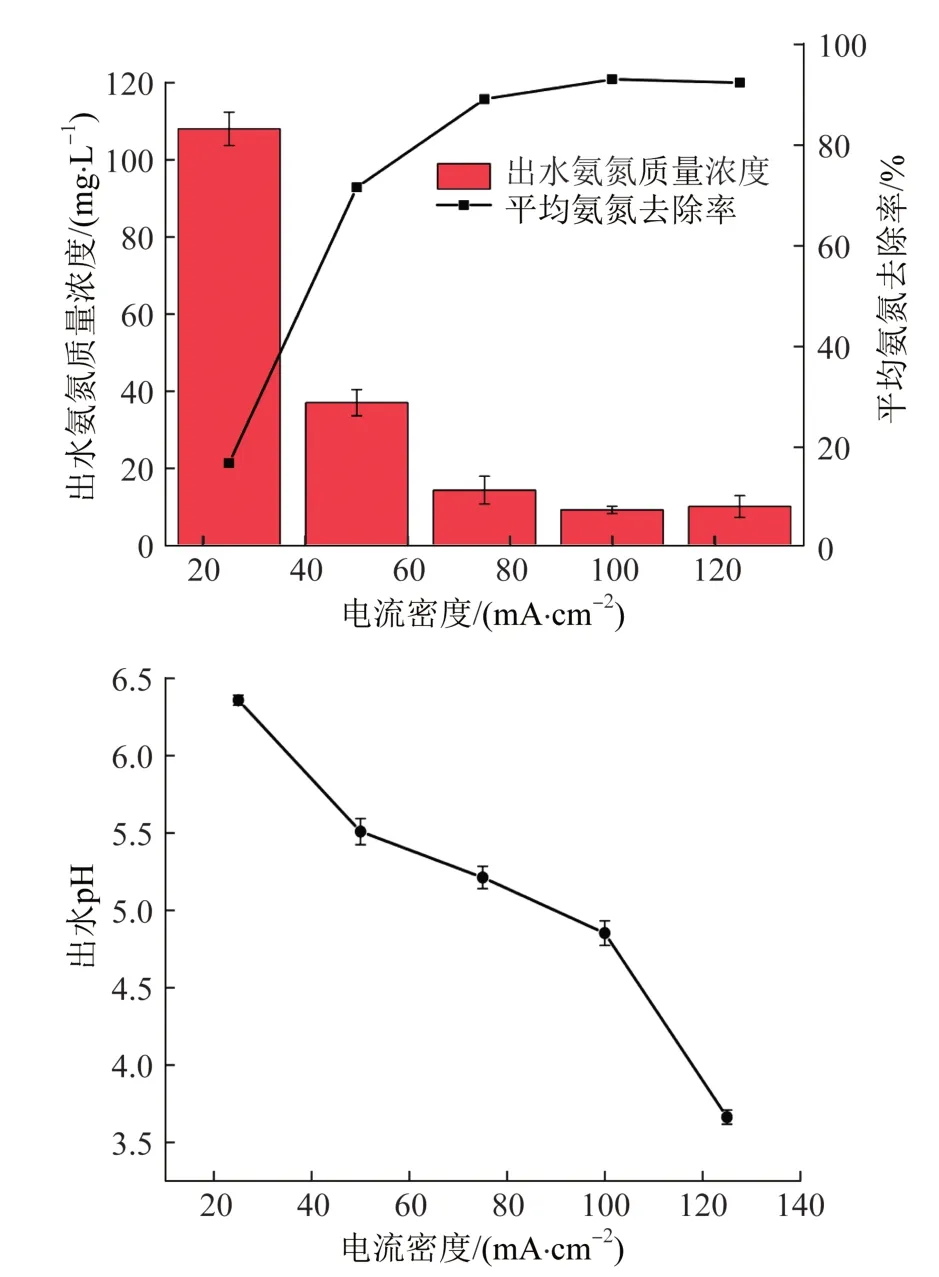
图4 电流密度对氨氮出水浓度、平均氨氮去除率与出水pH的影响Fig.4 Effect of current density on ammonia effluent concentration,average ammonia removal rate and effluent pH
由图4可知,随着电流密度的增加,pH的下降幅度以及平均氨氮去除率都提高。分析认为,在电流密度较低的阶段,氯离子在单位时间内得到的电子数目较少,HClO的生成速率不高,故过低的电流密度不利于反应进行。提高电流密度可以促进氧化剂HClO生成,使反应强度迅速提高。但考虑到电流密度越大热效应越强,故在30 ℃恒温条件下对电解液进行测温,发现电流密度在25~75 mA/cm2范围内体系没有明显升温,电流密度分别为100、125 mA/cm2的体系分别升高0.5、1 ℃。
值得注意的是,当电流密度超过75 mA/cm2,对应体系的平均氨氮去除率升幅不再明显,说明继续提高电流密度对增强氨氮的去除效果所起的作用甚微,随之而来的热效应却可能会加速有效氯的分解,增大能耗。
2.3 正交分析工艺条件
以反应温度、NaCl浓度和电流密度作为研究对象,以氨氮去除率作为指标,在单因素试验的基础上,通过正交实验对电化学氧化氨氮工艺进行优化,结果见表2~表5。
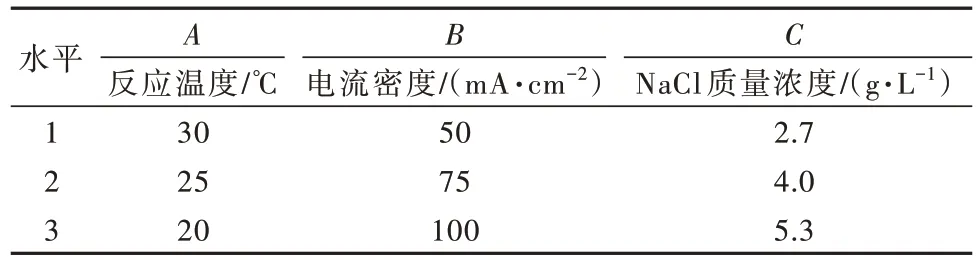
表2 因素水平Table 2 Horizontal factors table
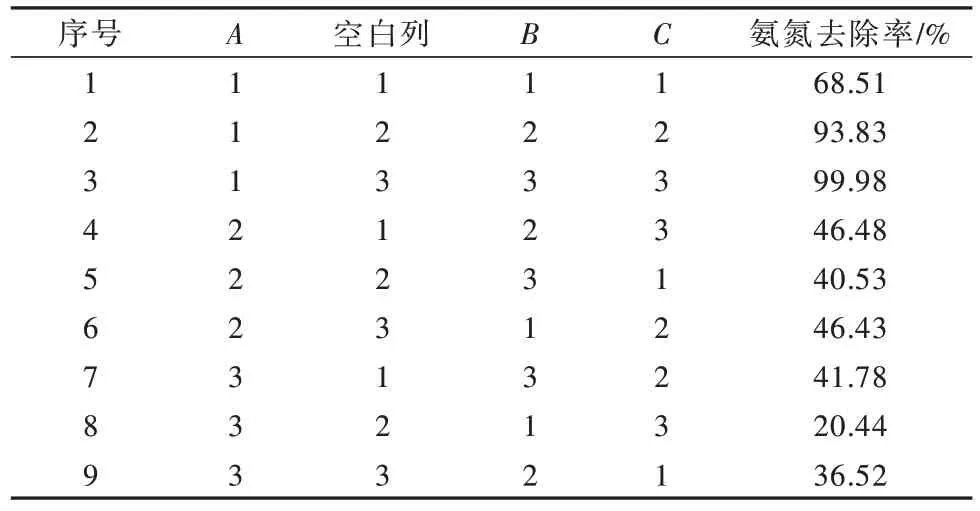
表3 正交实验方案及结果Table 3 Orthogonal experiment scheme and results
由表4可知,3个因素对氨氮去除率影响大小的次序:A(反应温度)>B(电流密度)>C(NaCl质量浓度)。同时,得出最佳工艺条件:反应温度为30 ℃,NaCl质量浓度为4.0 g/L,电流密度为100 mA/cm2。再对计算结果进行实验验证,结果见表5。
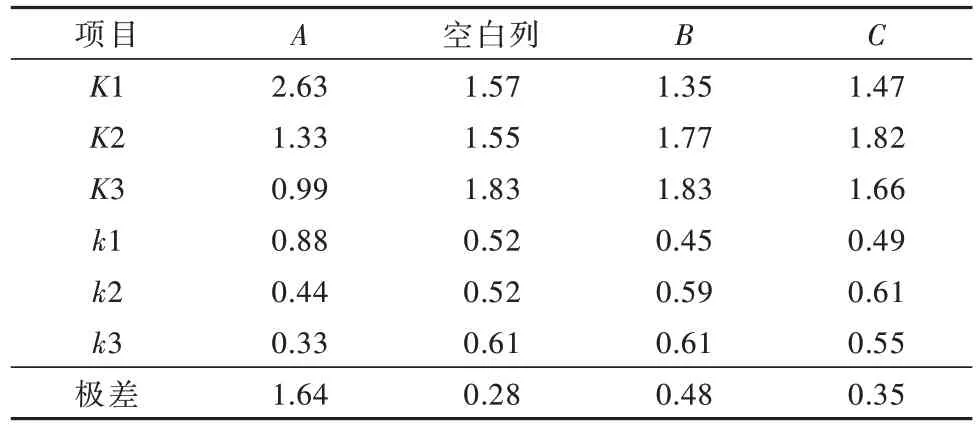
表4 极差分析结果Table 4 Range analysis results

表5 验证实验结果Table 5 Verify the experimental results
由表5可知,最佳工艺条件下(A1B3C2)氨氮的平均去除率为95.40%,RSD为0.93%,说明最佳工艺条件运行稳定,可以为养殖场去除含氨氮臭气提供工艺方案参考。
2.4 pH变化与氨氮降解机理的关系
结合图2~图4可知,pH降幅和氨氮去除效果在不同条件下有相似的变化趋势,二者受温度、电流密度和NaCl浓度变化的影响程度基本相同。为探究吸收剂的pH变化与氨氮降解机理的关系,采用离子色谱法追踪硝酸根和亚硝酸根在电化学氧化氨氮过程的浓度,并与不同时刻的氨氮进行对比。
采用正交法得出的最佳工艺(反应温度为30 ℃,每150 mL溶液的NaCl投加量为0.6 g,电流密度为100 mA/cm2)对含有130 mg/L氨氮的柠檬酸溶液进行电解,每隔30 min取样1次,实验重复5次,数据取平均值,实验结果见图5。
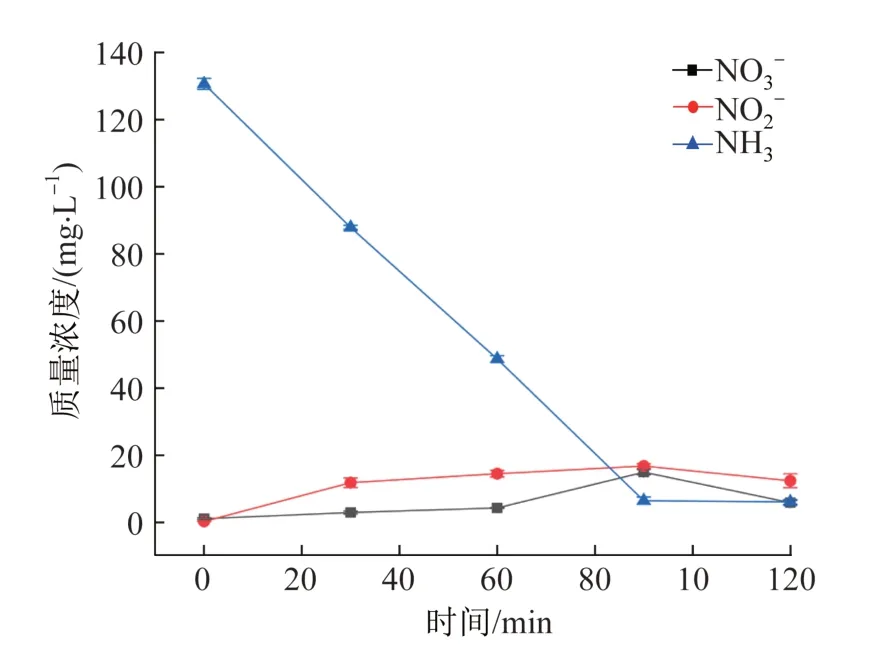
图5 硝酸根、亚硝酸根和氨氮的变化Fig. 5 Change of nitrate,nitrite and ammonia concentration
由图5可知,在任何时刻,无论是硝酸根还是亚硝酸根的质量浓度都始终保持在18 mg/L以下,表明在忽略氨气挥发的情况下,绝大部分的氨都转化为低价态的氮气,符合式(3)所描述的氧化反应机理。具体分析认为,氨被酸吸收后以NH4+的形式存在,并在参与氯化降解后能把H+解离出来,表观上体现为吸收剂的pH持续下降。此时对式(1)~式(3)进行整合,得到总反应式(6)。
总反应式(6)描述了吸收氨气和间接氧化的联合过程,其中不涉及吸收剂的损耗,也不涉及H+的得失。结合关于图1的讨论,常见吸收剂中只有柠檬酸能稳定存在于氨氮电化学氯化降解过程,并且不对氨氮的去除起消极作用。故本研究条件下,柠檬酸主要作为氨氮参与电化学氧化反应过程中的载体,在氨氮被降解后酸碱度会持续下降,恢复吸收容量。
2.5 体系pH与NH3-N的关系
由单因素实验数据可知,氨氮与吸收剂的pH在不同的反应条件下具有相似的响应,为确定二者的变化规律,对不同实验条件下含有氨氮(约130 mg/L)的柠檬酸体系分别进行3组平行试验,每隔15 min取样。
在NaCl质量浓度为4.0 g/L、反应温度为30 ℃和电流密度为100 mA/cm2的条件下,考察pH和氨氮的关系,结果见图6。
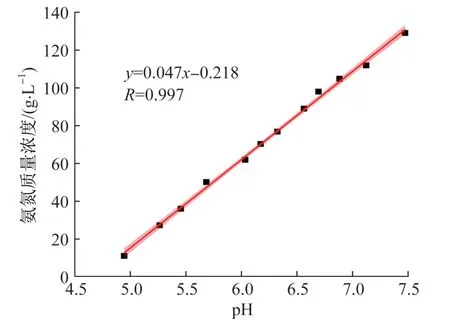
图6 pH和氨氮的关系Fig. 6 Relationship between pH and ammonia nitrogen
由图6可知,pH与氨氮呈线性关系,随着体系氨氮的减少,pH逐渐降低。因此,利用氨氮的间接氧化机理,并以电化学稳定性高的柠檬酸作为吸收剂,能在固定的废水浓度和已知的工艺条件下根据pH的动态变化来监测氨氮去除反应的进程。
为验证线性关系的合理性,应用上述的线性方程预测氨氮浓度,再以相同的反应条件对含氨吸收剂进行电化学处理,实验重复5次,数据取平均值,结果见图7。
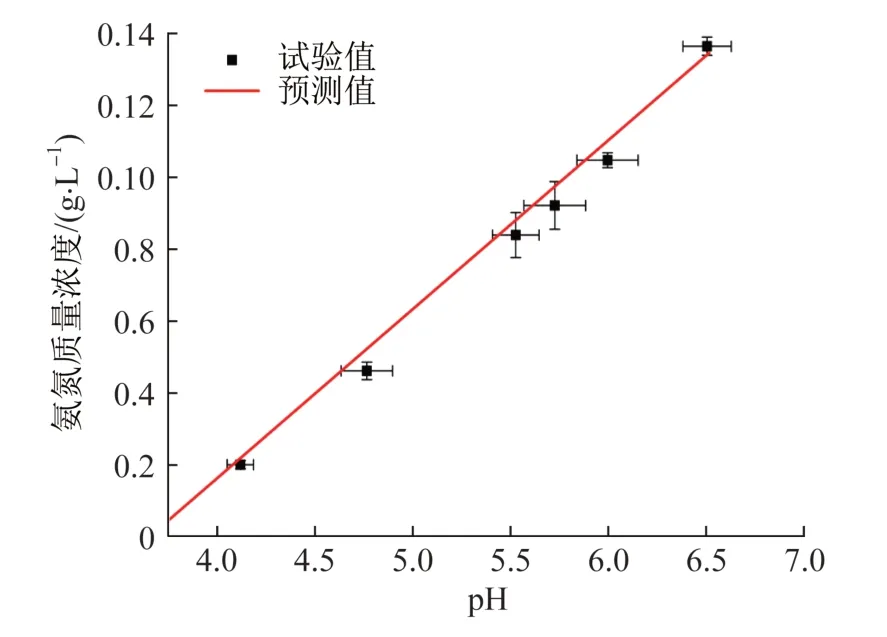
图7 氨氮浓度与pH关系的预测值和实验值比较Fig. 7 Comparison of the predicted and experimental values of the relationship between ammonia nitrogen and pH
由图7可知,预测值与纳氏试剂检测的结果吻合,误差值在0.01~0.1之间,证明运用由pH动态数据与氨氮得出的拟合线性方程对实际氨氮的监测是具有可靠性和实用性的。
目前,常见的氨氮现场检测方法需要现场取样、样品储存、转运、实验室分析和数据处理等繁杂的步骤〔17-18〕。笔者对氨氮氯化降解机理和柠檬酸电化学稳定性结合运用,开发了利用吸收剂pH动态变化数据对体系氨氮浓度的实时监测方法,大大降低了氨氮去除工艺的监测成本与操作难度。在实际应用中,仅需在电解装置中配备酸度计即可获取实时的氨氮去除效果信息。
3 结论
1)柠檬酸作为氨气吸收剂能稳定存在于电化学氧化反应,不影响反应进行。
2)工艺的最佳条件:反应温度为30 ℃、电流密度为100 mA/cm2和NaCl投加量为4.0 g/L,平均氨氮去除率达95.40%。
3)吸收剂的pH持续下降主要是由氨氮间接氧化为氮气的反应机理决定的。为此,可以利用该特征建立氨氮和pH的函数关系现场监测氨氮。
