磁性催化剂制备及其在臭氧催化氧化+磁分离工艺中的研究
2023-09-25于金旗孙磊黄光华田彩星张鹤清佟庆远
于金旗,孙磊,黄光华,田彩星,张鹤清,佟庆远
(1.中建环能科技股份有限公司,四川成都 610045; 2.中国建筑生态环境工程研究中心(水环境技术与装备),北京 100037; 3.中建环能(北京)环保有限公司,北京 100043)
臭氧催化氧化是一种十分有效的高级催化氧化技术,在难降解有机废水、市政污水及工业废水的深度处理中被广泛应用〔1〕。催化剂是臭氧催化氧化的核心,可催化臭氧产生羟基自由基(·OH)强氧化去除废水中的有机污染物。目前,实际工程中应用最多的臭氧催化剂为直径约2~6 mm的负载有过渡金属氧化物的分子筛球,制备方法多为浸渍法,反应器多采用固定填充床。然而,该类分子筛球催化剂和固定床反应器大部分活性位点分布于球体孔隙内,污染物和氧化剂需经过孔隙扩散后方可与催化剂活性位点结合,反应速度慢、时间长,且存在填充床易堵塞、板结和催化剂流失、失活的问题。流化床反应器是近些年研究的热点〔2〕,其通过简单的机械搅拌可将臭氧和微小颗粒、密度轻的催化剂均匀分散悬浮于污水中,以提高有机污染物、臭氧和催化剂的碰撞反应几率,从而提高系统催化氧化的综合效能,但存在微小颗粒催化剂不便于回收和重复利用的问题;并且,微小的颗粒物催化剂随水排放至环境中,易造成二次污染;这些均限制了臭氧催化氧化流化床反应器在实际工程中的推广与应用。
磁性催化剂是一种具有磁响应特性的催化剂,其不仅催化活性高,还具有独特的磁响应性,在外加磁场的作用下可以实现分离与回收,从而达到重复利用的目的〔3〕,十分适合应用于流化床反应器。磁性催化剂颗粒物尺寸及密度是影响流化床反应器运行的重要参数,颗粒物尺寸越小、密度越轻则越易在水中流化。传统的磁性物质密度一般大于4 g/cm3(如超磁分离商用磁种密度约4.4 g/cm3,磁铁矿和四氧化三铁密度均约5.2 g/cm3等),在流化床中流化性能较差,或需较大的流化动力方能实现流化床的高效稳定运行。粉末活性炭(PAC)具有较大的比表面积和发达的孔隙结构,是良好的磁性催化剂载体,且密度轻(约0.38~0.45 g/cm3),以其为载体制备出的磁性催化剂在水中易悬浮和流化。早在20世纪末就有研究发现,臭氧结合活性炭技术比两种技术单独使用具有更好的污染物去除效果〔4〕;马军院士及其团队也研究发现,负载锰的活性炭催化臭氧氧化对难降解有机污染物硝基苯的氧化去除效率是单独臭氧氧化的2.0~3.0倍〔5〕。因此,以PAC为载体的磁性催化剂应用于臭氧催化氧化流化床反应器结合磁分离回收装置存在三方面的独特优势:一是磁性催化剂呈微小颗粒状、催化活性位点位于颗粒表面,且质量轻,便于流化,运行能耗低,可克服固定床反应器孔隙易堵塞、易板结等难题;二是磁性催化剂比表面积大、吸附性能强、催化效率高,利于吸附、富集及催化氧化降解有机污染物;三是磁性催化剂带有磁响应性,可被磁分离装置回收及重复利用,有效解决流化床反应器微小颗粒的回收难题。
目前,制备磁性催化剂常用的方法有水热法〔6〕、共沉淀法〔7〕、溶胶-凝胶法〔8〕和浸渍法〔5〕,且针对臭氧催化氧化工艺的磁性催化剂报道已屡见不鲜〔9-10〕,但以PAC为载体的磁性催化剂在臭氧催化氧化流化床反应器结合磁分离装置中的应用研究较少,且很难找到相关的理论支持数据。笔者以粉末状PAC为载体,采用一种简易、可大批量生产的方法,制备出呈微小颗粒状、具有比表面积大、催化活性高、稳定性好、质量轻和易于回收等特点的磁性催化剂以用于流化床反应器;并通过电子扫描显微镜(SEM)、X射线衍射(XRD)等表征方法分析了微小颗粒磁性催化剂的表面形貌、化学组成、孔隙结构、比表面积、表面羟基基团及磁性等基本特性。同时,将新制备的磁性催化剂应用于臭氧催化氧化流化床反应器,结合磁分离回收技术,以亚甲基蓝(MB)为目标污染物,考察了臭氧催化氧化结合磁分离工艺中磁性催化剂的吸附性能、催化氧化效能、稳定性、重复利用性和回收率等,为臭氧催化氧化结合磁分离工艺实际应用提供必要的理论数据和技术支持。
1 材料与方法
1.1 实验试剂与仪器
试剂:亚甲基蓝、碘化钾、微米级粉末状活性炭、硫酸亚铁、硫酸铁、无水硫酸铜、硫酸锰和硫酸铈均为分析纯,购自国药集团;实验用水均采用超纯水。
仪器:DF101S型集热式磁力搅拌器,上海力辰仪器科技有限公司;DHG-9240A型电热鼓风干燥箱,上海一恒科学仪器有限公司;MFLGKD410-12型自动真空管式炉电阻丝高温炉微型高温陶瓷炉,上海马弗炉科技仪器有限公司;DOZ30P型溶解臭氧浓度检测仪,台湾CLEAN;UV-300型气体臭氧浓度检测仪、CF-YG10型臭氧发生器,北京山美水美臭氧高科技有限公司。
1.2 磁性催化剂的制备
采用多金属共浸渍法结合共沉淀法制备磁性催化剂。分别称取一定量的三价铁盐、二价铁盐和多种二价过渡金属Y(Mn2+、Cu2+、Co2+、Ce2+)盐,按照Fe3+∶Fe2+∶Y2+(物质的量比)=2∶(0.5~0.9)∶(0.1~0.5)溶解于水中,然后加入一定量的PAC,使之充分混和均匀,隔绝空气共浸渍12~24 h;在机械搅拌的同时缓慢逐滴加至装有5 mol/L碱液的容器中,待共沉淀反应结束后用滤纸过滤,截留的黑色物质置于80 ℃烘箱烘干,得到黑色粉末;在N2保护下,于300 ℃马弗炉中煅烧约2 h,得到黑色颗粒磁性物质,记作YxFe3-xO4/PAC(其中,Y为二价铜、锰、钴和铈混合物,x为Y2+/(Y2++Fe2+)物质的量比;当x=0.1时,即二价过渡金属(不含Fe2+)与总二价过渡金属(含Fe2+)的物质的量比为0.1,产生的磁性催化剂分子式记作Y0.1Fe2.9O4/PAC;当x=0.3时,分子式记作Y0.3Fe2.7O4/PAC。
1.3 实验装置及步骤
磁性催化剂的催化效能评估反应装置见图1。
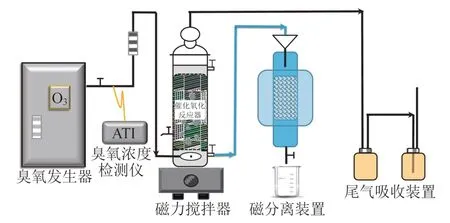
图1 实验装置Fig. 1 Schematic diagram of experimental setup
由图1可知,装置主要由六部分构成,分别为臭氧发生器、臭氧浓度检测仪、流化床催化氧化反应器、磁力搅拌器、磁分离装置和尾气吸收装置。臭氧发生器为制氧和臭氧一体机,内部含有制氧机,制备臭氧量≤10 g/h(可调节);臭氧浓度检测仪检测范围为0~200 mg/L,用于实时监测臭氧发生器产生气体的臭氧浓度;流化床催化氧化反应器主体采用石英玻璃材质,具有较强的抗氧化性能;磁力搅拌器转速范围为0~2600 r/min,用于固液混合机械搅拌及反应结束后磁性催化剂的快速沉淀;磁分离装置采用超导磁分离装置,用于考察不同磁场强度对磁性催化剂的回收效果;尾气吸收装置用于吸收破坏未被利用的气体残留臭氧;整个系统所用管路均为硅胶管,并设有止回阀以防止臭氧泄漏至空气危害实验人员身体健康。
实验步骤:1)用量筒准确称取1 L配制好的MB溶液置于流化床催化氧化反应器内,将一定量的微小颗粒状磁性催化剂加入MB水溶液,磁力搅拌快速混合均匀,形成黑色悬浊液;2)通入臭氧,并继续磁力搅拌,臭氧气体投加量为0.1 L/min,气体臭氧质量浓度约50 mg/L,间隔相同时间取样,并测试MB在水中的浓度变化以评判各种催化剂的催化效能;3)反应结束后,停止磁力搅拌,溶液进入磁分离装置,黑色粉末状磁性催化剂被吸附分离,出水检测过渡金属元素残留量以评判离子渗出量及磁性催化剂稳定性、回收率等。
1.4 分析项目及方法
采用德国ZeissSigma500电子扫描电镜(SEM)进行表面形貌分析,工作电压为10 kV,电流为5~15 µA;催化剂表面含氧基团通过傅里叶变换红外光谱(FT-IR)谱图进行分析;采用德国Bruker D8 Advance型X射线衍射仪(XRD)对催化剂晶体结构进行分析,辐射源为Cu Kα,管电压和电流分别为45 kV和200 mA,扫描速度为6(°)/min,扫描范围为5~90°;比表面积、孔径及孔体积通过采用美国Micromeritics公司的ASAP2460比表面积分析仪进行N2吸附脱附等温线分析;催化剂磁性通过美国QuantunDesig公司的振动样品磁强计(VSM)分析研究。水中MB浓度的测定采用分光光度法,即在最大吸收波长664 nm下测定;水中溶解臭氧残留量采用台湾CLEAN的笔式溶解臭氧浓度检测仪测定;水中铁、锰渗出浓度按照《水质32种元素的测定 电感耦合等离子体发射光谱法》(HJ 776—2015)测定;铜、钴渗出浓度按照《水质65种元素的测定 电感耦合等离子体质谱法》(HJ 700—2014)测定。
2 结果与讨论
2.1 磁性催化剂表征分析
2.1.1 SEM+Mapping图谱分析
PAC、Y0.1Fe2.9O4、Y0.1Fe2.9O4/PAC的SEM和Y0.1Fe2.9O4/PAC的实物图见图2。

图2 PAC(a)、Y0.1Fe2.9O4(b)、Y0.1Fe2.9O4/PAC(c)的SEM和Y0.1Fe2.9O4/PAC实物图(d)Fig. 2 SEM images of PAC(a),Y0.1Fe2.9O4(b),Y0.1Fe2.9O4/PAC(c)catalysts and the photograph of Y0.1Fe2.9O4/PAC catalysts(d)
由图2(a)可知,原PAC为微米级,呈现块状,表面较光滑,而负载了磁性催化剂的Y0.1Fe2.9O4/PAC则表面较粗糙,且有粉末状颗粒物存在,说明磁性颗粒成功负载到了PAC的表面。图2(b)展示了单独磁性催化剂Y0.1Fe2.9O4的微观形貌,类似小球形颗粒状,球径介于几十纳米之间,与图2(c)表面散布的颗粒物相似,进一步说明磁性颗粒物负载到了PAC上。Y0.1Fe2.9O4/PAC的实物图〔图2(d)〕显示,磁性催化剂呈粉末状,可被磁铁吸附,亦可说明PAC被赋予了磁性。
Y0.1Fe2.9O4/PAC的Mapping图谱见图3。

图3 Y0.1Fe2.9O4/PAC的Mapping图谱Fig. 3 Mapping images of Y0.1Fe2.9O4/PAC
由图3中不同颜色光点的分布可知,Fe、Mn、Cu、Co、Ce元素均已均匀地分布在PAC的表面。
2.1.2 XRD分析
PAC、Y0.1Fe2.9O4和Y0.1Fe2.9O4/PAC的XRD见图4。
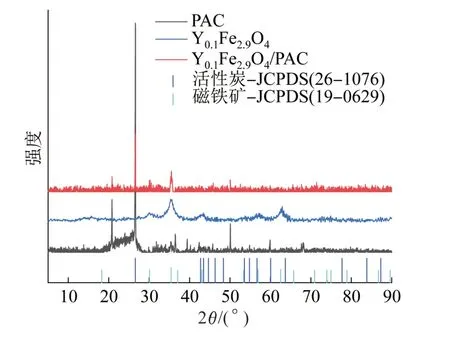
图4 PAC、Y0.1Fe2.9O4和Y0.1Fe2.9O4/PAC的XRDFig. 4 XRD patterns of PAC,Y0.1Fe2.9O4 and Y0.1Fe2.9O4/PAC catalysts
由图4可知,Y0.1Fe2.9O4在2θ分别为30.10°、35.42°、43.05°和62.52°处有明显的衍射峰,与磁铁矿(JCPDS No. 19—0629)标准卡匹配良好,说明掺杂了部分过渡金属元素Y的磁铁矿依旧可以保持原有晶型。Y0.1Fe2.9O4/PAC出现了5个强度较强的衍射峰,对应5个不同的晶面,分别位于21.88°、26.60°、35.42°、35.42°、50.08°处,与磁铁矿(JCPDS No. 19—0629)和活性炭(JCPDS No. 26—1076)标准卡均具有良好的匹配性,且原PAC在2θ分别为21.88°、26.60°、50.08°处均有明显的衍射峰,说明Y0.1Fe2.9O4已成功负载到PAC的表面。
2.1.3 BET分析
3种物质的吸附-脱附等温线见图5(a),催化剂的孔径分布见图5(b)。

图5 不同催化材料的N2吸附-脱附等温线和孔径分布曲线Fig. 5 N2 adsorption-desorption isotherms and pore size distribution curves of the different catalysis
由图5(a)可知,在相对低压力(p/p0<0.15)范围内,PAC、Y0.1Fe2.9O4/PAC两种物质等温线上升速度较快,这是由于微孔具有较强的吸附能力造成的现象,说明该两种物质存在微孔结构,而Y0.1Fe2.9O4则不具备微孔;在p/p0为0.5~1.0处出现了回滞环,且相同压力下脱附等温线的吸附量(标准状态下,下同)大于吸附等温线的吸附量,说明PAC、Y0.1Fe2.9O4和Y0.1Fe2.9O4/PAC这3种物质均存在介孔结构;在吸附等温线的末端(p/p0>0.8),PAC和Y0.1Fe2.9O4/PAC两种物质出现上升的现象,一般是由于多层吸附造成的,说明该两种物质存在大孔结构,且Y0.1Fe2.9O4/PAC比PAC上升趋势更明显,可能是由于磁性物质Y0.1Fe2.9O4的负载,导致了大孔增多,而Y0.1Fe2.9O4的等温曲线在末端几乎平行,说明其不存在大孔结构。通过比较发现,Y0.1Fe2.9O4/PAC和PAC有相似的吸附-脱附等温线变化趋势,但Y0.1Fe2.9O4/PAC要比PAC的吸附氮气量少,说明负载的Y0.1Fe2.9O4对PAC具有一定的堵塞作用,从而造成比表面积减小;Y0.1Fe2.9O4吸附氮气量最小,且多为介孔结构,比表面积理应最小。
由图5(b)可知,PAC的孔径主要分布在2~50 nm,以介孔为主;Y0.1Fe2.9O4/PAC的孔径分布同PAC类似,但其大孔结构要比活性炭多,说明磁性物质Y0.1Fe2.9O4负载到活性炭上,可改变其孔径分布,使大孔增多。从孔径分布曲线看,Y0.1Fe2.9O4孔径分布全部低于50 nm,不存在大孔结构,这与其吸附等温曲线变化相同。
3种材料的结构性质见表1。

表1 3种材料的结构性质Table 1 Textural characteristics of three materials
由表1可知,3种物质的比表面积PAC>Y0.1Fe2.9O4/PAC>Y0.1Fe2.9O4;平均孔径Y0.1Fe2.9O4>Y0.1Fe2.9O4/PAC>PAC;孔体积PAC>Y0.1Fe2.9O4/PAC>Y0.1Fe2.9O4,对比发现,负载磁性物质的PAC比表面积、孔径和孔体积均介于单独PAC和Y0.1Fe2.9O4之间,说明磁性物质的引入改变了PAC的形貌,从而可能会改变其吸附、催化性能。
2.1.4 FT-IR图谱分析
催化剂表面羟基基团密度越大,催化活性越强〔11〕,通过FT-IR分析了PAC和负载不同量磁性物质PAC的表面羟基基团,结果见图6。
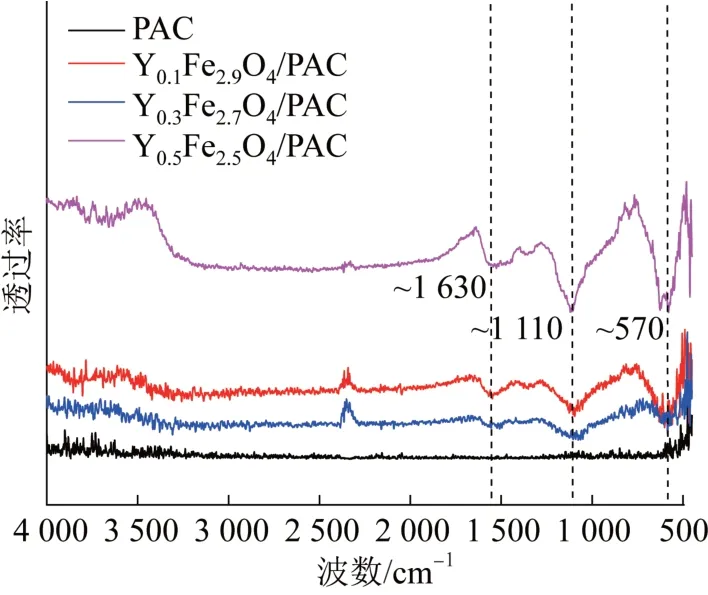
图6 PAC和负载磁性物质PAC的FT-IRFig. 6 The FT-IR spectrum of the four heterogeneous catalysts
由图6可知,负载磁性物质的PAC在FT-IR图谱中出现代表O—H键的吸收峰(~1630 cm-1)〔12〕、代表C—O键的吸收峰(~1110 cm-1)和代表Fe—O键的吸收峰(~570 cm-1)〔13〕,说明磁性氧化物已负载到PAC的表面并出现表面羟基基团,可能会有较高的催化活性;且随着负载过渡金属元素Y量的增加,羟基基团的吸收峰更加明显。而未负载磁性物质的PAC未见代表O—H键的吸收峰,可能不具备较高的催化活性。
2.1.5 VSM分析
用振动样品磁强计对磁性催化剂进行磁滞回线测定以评判其磁性,结果见图7。
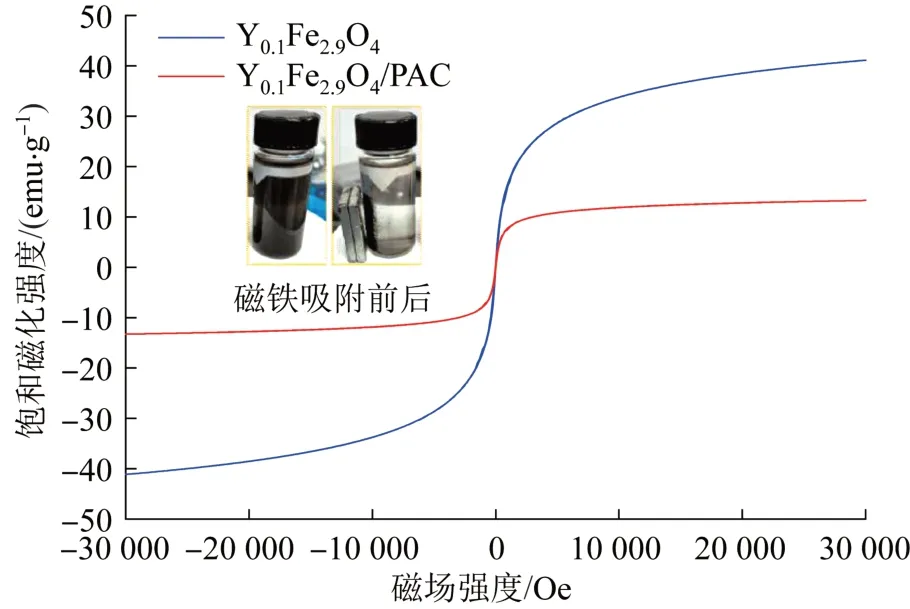
图7 用振动样品磁强计作的磁化曲线Fig. 7 Magnetization curves obtained by VSM
由图7可知,Y0.1Fe2.9O4和Y0.1Fe2.9O4/PAC均表现出超顺磁性,都为软磁材料,饱和磁化强度分别为41.12 emu/g和13.26 emu/g,均可被磁铁吸收,但负载到PAC上的复合磁性催化剂磁性偏弱,这与Lunhong AI等〔14〕的研究类似。
2.2 臭氧催化氧化结合磁分离工艺去除MB效果分析
MB具有毒性大、难生化降解的特点,常被用于评估多金属氧化物催化剂的催化性能〔15〕。本次系列实验采用流化床催化氧化反应器和磁分离装置,以MB为目标污染物,评估新制备磁性催化剂的吸附、臭氧催化氧化效能、稳定性、重复利用性及磁回收性能。每次实验用1000 mL MB溶液,初始质量浓度为41.2 mg/L,磁性催化剂投加量为0.3 g/L(若投加),臭氧投加量约5.0 mg/min(若投加)。
2.2.1 物理吸附性能分析
吸附在臭氧催化氧化过程中起到至关重要的作用,可加速催化氧化反应的进行〔16〕,也可促进有机污染物完全降解和矿化〔17〕。采用新制备的磁性催化剂进行多次吸附实验,每次实验机械搅拌足够时间后,测量MB在水中的浓度,并计算其去除率和吸附量,结果见图8。
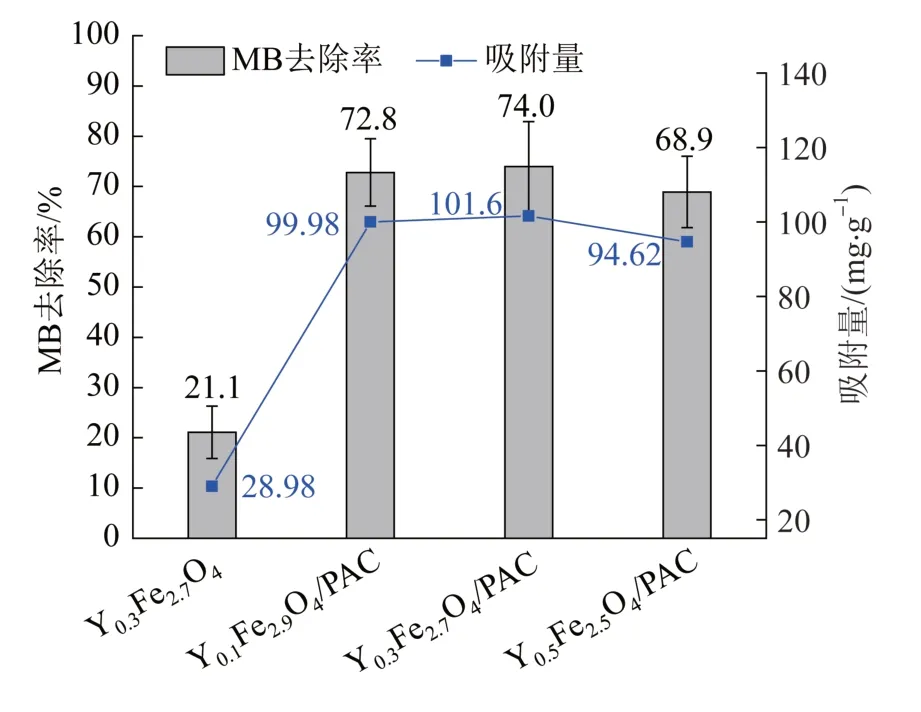
图8 不同磁性催化剂的吸附去除率和吸附量Fig. 8 Adsorption removal rate and adsorption capacity of different magnetic catalysts
由图8可知,在一定范围内,磁性催化剂的比表面积越大,吸附能力越强,吸附量越大,相应的MB去除率越高。由2.1.3小节BET分析和图8数据可推断,未负载到PAC上的磁性催化剂(Y0.3Fe2.7O4)比表面积、MB去除率和吸附量均低于负载到PAC上的磁性催化剂(YxFe3-xO4/PAC)。同时发现,掺杂不同比例过渡金属元素的磁性催化剂MB去除率和吸附量并没有明显变化,分别约71.9%(均值)和98.7 mg/g(均值),其中Y0.3Fe2.7O4/PAC表现出最高的吸附性能(MB去除率和吸附量分别为74.0%和101.6 mg/g)。
2.2.2 催化氧化性能分析
从理论上讲,负载的过渡金属元素越多,催化氧化效果越好,但考虑到负载过多可能会使磁性催化剂整体的比表面积减小,致使表面活性位点减少,影响其催化氧化效率,本实验考察了负载不同比例过渡金属的磁性催化剂对MB的去除效果,结果见图9。
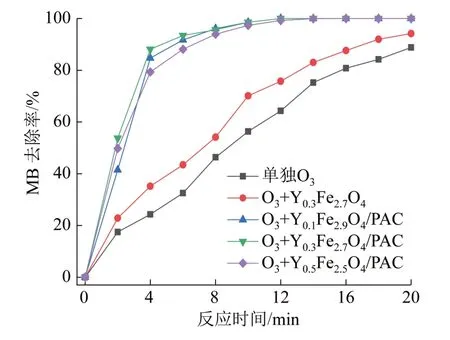
图9 不同磁性催化剂催化臭氧氧化的MB去除率Fig. 9 MB removal rate of ozonation catalyzed by different magnetic catalysts
由图9可知,MB去除率:YxFe3-xO4/PAC(x=1、2、3)>Y0.3Fe2.7O4>单独臭氧氧化,且在YxFe3-xO4/PAC催化作用下,约10 min即可将MB完全去除,而Y0.3Fe2.7O4催化和单独臭氧氧化完全去除则需反应20 min以上,说明YxFe3-xO4/PAC的加入对MB的去除效果显著,可缩短反应时间,从而减小反应器容积。同时发现,催化氧化降解MB的效果并没有随着负载过渡金属元素量的增加而等比例增加,Y0.3Fe2.7O4/PAC和Y0.5Fe2.5O4/PAC表现出相近的MB降解曲线,考虑到经济性问题,负载的过渡金属量越多,成本越高,可推断Y0.3Fe2.7O4/PAC掺杂过渡金属元素的比例最合适。未负载到PAC上的Y0.3Fe2.7O4对MB吸附去除率仅为21.1%(图8),在臭氧氧化条件下,反应降解速率也较缓慢,仅比单独臭氧氧化高约8.8%,说明Y0.3Fe2.7O4本身催化性能并不高,当负载到PAC上后,吸附和催化的共同作用提高了污染物降解速率,缩短了反应时间,这与隋铭皓等〔18〕研究的结果类似,即臭氧在催化剂表面的吸附、分解是催化臭氧氧化系统发挥其效能的关键。
水中溶解臭氧残留量可间接评价臭氧催化氧化的效果。本系列实验所用磁性催化剂投加量均为0.3 g/L,臭氧投加量为5 mg/min,MB初始质量浓度为41.2 mg/L,臭氧投加时间为30 min后,检测水中溶解臭氧的浓度,每种磁性催化剂实验重复3次,结果见图10。
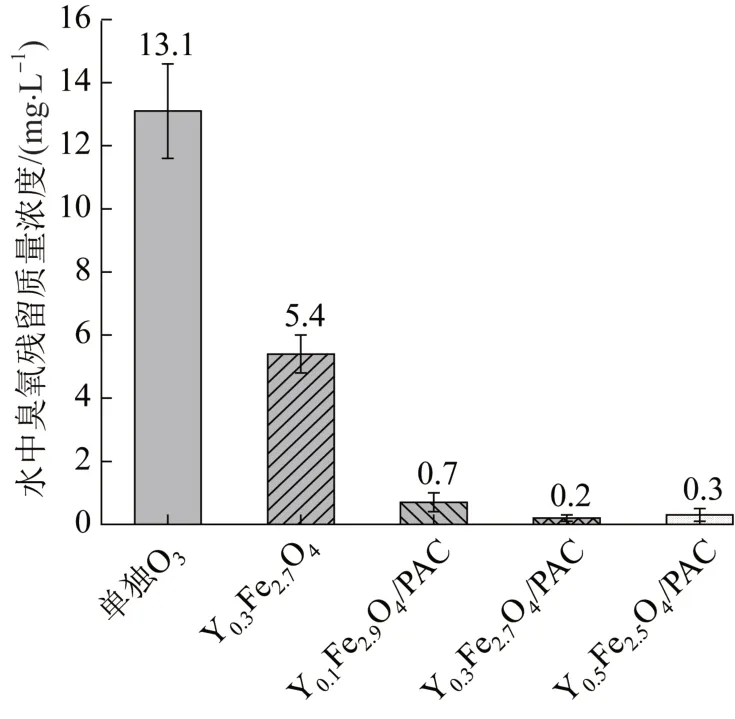
图10 反应结束后水中臭氧残留质量浓度Fig. 10 After the reaction,the residual ozone concentration in the water
由图10可知,当单独臭氧氧化时,残留在水中的溶解臭氧质量浓度最大,约13.1 mg/L;当投加Y0.3Fe2.7O4时,水中溶解臭氧质量浓度有所降低(约5.4 mg/L),说明Y0.3Fe2.7O4对臭氧有一定的催化降解作用;当投加YxFe3-xO4/PAC(x=1、2、3)时,溶解臭氧浓度均较低,且残留溶解臭氧浓度随着负载过渡金属元素的增多而降低,分析原因为磁性催化剂对臭氧的吸附和催化共同作用。
2.2.3 稳定性和可重复性分析
金属离子渗出量可间接说明新制备磁性催化剂的稳定性。本次实验所用磁性催化剂投加量均为0.3 g/L,臭氧投加量为5 mg/min,MB初始质量浓度为41.2 mg/L,臭氧投加30 min后过滤,检测滤出液中各过渡金属元素离子浓度。不同磁性催化剂催化臭氧氧化反应结束后水中金属离子的浓度见图11。
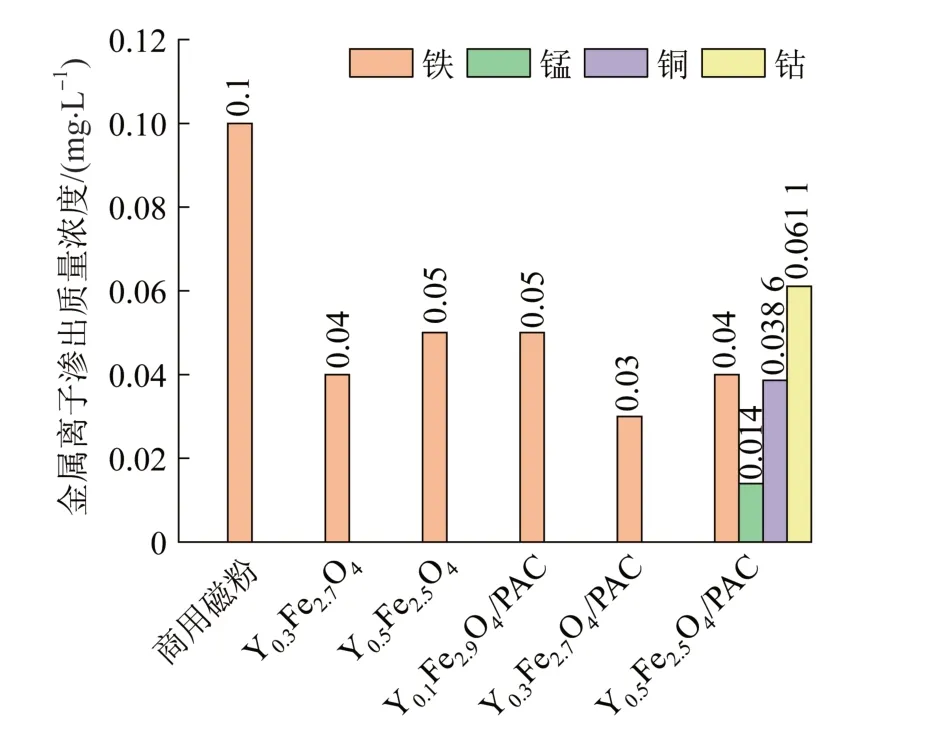
图11 不同磁性催化剂金属离子渗出浓度Fig. 11 Metal ion exudation concentrations of different magnetic supported ozone catalysts
由图11可知,当投加YxFe3-xO4或YxFe3-xO4/PAC(x=0.1或0.3)时,仅有少量铁离子溢出,与商用磁种相比较(铁离子渗出质量浓度约0.10 mg/L),稳定性较好;而当投加Y0.5Fe2.5O4/PAC时,却伴随有其他过渡金属元素(如铜、锰、钴)的渗出,说明此时制备的磁性催化剂不稳定,后期用于臭氧催化氧化可能存在二次污染问题。因此,综合考虑吸附、催化氧化效果及金属离子渗出问题,Y0.3Fe2.7O4/PAC表现出最佳性能。
在磁性催化剂投加量0.3 g/L,每次用完后过滤回收,80 ℃烘箱烘干约8 h后再次实验的条件下,考察Y0.3Fe2.7O4/PAC的重复利用效果曲线,结果见图12。
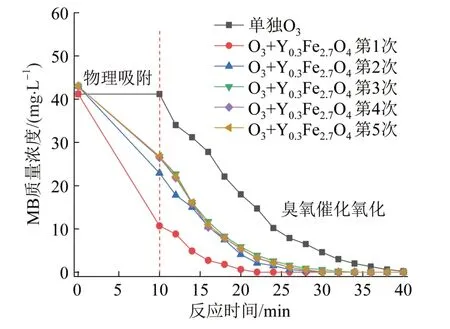
图12 磁性催化剂(Y0.3Fe2.7O4/PAC)的重复利用效果Fig. 12 Reuse effect of magnetic catalyst(Y0.3Fe2.7O4/PAC)
由图12可知,当Y0.3Fe2.7O4/PAC第1次使用时,物理吸附效果最强,MB去除率为74.1%,臭氧投加后约10 min可将MB彻底去除,去除速率约是单独臭氧氧化的3倍;当第2次使用时,物理吸附对MB的去除率降为46.7%,比第1次使用效果降低了约1/3,投加臭氧后约18 min可将MB彻底去除,去除时间有所延长,推测原因为磁性催化剂重复性实验时,未像其他研究者〔19〕一样采用煅烧的方式(煅烧可将吸附至磁性催化剂的有机物去除),而被有机物MB堵塞,影响其吸附和催化效果。第3、4、5次的使用效果几乎接近,Y0.3Fe2.7O4/PAC去除MB效果没有随着使用次数的增多而进一步减小,吸附去除率约为37.9%,投加臭氧后约18 min可将MB彻底去除(此时去除速率是单独臭氧氧化的1.7倍),说明催化剂的吸附去除量及臭氧催化氧化去除量达到一个相对稳定状态,即新吸附的MB与臭氧催化氧化降解的MB浓度相等。在多相催化臭氧氧化过程中,催化剂表面的吸附起着至关重要的作用,公认的臭氧催化机理之一为臭氧分子和有机污染物同时被化学吸附到催化剂表面,随后发生催化氧化反应〔20〕。磁性催化剂去除MB可能具有类似的机理,MB和臭氧被吸附于磁性催化剂的表面,覆盖住吸附位点,磁性催化剂表面含有的Fe、Mn、Cu等过渡金属氧化物催化臭氧产生羟基自由基与MB反应,使其彻底降解和矿化,同时释放吸附位点,腾出空间再次吸附新的臭氧和MB,进入下一个催化氧化降解过程,周而复始,往复循环,使磁性催化剂一直保持一定的吸附性能和催化效能。
2.2.4 回收率分析
当磁性催化剂负载到PAC上,会导致饱和磁化强度降低〔21〕,相应的回收磁场强度也会变大。本实验采用超导磁分离装置考察不同磁场强度下Y0.3Fe2.7O4/PAC的回收率,实验投加磁性催化剂质量浓度为1.0 g/L,强机械搅拌约60 min,检测混合溶液经过磁分离装置前后的全铁浓度,结果见图13。
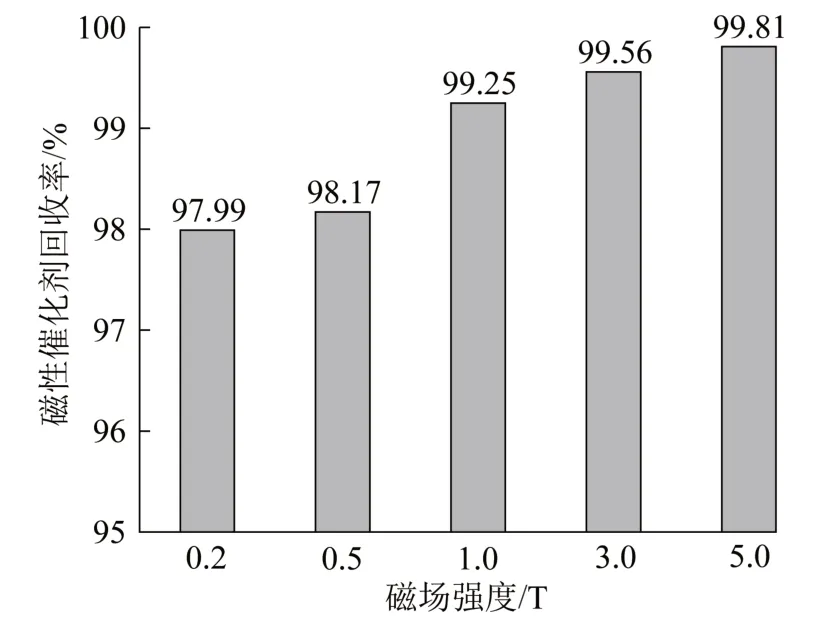
图13 不同磁场强度下的磁性催化剂回收率Fig. 13 Recovery of magnetic catalyst under different magnetic field intensity
由图13可知,当磁场强度大于0.2 T时,磁性催化剂回收率基本大于98%,并随着磁场强度的增大而升高;再由2.2.3节中图11可知,Y0.3Fe2.7O4/PAC催化反应后溶液中溶解性铁几乎未检出(铁检出限为0.3 mg/L),说明水中尚有部分小颗粒固体磁性催化剂不能被磁场回收。刘荣芝等〔22〕为该结论提出了合理的解释,磁性物粒径越小,越不易磁化,也不易被磁回收,新制备的Y0.3Fe2.7O4/PAC颗粒较小,部分粒径甚至达到微纳米级,回收难度相对较大。目前,在实际水处理工程应用的超磁分离设备磁鼓表面磁场强度均大于0.2 T,磁种回收率均大于95%〔23〕,磁性催化剂98%的回收率可基本达到要求,但要在水处理中达到99%以上的回收率〔24〕,则需磁场强度达到1.0 T以上,而超磁分离设备很难实现(最高磁场强度可达0.8 T),超导磁分离为其提供了可能(磁场强度超过5.0 T)〔25〕。
3 结论与展望
1)采用多金属共浸渍法结合共沉淀法制备的新型磁性催化剂(YxFe3-xO4/PAC)具有微小颗粒状、质量轻、负载过渡金属元素均匀、比表面积大(624.33 m2/g)、介孔结构(平均孔径为3.20 nm)、富含表面羟基基团以及超顺磁性(饱和磁化强度为13.26 emu/g)易于磁回收等特点,可应用于流化床催化氧化反应器。
2)吸附、催化氧化实验结果显示,当x=0.3时,磁性催化剂(Y0.3Fe2.7O4/PAC)具有最佳的吸附、催化降解MB性能,且稳定性和重复使用性能好;实验过程中仅有少量铁离子溢出,未见其他过渡金属元素流失;当Y0.3Fe2.7O4/PAC重复使用5次后,其对MB的吸附去除率稳定在37.9%,催化氧化去除速率约是单独臭氧氧化的1.7倍。
3)磁性催化剂粒径是影响回收率的重要因素,微纳米级磁性催化剂颗粒限制了回收率的提升。当磁场强度要求大于0.2 T时,磁性催化剂回收率可达98%,可通过超磁分离设备实现Y0.3Fe2.7O4/PAC的回收,但当回收率要求达到99%以上时,则需较大的磁场强度,超导磁分离设备则为其提供了可能。
4)流化床臭氧催化氧化结合磁分离工艺吸附、催化氧化降解有机污染物效率高,相应设备结构简单、应用成熟,可应用于工业废水、市政污水的深度处理及提标改造项目。同时,考虑到其强吸附、催化氧化性,下一步可考察其对水中微污染物、病毒等的去除效果及在应急污水处理项目中的应用。
