金属有机框架掺杂氧化石墨烯对水中锑的吸附研究
2023-09-25杨秀贞成双婵张浩麟周斌侯保林
杨秀贞,成双婵,张浩麟,周斌,侯保林
(湖南科技大学土木工程学院,湖南湘潭 411201)
中国是世界上锑储量最大、产量最大的国家,2018年锑产量达到8.96万t,占全球产量的60.95%〔1〕。锑被用于生产半导体、真空管和红外探测器,锑化合物可用于制造再生纤维、刹车片等〔2〕。由于其广泛的应用导致的锑污染问题也不容小觑。在一些锑矿矿区,发现地表水中Sb的质量浓度为4.58~29.4 mg/L,在一些严重污染的水体中,Sb的质量浓度甚至达到100~7000 mg/L〔3〕。长期接触高浓度锑(主要是通过饮用水污染)将导致严重的健康问题,包括皮肤病、神经系统疾病、心肌炎和癌症等〔4〕。一般情况下,未污染水体中要求Sb的质量浓度低于0.001 mg/L,欧洲联盟理事会(CEC)和美国环境保护局(USEPA)确定了Sb在饮用水中的最高允许质量浓度分别为6、10 mg/L〔5〕。而中国的标准更高,将饮用水中Sb的阈值定为5 mg/L〔6〕。
目前去除锑的方法主要有吸附法〔7〕、膜技术〔8〕、混凝法〔9〕、微生物法〔10〕、正向渗透法〔11〕。然而,这些技术具有一定的约束条件,如操作时间过长、初始安装成本高、能耗高等。其中吸附法由于具有效率高、成本低、吸附剂可重复使用等优点被广泛应用〔12〕。
氧化石墨烯(GO)是一种二维纳米材料,是通过对天然石墨的化学氧化制备而成的,具有大比表面积、丰富的活性位点和离域π电子系统〔13〕。与原始石墨不同,GO携带羟基、羧基和环氧官能团〔14〕使其具有高度亲水性和在水中良好的分散性,被广泛应用,如作为汞(Ⅲ)和放射性核素铀〔15〕等重金属的吸附剂。
MOFs作为一种多孔材料,具有可调节的孔隙结构和丰富的官能团,对Cd2+、Cr3+、Pb2+和Hg2+等金属离子的去除率可达99%〔16〕。MIL-53是MIL(Materials institute lavoisier)系列中典型的MOF材料,是金属盐MO4(OH)2(M=Al3+、Cr3+、Fe3+)与有机对苯二甲酸根配体自组装而成的三维骨架材料,具有斜方孔结构。在可能的MIL-53配方中,MIL-53(Fe)具有结构稳定性好、存在不饱和的配位金属位等优点〔17〕。GO掺杂入MOFs,可以作为金属有机骨架晶体生长的结构导向模板,为MOF提供了新的化学性能,然而,目前关于GO掺杂其他材料的报道较少〔18〕。
本实验成功将GO掺杂入MIL-53(Fe)中,探究不同质量分数的GO掺杂对晶体结构的影响,对复合材料的形貌、理化性质等进行了综合分析。考察了共存离子对吸附性能的影响,同时,利用吸附动力学模型及吸附等温线模型进行了吸附性能分析,并对吸附剂的可重复使用性、稳定性进行了探讨分析,为GO掺杂入MOFs在吸附方面的应用提供进一步的帮助。
1 实验部分
1.1 试剂与仪器
主要原料及试剂:对苯二甲酸(C8H6O4)、六水三氯化铁(FeCl3·6H2O)、N,N-二甲基甲酰胺〔HCON(CH3)2〕,国药集团;GO,南京吉仓纳米有限公司;无水乙醇,湖南汇虹试剂有限公司;焦锑酸钾(K2H2Sb2O7·4H2O),阿拉丁试剂公司;氯化钠(NaCl)、硫酸钠(Na2SO4)、碳酸钠(Na2CO4)、乙二胺四乙酸(EDTA)、氢氧化钠(NaOH),西陇科学股份有限公司;浓盐酸(HCl),昆山金城试剂有限公司;锑标准溶液(1000 µg/mL),北京有色金属研究总院。
主要仪器:AA-7002A型火焰原子吸收光谱仪,北京三雄科技公司;JSM-6610LV型电镜扫描仪,日本电子株式会社;D8-Advance型X-射线衍射图谱,德国布鲁克公司;EscaLab 250Xi型X-射线光电子能谱,美国赛默飞世尔公司;Brucker Tensor Ⅱ FTIR型傅里叶红外光谱,美国赛默飞世尔公司;TriStar RⅡ3020型孔径和比表面积分析,美国麦克仪器公司。
1.2 材料的制备
首先,借助超声振荡120 min,使不同质量分数的GO均匀分散到10 mL DMF中。然后在室温下搅拌FeCl3·6H2O(0.724 g)、H2BDC(0.445 g)和60 mL DMF的混合物,溶液澄清后,将分散均匀的GO添加到上述溶液中再连续搅拌1 h。混合物置于铁氟龙衬管中,密封在高压釜中进行溶剂热处理,在真空150 ℃下反应24 h。将高压釜冷却至室温,用DMF和无水乙醇反复洗涤并离心得到所制备材料。最后,将所得样品在80 ℃下真空干燥,得到复合材料。
1.3 吸附实验
1)共存离子影响。在初步单因素实验的基础上,经过响应面实验,测得吸附Sb(Ⅴ)的最适吸附条件。在最适吸附条件下,分别添加50、150、300、500 mg/L 4种不同质量浓度无机离子(Na+、Cl-、CO32-、SO42-)在20 mg/L的Sb(Ⅴ)溶液中,配制50 mL初始质量浓度为20 mg/L的Sb(Ⅴ)和Pb(Ⅱ)、Sb(Ⅴ)和Mn(Ⅱ)混合溶液〔以Sb(Ⅴ)计〕,探究无机离子共存影响。
2)吸附再生实验。在响应面实验得出的最优条件下,吸附饱和后沉淀10 min,倒去上清液,将吸附剂真空干燥后,分别加入50 mL 0.1 mol/L的4种解析液(纯水、乙二胺四乙酸、盐酸、氢氧化钠),置于超声振荡器中超声2.7 h进行解吸。选出最适解析液后,4个不同浓度(0.01、0.05、0.1、0.2 mol/L)的解析液在最佳吸附条件下进行多次解吸-吸附实验,探究最适浓度。在相同的条件下进行上述吸附再生实验,重复4次,计算出每次对应的去除率。
1.4 模型拟合
采用准一级动力学方程和准二级动力学方程对吸附过程进行动力学模型拟合。
采用Langmuir模型和Freundlich模型进行吸附等温线拟合。
2 结果与讨论
2.1 材料性质
2.1.1 SEM
MIL-53(Fe)和2%GO@MIL-53(Fe)的形貌特征见图1。

图1 MIL-53(Fe)和2%GO@MIL-53(Fe)的SEMFig.1 SEM images of MIL-53(Fe) and 2%GO@MIL-53(Fe)
由图1可知,MIL-53(Fe)的大小相对均匀、表面较光滑,形状为两端尖中间宽的八面体棱形结构〔19〕;由2%GO@MIL-53(Fe)的形貌特征可以看出复合材料的形状不再是棱角分明的八面体,但仍保持了MIL-53(Fe)的多面体结构,呈多块状黏结,其形态更加无序、不规则。两种材料形状均易于区分,结晶性较好。对比可知GO已经成功与MOFs晶体复合,因此导致材料形貌发生变化。
2.1.2 XRD
采用XRD技术对GO、MIL-53(Fe)、n%GO@MIL-53(Fe)(n%为不同质量分数的GO)的结构进行分析,结果见图2。

图2 GO、MIL-53(Fe)和n%GO@MIL-53(Fe)的XRDFig. 2 XRD patterns of GO,MIL-53(Fe) and n%GO@MIL-53(Fe)
由图2可知,MIL-53(Fe)和2%GO@MIL-53(Fe)在2θ=8.8°处均出现衍射峰,但后者的峰强度被增强。n%GO@MIL-53(Fe)的衍射峰与MIL-53(Fe)相比有一定的偏差,可能是由于GO分散在MIL-53(Fe)表面,使MIL-53(Fe)的结晶度发生了变化〔20〕;在2θ=18.9°附近,相对于MIL-53(Fe)的峰强度,2%GO@MIL-53(Fe)衍射峰更加密集,在2θ=10.3°处出现了GO的典型特征峰〔21〕。在2θ=8.8°处,随着GO质量分数由0.5%增加到2%,衍射峰强度也逐渐增加,但GO质量分数继续增加到10%,衍射峰强度逐渐减小,这可能是因为随着GO质量分数的增加,GO会分散在MIL-53(Fe)的表面。另外,在2θ=35.59°处存在少量的α-Fe2O3〔22〕。结果表明复合材料主要以MOFs晶体为主体,且添加GO并不会改变MIL-53(Fe)的晶体结构。
2.1.3 N2吸附-脱附
MIL-53(Fe)和2%GO@MIL-53(Fe)的N2吸附-脱附等温线和孔径分布曲线见图3。
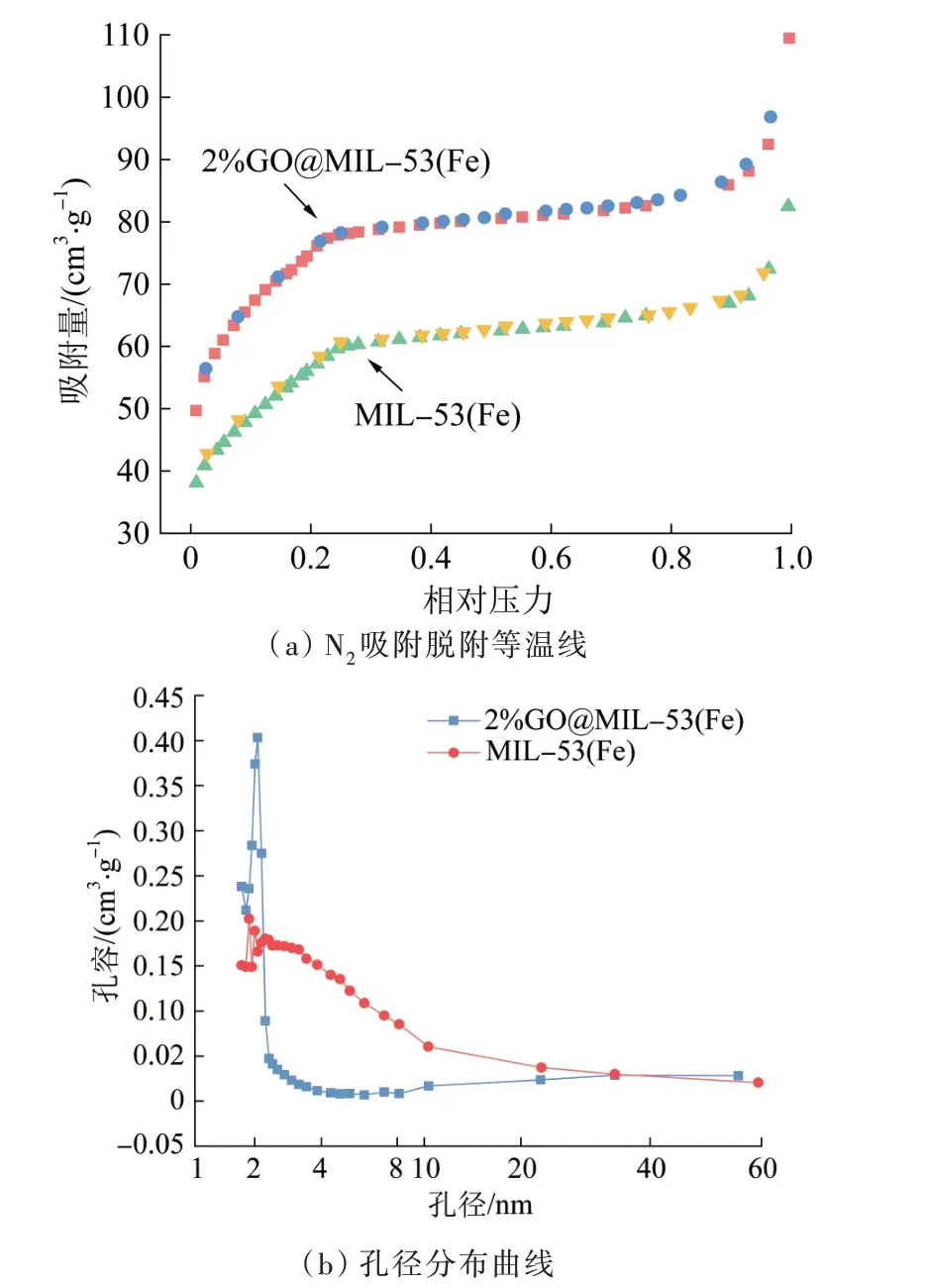
图3 MIL-53(Fe)、2%GO@MIL-53(Fe)的N2吸附脱附等温线及孔径分布曲线Fig.3 N2 adsorption-desorption isotherms and pore size distributions of MIL-53(Fe) and 2%GO@MIL-53(Fe)
由图3(a)可知,图形特征明显,符合介孔材料的S型的Ⅱ型等温线;由图3(b)可知,2%GO@MIL-53(Fe)样品的孔径均匀、狭窄地分布于1.72~2.34 nm之间。
2%GO@MIL-53(Fe)和MIL-53(Fe)的物理性质见表1。

表1 2%GO@MIL-53(Fe)和MIL-53(Fe)的物理性质Table 1 Physical properties of 2%GO@MIL-53(Fe) and MIL-53(Fe)
由表1可知,N2等温线测得2%GO@MIL-53(Fe)的比表面积为268.43 m2/g,远大于MIL-53(Fe)的174.41 m2/g,提高了53.91%。MIL-53(Fe)和2%GO@MIL-53(Fe)的微孔体积分别为0.05、0.12 cm3/g,吸附剂中的微孔具有吸附作用,微孔体积越大,吸附效果越好。2%GO@MIL-53(Fe)孔体积(P/P0=0.996)为0.18 cm3/g,MIL-53(Fe)孔体积(P/P0=0.994)为0.11 cm3/g,表明该材料具有高度均匀的孔结构〔23〕。
2.1.4 FT-IR
为分析材料的官能团结构,进行红外光谱表征,结果见图4。

图4 MIL-53(Fe)、2%GO@MIL-53(Fe)和吸附后2%GO@MIL-53(Fe)的FT-IRFig. 4 FT-IR spectra of MIL-53(Fe),2%GO@MIL-53(Fe)and 2%GO@MIL-53(Fe) samples after adsorption
由图4可知,MIL-53(Fe)的特征峰分别出现在3229、1654、1592、1383、747、545 cm-1处,3229 cm-1处为C—H、—OH的拉伸振动峰,1654 cm-1处为C= = O吸收峰,1592、1383 cm-1处为来自对苯二甲酸中—COO-的对称与不对称伸缩振动峰〔24〕,747 cm-1处为有机配体苯环中C—H的弯曲振动峰〔25〕,545 cm-1处为拉伸引起的Fe—O振动峰〔26-27〕,为对苯二甲酸羧基与Fe(Ⅲ)之间形成的金属氧化物键。2%GO@MIL-53(Fe)的红外光谱中出现了1099 cm-1的特征峰,为GO独特的C—O—C伸缩振动〔28〕,从而证实了GO的成功掺入,其余特征峰相同。
在Sb吸附后,吸附剂的红外光谱特征峰发生了明显的变化,在3384 cm-1处C—H、—O—H的拉伸强度基本已经消失,且发生大范围的红移,仅在2993 cm-1处观察到微弱的峰值,整个区域范围已经变得非常平滑,可能是羟基中O原子提供的孤对电子进入Sb的空轨道形成锑配合物〔29〕。1650、1600 cm-1处的峰值在吸附Sb(Ⅴ)后分别出现了蓝移(+38 cm-1)和红移(-23 cm-1),1382 cm-1处的峰值在吸附后发生微小的蓝移,但峰强度明显减弱,说明C= = O、—COO-可能与Sb发生了化学反应,参与了吸附过程;547 cm-1处的Fe—O振动峰,Sb吸附发生后,其附近振动峰值明显增多,吸附Sb(Ⅴ)后蓝移至553 cm-1,也从侧面证实Fe—O基团中带晶格氧通过共享电子对形成Fe—O—Sb配位键〔30〕。
2.1.5 XPS
对2%GO@MIL-53(Fe)吸附锑前后进行了XPS分析,结果见图5。
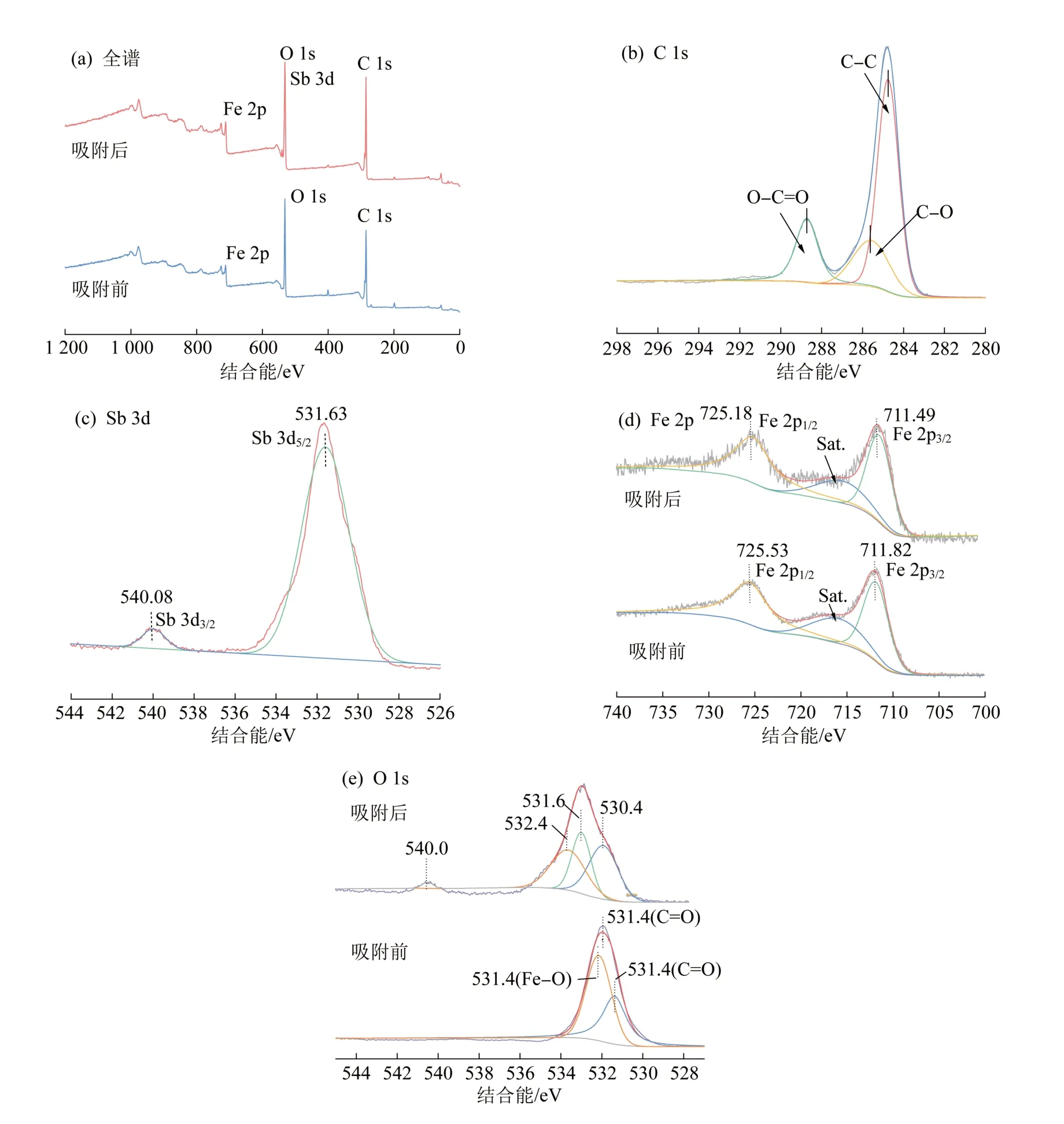
图5 2%GO@MIL-53(Fe)吸附Sb(Ⅴ)前后的XPSFig.5 XPS spectra of 2%GO@MIL-53(Fe) adsorbent before after Sb(Ⅴ) adsorption
由图5(a)可知,2%GO@MIL-53(Fe)中存在C、O、Fe的光谱,在发生吸附反应后O 1s处出现了Sb的特征光谱,且峰强度明显被加强,表明Sb(Ⅴ)已经被复合材料成功吸附;由图5(b)可知,C 1s光谱可以分峰出3个卷积峰:GO的碳原子键C—C(284.7 eV)〔31〕、碳的有机连接剂C—O(285.6 eV)和O—C= = O(288.7 eV)〔32〕;由图5(c)可知,在吸附Sb(Ⅴ)后,Sb 3d出现2个峰,分别以531.59 eV和539.98 eV为中心,531.59 eV属于Sb 3d5/2,539.98 eV属于Sb 3d3/2;由图5(d)可知,位于711.82 eV和725.53 eV的两个峰分别归属于Fe 2p3/2和Fe 2p1/2〔33〕,两个峰峰距为13.71 eV,与α-Fe2O3非常相似〔20〕。作为以阴离子形态存在的Sb,能够给出一对电子(路易斯碱),与Fe3+(路易斯酸)发生强烈相互作用〔34〕。在吸附Sb(Ⅴ)的过程中,Fe 2p1/2处结合能峰为725.53~725.18 eV,Fe 2p3/2处结合能峰为711.82~711.49 eV。结果表明在吸附锑过程中Fe3+、α-Fe2O3与Sb存在相互作用;由图5(e)可知,531.4 eV为羧酸基团中的C= = O键,531.9、532.2 eV分别对应C—O键和Fe—O键中的氧原子〔35〕。在吸附Sb后,O 1s峰出现了Sb的分峰,证实Sb被吸附剂成功吸附。在Sb(Ⅴ)被吸附后,Fe—O结合能峰移动至532.4 eV,C—O结合峰为531.9~531.6 eV,C= = O结合能峰为531.4~530.4 eV,从吸附后的分峰图中看出,结合峰的面积相对发生大幅变动,可见Fe—O、C—O、C= = O官能团参与了吸附过程,在吸附Sb(Ⅴ)中起了更重要的作用。
2.2 吸附性能
2.2.1 响应面实验
响应面实验设计及结果见表2。

表2 Sb(V)BBD实验设计与结果Table 2 Sb(V)BBD experimental design and results
根据软件得到去除率与影响因子之间的多项式函数表达式见式(1)。
式中:Y为Sb(Ⅴ)的吸附去除率的响应函数值、A表示吸附时间、B表示吸附剂投加量、C表示pH、D表示温度、E表示Sb(Ⅴ)初始质量浓度。
根据实验数据,得到去除Sb(Ⅴ)的最优吸附条件:Sb(Ⅴ)初始质量浓度为23.22 mg/L、吸附时间为2.7 h、吸附剂投加量为27.22 mg、反应温度为34.63 ℃、pH=4.13,预测去除率为99.11%。在最佳条件下进行吸附实验,得到对Sb(Ⅴ)的去除率为98.92%,与预测结果相比误差仅有0.19%,结果表明,预测的吸附条件能够作为实际吸附实验的最佳条件。
ANOVA方差分析见表3。
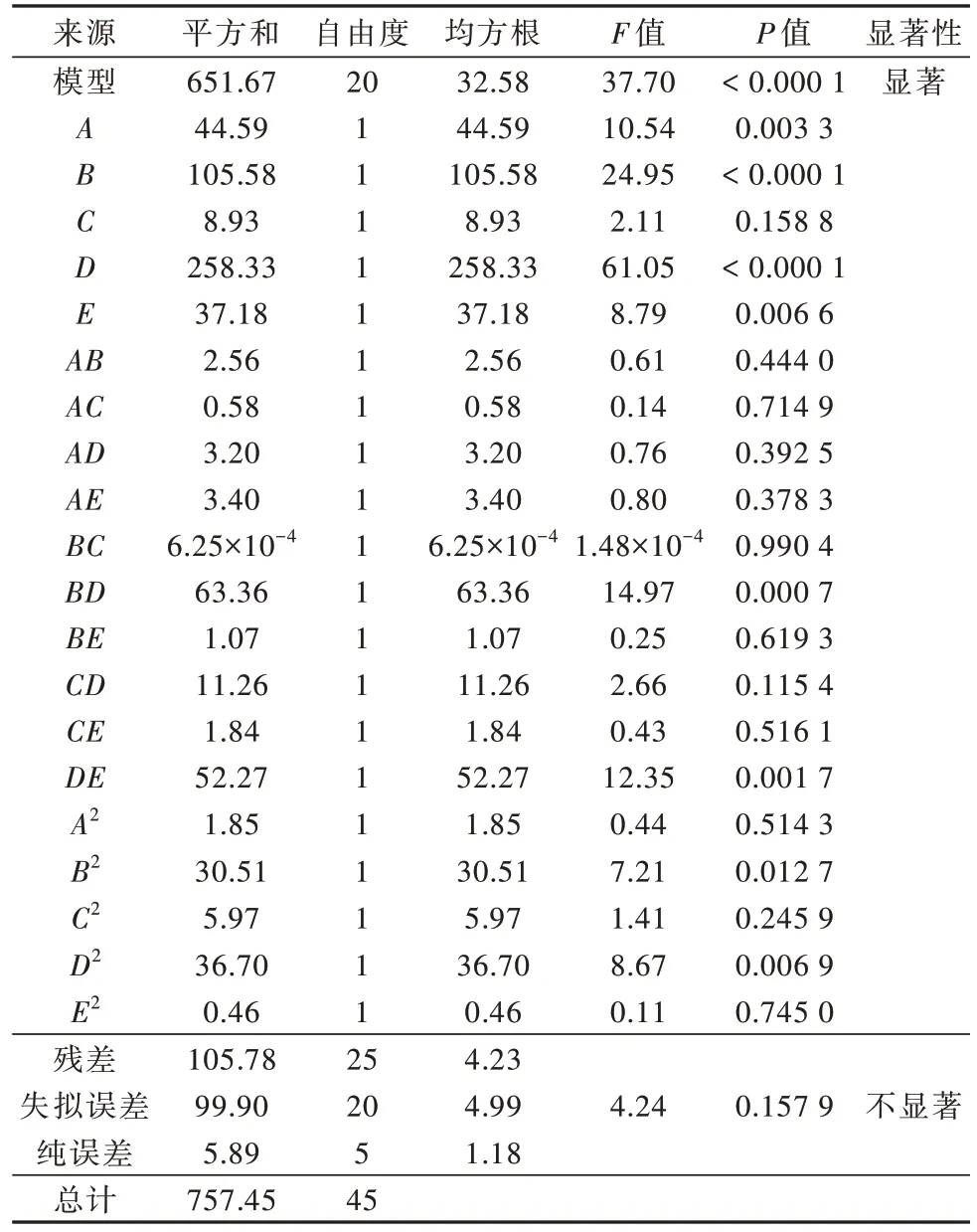
表3 ANOVA方差分析Table 3 ANOVA analysis of variance
由表3可知,模型的F值和P值分别为37.70和<0.0001,模型失拟误差P=0.1579>0.05。模型回归系数R2=0.963,模型预测Rpred2=0.968,调整后的Radj2=0.941,二者有较低的标准差值(0.0187<0.2);变异系数(CV)=0.0217<0.1,模型精密度=13.179>4,表明模型可以重现,数据较理想,可用于设计对Sb(Ⅴ)的吸附。根据不同影响因素的P值可知,投加量、温度对吸附Sb(Ⅴ)的效率有高度显著影响,而吸附时间、Sb(Ⅴ)初始浓度的影响较小,因为Sb(Ⅴ)在pH为2.7~11的范围内以Sb(OH)6-的形态存在〔36〕,对吸附过程几乎没影响;平方项中,投加量和温度对Sb(Ⅴ)的去除率显著影响;其他P值均大于0.05,表明对Sb(Ⅴ)去除效果的影响不显著。
2%GO@MIL-53(Fe)吸附Sb(Ⅴ)过程中两个因素之间具有显著关系的3D曲面及2D等高线图见图6。

图6 影响因子等高线与曲面图Fig.6 Contour and surface map of influencing factors
由图6(a)可知,当其他因素一定,吸附温度确定时,吸附剂投加量由20 mg增加到40 mg时,Sb(Ⅴ)的去除率由84.94%上升至95.36%,由于吸附剂投加量的增加,吸附剂表面具有较多的吸附空位,能够容纳Sb的活性位点增加,吸附率增加,因此提高了对Sb(Ⅴ)去除率。投加量确定时,当温度由25 ℃增加到45 ℃,加速吸附剂表面官能团的电离使吸附点位得到释放,同时使溶液布朗运动增强,使Sb(Ⅴ)对吸附剂的扩散阻力降低,Sb(Ⅴ)的去除率由83.25%增加至94.58%,Sb(Ⅴ)去除率上升,推测2%GO@MIL-53(Fe)吸附Sb(Ⅴ)的过程属于吸热反应;由图6(b)可知,当其他因素一定,吸附温度确定时,当Sb(Ⅴ)初始质量浓度由10 mg/L增加到30 mg/L,大多数吸附剂的活性部位都处于饱和状态,Sb(Ⅴ)的去除率由95.82%下降至90.09%,其下降幅度仅有5%左右,可见吸附剂表面有限的活性位点对于Sb(Ⅴ)的去除也是足够的。
2.2.2 共存离子影响
考察共存无机离子对2%GO@MIL-53(Fe)吸附Sb(Ⅴ)的影响,结果见图7。

图7 共存无机离子对2%GO@MIL-53(Fe)吸附Sb(Ⅴ)的影响Fig.7 Effects of different ion concentrations on Sb(Ⅴ) removal efficiency
由图7可知,CO32-会抑制复合材料对Sb(Ⅴ)的吸附,且浓度越大,抑制越显著,而Na+、SO42-、Cl-则不影响。当CO32-增大到500 mg/L时,2%GO@MIL-53(Fe)对Sb(Ⅴ)的去除率下降到40%。在中性环境下CO32-会与以Sb(OH)6-形态存在的Sb(Ⅴ)形成紧密的内层络合物〔34〕,CO32-也会与Sb(Ⅴ)竞争,优先占据吸附剂的吸附点位,导致对Sb(Ⅴ)的去除效果降低。在有Pb(Ⅱ)和Mn(Ⅱ)干扰的条件下,随着吸附时间的增加,复合材料对Sb(Ⅴ)的吸附效果明显降低,其降幅均在10%左右,可见,Pb2+和Mn2+的存在对复合材料吸附Sb(Ⅴ)的效果影响较大,可能原因是金属阳离子与阴离子状态的Sb(Ⅴ)相结合,导致吸附剂无法充分吸附Sb(Ⅴ),去除效果降低。
2.2.3 吸附剂的再生
将被吸附剂吸附的锑解析出来,然后测Sb质量浓度,计算解析率,测得4种解析液的回收率见表4。

表4 不同解析液对应的Sb(Ⅴ)回收率Table 4 Analytical effect of different analytical solutions on Sb(Ⅴ)
由表4可知,吸附剂回收率EDTA>NaOH>HCl>H2O,因此选择EDTA作为解析液探究对吸附剂的回收效果。
考察EDTA浓度及循环次数对Sb(Ⅴ)去除率的影响,结果见图8。
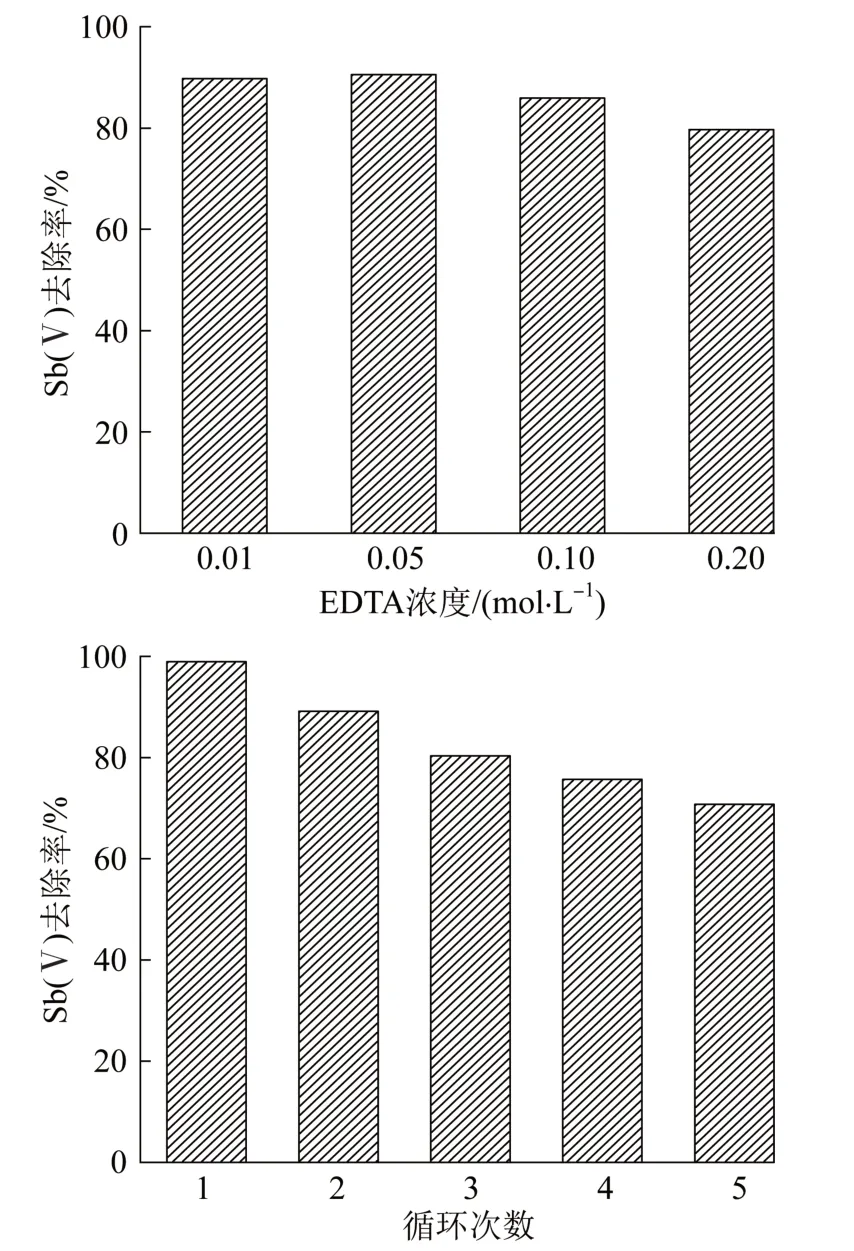
图8 EDTA浓度及循环次数对Sb(Ⅴ)去除率的影响Fig.8 Effects of EDTA concentration and cycles on Sb(Ⅴ) removal rate
由图8可知,低浓度的EDTA对其解析效果最好,随着EDTA浓度的增加,2%GO@MIL-53(Fe)复合材料的再生率逐渐降低,这是由于EDTA的浓度太高,会影响到材料的结构,导致解析率下降。当EDTA浓度为0.05 mol/L时,解析效果最好,解析率高达92.35%,在经过4次解析-吸附后,复合材料对Sb(Ⅴ)溶液的去除率为70.78%,相比第一次使用吸附率有所下降,但其去除率仍然在70%以上,显示出其优良的可回收利用性。
2.2.4 吸附等温线
为了进一步解释Sb(Ⅴ)与吸附剂的相互作用,分析吸附等温线具有重要意义。笔者研究了Sb(Ⅴ)初始质量浓度为0~55 mg/L,温度分别为298、308、318 K时的吸附等温线。实验数据进一步采用Langmuir和Freundlich模型进行拟合,结果见图9,吸附参数见表5。不同铁基吸附剂对锑的吸附效果见表6。
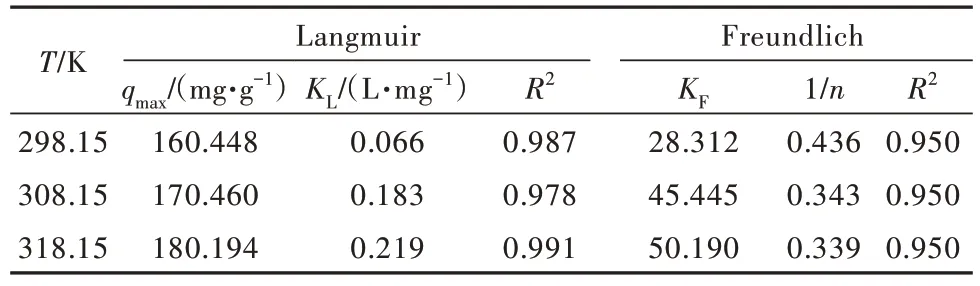
表5 吸附等温模型拟合参数Table 5 Isothermal fitting model parameter values

表6 不同铁基吸附剂对锑的吸附效果Table 6 Adsorption effect of different Fe-based adsorbents on Sb

图9 吸附等温模型拟合曲线Fig.9 Fitting curves of adsorption isotherm model
由图9、表5、表6可知,Langmuir模型更适合Sb(Ⅴ)吸附过程,推测2%GO@MIL-53(Fe)吸附Sb(Ⅴ)属于单层吸附和化学吸附〔37〕。这也表明2%GO@MIL-53(Fe)吸附Sb(Ⅴ)的速度较快,究其原因是2%GO@MIL-53(Fe)吸附Sb(Ⅴ)属于单分子层吸附,各个吸附位点单独作用,互不影响〔38〕。2%GO@MIL-53(Fe)在298、308、318 K温度下吸附Sb(Ⅴ)的qmax分别为160.448、170.460、180.194 mg/g,这是由于温度升高,利于吸附剂所含官能团电离,使之拥有更多的吸附位,导致材料对锑的吸附容量增大。与其他Fe基类吸附材料比较该吸附材料对Sb的吸附容量更大(表6)。
2.2.5 吸附动力学
本研究采用准一级、准二级动力学模型和颗粒内扩散模型对2%GO@MIL-53(Fe)复合材料的吸附过程进行拟合,确定2%GO@MIL-53(Fe)吸附Sb速率的影响因素,推测吸附过程机理。吸附Sb(Ⅴ)过程的动力学拟合结果见图10。
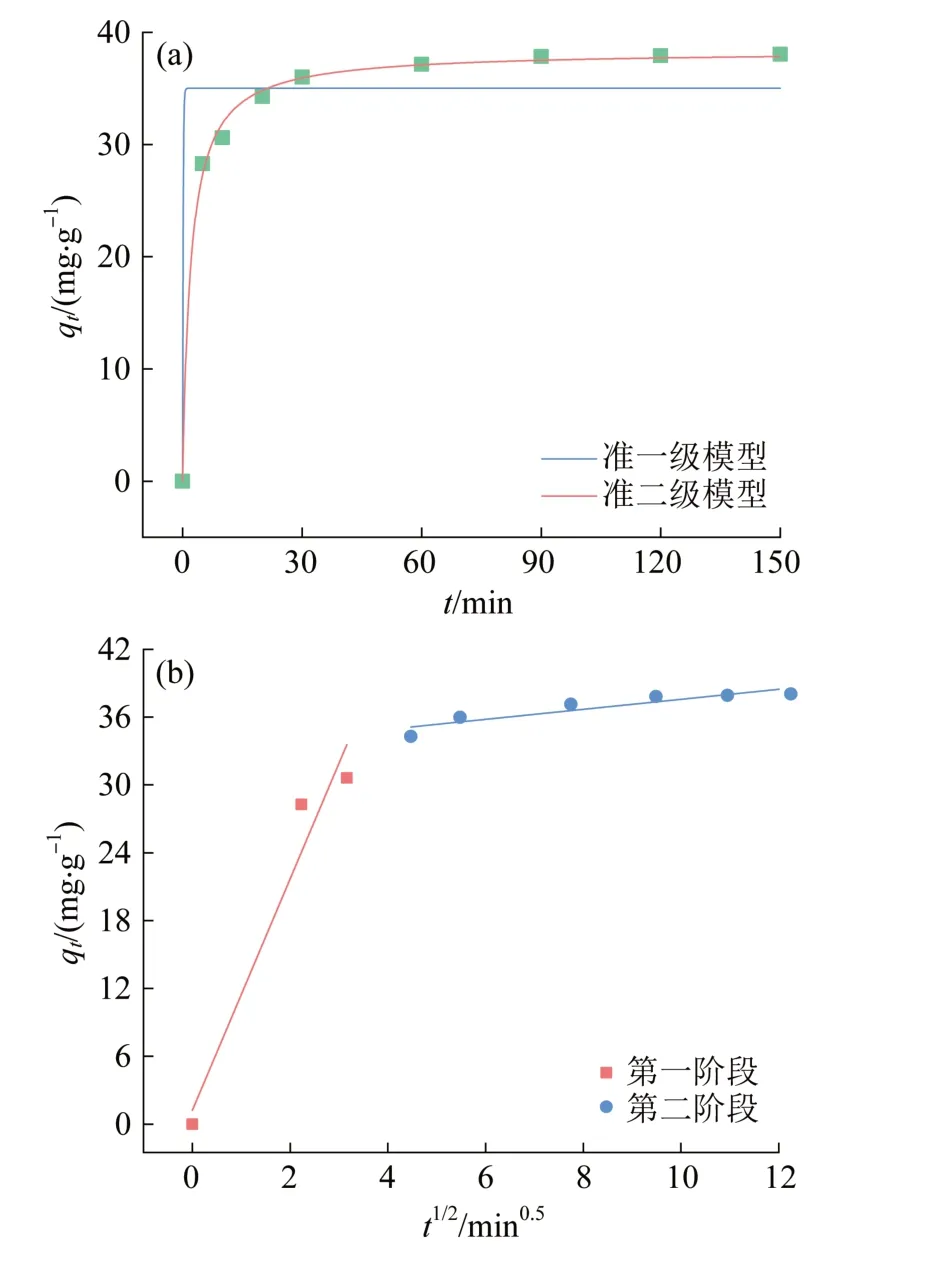
图10 吸附动力学过程拟合曲线Fig.10 Fitting curves of adsorption kinetic model
由图10(a)可知,准二级模型的R2(0.997)优于准一级模型的R2(0.907),因此用准二级模型去分析2%GO@MIL-53(Fe)吸附Sb(Ⅴ)的过程更有优势,表明吸附过程为化学吸附〔37〕。
在吸附锑的过程中,吸附速率不仅受锑浓度的限制,而且也跟吸附剂的表面性质密切相关,为了研究吸附剂的扩散效应以及吸附的迁移过程,采用吸附扩散模型去分析速率扩散步骤,由图10(b)可知,2%GO@MIL-53(Fe)吸附Sb(Ⅴ)过程存在两个阶段:1)外部转移,重金属锑从溶液边界膜到达2%GO@MIL-53(Fe)表面界面;2)颗粒内扩散,重金属穿过材料表面,进一步渗透到颗粒空隙中,二者相互作用直至饱和〔42〕。由图可知,直线未过原点,说明边界层外部液体扩散和颗粒内扩散都影响吸附速率。第一阶段k2=10.227,R2=0.904,第二阶段k2=0.443,R2=0.841,可以看出在吸附过程开始时外部扩散的吸附速率是最快的。因此目前的吸附速率主要由孔隙(颗粒内)扩散而不是边界层(外部)扩散控制。
2.2.6 吸附机理
通过对复合材料吸附Sb(Ⅴ)过程的动力学和吸附等温线拟合以及吸附前后的表征分析可知,材料所含的不同官能团参与了吸附过程,可见2%GO@MIL-53(Fe)吸附Sb(Ⅴ)是多种化学反应共同作用的结果。pH为2.7~11时,Sb(Ⅴ)以Sb(OH)6-〔43〕的形式存在,在吸附过程中发生络合反应分别生成Fe—O-H2SbO3和Fe—O-Sb(OH)6。复合材料含有多种官能团参与吸附过程(C= = O、—OH、Fe—O)〔44〕,—OH能够提供孤对电子与Sb(Ⅴ)形成配合物,含氧官能团质子化/去质子化的相互作用也可能有利于Sb(Ⅴ)的吸附〔45〕。吸附剂中α-Fe2O3与Sb(Ⅴ)发生氧化反应也会生成Fe-SbO3氧化物,从而使得Sb(Ⅴ)被吸附去除。此外,通过氧化还原反应生成的Sb(Ⅴ)和Fe(Ⅱ)可以从2%GO@MIL-53(Fe)表面溶解到水溶液中,直接生成Fe—O—Sb(Ⅴ)配合物负载在吸附剂的表面上。因此,2%GO@MIL-53(Fe)吸附Sb(Ⅴ)主要以表面吸附、络合、氧化等多种化学作用共同参与。
3 结论
将GO掺杂入MIL-53(Fe)得到复合材料2%GO@MIL-53(Fe),考察了其对水中锑的吸附性能。GO的掺杂为MIL-53(Fe)在不改变结构的基础上,提供了更大的表面积,提高了吸附能力。制备的2%GO@MIL-53(Fe)吸附Sb(Ⅴ)符合Langmuir吸附等温模型,吸附过程为化学吸附主导的吸热、自发反应。动力学拟合结果表明其对Sb(Ⅴ)吸附符合准二级模型,且吸附分为外部转移和颗粒内扩散两个阶段;吸附过程存在配位、络合、氧化等多种化学反应以及物理吸附。综上所述所制备的吸附剂在高效、快速去除废水中重金属离子方面显示出巨大的应用潜力。
