超微血管成像和DWI 对卵巢癌Ki-67 表达的评估
2023-09-22闫磊,陈兰
闫 磊,陈 兰
1.河北中石油中心医院影像科,河北 廊坊 065000;2.河北省廊坊市人民医院超声二科,河北 廊坊065000
在我国,卵巢癌的发病率居女性生殖系统肿瘤的第3 位,且呈逐年上升趋势,卵巢癌5 年生存率仅约30%[1]。抗原Ki-67 是一种反映细胞增殖状态的相关抗原,其功能与细胞的有丝分裂密切有关。Qiu 等[2]分析发现,Ki-67 的高表达与较低的生存率有显著相关性,可作为卵巢癌患者预后的生物标志物之一。DWI 在评估肿瘤的良恶性、分级、分化和分期,以及肿瘤Ki-67 表达方面有重要作用。超微血管成像(superb microvascular imaging,SMI)是一种创新的多普勒超声技术,无需注射对比剂就能显示微血管[3]。多项研究表明,SMI 可无创诊断和评估肿瘤的恶性程度,提高炎性病变的诊断准确率,在体表组织器官、消化系统、肌肉骨骼、妇产科疾病中均有应用[4-12]。但有关SMI 评估卵巢癌的Ki-67 表达情况鲜有报道,故笔者利用SMI 评估卵巢癌的Ki-67 表达情况,以探讨其与DWI 联合是否可为患者带来获益。
1 资料与方法
1.1 一般资料
回顾性分析河北中石油中心医院和河北省廊坊市人民医院2019 年1 月至2022 年10 月经手术病理证实为卵巢癌的74 例患者,年龄32~82 岁,平均(59.68±11.87)岁。纳入标准:①原发性卵巢癌患者,无术前治疗史,临床病理资料完整,术后免疫组化指标包含Ki-67;②无对比剂使用禁忌证,术前均行SMI 和DWI 检查;③呼吸状态较好,图像质量良好。排除标准:①病灶最大径>6 cm;②病理结果不明确者。
1.2 仪器与方法
使用GE Signa HDxt 3.0 T MRI 扫描仪和佳能Aplio 500 彩色超声诊断仪(配备SMI 软件和腔内探头)进行检查。
MRI 扫描序列与参数:①轴位T1WI,TR/TE 5.4 ms/2.5 ms,矩阵256×200,视野380 mm×340 mm,层厚5 mm,层距1.0 mm,扫描时间1 min 18 s;②轴位T2WI,TR/TE 4 000 ms/125,矩阵320×320,视野380 mm×380 mm,层厚5 mm,层距1.0 mm,扫描时间2 min 47 s;③轴位DWI,TR/TE 5 455 ms/82 ms,矩阵128×128,b 值为0、1 500 s/mm2,视野380 mm×320 mm,层厚5 mm,层距1.0 mm,扫描时间2 min 32 s。SMI 参数:彩色壁滤波40~45 Hz,彩色血流速度15~20 cm/s,采样线和血管之间的角度0°~30°,调整彩色增益使小血管恰好被检出。
1.3 图像处理与数据分析
将轴位DWI 图像导入ADW4.5 工作站,由2 位分别具有5、8 年MRI 诊断经验的影像科医师在不知病理结果的前提下分别对图像进行分析。选择病灶实性成分最多的最大层面,注意避开坏死、囊变、出血区,在相邻的3 个层面每层放置ROI,大小约1.0 cm2,测量3 次取平均值。以2 位医师测量的平均值进行数据分析。
由2 位分别具有5、8 年超声工作经验的医师行二维灰阶超声和SMI 检查,观察并记录肿瘤中的较长血管(长度接近或超过肿瘤半径)数量,出现分歧时,经协商达成一致。
1.4 Ki-67 表达的测定
Ki-67 表达定位于肿瘤细胞核内,判定其表达阳性的标准为肿瘤细胞胞浆内出现清晰的棕黄色颗粒,且着色程度高于非特异染色背景。由3 位病理科医师在该标记最强区域(热点区)计数2 000 个肿瘤细胞阳性百分比的平均值。按照相关标准,Ki-67 表达≥50%为高表达组,<50%为低表达组[13-14]。
1.5 统计学分析
使用SPSS 22.0、Medcalc(v20.0.3)软件进行数据分析。正态性检验利用S-W 检验,符合正态分布者以表示,2 组间比较行独立样本t 检验。2 位医师ADC 值一致性分析利用组内相关系数(intraclass correlation coefficients,ICC),其中ICC<0.40 为一致性较差,0.40≤ICC<0.75 为一致性中等,ICC≥0.75为一致性良好。采用二元logistic 回归分析联合有统计学意义的参数。采用ROC 曲线评估有统计学意义的参数对2 组病灶的鉴别效能,计算AUC,并根据最大约登指数确定阈值及其相应的敏感度、特异度。采用DeLong 检验比较参数的AUC。采用Pearson 相关性分析对有统计学意义的参数值与Ki-67 表达的相关性进行分析(相关系数r 取值-1~1,0≤|r|<0.20 为无相关性或相关性极弱,0.20≤|r|<0.40 为相关性弱,0.40≤|r|<0.60 为相关性中等,0.60≤|r|<0.80 为相关性强,0.80≤|r|≤1 为相关性极强)。以P<0.05 为差异有统计学意义。
2 结果
74 例中,高表达组46 例,低表达组28 例。2 组临床特征差异无统计学意义(P>0.05)(表1)。高表达组的血管数量多于低表达组,ADC 值低于低表达组,差异均有统计学意义(均P<0.05)(表2,图1、2)。2 位医师测量的ADC 值一致性良好(ICC>0.80)。

图1 卵巢癌患者MRI、超微血管成像(SWI)及病理图像 注:患者,女,48 岁。图1a 为T1WI,示左侧附件区肿瘤呈低信号;图1b 为T2WI,病灶呈稍高信号;图1c 为DWI,病灶呈高信号;图1d 为ADC 图,病灶呈低信号,ADC 值0.817×10-3 mm2/s;图1e 为SMI,示右侧附件区肿瘤见4 条较长血管;图1f 为病理图(HE 染色,高倍放大),光镜下见肿瘤细胞内棕褐色深染颗粒,Ki-67 高表达(70%)

图2 卵巢癌患者MRI、超微血管成像(SWI)及病理图像 注:患者,女,56 岁。图2a 为T1WI,示左侧附件区肿瘤呈低信号;图2b 为T2WI,病灶呈稍高信号;图2c 为DWI,病灶呈高信号;图2d 为ADC 图,病灶呈低信号,ADC 值0.956×10-3 mm2/s;图2e 为SMI,示右侧附件区肿瘤见2 条较长血管;图2f 为病理图(HE 染色,高倍放大),光镜下见肿瘤细胞内棕褐色深染颗粒,Ki-67 低表达(30%)

表1 2 组一般资料比较
表2 2 组血管数量及ADC 值比较()
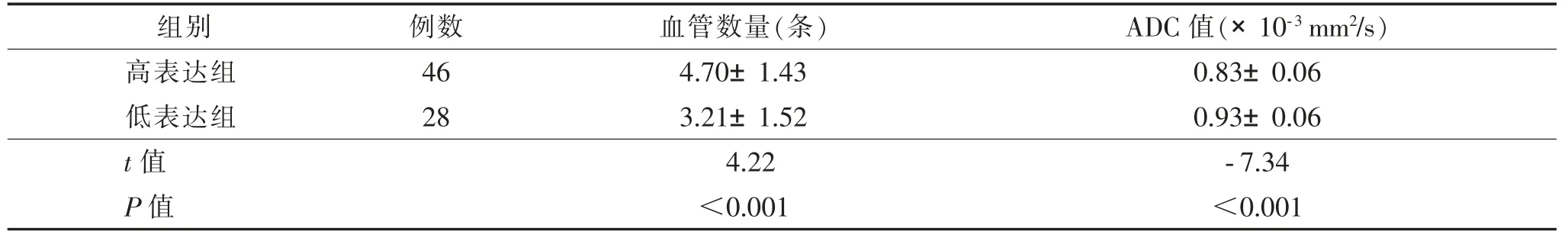
表2 2 组血管数量及ADC 值比较()
各参数鉴别2 组的AUC、阈值、敏感度、特异度结果见表3、图3,其中联合血管数量ADC 值的AUC 达0.913,敏感度高于单一参数。AUC 两两比较,血管数量和ADC 值差异有统计学意义(Z=2.390,P=0.016 7),血管数量联合ADC 值与血管数量的AUC 差异有统计学意义(Z=313.000,P=0.001 8),血管数量联合ADC 值与ADC 值的差异无统计学意义(Z=0.665,P=0.505 9)。Pearson 相关性分析表明,血管数量与ADC 值呈中等负相关(r=-0.524),血管数量与Ki-67呈强正相关(r=0.725),ADC 值与Ki-67 呈强负相关(r=-0.799)。
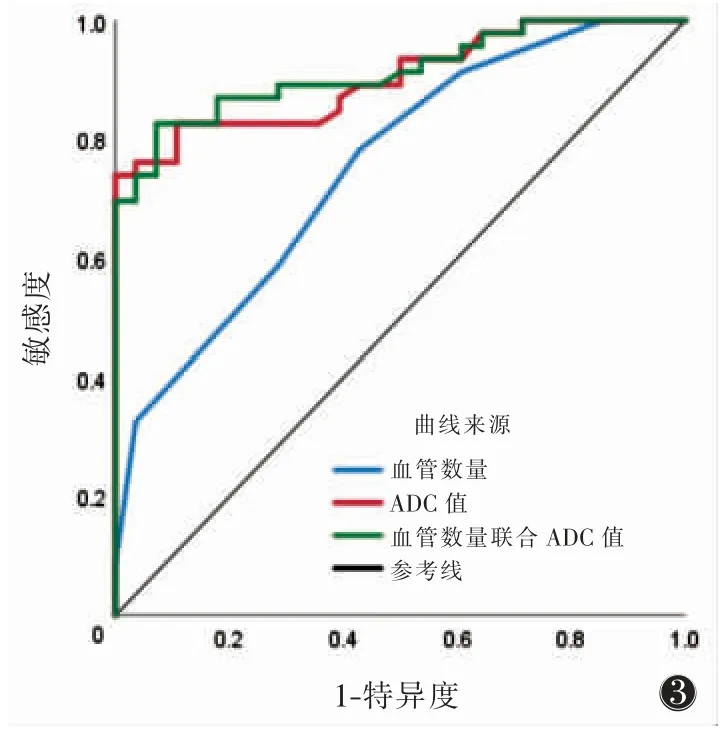
图3 血管数量、ADC 值和血管数量联合ADC 值鉴别Ki-67高表达组卵巢癌的ROC 曲线

表3 各参数鉴别Ki-67 高、低表达组的AUC、阈值、敏感度、特异度
3 讨论
抗原Ki-67 又称单克隆抗体Ki-67 鉴定的抗原,主要存在细胞分裂的G1、S、G2 和M 期,在M 期结束后,很快降解。Ki-67 在G0 期细胞不表达,因此可作为评估细胞增殖状态的指标[15]。目前,Ki-67 已应用到肝癌、胶质瘤、乳腺癌、胃肠间质瘤、软组织肿瘤、肺癌等的诊断中,但其表达情况仅在术后经免疫组化染色分析后获得,如能在术前获得Ki-67 的表达情况,可帮助临床间接判断卵巢癌的细胞增殖情况,为治疗方案的制订提供参考。
本研究发现,DWI 和SMI 均可定量评估卵巢癌Ki-67 的表达情况,随Ki-67 表达的增加,ADC值降低,肿瘤内血管数量增多;且DWI 的效能优于SMI(P<0.05)。原因可能是随着Ki-67 表达的增加,肿瘤细胞的恶性程度增加,供应肿瘤营养的微血管数量也随之增多,因此肿瘤内血管数量相应增多;同时,异型细胞核分裂越多,细胞外间隙减小,导致水分子弥散受限[16],进而引起ADC 值减低。本研究与方梦佳等[17]的结果相同。多项研究证实,SMI 可评估肝脏局灶性病变和乳腺癌Ki-67 的表达情况[18-19],但SMI 的评估效能低于DWI;原因可能是SMI 主要评估微血管的情况,会遗失部分血管,且超声具有较高的个人主观性。DWI 作为较成熟的MRI 功能成像技术,在肿瘤良恶性评估方面具有重要作用。因此,SMI 评估卵巢癌Ki-67 表达情况的效能明显低于DWI。另外,本研究发现,2 种影像技术联合的AUC 较单一技术提高,且能在保证较高特异度的同时,提高敏感度。
本研究中肿瘤内血管数量与ADC 值呈中等负相关(r=-0.524),血管数量与Ki-67 呈强正相关(r=0.725),ADC 值与Ki-67 呈强负相关(r=-0.799)。肿瘤内血管数量、ADC 值和Ki-67 均可作为半定量参数反映肿瘤细胞的恶性程度,因此三者间具有一定的相关性。
综上所述,SMI 作为一种新型的多普勒超声技术,在评估卵巢癌Ki-67 表达情况方面具有较好的临床应用前景。本研究的局限性:①样本量有限,未对卵巢癌的病理分型、分级等作进一步细化研究,需增加样本量进行针对性的细化研究。②ROI 的放置区域未能与免疫组化取材区完全对照,可能会对结果造成一定影响。
综上所述,SMI 和DWI 均可作为评估卵巢癌细胞增殖的无创方法,具有一定临床应用价值。2 种技术联合可提高诊断效能,具有较高的临床应用价值。
