表阿霉素联合白蛋白结合型紫杉醇治疗晚期三阴性乳腺癌对血清肿瘤标志物及血清学指标影响
2023-09-22马善义吴芳芳
董 骏, 马善义, 吴芳芳, 杨 帆, 胡 楠
1.宣城市中心医院 肿瘤科,安徽 宣城 242000;2.连云港市第一人民医院 肿瘤化疗科,江苏 连云港 222000
三阴性乳腺癌(triple negative breast cancer,TNBC)属于乳腺癌的一种特殊亚型,病理检查显示雌孕激素受体及原癌基因为阴性,且与其他类型的乳腺癌比较,TNBC具有非常高的侵袭性、转移性和复发率,确诊时已处于高危期,早期TNBC患者的5年存活率可达到75%~80%,而晚期仅为14%[1-2]。由于TNBC患者雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人体表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)均为阴性,因此,对常见的靶向治疗和内分泌治疗敏感性较低,目前,化疗是治疗TNBC的首选方法。临床上新辅助化疗在术前多采用含紫杉类的药物,如紫杉醇、多柔比星、卡铂等来干扰癌细胞的生长和分裂,以促使肿瘤降期,提高手术根治率。有研究报道,TNBC对紫杉类和蒽环类化疗药物敏感性较高[3]。紫杉类药物以紫杉醇为主,其中,白蛋白结合型紫杉醇(nanoparticle albumin-bound paclitaxel,Nab-P)以纳米微粒蛋白为载体,其疗效确切,且相较于其他紫杉醇药物毒性较轻,并能在抗肿瘤的过程中发挥紫杉醇的最大浓度,取得更好的治疗效果。蒽环类常见药物为表阿霉素,可以通过抑制分裂癌细胞来达到抗肿瘤的效果。本研究旨在探讨表阿霉素联合Nab-P治疗晚期TNBC的疗效,以及治疗后对患者血清肿瘤标志物、血清学指标[血管内皮生长因子(vascular endothelial growth factor,VEGF)、缺氧诱导因子(hypoxia-inducible factor-1α,HIF-1α)]的影响。现报道如下。
1 资料与方法
1.1 一般资料 选取自2019年5月至2022年5月宣城市中心医院收治在院的78例晚期TNBC患者为研究对象。采用随机数字表法将患者分为常规组与观察组,每组各39例。纳入标准:(1)诊断符合《中国抗癌协会乳腺癌诊治指南与规范(2013版)》[4],且病理检查表明临床分期为Ⅳ期;(2)转移病灶均经X线、CT、骨扫描等确诊,存在可测肿瘤;(3)女性;(4)4周内未应用其他抗癌药物且无放射治疗史;(5)预计后期生存时间>3个月;(6)Kamofsky行为状态评分[5]>60分。排除标准:(1)对本研究药物表阿霉素和Nab-P过敏;(2)存在神经功能障碍;(3)患有其他恶性肿瘤;(4)患有其他器质性疾病;(5)化疗依从性差。常规组患者平均年龄(50.67±4.31)岁;病理类型:浸润性导管癌30例,浸润性小叶癌5例,髓样癌4例;转移器官部位数:1个11例,2~3个26例,转移器官部位数>3个2例。观察组患者平均年龄(50.84±4.45)岁;病理类型:浸润性导管癌29例,浸润性小叶癌7例,髓样癌3例;转移器官部位数:1个12例,2~3个24例,转移器官部位数>3个3例。两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。所有研究对象均对本研究知情同意。
1.2 研究方法 常规组给予Nab-P(江苏恒瑞医药股份有限公司,国药准字H20183378)治疗,剂量为260 mg/m2,给药途径为静脉滴注,在0.5 h内滴注完成,以21 d为1个疗程,共治疗6个疗程。观察组接受表阿霉素联合Nab-P治疗,Nab-P剂量为260 mg/m2,0.5 h静脉滴注完成;表阿霉素(北京协和药厂,国药准字H20143165)剂量为75 mg/m2,0.5 h内输注完成;以21 d为1个疗程,共治疗6个疗程。
1.3 观察指标 (1)血清肿瘤标志物水平:化疗前后于清晨抽取患者空腹静脉血3 ml,抽取之后及时摇匀,静置0.5 h后分离血清(3 000 r/min离心10 min),检测肿瘤标志物癌胚抗原(carcino-embryonic antigen,CEA)、糖类抗原153(carbohydrate antigen 153,CA153)、糖类抗原125(carbohydrate antigen 125,CA125),仪器为罗氏公司E170及配套试剂盒,均严格按照仪器产品说明书执行操作。(2)血清学指标:化疗前后利用酶联免疫吸附法(上海酶联生物科技有限公司)测定VEGF、HIF-1α及内皮素(endothelin,ET)指标水平。(3)疗效:按照《实体瘤治疗疗效评定标准-RECIST》[6]进行判定,以RECIST推荐CT及磁共振成像为测量依据,并运用磁共振动力学指标肿瘤时间-信号强度曲线(time-signal intensity curve,TIC)来评估肿瘤血流灌注和廓清情况,其分型分为Ⅰ型(渐增型)、Ⅱ型(平台型)、Ⅲ型(流出型)、Ⅱ~Ⅲ型[7]。Ⅰ型多为良性病变,Ⅲ型多为恶性病变,化疗后TIC变化趋势分为下降(Ⅲ型或Ⅱ~Ⅲ型下降为Ⅱ型或Ⅰ型,Ⅱ型下降为Ⅰ型)、上升或无变化。其中,原发或转移灶消失,维持时间>4周,TIC变化由Ⅲ型、Ⅱ~Ⅲ型下降为Ⅰ型视为完全缓解;可测量的目标病灶直径总和降低>基线水平30%,TIC变化由Ⅲ型或Ⅱ~Ⅲ型下降为Ⅱ型、Ⅱ型下降为Ⅰ型为部分缓解;所有可测量的目标病灶直径总和增加>基线水平20%,病灶直径增加>5 mm,或出现新的病灶,TIC变化呈上升趋势或无变化视为无缓解。(4)不良反应发生情况:记录并比较化疗期间两组不良反应发生率。
总有效率=(完全缓解+部分缓解)例数/总例数×100%
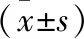
2 结果
2.1 血清肿瘤标志物水平比较 化疗后,两组CEA、CA153、CA125水平均低于各组化疗前,且观察组低于常规组,差异均有统计学意义(P<0.05)。见表1。
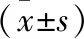
表1 血清肿瘤标志物水平比较
2.2 血清学指标水平比较 化疗后,两组血清VEGF、HIF-1α及ET水平均低于各组化疗前,且观察组低于常规组,差异均有统计学意义(P<0.05)。见表2。
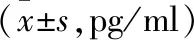
表2 血清学指标比较
2.3 疗效比较 化疗后,观察组部分缓解25例,无缓解14例,总有效率为64.10%(25/39)。常规组部分缓解16例,无缓解23例,总有效率为41.03%(16/39)。观察组总有效率高于常规组,差异有统计学意义(P<0.05)。
2.4 不良反应发生情况比较 观察组发生恶心呕吐5例、腹泻4例、白细胞减少2例、心脏毒性2例、肝功能异常1例、肾功能异常1例,不良反应发生率为38.46%(15/39)。常规组发生恶心呕吐8例、腹泻5例、白细胞减少1例、心脏毒性3例、肝功能异常2例、肾功能异常3例,不良反应发生率为56.41%(22/39)。两组不良反应发生率比较,差异无统计学意义(P>0.05)。
3 讨论
TNBC是一类侵袭力极强的恶性肿瘤,易转移至脑或内脏,造成患者预后差,存活率低,其常见临床症状为乳晕肿块、乳腺刺痛、乳房皮肤红肿及乳头溢液[8-9]。因TNBC缺乏内分泌及Her-2治疗的靶点,临床上对此尚无标准化治疗方案,且TNBC在早期确诊时已造成全身性病变,利用化疗手段控制病灶转移、改善预后,已成为主要的治疗目标[10]。Nab-P是一种紫杉烷类抗肿瘤药物,其载体为人血白蛋白,避免了传统紫杉醇类药物需要使用助溶剂带来的不良反应,其通过结合双向途径(白蛋白受体穿胞和癌细胞外间质的富含半胱氨酸的酸性分泌蛋白途径)来发挥化疗药物对局部肿瘤的集中疗效,抗肿瘤活性高,药物毒性相对较低[11]。但由于化疗药物需要长期应用,耐药问题极大阻碍了抗肿瘤的治疗进程,单独应用一种药物治疗的疗效逐渐趋于不理想,且药物毒副作用仍然很大。新辅助化疗能降低乳腺癌的分期,提高患者远期存活率,消除全身微转移灶,增加保乳的可能性,减小手术范围,降低耐药细胞出现的可能性,目前,已在TNBC中得到逐渐推广与应用,且临床研究上会更倾向于选择两种辅助药物联合使用来提升抗肿瘤疗效[12]。作为临床治疗乳腺癌的一线药物,蒽环类抗癌药物代表表阿霉素抗癌机制为抑制细胞周期,阻止乳腺癌细胞增生,进而促进肿瘤细胞凋亡,抗癌效果较好。
本研究结果发现,表阿霉素联合Nab-P较单用Nab-P抗肿瘤疗效更确切,能显著控制患者病情及癌细胞转移。考虑原因为表阿霉素通过干扰RNA合成和DNA复制,使肿瘤细胞分裂受限,并通过抑制拓扑异构酶Ⅱ,可让DNA超螺旋转变为松弛状态,从而阻止DNA的复制和转录[13]。表阿霉素与Nab-P联用是以聚集药物浓度的方式来对癌细胞发挥持续稳定的药效,改善血清肿瘤标志物水平,继而提高疗效。
本研究结果还发现,化疗后,观察组血清学指标HIF-1α、VEGF及ET水平均低于常规组,差异有统计学意义(P<0.05),这表明表阿霉素联合Nab-P有利于加强对肿瘤细胞生长代谢的抑制作用,对改善病情起到了良好的效应。HIF-1α为缺氧条件下存在于人体中的异源二聚体之一,能引起VEGF及糖酵解等相关酶的表达,提高机体血氧和能量的供应能力,以起到维护癌细胞代谢功能的作用[14]。VEGF对血管内皮细胞活化与增殖过程具有重要的促进作用,并在许多实体恶性肿瘤中显示较高表达。乳腺癌的生长和转移与血管生成密切相关,而血管生成一般受VEGF调节[15]。ET为具有强烈收缩血管作用的生物活性物质,也被作为促分化剂,并发挥细胞生长因子的作用,与各种类型肿瘤的病理发展有着紧密的联系[16]。上述3个指标的变化充分反映了表阿霉素联合Nab-P,可以利用表阿霉素阻断DNA复制和紫杉醇阻碍癌细胞有丝分裂作用,促进微管蛋白聚合,使肺功能微管束趋于平稳,从而控制HIF-1α、VEGF的高表达,阻止其抑制肿瘤细胞凋亡并降低化疗敏感性[17],一定程度上可以破坏肿瘤的生长和转移发展,降低肿瘤细胞的侵袭力,达到改善患者预后的效果。
本研究结果还显示,两组患者均存在恶心呕吐、腹泻、白细胞减少、心脏毒性等不良反应,这与化疗药物本身对机体的损伤有关,但两组不良反应发生率比较,差异无统计学意义(P>0.05),表明表阿霉素联合Nab-P治疗不会增加化疗不良反应的发生率,对患者耐受影响小。一般乳腺癌化疗产生的主要毒副作用是骨髓抑制和消化道反应,但表阿霉素联合Nab-P可通过降低药物剂量的密度,一定程度上控制不良反应的发生。
综上所述,表阿霉素联合Nab-P治疗晚期TNBC疗效显著,可有效改善肿瘤标志物水平,降低VEGF、HIF-1α水平,且不会增加毒副反应,临床应用具有安全性和可行性。
