乳头状肾细胞癌诊断和预后相关miRNA的生物信息学研究
2023-09-21王宁刘昌伟褚校涵王晓甫赵兴华郝斌许长宝
王宁,刘昌伟,褚校涵,王晓甫,赵兴华,郝斌,许长宝
(郑州大学第二附属医院 泌尿外科,河南 郑州 453000)
肾细胞癌是泌尿系统致死率最高的恶性肿瘤,且发病率持续升高。乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)是第二常见的肾细胞癌,占15%~20%[1]。根据病理学特征,PRCC可分为Ⅰ型和Ⅱ型。Ⅰ型PRCC的瘤体由管状及小核仁的乳头状嗜碱性细胞组成;Ⅱ型PRCC的瘤体则由大核仁的嗜酸性细胞组成。Ⅱ型PRCC细胞生物恶性度相对较高,常对应高T分期和差的核分级,易出现血管浸润或远处迁移,预后更差[2]。目前早期PRCC患者的首选治疗方式是手术治疗,晚期患者缺乏有效的治疗方法[3]。早发现、早治疗PRCC十分重要。本研究基于生物信息学挖掘PRCC生物标志物有助于诊断和预后评估,可为临床治疗提供新思路。
miRNA是一类内源性、非编码、单链小RNA,通过调控靶基因转录后表达参与一系列生物过程[4-5]。miRNA可通过正向或负向调控靶基因,发挥促癌或抑癌作用[6],也可参与肿瘤免疫识别以及免疫逃逸,引起免疫系统紊乱,进而影响癌症进展[7]。基于miRNA在癌症发生发展中的作用,miRNA作为癌症生物学标志物被广泛用于早期诊断及预后评估[8-9]。本研究通过生物信息学方法分析TCGA数据库中PRCC临床信息及miRNAs表达,旨在挖掘PRCC诊断和预后相关的miRNA生物标志物。
1 资料与方法
1.1 数据的获取与处理
从TCGA(https://portal.gdc.cancer.gov/)数据库下载326例样本miRNA表达数据(292例PRCC样本,34例正常样本)及匹配的临床数据(291例PRCC样本,34例正常样本),如年龄、性别、肿瘤分期、生存状态等(项目ID为TCGA-KIRP)。
1.2 差异表达miRNA筛选
利用R软件“edgeR”包筛选出差异表达miRNAs(|log2FC|>1,P<0.05),并绘制热图和火山图。
1.3 筛选PRCC诊断及预后相关的差异表达miRNA
利用单因素Cox回归、LASSO及多因素Cox回归分析筛选与生存相关的miRNAs(P<0.05)。借助R软件“Survival”包绘制生存曲线。并借助受试者工作特征(receiver operating characteristic,ROC)曲线评价其诊断PRCC的准确度。
1.4 转录因子预测
借助GeneCards(https://www.genecards.org)和TransmiR (https://www.cuilab.cn/transmir)数据库预测筛选差异表达miRNAs的转录因子(transcription factor,TF),并对预测结果取交集。运用Cytoscape软件将miRNAs及其TFs进行可视化。
1.5 靶基因预测
借助miRDB(http://www.mirdb.org)、TargetScan(https://www.targetscan.org/vert_80/)、miRTarBase(https://mirtarbase.cuhk.edu.cn/~miRTarBase/miRTarBase_2022/php/index.php)数据库进行差异表达miRNAs的靶基因预测,其中miRDB数据库中选取靶基因预测得分>80。取3个数据库预测结果的交集,并运用Cytoscape软件将miRNAs及其靶基因进行可视化。
1.6 靶基因的功能富集分析
借助DAVID数据库(https://david.ncifcrf.gov/)将筛选的差异表达miRNAs靶基因进行GO以及KEGG富集分析,探索靶基因涉及的生物学过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(melecular function,MF)以及参与的信号通路。
1.7 免疫浸润
借助TIMER 2.0免疫浸润数据库(http://cistrome.dfci.harvard.edu/TIMER/)分析miRNA靶基因与多种免疫细胞浸润水平的相关性。
1.8 统计学方法
应用R软件进行差异表达miRNA筛选、单因素Cox、LASSO及多因素Cox回归分析及ROC曲线绘制和生存分析。借助GraphPad Prism9软件进行不同肿瘤Stage、TMN分期的miRNA表达量统计分析,采用单因素ANOVA分析及Bonferroni法校正。P<0.05为差异有统计学意义。
2 结果
2.1 差异表达miRNAs
TCGA数据库中292例PRCC样本和34例正常样本共筛选出163个差异表达miRNAs(|log2FC|>1,P<0.05),其中82个miRNAs上调,81个miRNAs下调。显著上调的5个miRNAs分别为hsa-miR-21、hsa-miR-106b、hsa-miR-589、hsa-miR-671和hsa-miR-93;显著下调的5个miRNAs分别为hsa-miR-184、hsa-miR-33a、hsa-miR-129-2、hsa-miR-129-1、hsa-miR-126(图1)。

图1 差异表达的miRNA
2.2 筛选预后相关及诊断PRCC的差异表达miRNAs
为分析差异表达miRNAs对PRCC的预后影响及其诊断意义,选取TCGA数据库共291例PRCC样本的生存时间信息进行处理。单因素Cox回归初筛出14个差异表达miRNAs与患者的总体生存率相关(P<0.05,HR>1),分别为hsa-miR-589、hsa-miR-219a-1、hsa-miR-34a、hsa-miR-3170、hsa-miR-875、hsa-miR-599、hsa-miR-4636、hsa-miR-211、hsa-miR-551b、hsa-miR-1258、hsa-miR-4423、hsa-miR-486-2、hsa-miR-486-1、hsa-miR-4732。采用LASSO回归进一步筛选出6个与预后相关的差异表达miRNAs,分别为:hsa-miR-219a-1、hsa-miR-34a、hsa-miR-3170、hsa-miR-551b、hsa-miR-1258、hsa-miR-4423。采用多因素Cox回归分析进一步筛选,结果显示hsa-miR-34a和hsa-miR-551b与PRCC预后相关(P<0.05,图2A)。以miRNA的中位表达量将PRCC样本分为高表达组和低表达组,并绘制生存曲线。生存分析显示, hsa-miR-34a及 hsa-miR-551b高表达组的生存期明显长于低表达组(P<0.001,图2B)。

A为多因素Cox回归分析结果;B为hsa-miR-34a及hsa-miR-551b的生存曲线图,以其在PRCC样本表达量的中位数为基准划分高表达和低表达;C为hsa-miR-34a及hsa-miR-551b在不同分期的表达量(**P<0.01,***P<0.001)。
为进一步探索hsa-miR-34a及hsa-miR-551b表达量与PRCC临床分期的关系,本文分析hsa-miR-34a及hsa-miR-551b在PRCC不同肿瘤Stage、TMN分期中的表达量。结果显示,hsa-miR-34a在PRCC Stage Ⅲ、Ⅳ期、M1期、N2期、T3期的表达量下调(P<0.01,图2C),提示hsa-miR-34a表达水平与临床分期相关,对PRCC发展可能存在一定的抑制作用。对比hsa-miR-551b在PRCC不同肿瘤Stage、TMN分期中的表达量,图2C显示随着肿瘤进展,hsa-miR-551b表达水平出现不同程度的下调。
绘制hsa-miR-34a及hsa-miR-551b的ROC,结果显示hsa-miR-34a的曲线下面积(area under curve,AUC)>0.7,诊断PRCC的准确度和敏感度更高(图3)。

图3 hsa-miR-34a及hsa-miR-551b的ROC曲线
2.3 转录因子预测
转录因子可激活或抑制miRNA,介导miRNA成熟。图4显示,hsa-miR-34a的上游转录因子包含经典的TP53、STAT1、STAT3及FOS等共26个。

图4 hsa-miR-34a的转录因子预测
2.4 靶基因功能分析
TargetScan、miRDB(靶基因预测得分>80)及miRTarBase数据库预测结果取交集显示hsa-miR-34a的靶基因共28个(图5A)。GO富集分析显示,hsa-miR-34a靶基因主要参与以DNA为模板的转录负调控、RNA聚合酶Ⅱ启动子的转录负调控及细胞因子生成负调控等生物学过程(图5B)。其中靶基因PPP1R11及LGR4参与细胞因子生成负调控。细胞定位分析显示靶基因主要位于细胞核(图5C)。KEGG分析显示靶基因主要富集在癌症中的miRNAs通路和甲状腺激素通路(图5D)。
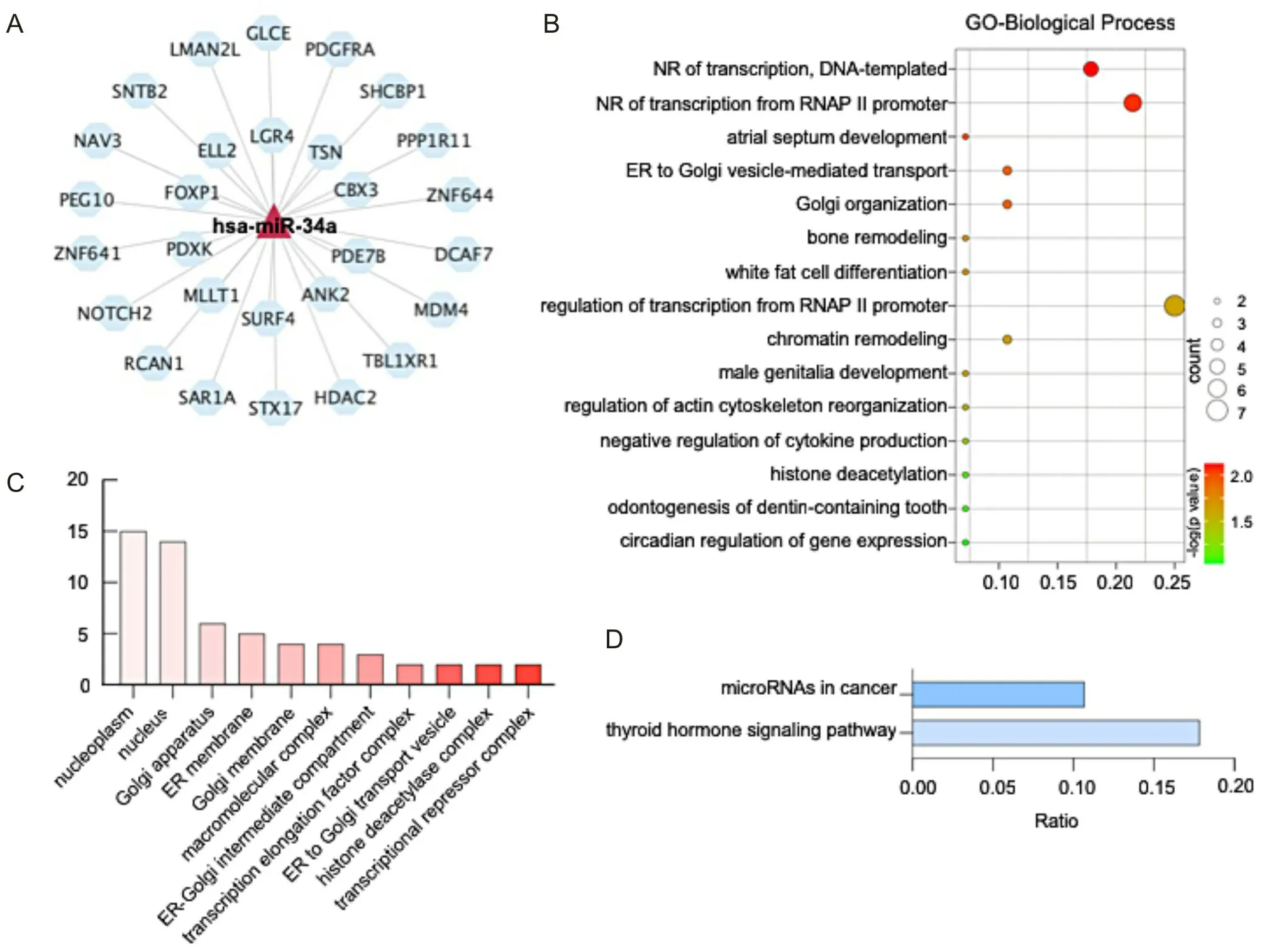
A为hsa-miR-34a的预测靶基因;B为靶基因的GO-生物过程分析;C为靶基因的亚细胞定位;D为靶基因的KEGG通路分析。
2.5 PPP1R11及LGR4与免疫细胞的关系
T细胞、B细胞可诱导炎症因子的产生,进一步加剧炎症反应。GO-BP分析显示hsa-miR-34a的靶基因PPP1R11及LGR4参与细胞因子生成的负调控。借助TIMER2.0分析PPP1R11及LGR4表达与多种免疫细胞(B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞及树突状细胞)浸润水平的相关性。结果显示,PRCC患者PPP1R11表达与B细胞、CD8+T细胞、中性粒细胞和树突状细胞的浸润水平呈正相关(图6A);LGR4表达与树突状细胞的浸润水平呈正相关(图6B)。

图6 PPP1R11及LGR4表达与免疫细胞浸润水平的关系
3 讨论
miRNA表达稳定、特异性强且检测灵敏度高,因此被广泛用于疾病及癌症的早期检测、疗效预测、实时并发症监测及预后判断[10-12]。近年来,研究发现miRNA在RCC肿瘤组织鉴别、组织学分型及预后判断方面发挥作用[13-14]。Faragalla 等[15]发现透明细胞肾细胞癌及PRCC患者hsa-miR-21表达升高,且其表达量与癌症Stage分期呈正相关,与生存周期呈负相关,可用于鉴别诊断透明细胞肾细胞癌、PRCC与嫌色肾细胞癌、嗜酸细胞瘤。上述研究提示miRNA在PRCC早期诊断、分期鉴定及预后评估中的潜在作用。
本研究对TCGA数据库共292例PRCC样本及34例正常样本的miRNA进行差异分析,筛选出163个差异表达miRNAs,其中82个上调,81个下调。进一步利用单因素Cox、LASSO及多因素Cox回归筛选出2个与PRCC预后相关的miRNAs:hsa-miR-34a和hsa-miR-551b,其中hsa-miR-34a的诊断准确度和敏感度更高。随着肿瘤瘤体增大,浸润程度增加,远处转移和淋巴结迁移,患者预后不良且hsa-miR-34a表达降低,而hsa-miR-34a高表达的PRCC患者预后良好,提示hsa-miR-34a可能抑制PRCC发生发展。有研究发现hsa-miR-34a抑制癌细胞增殖与浸润,抑制肾细胞癌发生发展[16-18],且对乳腺癌、结肠癌等多种实体瘤均存在抑制作用[19-21]。因此,hsa-miR-34a有望成为PRCC新的诊断及预后评估标志物和潜在治疗靶点。
转录因子通过结合miRNA的特定序列,调控miRNA表达。本文借助GeneCards及TransmiR数据库预测hsa-miR-34的上游转录因子,其中TP53、STAT3等参与癌细胞浸润与转移,影响癌症发生发展,与相关研究结果[22-23]一致。抑癌因子p53可占据hsa-miR-34a转录起始位置附近的高度保守结合位点,激活hsa-miR-34a转录,抑制上皮细胞间充质细胞转化(epithelial-to-mesenchymal transition,EMT),抑制癌细胞浸润与转移[22]。STAT3磷酸化则抑制hsa-miR-34a表达,促进EMT、肿瘤细胞浸润与转移[22-23]。
为探索hsa-miR-34a参与抑制PRCC的潜在机制,本文借助多个数据库预测其靶基因并进行通路富集和功能分析。其中,hsa-miR-34a可引起PPP1R11表达下调,进而抑制结直肠癌细胞EMT与浸润[24]。SHCBP1在多种癌症中过表达,抑制SHCBP1表达可诱导多种癌细胞凋亡、抑制迁移与浸润[25-27]。研究发现乳腺癌组织中DCAF7表达上调[28]。采用DAVID数据库进行靶基因功能富集分析。KEGG分析显示,hsa-miR-34a的靶基因不仅参与miRNAs与癌症通路,也通过甲状腺激素通路介导PRCC的发生发展。研究表明miRNAs与癌症通路也参与肺腺癌预后相关miRNA靶基因调控通路[29]。甲状腺激素T3和T4借助转运蛋白进入胞内,随后T4转化为T3,T3转移入核,与配体结合位点结合,招募聚合酶Ⅲ,进而激活下游基因表达[30]。甲状腺激素紊乱可增加患多种癌症的风险,研究表明甲亢患者患甲状腺癌、乳腺癌、前列腺癌及肝细胞癌的风险增加[31-32]。且甲亢病史10 a甚至更长的患者,尤其是女性患者,患肝细胞癌的风险更高[33]。GO富集结果显示,hsa-miR-34a的靶基因参与RNA聚合酶Ⅱ启动子的转录调节、炎症因子生成负调控等生物学过程,且上述生物学过程均与癌症的产生及发生发展相关[34-35]。研究表明炎症与癌症关系密切,炎症过程中产生的细胞因子等炎症介质诱发癌症[36]。炎症因子生成减少,炎症反应减轻,癌症发生率降低。本研究结果显示靶基因PPP1R11、LGR4与细胞因子生成负调控紧密相关。PPP1R11可抑制炎症因子分泌,减轻炎症反应[37]。而LGR4可激活NF-κB信号通路,诱导炎症因子等产生,引起炎症反应[38]。
T细胞、B细胞、中性粒细胞、巨噬细胞等免疫细胞介导的炎症调控可影响癌症免疫豁免、免疫监测,参与癌症的发生发展[39-41]。本文发现参与细胞因子生成负性调控的靶基因表达与免疫细胞浸润水平关系紧密。PPP1R11表达与PRCC中B细胞、CD8+T细胞、中性粒细胞和树突状细胞的浸润水平呈正相关。Joshi等[37]也发现PPP1R11可调节T细胞对调节性T细胞介导抑制作用的敏感度。LGR4表达与PRCC中树突状细胞的浸润水平呈正相关。LGR4表达变化引起免疫平衡改变,CD4+T、CD16+NK细胞、调节性T细胞、CD20+B细胞等免疫细胞数量发生不同改变[42]。Tan等[43]发现LGR4通过介导LGR4/ERK/STAT3通路促进巨噬细胞M2极化,诱导癌细胞增殖及浸润。由此推测hsa-miR-34a的靶基因PPP1R11及LGR4参与细胞因子生成负性调节,且可通过影响PRCC多种免疫细胞浸润,影响患者预后。
4 结论
本研究采用生物信息学方法筛选出hsa-miR-34a与PRCC诊断及预后相关。hsa-miR-34a对多种癌症均有一定的抑制作用,但影响PRCC预后的研究鲜有报道,有望成为新的PRCC早期筛查及预后判断标志物。
