药用真菌桑黄的液态发酵工艺优化及体外抗肿瘤活性研究
2023-09-19魏宝红刘佳毕旺华胡淑曼马晓青杨文哲杨雪孙皓岩张鹏
魏宝红,刘佳,毕旺华,胡淑曼,马晓青,杨文哲,杨雪*,孙皓岩,张鹏
(1.中国海洋大学 医药学院,山东青岛 266003;2.青岛海洋生物医药研究院,山东青岛 266071)
桑黄(Inonotus hispidus)属真菌界、担子菌门、伞菌纲、锈革孔菌目、锈革孔菌科,是一种多年生的珍稀食药兼性菌类,属于高附加值食用菌,有“森林黄金”之美称,是目前国际公认的生物治癌领域中有效率排在第一位的药用菌[1-4]。《神农本草经》《药性论》和《本草纲目》等记载,桑黄利五脏,宣肠胃气,排毒气。桑黄的主要活性成分为多糖、黄酮及三萜类物质,具有很好的抗肿瘤、降血糖、降血脂和活血化瘀等功效[5-10]。
桑黄菌属于多基原真菌,目前我国桑黄类真菌主要包括桑黄菌属的桑树桑黄菌(Sanghuangporus sanghuang)、鲍姆桑黄菌(S. baumii)、瓦宁桑黄菌(S. vaninii)和纤孔菌属的粗毛纤孔菌(Ionnouts hispidus)等[11-12]。野生桑黄在我国主要分布在东北、西藏南部及东南部,云南、四川、湖南、湖北、陕西山区也有少量分布,国外主要分布在日本、韩国、俄罗斯等地。野生桑黄在中国经过多年的采收后,产量逐年减少,较大型的子实体需要10 年以上长成[13]。由于其自身这种生理状态的特殊性、复杂性及外界环境的影响,野生桑黄菌子实体稀少,且人工栽培周期长,其产量已无法满足人们对珍稀桑黄日益增长的需求,使得桑黄子实体的开发和利用受到了限制,因此探究桑黄液体发酵菌丝体替代子实体的应用极具开发意义。液体发酵技术具有生产周期短、工艺简单、效率高等优点,可有效解决桑黄资源短缺问题。
本研究以菌丝体生物量、胞内多糖含量、胞内黄酮含量、DPPH 清除率等为考察指标,通过单因素试验和正交试验确定最优液体发酵培养基,并进行扩大培养,研究桑黄菌丝体在放大生产过程中菌丝体质量、胞内成分的变化规律。同时,对扩大培养获得菌丝的生物活性进行初步评价,以期为工业生产过程中桑黄发酵产物的精准把控提供依据,为桑黄菌丝体的应用奠定基础。
1 材料与方法
1.1 仪器与设备
MDQ-B1T 振荡培养箱,上海旻泉仪器有限公司;ZHJH-C1115B 垂直流超净工作台,上海智城分析仪器制造有限公司;LDZH-150KBS 立式压力蒸汽灭菌器,上海申安医疗器械厂;ME204E 万分之一天平,梅特勒-托里斯多仪器(上海)有限公司;GL 冷冻高速离心机,湖南湘仪实验室仪器开发有限公司;UV6000PC 紫外分光光度计,上海元析仪器有限公司;HWS-26 水浴锅,上海一恒科学仪器有限公司;30 L 自动灭菌发酵罐,上海百仑生物科技有限公司。
1.2 材料与试剂
实验用菌种由临清清源正本生物医药科技有限公司提供;人非小细胞肺癌细胞A549、人结肠癌细胞HCT-116、人肝癌细胞HepG2、人乳腺癌细胞MCF-7、人宫颈癌细胞Hela、人脐静脉内皮细胞HUVEC,中科院上海细胞库;安琪酵母浸粉FM902(2022051401B1),安琪酵母股份有限公司;麦芽糖(2020210416),国药集团化学试剂有限公司;马铃薯淀粉(食品级),上海枫未食业有限公司;蛋白胨(BR,20190520),北京双玄微生物培养基制品厂;玉米面粉(食品级),嘉祥永胜食品有限公司;可溶性淀粉、尿素、蔗糖、乳糖、葡萄糖、磷酸二氢钾、硫酸镁、氯化铵、硫酸铜、硫酸锌及亚硫酸铁等均为分析纯,国药集团化学试剂有限公司。PBS 磷酸盐缓冲液(0.01 mol/L,pH 7.2 ~7.4,批号为2022102403)、RPMI1640 培养液(货号CR31800,批号2022101103)、DMEM 高糖培养液(货号CR12800,批号2022112502)、McCOY’S 5A(货号CR16600,批号2022032202),均购自浙江森瑞生物科技有限公司;盐酸阿霉素(703E021),北京索莱宝科技有限公司;青链霉素混合液(20221012),北京索莱宝科技有限公司;Tris(161-0716),美国BIO-RAD 公司;SRB(MKBG5106V),北京索莱宝科技有限公司;96 孔细胞培养板、90 mm×20 mm 细胞培养皿,生工生物工程(上海)股份有限公司。
1.3 试验方法
1.3.1 培养基配方
(1)马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g/L(煮汁),葡萄糖20 g/L,琼脂15 g/L。
(2)液体种子培养基:去皮马铃薯200 g/L(煮汁),葡萄糖20 g/L。
(3)基础培养基:葡萄糖20 g/L、酵母浸粉5 g/L、KH2PO46 g/L、MgSO43 g/L。
1.3.2 菌种活化
接种桑黄菌种于PDA 固体培养基,于28 ℃恒温培养箱培养10 d。
1.3.3 液体种子培养
将活化后的菌种用接种环取同样大小的菌块(0.5 cm×0.5 cm),每瓶接种5 个菌块,每个500 mL培养瓶的装液量为200 mL,于28 ℃、160 r/min 振荡培养10 d。
1.3.4 单因素试验
1.3.4.1 试验设计
(1)碳源筛选试验:在基础培养基配方中,分别以葡萄糖、蔗糖、可溶性淀粉、麦芽糖、乳糖、马铃薯淀粉为碳源,添加量为20 g/L,接种量为10%,装液量40%,于28 ℃、160 r/min 培养7 d,每组设定3 个重复,测定菌丝体质量、胞内多糖产量、胞内黄酮产量。
(2)氮源筛选试验:在基础培养基配方中,分别以麸皮、玉米粉、酵母浸粉、蛋白胨、氯化铵、尿素为氮源,添加量为5 g/L,其他试验条件及考察指标同1.3.4.1 项(1)。
(3)无机盐种类筛选:在基础培养基配方中,分别 添 加1 g/L MnSO4、ZnSO4·7H2O、FeSO4·7H2O、CuSO4和Na2SO4,以不加上述无机盐为对照,其他试验条件及考察指标同1.3.4.1 项(1)。
(4)碳源添加量考察:在确定了最优碳源、氮源、无机盐种类后,碳源添加量设定为0.5%、1.0%、2.0%、3.0%、4.0%、5.0%、6.0%,保持其他培养基组成比例不变[同1.3.1(3)],试验条件及考察指标同1.3.4.1项(1)。
(5)氮源添加量考察:在确定了最优碳源、氮源、无机盐种类后,将氮源添加量设定为0.25%、0.50%、1.00%、2.00%、4.00%,其他培养基组成比例不变[同1.3.1(3)]。其他试验条件及考察指标同1.3.4.1 项(1)。
(6)无机盐添加量考察:有文献报道,药用真菌桑黄液体发酵培养基优化中,无机盐的添加量范围较窄,通常最优比例在0.1%~0.2%[14-15],本文在确定了无机盐种类的基础上选取无机盐添加量为0.05%~0.20%,并进行下一步正交试验考察。
1.3.4.2 试验评价方法
以菌丝体生物量、单位质量菌丝体中总糖含量、单位质量菌丝体中总黄酮含量为主要评价指标,进行单因素试验考察,并计算综合得分。综合得分按公式(1)计算。
式中:MB、TS、TF分别代表实验中测定样品的菌丝体生物量、单位质量菌丝体总糖含量、单位质量菌丝体总黄酮含量;MBmax、TSmax、TFmax分别代表实验中测定样品的菌丝体生物量、单位质量菌丝体总糖含量、单位质量菌丝体总黄酮含量的最大值。
1.3.5 正交试验
1.3.5.1 试验设计
以单因素试验为基础,选用L9(34)正交表进行试验,每个因素设定3 个水平,因素水平表见表1。

表1 正交试验因素水平表
1.3.5.2 评价方法
试验条件及考察指标同1.3.4.1 项(1),以菌丝体质量、单位质量菌丝体中总糖含量、单位质量菌丝体中总黄酮含量及DPPH 清除率等指标的综合评分进行评价。综合评分按公式(2)计算。
式中:MB、TS、TF、DC分别代表实验中测定样品的菌丝体生物量、单位质量菌丝体总糖含量、单位质量菌丝体总黄酮含量和DPPH 清除率;MBmax、TSmax、TFmax、DCmax分别代表实验中测定样品的菌丝体生物量、单位质量菌丝体总糖含量、单位质量菌丝体总黄酮含量和DPPH 清除率的最大值。
1.3.5.3 最优工艺验证试验
按照优化后的发酵工艺进行验证,设定3个重复,结果取平均值。
1.3.6 扩大培养
采用试验优化后的培养基进行30 L 发酵罐的扩大培养,初步探索放大工艺。在30 L 发酵罐中加18.0 L 液体培养基,闭罐,于115 ℃灭菌1 h 后用冷却水循环冷却。取500 mL 锥形瓶培养10 d 的桑黄菌丝体10 瓶,在无菌操作下倒入发酵罐中,接种量为10%,设定温度为28 ℃,搅拌浆转速为300 r/min,罐内气压为0.02 ~0.04 MPa,培养9 d,观察记录。
1.3.7 指标测定
(1)菌丝体生物量的测定:将发酵液收集后用纱绢过滤,将纱绢上的菌丝体用无菌水淋洗2 次后,每次取200 mL,10 000 r/min 离心10 min,取沉淀于60 ℃烘箱中烘干,称重得菌丝体产量。
(2)菌丝体中总糖含量测定:将菌丝体烘干后研磨,采用热水浸提法进行提取,具体方法为料液比1 ∶20(g ∶mL),提取温度60 ℃,提取时间2.5 h,12 000 r/min 离心10 min,取上清,提取2 次,合并上清液,备用[16-18]。以葡萄糖为标准品,采用蒽酮-硫酸法测定菌丝体总糖含量[19-21]。
(3)菌丝体中总黄酮含量测定:将菌丝体烘干后研磨,取0.2 g 加2 mL 70%乙醇,在70 ℃下超声提取两次,每次0.5 h,12 000 r/min 离心10 min,取上清,提取2 次,合并上清液,备用[22-25]。以芦丁为标准品,采用亚硝酸钠-硝酸铝法测定黄酮含量[25-26]。
1.3.8 抗氧化活性测定
以维生素C 为阳性对照,按照CHEN 等[27]的方法测定DPPH 自由基清除活性,清除率按公式(3)计算。
式中:A1表示样品在517 nm 处的吸光度;A2表示以70%乙醇代替样品测定的吸光度;A0表示以70%乙醇代替DPPH 溶液测定的吸光度。
1.3.9 抗肿瘤活性测定
采用SRB 法测定桑黄菌丝体对6 种细胞的增殖抑制能力。取对数生长期的A549、HCT-116、HepG2、MCF-7、Hela、HUVEC 细胞分别以5 000个/孔接种于96 孔板,四周加入100 μL PBS 防止边缘效应。将96 孔板放入培养箱中培养,待细胞贴壁。将之前培养的96 孔板取出,弃去培养基,加入不同种类的含药培养基。设置样品组、阴性对照组和阳性对照组。其中,样品组分别为正交验证试验样品(S1)、扩大培养第5 天的样品(S2),终浓度均为100 μg/mL;阳性对照组药物为阿霉素,终浓度为1 μmol/L;阴性对照组加入同样品组相同体积的无菌水,每个样品设3 个复孔。药物作用72 h 后,每孔加入50%(m/v)冰冷的三氯乙酸(TCA)固定细胞,SRB 染色后,加入Tris 溶液,于酶标仪上测定540 nm处的OD 值,按公式(4)计算受试样品对肿瘤细胞生长的抑制率。
式中,ODck和ODeg分别为540 nm 下对照组和给药组的OD值。
1.4 数据统计及分析
每组试验平行测定3 次,结果以±s表示。检测结果采用Excel 2021软件作图,SPSS 21.0软件分析,采用t-test 统计分析,P<0.05 表示差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 种类筛选结果
由图1 可以看出,碳源、氮源、无机盐的种类对桑黄液体发酵影响较大。当培养基中的碳源为蔗糖时,综合评分最高,因此本研究选择蔗糖作为碳源;当选择酵母浸粉、麸皮与蛋白胨为氮源时,评分较高且无显著性差异,综合考虑,选择酵母浸粉作为氮源;无机盐的选择中,硫酸铜可以明显促进桑黄液体发酵各评价指标的提高。因此,确定培养基的碳源、氮源、无机盐种类分别为蔗糖、酵母浸粉和硫酸铜。
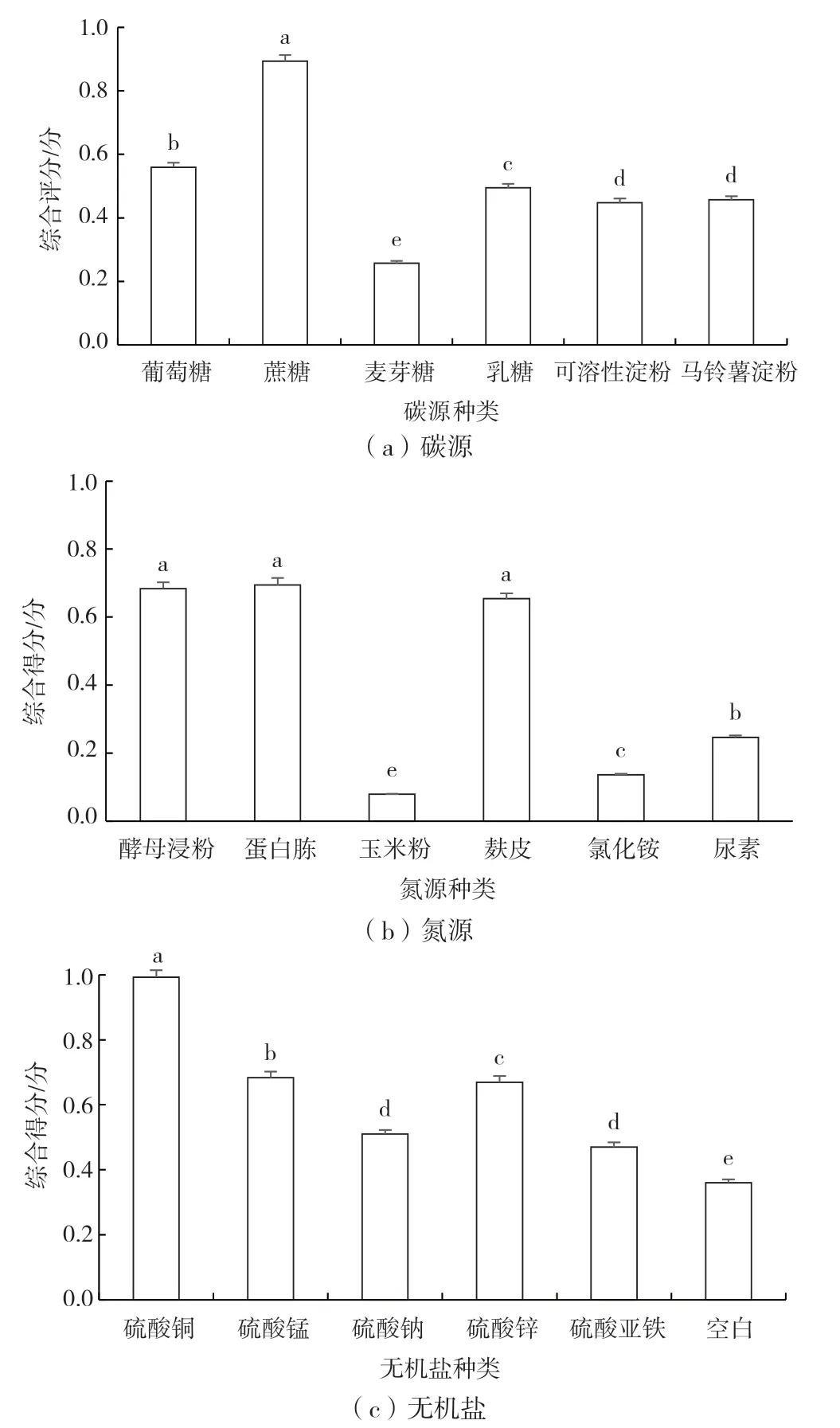
图1 不同碳源、氮源、无机盐种类对桑黄发酵结果的影响
2.1.2 添加量筛选结果
如图2 所示,蔗糖添加量在1%~4%时,评分基本一致,因此本文选择蔗糖添加量为1%~3%进行后续正交试验;酵母浸粉的添加量考察中,未获得明显的平台期,提示后期的正交试验需继续提高酵母浸粉的添加量,本文设置酵母浸粉添加量为2%~6%进行后续正交试验。

图2 碳源、氮源添加量对桑黄发酵指标的影响
2.2 正交试验结果
正交试验结果及方差分析见表2、表3。由R值可知,影响桑黄发酵程度的因素为B >C >A,K值分析可知最佳培养基配方为A3B1C2,即蔗糖3%、酵母浸粉2%、硫酸铜0.1%,但该配方组合与正交表中最优组合不一致,因此进行进一步的验证。验证试验结果显示,A3B1C2组合的综合评分均值为0.93 分,相对误差较小,试验结果稳定,可为以液态发酵法大量生产菌丝体提供理论支持,因此确定最佳组合为A3B1C2。
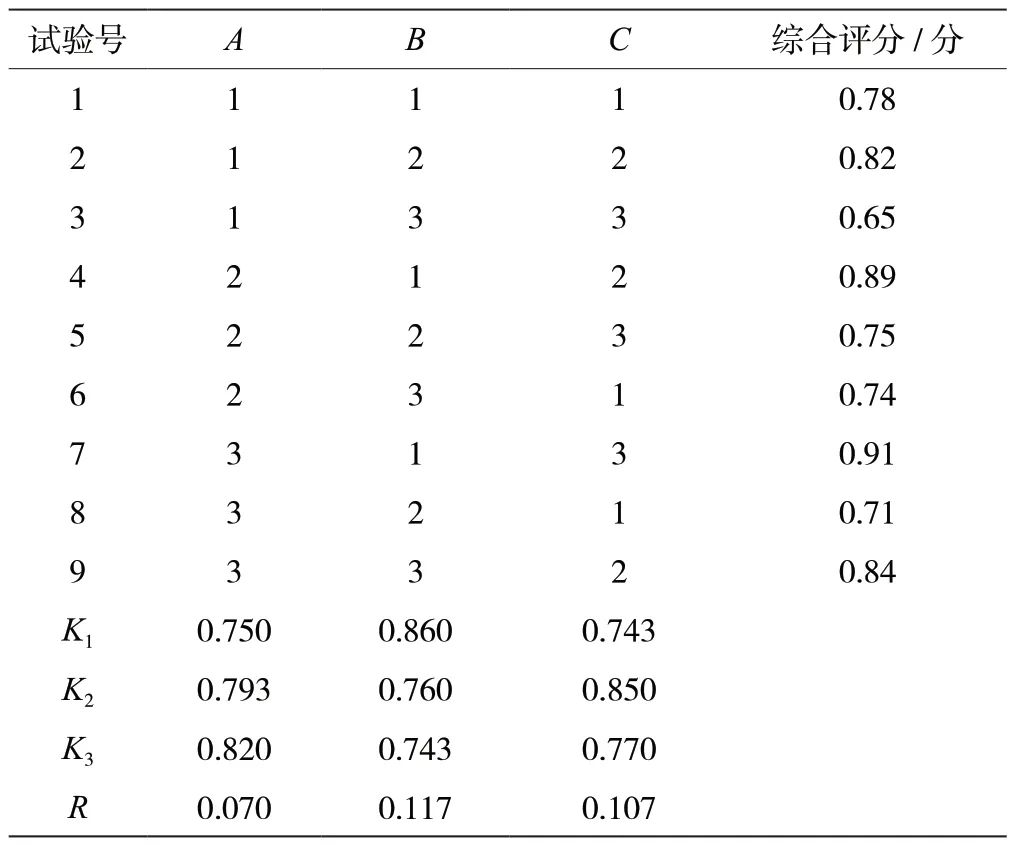
表2 正交试验结果表
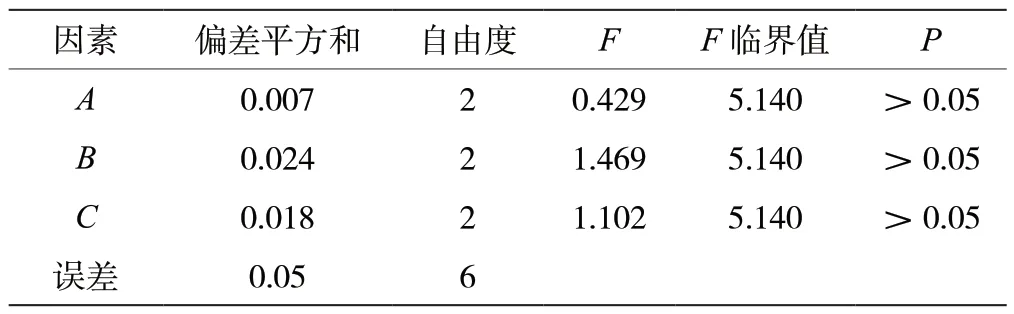
表3 正交实验结果的方差分析
2.3 扩大培养实验结果
为了逐步将桑黄的发酵工艺应用于实践中,将摇瓶的发酵条件进行30 L 的扩大培养,从第5 天起,每隔24 h 取样,共培养9 d,测定菌丝体生物量、菌丝体的总糖含量、总黄酮含量及DPPH 清除率。由表4 可知,本次扩大培养第5 天样品的综合评分最高(0.90分),发酵菌丝体生物量为9.74 g/L(第5 天),较正交验证试验所得菌丝体生物量提高了41.36%,而单位质量菌丝体中总糖含量、单位质量菌丝体中总黄酮含量及DPPH 清除率呈现不同程度的下降。结合两种培养规格下菌丝的生长状态(摇瓶中主要是菌丝球,而发酵罐中主要是菌丝),推测原因可能是扩大培养时,发酵罐中搅拌桨的转速为300 r/min,明显高于摇瓶转速(160 r/min),较高的转速增加了溶氧量,促进菌丝体生物量的大幅提升;但较高转速容易导致菌丝无法生长成球,且细胞壁破坏程度高,菌丝的胞内成分大量溶出至发酵液中,从而导致菌丝体中各成分含量的减少。
表4 扩大培养实验结果表(±s)
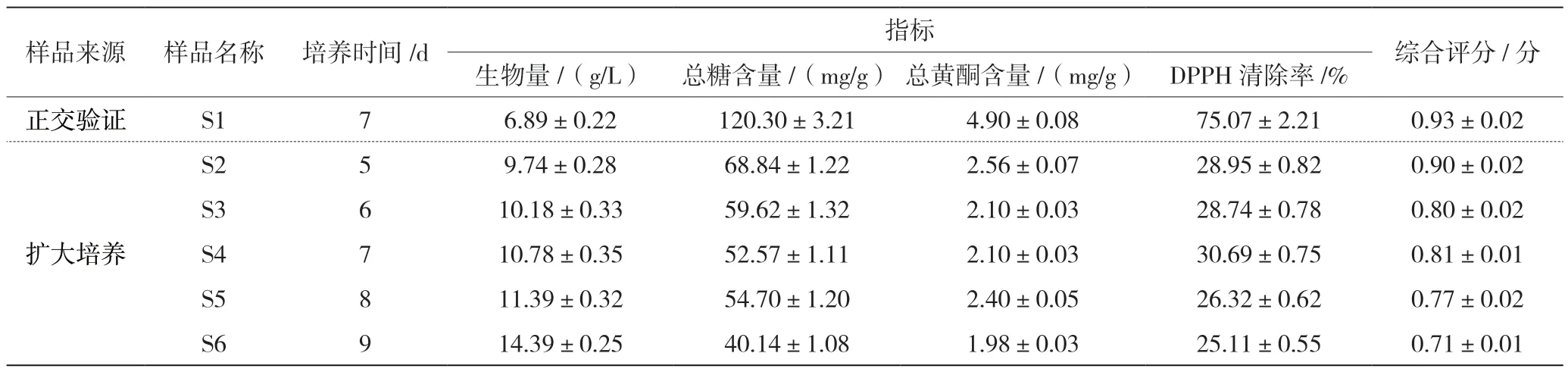
表4 扩大培养实验结果表(±s)
样品来源 样品名称 培养时间/d 指标 综合评分/分生物量/(g/L) 总糖含量/(mg/g) 总黄酮含量/(mg/g) DPPH 清除率/%正交验证 S1 7 6.89±0.22 120.30±3.21 4.90±0.08 75.07±2.21 0.93±0.02扩大培养S2 5 9.74±0.28 68.84±1.22 2.56±0.07 28.95±0.82 0.90±0.02 S3 6 10.18±0.33 59.62±1.32 2.10±0.03 28.74±0.78 0.80±0.02 S4 7 10.78±0.35 52.57±1.11 2.10±0.03 30.69±0.75 0.81±0.01 S5 8 11.39±0.32 54.70±1.20 2.40±0.05 26.32±0.62 0.77±0.02 S6 9 14.39±0.25 40.14±1.08 1.98±0.03 25.11±0.55 0.71±0.01
2.4 桑黄菌丝体体外抗肿瘤活性
结合表4 可知,扩大培养第5 天样品的综合评分最高(0.90 分),因此选取第5 d 的样品进行体外抗肿瘤活性评价。对正交验证样品S1 和扩大培养样品S2的体外抗肿瘤活性进行测定,结果见表5。2 个样品对HCT-116、Hela、HUVEC、HepG2 均表现出不同程度的抑制作用,其中对HUVEC 细胞的增殖抑制作用最强,且S2 活性明显高于S1;2 个样品对A549、MCF-7 细胞的增殖未表现出抑制作用。
表5 2 种桑黄水提物对6 种人源肿瘤细胞的体外抑制率(±s,%)

表5 2 种桑黄水提物对6 种人源肿瘤细胞的体外抑制率(±s,%)
组别 HUVEC HepG2 Hela HCT-116 A549 MCF-7 S1 36.59±3.79 17.19±1.90 19.12±0.45 19.00±1.92 3.92±2.90 -11.03±5.70 S2 45.31±0.06 39.67±2.28 18.88±4.51 14.74±1.93 2.73±2.37 2.34±0.05阿霉素 93.59±0.01 92.02±0.54 88.31±4.51 94.01±0.61 92.21±0.3 71.13±2.43
3 讨论与结论
药用真菌发酵方式包括固体发酵和液体发酵。其中,固态发酵即人工栽培技术,在药用真菌的生产中有一定的应用,但是由于药用真菌生理需求的特殊性和复杂性,人工栽培药用真菌技术存在周期长、能耗高、产率低等问题,严重制约了药用真菌的开发利用。利用液体发酵技术获取菌丝体代替子实体是目前的研究热点。液体发酵培养具有菌丝体产量高、培养周期短、可控性好等优点,更易于工业化大量生产,具有广泛的市场前景。在液体发酵中,菌丝体的生长及有效成分的积累不仅与碳源、氮源、无机盐的种类密切相关,而且受碳氮源、无机盐比例及浓度的影响。本研究通过单因素和正交试验,筛选出适用于桑黄液态发酵的最佳工艺,同时进行放大培养,并对其菌丝体抗肿瘤活性进行了初步探索。研究确定了桑黄液体发酵培养基配方为蔗糖3%、酵母浸粉2%、硫酸铜0.1%、磷酸二氢钾0.6%、硫酸镁0.3%,优化得到的培养工艺条件稳定、重复性良好,成本较低,适合放大生产。抗肿瘤活性研究结果显示,液体发酵菌丝体水提物对HUVEC、HepG2 有较强的增殖抑制作用。
本研究中30 L 发酵罐的扩大培养为桑黄液态发酵的扩大生产和应用奠定了坚实基础,对桑黄的优质高产具有重要的指导意义,可有效解决其资源匮乏的问题。后续将对液态发酵菌丝体与子实体在成分、功效方面的差异进行对比研究,以期推动桑黄在食药用菌产业方面的推广和应用。
