有效微生物菌群(EM)对加州鲈池塘养殖水质和水体菌群结构的影响
2023-09-19胡佳雯聂志娟郑兆伟李士恒邵乃麟徐钢春
胡佳雯,聂志娟,郑兆伟,李士恒,孙 毅,邵乃麟,徐钢春,徐 跑
(1.中国水产科学研究院淡水渔业研究中心,江苏无锡 214081;2.南京农业大学无锡渔业学院,江苏无锡 214081;3.上海海洋大学水产与生命学院,上海 201306)
大口黑鲈(Micropterussalmoides)俗称加州鲈,源产于北美洲,是一种肉质鲜美、无肌间刺、生长快、适温广的淡水肉食性鱼类[1]。从我国1983年引进以来,其人工繁育和全程专用配套饲料研发技术不断突破,现已成为国内重要的优质淡水池塘养殖品种[2]。中国大口黑鲈养殖产量逐年递增,据2020中国渔业统计,大口黑鲈年产量已达到47.7万吨,仅次于罗非鱼,养殖区域遍布华南、华东、华中、西南等区域[3]。大部分区域主要以中高密度集约化池塘养殖为主[4],在养殖过程中大量投喂人工配合饲料,50%~80%摄食氮源、60%~75%饲料磷被作为残饵或排泄物释放养殖水体中[5-6],易导致水体富营养化,爆发蓝藻,严重阻碍了大口黑鲈养殖业的健康发展。
养殖水体和沉积物修复可通过物理、化学和生物方法进行。其中,生物修复因具有绿色环保、生态友好、经济实惠等特点而被广泛认可[7],益生菌在水产养殖系统中的环境修复也受到越来越多的关注和应用[8]。许多研究表明,养殖水体泼洒益生菌,可优化水体菌群结构,从源头上降低养殖水体中氨氮、亚硝酸盐等有毒害物质的含量,营造良好的水域生态系统环境[9-13]。而生态环境改善,有利于菌群结构的多样性和稳定性[14]。EM复合益生菌为一种混合菌,一般包括光合菌、酵母菌、乳酸菌等有益菌类,可调控水体微生物结构,减少病原菌,平衡微生态,提高水产动物免疫力。李士恒等[15]采用EM复合益生菌开展对蟹鲈混养模式下养殖水体菌群结构的影响研究,发现EM复合益生菌能够优化菌群结构,具有显著的水体原位修复功能。本实验以此为基础进行拓展研究,延长实验周期,探究EM复合益生菌对大口黑鲈池塘养殖水体原位修复效果,及其对养殖水体菌群结构的影响,以期为益生复合菌合理科学使用提供指导,促进我国大口黑鲈池塘养殖业的长期可持续发展。
1 材料方法
1.1 材料方法
养殖大口黑鲈购自安徽张林渔业有限公司;EM复合益生菌购自江苏恒泰环保科技发展有限公司,(pH 3.0~4.0;菌种类数>80;总菌数≥107CFU/mL;乳酸菌数1.0×106~107CFU/mL;酵母菌数1.0×104~105CFU/mL;光合菌数(1.0~2.0)×103CFU/mL;放线菌数(1.0~3.0)×103CFU/mL)。
实验于中国水产科学研究院淡水渔业研究中心扬中基地开展,单个养殖池塘面积为1 666.7 m2,水深2 m。实验分为EM鲈实验组(EL)和鲈对照组(L),每组设三个重复。鲈放养时间为2020年4月2号,放养规格为184 g/尾,放养密度为1 500尾/666.7 m2。养殖实验期间,每天投喂两次,投喂量为鲈体质量的3%~5%。实验开始后,实验组池塘每10 d按500 g/667 m2比例进行EM泼洒。每个养殖池塘均配备微孔增氧机,夜间开启增氧设备,溶解氧维持在6~8 mg/L。
1.2 样品的采集和处理
1.3 样品DNA提取及PCR扩增
取3 L混匀水样,在4 ℃、12 000 r/min的条件下离心30 min,取沉淀放于离心管中用于后续DNA提取。根据E.Z.N.A.®soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.)抽提总DNA,通过NanoDrop 2000检测DNA的浓度和纯度,以1%琼脂糖凝胶电泳检测DNA提取质量;用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACH VG GG TW TCTAAT-3′)引物[15]对细菌16S rRNA基因的V3-V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共计27个循环;72 ℃延伸10 min。反应体系为(20 μL):4 μL 5×FastPfu缓冲液、2 μL 2.5 mmol/L dNTPs、0.8 μL引物(5 μmol/L)、0.4 μL FastPfu聚合酶;10 ng DNA模板。
1.4 Illumina Miseq测序
PCR产物用2%的琼脂糖凝胶回收,利用AxyPrep DNA Gel Extraction Kit(Axygen,U.S.)进行纯化,三(羟甲基)氨基甲烷(Tris-HCl)洗脱,2%琼脂糖凝胶电泳检测,并通过QuantiFluorTM-ST(Promega,U.S.)进行定量检测。根据Illumina MiSeq平台(Illumina,SanDiego,USA)标准操作规程将纯化后的扩增片段构建测序文库,然后利用Illumina公司的Miseq PE300平台进行高通量测序(上海美吉生物医药科技有限公司)。
1.5 数据分析
原始测序序列用Trimmomatic软件质控,通过FLASH软件进行拼接:首先设置50 bp的窗口,当窗口内的平均质量低于20 bp时,从窗口前端位置截去该碱基后端所有序列,再去除质控后长度低于50 bp的序列;根据重叠碱基overlap,将两端序列拼接,长度要大于10 bp,overlap间的最大错配率为0.2;根据序列首尾两端的barcode及引物将序列拆分到每个样本,barcode匹配需精确,引物可有2 个碱基的容错,除去模糊碱基序列。使用UPARSE 软件,以97%的相似度水平对序列进行OTU聚类。使用双因素方差分析进行统计学检验,(P<0.05)认为差异显著;水体理化指标、微生物多样性指数及主要菌属的相对丰度间的差异通过上海美吉云平台软件分析。
2 结果
2.1 水质指标
水质测定结果显示(表2):Ⅰ期和Ⅱ期亚硝酸氮含量较低,无显著差异,但在Ⅲ期EL组亚硝酸氮含量显著低于L组;硝酸氮含量在Ⅰ期和Ⅱ期实验组显著高于对照组,但Ⅲ期和Ⅳ期显著低于对照组;EL组总氮含量在Ⅰ期显著低于L组,其它时期无显著差异;EL组总磷含量在Ⅱ期、Ⅲ期、Ⅳ期显著高于L组,Ⅰ期差异不显著;氨氮指标在整个测定期无显著差异。
2.2 菌群多样性特征
测序结果显示为24个样品的有效序列数共1 011 929条,有效序列的平均长度为416 bp,以97%相似水平对测序样品进行OTU划分,可分为1 372个OTU,物种注释结果显示共26个门,76个纲,190个目,318个科,555个属,857个种。显示菌群丰富度的Chao指数在4个采样期无代表意义的显著差异,而多样性pd指数显示较多显著差异(图1)。其中,EL组在Ⅰ期pd指数显著低于对照组,而在Ⅲ期pd指数极其显著高于对照组。从Ⅱ期开始,随着采样月份的增长,EL组和L组水体pd多样性指数不断增加,说明养殖期不同月份温度气候差异等因素对养殖水体微生物多样性组成存在影响。

图1 样品中细菌丰富性和多样性Fig.1 Richness and diversity of becteria in samples A:Chao指数;B:Pd指数;*代表0.01≤P≤0.05;**代表0.001≤P≤0.01;***代表P≤0.001
基于属水平PCoA分析(图2)结果显示,横轴(PC1)贡献度为34.2%,纵轴(PC2)贡献度为20.72%。EL组与L组在不同月份其水体菌群结构组成上存在显著差异,距离较远,但在I期和Ⅱ期,同一采样期实验组和对照组样品距离较近,而在Ⅲ期,两组样品距离则较远。
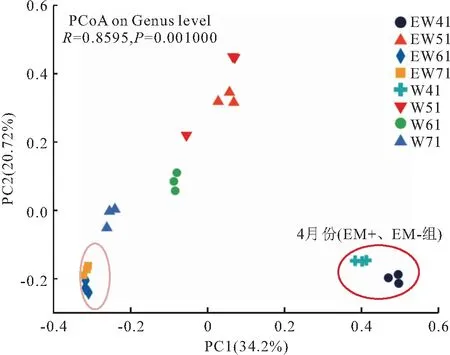
图2 基于属水平的主坐标分析结果Fig.2 Result of principal co-ordinates analysis(PCoA)based on the genus level
2.3 菌群结构组成
样本在门水平的物种组成结构(图3)结果显示,在实验开始(I期),实验组与对照组优势菌门(丰度大于1%)都为拟杆菌、变形菌、放线菌、蓝细菌、Verrucomicrobiota。在Ⅱ期,实验组绝对优势菌为变形菌(43.98%),高于对照组(30.76%),厚壁菌门为对照组的绝对优势菌丰度为46.22%,高于实验组(1.56%)。在Ⅲ期和Ⅳ期,实验组的丰度最高菌为拟杆菌,丰度分别为42.07%、38.52%;而对照组丰度最高菌为放线菌,丰度分别为71.83%%、31.37%;此外,放线菌在实验组为优势菌,分别为23.65%、26.34%;而拟杆菌在对照组含量丰度相对低,为2.22%、19.28%。变形菌在养殖水体整个采样期都为优势菌,在实验组(20.25%~43.98%),对照组(14.77%~30.76%);绿弯菌仅在养殖后期(Ⅲ期和Ⅳ期)丰度增加,高于1%,实验组分别为2.18%、2.31%,对照组分别为3.48%、13.21%;蓝细菌在实验组的养殖前期丰度较大,但在后期(Ⅲ期和Ⅳ期)丰度小于1%,而在对照组整个采样期都为丰度大于1%的优势菌门出现,说明添加EM菌可以改变影响养殖水体的菌群结构,且对蓝藻有一定的控制和抑制效应。

图3 基于门水平的细菌组成结构Fig.3 The microbiota composition at Phylum level
水体微生物群落丰度大于1%的菌属如图4所示,在实验前期(Ⅰ期和Ⅱ期),同一月份的实验组和对照组聚为一类,在实验后期(Ⅲ期和Ⅳ期),实验组聚为一类,这和PCoA分析结果一致。水体中的主要菌属为Dinghuibacter、norank-f-norank-o-chloroplast、分支杆菌属(Mycobacterium)、黄杆菌属(Flavobacterium)等,实验组Ⅰ期最优势菌属为黄杆菌属(35.57%),Ⅱ期norank-f-norank-o-chloroplast(37.86%),Ⅲ期和Ⅳ期皆为Dinghuibacter(40.18%~32.87%);对照组Ⅰ期最优势菌属为黄杆菌属(8.52%),Ⅱ期微小杆菌属(Exiguobacterium40.44%),Ⅲ期CL500-29-marine-group(26.74%),Ⅳ期Dinghuibacter(15.06%)。Dinghuibacter主要存在于实验组Ⅲ期和Ⅳ期,而对照组主要为分支杆菌属,黄杆菌属主要存在于实验组和对照组的Ⅰ期水体中,在其余时期皆低于1%。
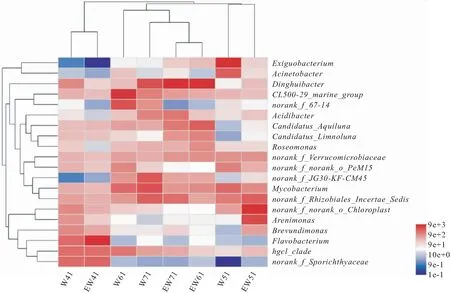
图4 两种处理下的优势菌属热图Fig.4 Heatmap of dominant bacteria at the genus level under the two treatments
2.4 菌群差异分析
所有样品进行菌属差异分析,显著差异菌属主要为Dinghuibacter、分支杆菌属、黄杆菌属、微小杆菌属、酸化菌属(Acidibacter)(图5)。将这5种差异菌属在同一采样期进行单独差异分析显示,Dinghuibacter丰度在实验开始(Ⅰ期)两组含量都较低,且实验组极显著低于对照组,但在之后实验期(Ⅱ、Ⅲ和Ⅳ)实验组中丰度明显增加,丰度都显著高于对照组;黄杆菌属(Flavobacterium)实验开始(Ⅰ期)含量高,在实验组极显著高于对照组,但在之后实验期实验组中丰度明显降低;微小杆菌属显示有差异,但在两组同一时期单独分析显示结果为差异不显著;实验前期,分支杆菌属差异不显著,但在Ⅲ期和Ⅳ期,对照组水体中分支杆菌属相对丰度极显著高于实验组。
2.5 菌群与水质理化因子相关性

图6 优势菌属与水质理化因子之间的RDA分析Fig.6 RDA bioplot of water environment factors and differential microorganismsB1:Dinghuibacter;B2:Mycobacterium;B3:Flavobacterium;B4:norank_f_norank_o_chloroplast;B5:Exiguobacterium;B6:CL500_29_marine-group;B7:Acidibacter;B8:Norank_f_Rhizobiales_Incertae_Sedis
3 讨论
水质的优劣是衡量水产养殖特别是集约化水产养殖成败的关键,加强对池塘养殖水质的净化,已成为社会和养殖系统本身关注的重要问题,也是池塘养殖可持续发展的迫切需要[14]。微生物修复已被广泛应用于养殖水体的调控净化[15]。微生物修复即为有益微生物的净水生态过程,通过菌群分泌的各种酶将养殖水体中不断产生的残余饵料、排泄物等有机物,通过其氧化、氨化、反硝化、解磷、硫化、固氮等作用迅速分解,有效降低水体氨氮和亚硝酸盐等有害物质的浓度[17]。水质净化是一系列生物化学反应,单一菌种微生物在控制、净化水质方面都有一定的局限性[18-19]。赵留群等[20]得出内含芽孢杆菌、酿酒酵母、植物乳杆菌、光合细菌的EM菌改善水质的效果优于单一的芽孢杆菌与海洋红酵母。陈红菊等[21]将筛选的氨氮降解菌用于养殖水体水质调控,具有明显的降氨氮特性,并能有效增加藻类数量,但对亚硝酸盐降解效果不显著。因此实际应用中,往往需要多种菌组合的复合有益菌参与共同发挥作用,改善水质,维持水产养殖环境的生态平衡[22]。本研究采用日本比嘉照夫发明的包含乳酸菌、酵母菌、光合菌和放线菌4大类为主的EM复合益生菌,在三个月试验期,显著增加水体微生物多样性,显著降低水体亚硝酸的含量,而课题组李士恒等[15]研究得出,在一个月四次采样后期显著降低氨氮,但是亚硝酸盐降解效果不显著,说明养殖水体微生物修复需要一定的效应期,需长期合理使用复合益生菌。
复合益生菌对水体菌群的影响相对复杂,也容易受到外界气温等环境条件变化的限制[23-24]。本研究中,加州鲈鱼养殖水体的菌群结构在不同月份,同一月份不同处理组都发生变化。I期和Ⅱ期,同一月份采样样品距离较近,试验前期环境的变化对水体菌群相比较EM菌的添加影响更大,但养殖实验后期(Ⅲ期和Ⅳ期)EM实验组样品间相比对照组距离更近,且样品间重叠,说明合理使用EM菌一段时间可以稳定养殖池溏的菌群结构。菌群结构显示,在一个月实验期后(Ⅱ期),厚壁菌门在实验组的含量(1.56%)显著低于对照组(46.22%)。表明复合益生菌中的一些菌或者分泌的产物可能对水体本身的厚壁菌有竞争性或抑制效果,导致厚壁菌显著变少,这一结果和郑佳佳[25]研究复合益生菌对草鱼养殖水体水质和菌群结构的影响一致,且其厚壁菌减少更多,为91.21%。在Ⅲ期和Ⅳ期,实验组的丰度最高菌为拟杆菌(42.07%、38.52%),显著高于对照组(2.22%、19.28%),根据WAGNER[26]等关于废水生物处理反应器中细菌群落结构的研究,拟杆菌一直是废水处理系统中的最优势类群。拟杆菌是藻类衍生碳水化合物最主要的分解者,除此之外还可分解蛋白质和脂质等复杂结构营养物质,水体中拟杆菌的存在可积极推动水体碳和营养循环。其中实验组中拟杆菌主要为Dinghuibacter(40.18%~32.87%),隶属于Chitinophagaceae科,李继兵[27]应用DNA的稳定同位素探针(DNA-SIP)和高通量测序技术首次证实Chitinophagaceae对菲有降解能力。此外,Dinghuibacter也是调节小龙虾肠道和养殖水体重要的关键菌属[28]。在Ⅲ期和Ⅳ期,复合益生菌的使用极显著降低了养殖水体中分支杆菌属相对丰度(P≤0.001),分支杆菌多数为致病菌,通过浸泡的方式可致条纹鲈、鲟鱼、斑马鱼等水生动物感染[29-32],严重可产生爆发性死亡。
4 结论
综上所述,在传统养殖池塘长期定期泼洒复合益生菌,可降低水体亚硝酸盐,改善养殖水体水质,增加水体微生物物种多样性,调节水体菌群结构,减少致病菌群的丰度,使养殖水体的生态系统稳定性有所提高。复合有效微生物减少池塘养殖的负荷,利于养殖水体的原位修复,应大力推广,促进池塘养殖可持续绿色发展。
