基于网络药理学和动物实验探讨贯叶金丝桃黄酮类成分对缺血性脑损伤的治疗作用
2023-09-19刘庆焕刘伟伟
张 岩,刘庆焕,王 宏,康 利,刘伟伟,陈 冠,傅 予
(天津市医药科学研究所,天津 300020)
贯叶金丝桃为藤黄科金丝桃属植物贯叶金丝桃HypericumperforatumL.的干燥地上部分,具有多种药理作用,为近年来研究的热点草药之一[1]。贯叶金丝桃中黄酮类成分含量丰富,为其主要活性成分之一,具有抗炎、抗病毒、抗肿瘤等多种生理活性,可用于防治心脑血管疾病[2-4]。缺血性脑损伤具有高发病率和致残率,为严重危害人类生命健康的脑血管意外多发病[5]。研究证实黄酮类化合物对缺血性脑损伤具有保护作用[6],因此推测贯叶金丝桃中黄酮类成分可能对缺血性脑损伤有一定保护作用。
网络药理学在揭示药物、疾病关系方面具有整体性和系统性的特点,这与中药多组分、多靶点的治病特点相吻合[7-8]。因此,本研究拟采用网络药理学方法揭示贯叶金丝桃中黄酮类成分对缺血性脑损伤的治疗作用,探讨其多成分、多靶点的作用机制,并采用动物实验对其作用靶点进行验证,以期为进一步研究其治疗缺血性脑损伤的作用机制奠定基础。
1 材料与方法
1.1 网络药理学
1.1.1 贯叶金丝桃中黄酮类活性成分及靶点筛选 基于中草药药理学分析平台TCMSP (https://tcmspw.com/tcmsp.php) 检索贯叶金丝桃中黄酮类成分,并筛选口服生物利用度(OB) 值>30%、类药性(DL) 值>0.18 的黄酮类成分;结合前期工作并检索文献数据库获取贯叶金丝桃中含有的已被证实的黄酮类药效成分,对于没有收载的成分则利用ChemDraw 软件绘制成分结构并在molsoft 分析平台上(http://www.molsoft.com/mprop/) 进行类药性预测,选取类药性评分0.9 以上的成分。综合检索结果,最终获得贯叶金丝桃中黄酮类活性成分。
利用TCMSP 平台检索黄酮类活性成分的相关靶点,对于平台中没有收录靶点的成分,通过SwissTargetPredicition(https://www.swisstargetprediction.ch) 靶点预测平台进行靶点预测。
1.1.2 检索缺血性脑损伤靶点 以“stroke” “cerebral ischemia” “ischemia” 为关键词,利用TTD (https://bidd.nus.edu.sg/BIDD-Databases/TTD/TTD.asp) 数据库、DrugBank (https://www.drugbank.ca) 数据库检索缺血性脑损伤疾病的相关靶点。
1.1.3 活性成分治疗缺血性脑损伤潜在靶点预测 利用VENNY 2.1 平台 (https://bioinfogp.cnb.csic.es/tools/venny/index.html) 对成分靶点和疾病靶点构建韦恩图,并取交集以获得两者共有靶点,即为贯叶金丝桃黄酮类成分治疗缺血性损伤疾病的潜在靶点。
1.1.4 药物成分-靶点-疾病网络构建 对贯叶金丝桃中黄酮类成分、缺血性损伤疾病及其相关靶点构建网络分析模型并利用Cytoscape 软件进行可视化分析。
1.1.5 潜在靶点PPI 网络构建与分析 利用SRING 在线分析平台(https://string-db.org/) 获取潜在靶点蛋白与蛋白间相互作用关系(PPI),并将分析结果导入Cytoscape 3.2.1 软件进行可视化分析,并根据度值(Degree) 大小设置节点的大小、颜色,获得最终的PPI 网络。通过网络节点中心性和网络模块2 种计算方式对PPI 网络进行综合分析,从中筛选贯叶金丝桃黄酮类成分治疗缺血性脑损伤的关键靶点。
1.1.6 靶点生物功能和通路分析 使用Metascape 数据库,限定物种为人,设定阈值P<0.01,综合获取贯叶金丝桃黄酮类成分治疗缺血性脑损伤相关靶点的生物功能注释信息,并根据P值和富集结果对靶点基因本体论(GO) 和KEGG通路进行筛选分析。
1.2 动物实验
1.2.1 动物 SPF 级健康雄性SD 大鼠40 只,体质量160~180 g,由北京维通利华实验动物技术有限公司提供[实验动物生产许可证号SCXK (京) 2016-0006],所有动物实验部分均符合天津市医药科学研究所动物伦理委员会的要求(伦理号IMPS-EAEP-Z-Z2019017-01)。
1.2.2 药物与试剂 贯叶金丝桃 (产地为四川,批号20190503) 购于亳州中药材批发市场,经天津市医药科学研究所王文彤研究员鉴定为藤黄科植物贯叶金丝桃HypericumperforatumL.的干燥地上部分,取500 g 贯叶金丝桃药材碎成粗粉,用60%乙醇加热回流提取,过滤,滤液减压回收乙醇至无醇味,加沸水溶解后抽滤,滤液用AB-8 大孔树脂纯化,不同体积分数乙醇溶液洗脱,收集60%乙醇洗脱液,浓缩干燥,即得总黄酮提取物[9]。尼莫地平片(规格30 mg/片,批号2003004,天津市中央药业有限公司);AB-8 大孔吸附树脂(批号20201110,英德市东鸿化工科技有限公司);红四氮唑 (TTC,货号L09A10S83253,上海源叶生物科技有限公司);线栓(货号2432-A4,北京西浓科技有限公司)。
1.2.3 模型制备 术前大鼠禁食不禁水12 h,腹腔注射10%水合氯醛(3.5 mL/kg) 进行麻醉,常规消毒,分离皮下组织,暴露颈内动脉(ICA)、颈外动脉(ECA) 和右侧颈总动脉 (CCA),用5-0 号丝线结扎CCA 和ECA,在CCA 距离分叉处0.5 cm 左右剪一小口,将线栓送入切口并经ICA 顺行至中动脉,遇到阻力时停止,即完成一侧的MCAO 模型[10],结扎ICA,缝合切口,2 h 后轻轻抽出线栓;假手术组只分离血管,不插线栓。术中白炽灯照射,使肛温保持在(37±0.5)℃。
1.2.4 分组及给药 将造模成功的大鼠按体质量随机分为模型组、尼莫地平组(阳性对照,0.012 g/kg,相当于临床用量的6 倍)、总黄酮组(0.012 4 g/kg,折合为生药量5.491 g/kg,相当于临床用量的4 倍)。造模当天开始灌胃给药,每天1 次,连续7 d;假手术组和模型组灌胃给予等体积纯净水。
1.2.5 脑梗死面积比例测定 给药结束后,大鼠断头取脑组织,冷盐水冲洗,于-20 ℃放置10 min,切除嗅球、垂体、低位脑干,由前向后冠状等分切成5 片。取脑片置于1% TTC 磷酸盐缓冲液中,37 ℃避光温育30 min,每5 min翻动1 次,并用4% 多聚甲醛固定。正常脑组织呈玫瑰红色,梗死组织呈白色,精确剥离梗死组织,电子天平精密称量梗死组织和全脑的质量并记录[11]。公式为脑梗死面积比例=(梗死部位质量/全脑质量) ×100%。
1.2.6 HE 染色观察脑组织病理变化 取大鼠脑组织,用10%甲醛溶液固定,常规HE 染色,于显微镜下观察脑组织皮质的形态学改变。
1.2.7 Western blot 法检测脑组织INS、VEGFA、TNF-α 蛋白表达 取大鼠脑组织,提取总蛋白,经电泳、转膜、封闭后,孵育一抗、二抗,显影发光后计算目的蛋白相对表达。
1.2.8 统计学分析 通过SPSS 16.0 软件进行处理,计量资料以(±s) 表示,多组间比较用单因素方差分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 贯叶金丝桃黄酮类活性成分筛选 筛选得到贯叶金丝桃黄酮类成分有5 种,分别为槲皮素、儿茶素、山柰酚、木犀草素和表儿茶素。结合前期检测结果和文献报道发现,贯叶金丝桃中异槲皮苷、金丝桃苷、阿福豆苷、紫云英苷、芦丁均可进入体内代谢并具有药理活性,经预测槲皮素-3-O-β-D-吡喃阿拉伯糖苷类药性评分为0.93,说明其成药性良好。因此将上述11 种成分作为贯叶金丝桃黄酮类活性成分进行后续研究,活性成分信息见表1。
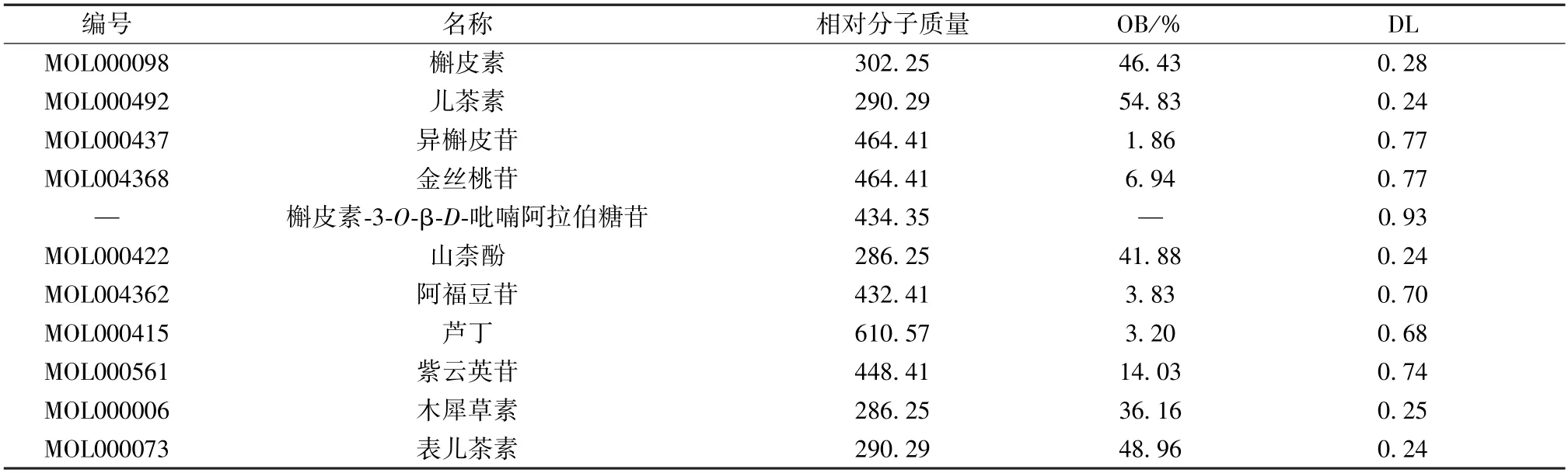
表1 贯叶金丝桃黄酮类化学成分
2.2 黄酮类活性成分治疗缺血性脑损伤潜在靶点筛选 经数据库检索和预测共获得11 种活性成分的222 个潜在靶标。TTD、DrugBank 数据库中检索的疾病靶点去除重复值,共得到539 个缺血性脑损伤靶点。利用VENNY 2.1 平台构建韦恩图(图1) 取交集,最终获得活性成分治疗缺血性脑损伤疾病的76 个潜在靶点。
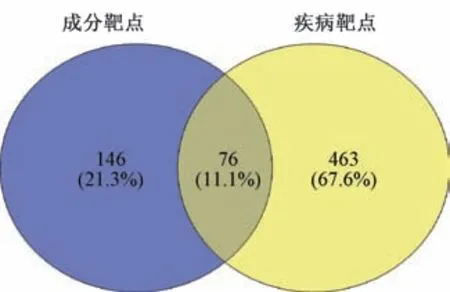
图1 成分-疾病靶点韦恩图
2.3 药物成分-靶点-疾病网络构建 “成分-靶点-疾病”网络如图2 所示,共有702 个节点,946 条边,图中绿色代表11 种黄酮类成分,黄色表示成分靶点,蓝色表示疾病靶点,红色为76 种成分治疗疾病的潜在靶点,其中成分节点大小按Degree 值的高低进行设定,节点越大表示其可作用的潜在靶点越多,靶点边线越多反映与其作用的成分越多,体现了贯叶金丝桃在治疗缺血性脑损伤时具有多成分、多靶标的特点。
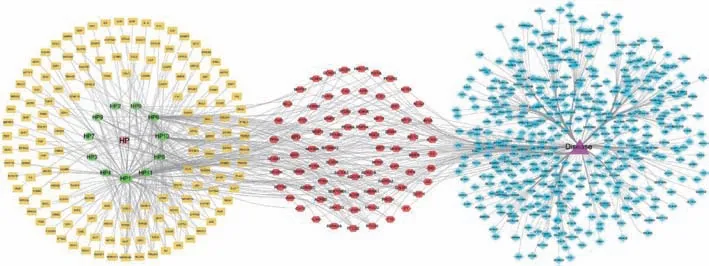
图2 成分-靶点-疾病网络
2.4 潜在靶点PPI 网络构建与分析 利用SRING 在线分析平台获取潜在靶点的PPI,76 个靶点中只有74 个靶点具有相互作用,将具有相互作用的靶点进行可视化分析,获得最终的PPI 网络(图3),节点越大、颜色越红表示与该节点相关作用的靶点越多,其在网络中的地位越重要。
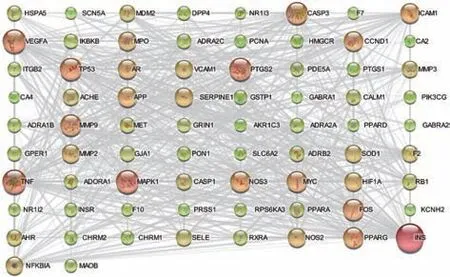
图3 PPI 网络
基于Cytoscape 软件对PPI 网络靶点进行包括介度中心性(图4A)、度中心性(图4B) 和接近中心性(图4C)在内的网络节点中心性进行计算分析,分别筛选位于前十位的靶点建模;基于网络模块计算拓扑参数,建立并选取评分最高的MCODE 模型(图4D)。综合2 种方式计算结果,取交集并进行加权评分得到6 个关键性靶点INS、VEGFA、TNF、MAPK1、TP53、FOS,其中排名前三位的靶点分别为INS、VEGFA、TNF,推测其为贯叶金丝桃总黄酮治疗缺血性脑损伤的关键靶点。
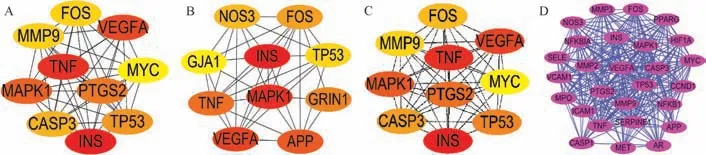
图4 PPI 网络分析模型
2.5 靶点生物功能和通路分析 GO 分析结果显示,贯叶金丝桃关键靶点主要涉及了细胞质膜微囊、质膜筏和神经元投射细胞质等细胞成分;具有RNA 聚合酶Ⅱ基础转录因子结合、无序结构域特异性结合、组蛋白乙酰转移酶结合等分子功能;并且参与了缺氧反应中RNA 聚合酶Ⅱ启动子转录的正调控、急性炎症反应的负调控和神经元投射维持等生物过程,表明贯叶金丝桃黄酮类成分对缺血性脑损伤的治疗作用与其对神经调节和缺氧反应调节有关,见图5。
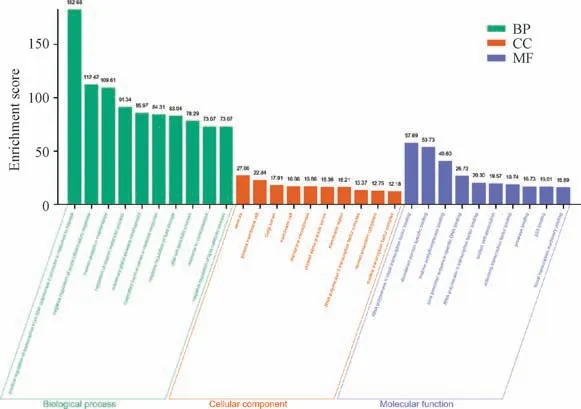
图5 GO 分析结果
KEGG 通路富集分析发现,关键靶点发挥作用的主要通路为癌症通路、卡波西肉瘤相关疱疹病毒感染、PI3KAkt 信号通路、流体剪应力与动脉粥样硬化、人巨细胞病毒感染等信号通路,表明贯叶金丝桃黄酮类成分对缺血性脑损伤的治疗作用与其对这些通路的调控密切相关,见图6。
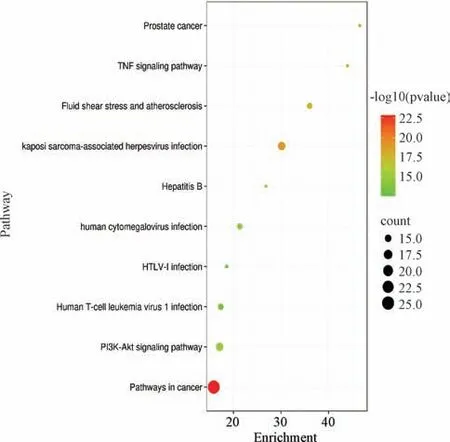
图6 KEGG 通路分析结果
2.6 贯叶金丝桃总黄酮对MCAO 大鼠缺血性脑损伤的影响
2.6.1 贯叶金丝桃总黄酮对MCAO 大鼠脑梗死面积比例的影响 如图7、表2 所示,与假手术组比较,模型组大鼠脑组织出现明显的脑缺血损伤现象,脑梗死面积比例增加(P<0.01);与模型组比较,阳性药组和总黄酮组大鼠脑梗死面积比例均减少(P<0.01)。结果表明贯叶金丝桃总黄酮可以有效改善模型大鼠的脑缺血损伤程度。
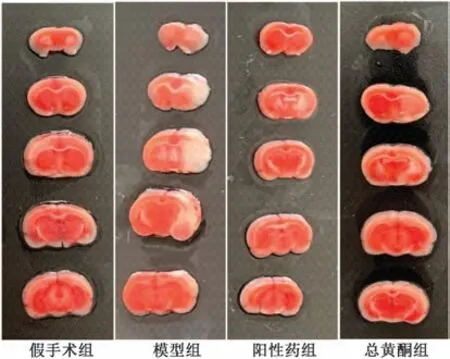
图7 各组大鼠脑组织TTC 染色
表2 贯叶金丝桃总黄酮对MCAO 大鼠脑梗死面积比例的影响(±s,n=5)

表2 贯叶金丝桃总黄酮对MCAO 大鼠脑梗死面积比例的影响(±s,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01。
组别脑梗死面积比例/%假手术组0模型组26.25±3.56**尼莫地平组7.87±2.53##总黄酮组10.25±2.70##
2.6.2 贯叶金丝桃总黄酮对MCAO 大鼠脑组织病理变化的影响 如图8 所示,假手术组大鼠大脑皮层神经细胞、胶质细胞及毛细血管形态正常,结构完整,核仁清晰,胞浆无红染;模型组大鼠缺血侧大脑皮层神经元大片消失,锥体细胞明显减少,排列紊乱,胞体变小,尼氏小体消失,核固缩深染,胞浆红染,变性坏死后形成大量空泡,小胶质细胞增生明显,脑组织水肿,细胞间隙增宽;与模型组比较,阳性药组和总黄酮组大鼠缺血侧大脑皮层病变明显减轻,坏死神经元减少,锥体细胞数量增多,形态结构趋于正常,细胞核较规则,少量神经元胞体变小,偶见胶质细胞或巨噬细胞增生。结果表明贯叶金丝桃总黄酮可改善缺血性脑组织皮层病变,恢复神经元细胞形态结构。
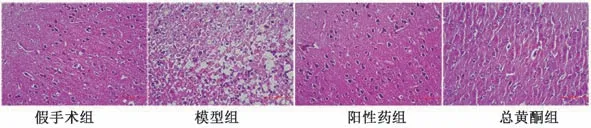
图8 各组大鼠脑组织皮层HE 染色(×200)
2.6.3 贯叶金丝桃总黄酮对MCAO 大鼠脑组织INS、VEGFA 和TNF-α 蛋白表达的影响 网络药理学研究结果显示,INS、VEGFA 和TNF-α 为贯叶金丝桃总黄酮治疗缺血性脑损伤中评分最高的3 个关键靶点。为了验证网络分析结果的准确性,本研究对大鼠脑组织INS、VEGFA 和TNFα 蛋白表达进行了检测,如图9、表3 所示,与假手术组比较,模型组大鼠脑组织INS、VEGFA 和TNF-α 蛋白表达均升高(P<0.01);与模型组比较,总黄酮组大鼠脑组织INS和TNF-α 蛋白表达降低(P<0.05,P<0.01),VEGFA 蛋白表达升高(P<0.05)。
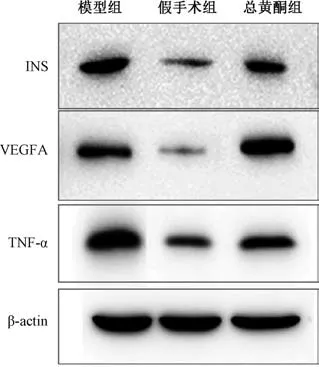
图9 各组大鼠脑组织INS、VEGFA 和TNF-α 蛋白表达
表3 贯叶金丝桃总黄酮对MCAO 大鼠脑组织INS、VEGFA 和TNF-α 蛋白表达的影响(±s,n=5)
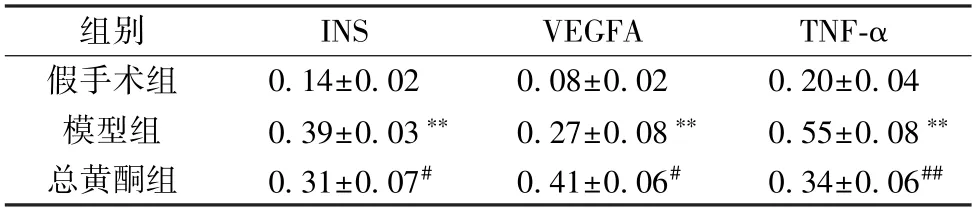
表3 贯叶金丝桃总黄酮对MCAO 大鼠脑组织INS、VEGFA 和TNF-α 蛋白表达的影响(±s,n=5)
注:与假手术组比较,**P <0.01;与模型组比较,#P <0.05,##P<0.01。
组别INSVEGFATNF-α假手术组0.14±0.020.08±0.020.20±0.04模型组0.39±0.03**0.27±0.08**0.55±0.08**总黄酮组0.31±0.07#0.41±0.06#0.34±0.06##
3 讨论
本研究结果显示,贯叶金丝桃在治疗缺血性脑损伤疾病中体现了多成分、多靶点协同治疗的特点,其治疗靶点间存在着相互关系,共同发挥作用,其中INS、VEGFA、TNF、MAPK1、TP53 和FOS 在整个复杂的靶点网络中具有核心调节作用,排名前三位的关键靶点为INS、VEGFA 和TNF。VEGF 为检测脑梗死的一个重要指标,参与了血管的渗透性、脑组织水肿及神经功能的调节[12]。TNF 为重要的炎症因子,其包含2 个成员TNF-α 和TNF-β,TNF-α 影响脑缺血区域细胞的坏死及凋亡程度[13]。研究显示TNF-α 与INS 协同作用于脑梗死的发生发展过程,影响急性脑梗死患者的神经受损状况及预后,并且TNF-α 可促使VEGF 产生调控障碍,促进脑卒中的形成和发展[14]。
KEGG 通路富集发现,贯叶金丝桃黄酮类成分可通过癌症通路、卡波西肉瘤相关疱疹病毒感染、PI3K-Akt 信号通路、流体剪应力与动脉粥样硬化、人巨细胞病毒感染等多个通路发挥作用,表明贯叶金丝桃中黄酮类成分对缺血性脑损伤的治疗具有多成分、多靶点、多通路的作用特点,充分体现了中药整体性、系统性的治病机制。
缺血性脑损伤的形成是由于局部脑血流的突然持续中断,导致了大脑处于缺血缺氧状态,造成了神经功能障碍等脑组织损伤甚至坏死[15],因此对缺血缺氧状态及恢复神经功能损伤的调节是治疗缺血性脑损伤的重要途径。经网络分析发现贯叶金丝桃黄酮类成分关键靶点参与了缺氧反应中RNA 聚合酶Ⅱ启动子转录的正调控、急性炎症反应的负调控和神经元投射维持等生物过程,表明贯叶金丝桃黄酮类成分可用于神经调节、缺氧反应调节和炎性反应调节,初步印证了贯叶金丝桃黄酮类成分可用于治疗缺血性脑损伤,并能减轻缺血性脑损伤引起的神经炎性反应。
为了验证网络分析结果,本研究通过动物实验进一步探讨了贯叶金丝桃总黄酮改善缺血性脑损伤的治疗作用,结果表明贯叶金丝桃黄酮类成分可减轻大鼠脑缺血损伤程度,改善缺血性脑组织皮层及神经元细胞形态结构病变,上调缺血脑组织VEGFA 蛋白表达,下调INS 和TNF 蛋白表达,进而使脑缺血状态和神经功能得以恢复。
综上所述,本研究证实了贯叶金丝桃总黄酮对缺血性脑损伤的治疗作用,该作用可能是通过调控关键靶点INS、VEGFA 和TNF-α 的表达来实现,这与网络药理学分析结果一致,说明该研究方法准确可靠,能为贯叶金丝桃总黄酮在缺血性脑损伤治疗方面的开发应用及作用机制深入研究提供科学依据。
