大蝎子草质量标准及指纹图谱研究
2023-09-19黎廷楷赵旭萍张敬杰孙宜春李慧馨刘亚华
黎廷楷,邹 娟,赵旭萍,杨 菁,张敬杰,何 康,孙宜春,李慧馨,刘亚华*
[1.贵州中医药大学,贵州 贵阳 550025;2.国药集团(贵州) 同济堂制药有限公司,贵州 贵阳 550009]
大蝎子草Girardiniadiversifolia(Link) Friis 为荨麻科蝎子草属多年生草本植物[1],又名掌叶蝎子草[2]、红活麻[3]、虎掌荨麻[4],主要分布于湖北、四川、贵州、云南等地[5],可用于治疗银屑病[2]、咳嗽痰多、水肿、疮毒[5]、丘疹、湿疹、荨麻疹[6]等疾病。现代研究发现,其含有三萜,甾体,黄酮,挥发油等成分[7-10],具有抗炎镇痛[11-13]、抗风湿[14]、抗菌[15]等作用。大蝎子草目前仅在《全国中草药汇编》[5]中有收载,但仅有其别名、来源、形态特征、生境分布、采集加工、性味功能、主治用法等,缺少TLC 鉴别、含量测定等相关质量控制内容,仅有单独成分的含量作为质控方法[9],专属性差,很难有效控制其质量。因此,为提高其用药质量,迫切需要对该药材建立质量标准。
鉴于此,本研究依据2020 年版《中国药典》及《国家药品标准工作手册》 中相关规定对大蝎子草水分、总灰分、酸不溶性灰分、浸出物进行研究;并对大蝎子草进行TLC 鉴别,采用HPLC 法建立大蝎子草药材的指纹图谱,并对其进行主成分分析及聚类分析,旨在建立大蝎子草的质量标准,以期为大蝎子草药材的质量控制提供参考依据,以便更好地开发和利用该药材。
1 材料
LC-2030C 型高效液相色谱仪 (日本岛津公司);Agilent C18色谱柱(250 mm×4.6 mm,5 μm)(美国Agilent 公司);JA2003 型电子天平(上海浦春计量仪器有限公司);OSB-2200 型油浴锅(上海爱朗仪器有限公司);SHZ-DIII 型循环水真空泵(巩义市予华仪器有限责任公司);SK8210HP 型超声波清洗器(上海科导超声仪器有限公司);高效硅胶G 薄层板(青岛海洋化工有限公司);GZX-9070MBE 型电热鼓风干燥箱(上海博讯实业有限公司医疗设备厂);点样毛细管(上海垒固仪器有限公司);ZF-7 型暗箱式三用紫外分析仪(上海嘉鹏科技有限公司)。
秦皮素、对羟基肉桂酸、紫云英苷、木犀草素、芹菜素对照品(北京索莱宝科技有限公司,纯度≥98%);东莨菪内酯对照品(成都普思生物科技股份有限公司,纯度≥98%)。甲醇、乙腈(色谱纯,美国Tedia 公司);甲酸(国药集团化学试剂有限公司);其余试剂均为分析纯;水为纯净水(杭州娃哈哈集团有限公司)。
大蝎子草来源见表1,经贵州中医药大学药学院吴之坤副教授鉴定来源为荨麻科蝎子草属大蝎子草Girardiniadiversifolia(Link) Friis。
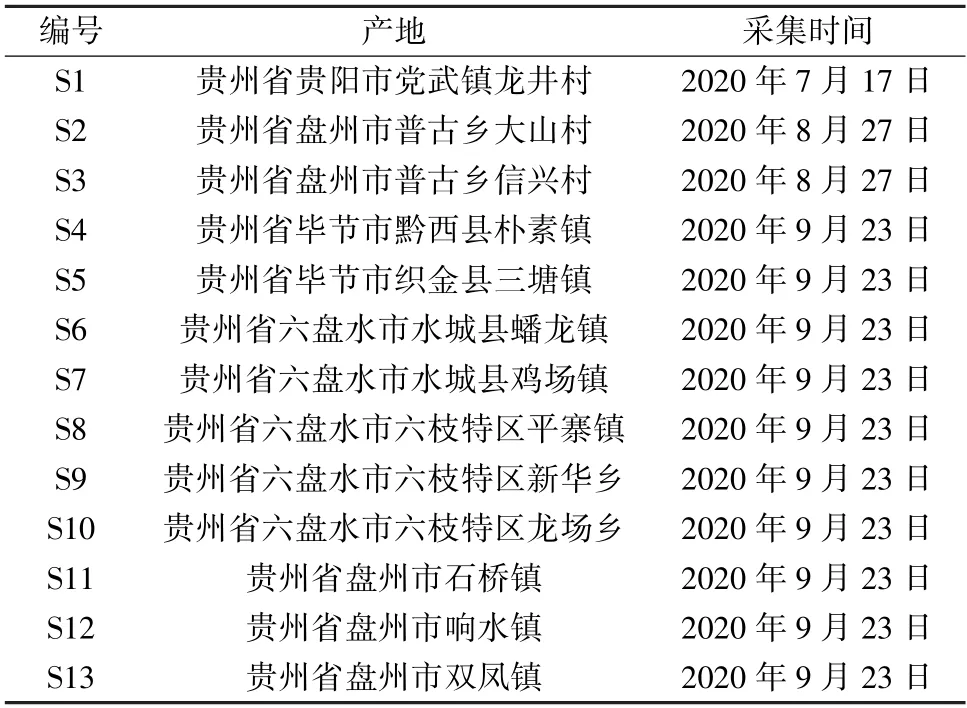
表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 TLC 鉴别 精密称取大蝎子草粉末4 g,加入95%乙醇50 mL,回流提取2 h,过滤,滤液蒸干,残渣加入1.5%盐酸30 mL 超声溶解,放冷,加石油醚萃取3 次,每次15 mL,弃去石油醚层。再加乙酸乙酯萃取3 次,每次15 mL,合并乙酸乙酯液,加水洗涤至中性,经放有无水硫酸钠2 g 的滤纸过滤,蒸干,残渣加入2 mL 乙酸乙酯溶解,作为供试品溶液。取东莨菪内酯对照品适量,配成每1 mL 含有0.02 mg 东莨菪内酯的乙酸乙酯溶液,即为对照品溶液。按照2020 年版《中国药典》 四部通则0502[16],分别吸取对照品溶液、供试品溶液各2 μL,点于同一硅胶G 薄层板上,以甲苯-乙酸乙酯-甲醇(6 ∶2 ∶1) 为展开剂,展开,取出,自然晾干,置紫外光灯(365 nm) 下检视。结果,供试品与对照品在相应位置上显相同颜色的荧光斑点。见图1。
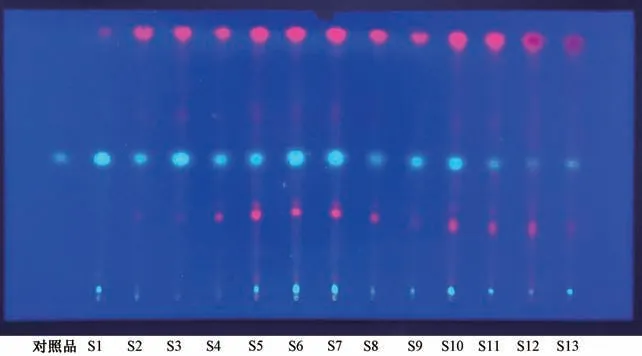
图1 大蝎子草薄层色谱图Fig.1 TLC chromatograms of G.diversifolia
2.2 水分、灰分、浸出物检查 采用《中国药典》 2020 年版第四部通则0832 水分测定法第二法烘干法测定水分;采用通则2302 灰分测定法测定灰分及酸不溶性灰分;采用通则2201 项下水溶性浸出物项热浸法,以水作溶剂,测定水溶性浸出物[16]。结果见表2。根据测定结果,参考2020 年版《中国药典》[17],建议大蝎子草水分为不得过13.0%,总灰分限度不得过21.0%,酸不溶性灰分不得过5.00%,浸出物不得少于14.0%。
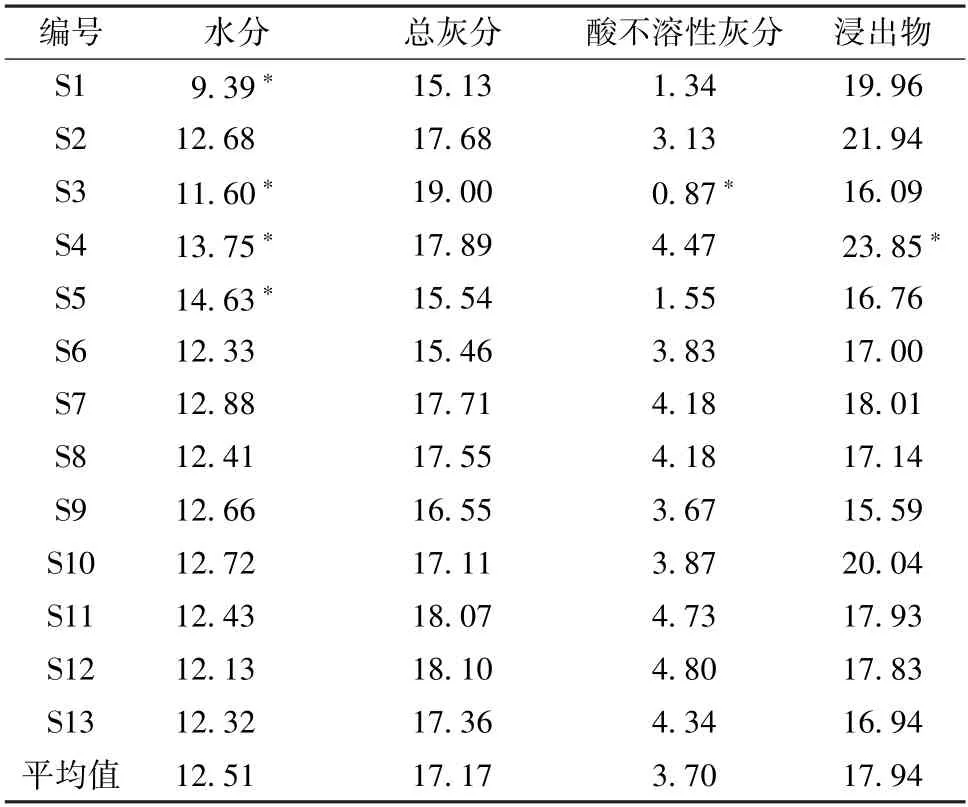
表2 大蝎子草的水分、灰分、浸出物含量测定结果(%)Tab.2 Results of content determination for water,ash and extract of G.diversifolia (%)
2.3 溶液制备
2.3.1 对照品溶液 分别精密称取对羟基肉桂酸、东莨菪内酯、紫云英苷对照品适量,加入甲醇,逐级稀释得到0.2 mg/mL、0.04 mg/mL、8 μg/mL、1.6 μg/mL、0.32 μg/mL 的对照品溶液。
2.3.2 供试品溶液 取大蝎子草粉末1 g,置100 mL 圆底烧瓶中,加入25 mL 60%甲醇,称定质量,回流提取60 min,冷却至室温,补足减失的质量,0.45 μm 微孔滤膜过滤,即得。
2.4 色谱条件 Agilent C18色谱柱(250 mm×4.6 mm,5μm);流动相0.1%甲酸(A)-乙腈(B),梯度洗脱(0~15 min,5%~8% B;15~45 min,8%~16% B;45~75 min,16%~30% B,75~95 min,30%~47%B;95~100 min,47%B);体积流量1.2 mL/min;柱温30 ℃;检测波长290 nm;进样量10 μL。
2.5 方法学考察
2.5.1 精密度试验 取大蝎子草粉末(S1) 适量,按“2.3.2” 项下方法制备供试品溶液,在“2.4” 项色谱条件下进样测定6 次,测得各色谱图的相似度均大于0.98,各共有峰的相对保留时间RSD 小于0.5%,相对峰面积RSD 小于1%,表明仪器精密性良好。
2.5.2 重复性试验 精密称定大蝎子草粉末(S1) 6 份,按“2.3.2” 项下方法制备供试品溶液,在“2.4” 项色谱条件下进样测定,测得各色谱图的相似度均大于0.97,各共有峰的相对保留时间RSD 小于0.4%,相对峰面积RSD 小于2.5%,表明该方法重复性良好。
2.5.3 稳定性试验 取大蝎子草粉末(S1) 适量,按“2.3.2” 项下方法制备供试品溶液,于0、2、4、6、8、12、24 h 在“2.4” 项色谱条件下进样测定,测得各共有峰的相对保留时间RSD 为0.05%~0.49%,相对峰面积RSD 为0.05%~1.5%,表明溶液在24 h 内稳定性良好。
2.6 指纹图谱结果分析
2.6.1 HPLC 指纹图谱的建立与峰的指认 将13批大大蝎子草粉末按“2.3.2” 项下方法制备供试品溶液,在“2.4” 项色谱条件下进样测定,记录HPLC 色谱图。将各色谱图以AIA 格式导入相似度软件,对相关数据进行自动匹配,见图2,共标定9 个共有峰。以所有样品共有的1 号色谱峰为参照峰,以其保留时间和峰面积为1。通过与对照品(图3) 进行比对,指认3 号峰为对羟基肉桂酸,4号峰为东莨菪内酯,6 号峰为紫云英苷。
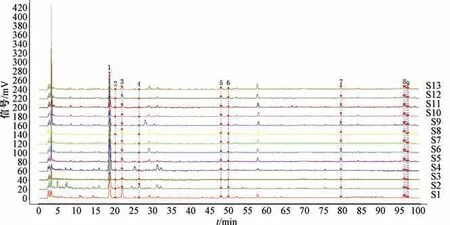
图2 大蝎子草HPLC 指纹图谱Fig.2 HPLC fingerprints of G.diversifolia
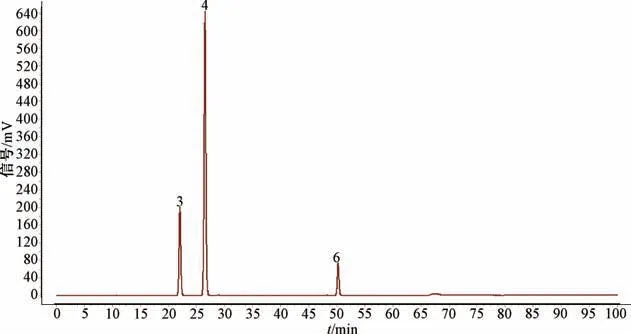
图3 对照品溶液HPLC 色谱图Fig.3 HPLC chromatograms of reference solutions
2.6.2 相似度评价 设定S1 为参照谱,采用多点校正,时间窗宽度为0.5,中位数法生成对照图谱,得出各色谱图的相似度。结果显示,各批大蝎子草相似度依次为0.916、0.986、0.989、0.985、0.995、0.982、0.994、0.950、0.980、0.971、0.989、0.991、0.991,在0.916~0.995 之间,从大蝎子草指纹图谱可知,根据产地分布的不同其所含成分有差异,其中贵州省贵阳市党武镇龙井村、贵州省六盘水市六枝特区平寨的差异最为明显。
2.6.3 聚类分析 将13 批大蝎子草指纹图谱中的9 个共有峰峰面积z-score 标准化。形成13×9 阶数据矩阵,导入SPSS 26.0 软件进行聚类分析,采用组间连接法进行系统聚类分析,聚类结果见图4。当欧式平方距离为25 时,可分为2 类,S1 (省贵阳市党武镇龙井村)、S8 (贵州省六盘水市六枝特区平寨) 聚为一类,其余聚为一类;当欧式平方距离为20 时,可分为3 类,S1、S8 聚为一类、S2~S4 聚为一类,其余聚为一类。
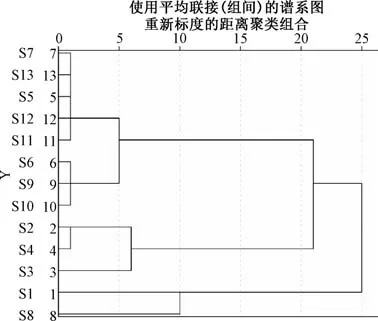
图4 大蝎子草聚类分析结果Fig.4 Results of cluster analysis for G.diversifolia
2.6.4 主成分分析 将13 批样品指纹图谱中的9个共有峰峰面积数据导入SPSS 26.0 软件进行主成分分析,以特征值>1 为标准得到3 种主成分,累计方差贡献率为89.246%,见表3。采用正交性旋转法,旋转后的成分矩阵见表4,得分系数矩阵见表5。通过Origin 软件做主成分分析得分图,见图5。由此可知,7~9 号共有峰对主成分1 具有较大的贡献;2~4 号共有峰对主成分2 具有较大的贡献,且4 号共有峰与主成分2 呈负相关;1、4、6号共有峰对主成分3 具有较大的贡献。
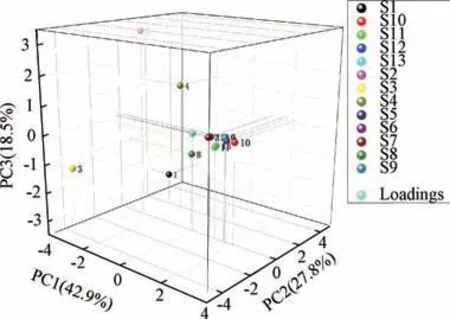
图5 大蝎子草主成分分析得分图Fig.5 Score diagram of principal compounds analysis for G.diversifolia
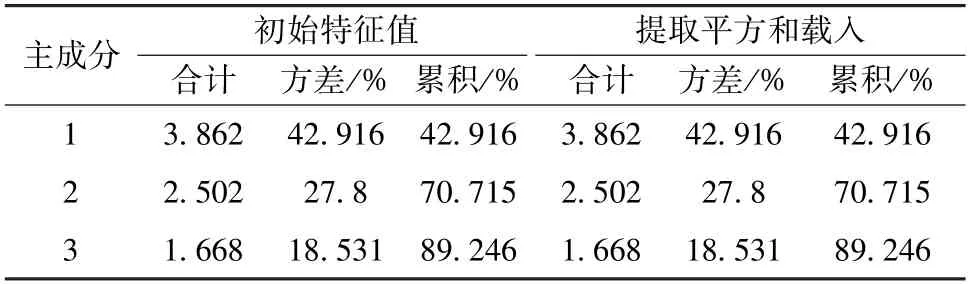
表3 大蝎子草主成分特征值及方差贡献率Tab.3 Principal compounds eigenvalues and variance contribution rates of G.diversifolia
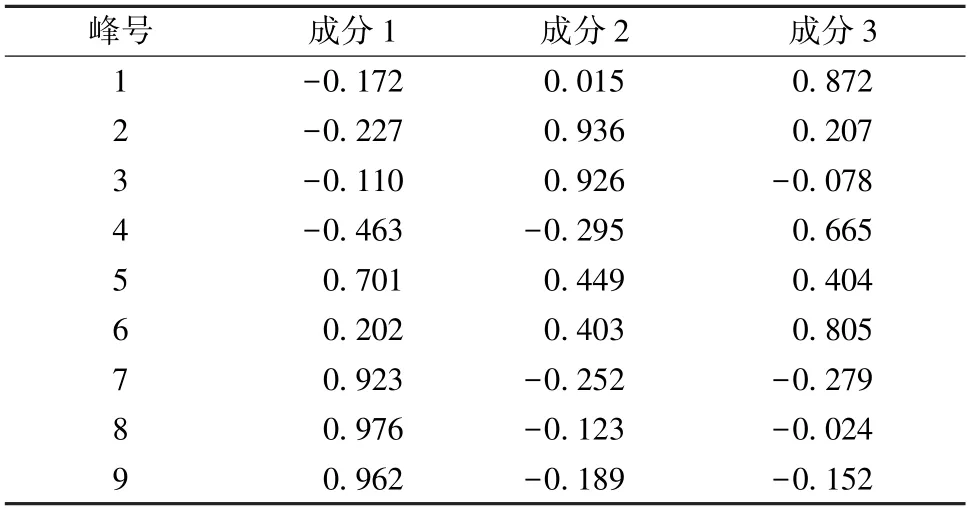
表4 大蝎子草旋转后的成分矩阵Tab.4 Composition matrix of G.diversifolia after rotation
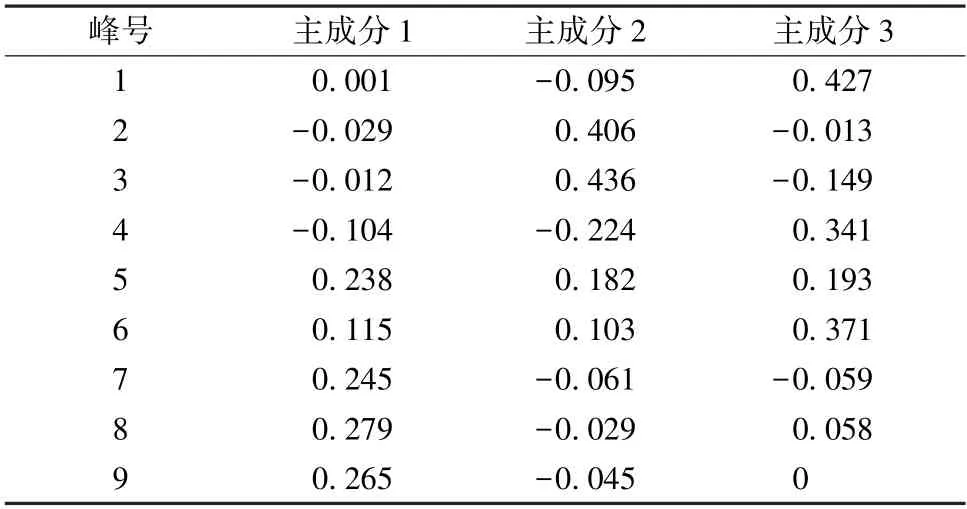
表5 大蝎子草主成分得分系数矩阵Tab.5 Score coefficient matrix of principal compounds of G.diversifolia
2.6.5 基于主成分分析建立贵州大蝎子草的质量综合评价模型 由表3、5 可知,选择Z1、Z2、Z3代表3 种主成分作为13 批大蝎子草所表达的成分信息,建立大蝎子草品质的评价模型,得出3种主成分的关系表达式分别为Z1=0.001X1-0.029X2-0.012X3-0.104X4+0.238X5+0.115X6+0.245X7+ 0.279X8+ 0.265X9,Z2=-0.095X1+0.406X2+0.436X3-0.224X4+0.182X5+0.103X6-0.061X7-0.029X8-0.045X9,Z3=0.427X1-0.030X2-0.149X3+0.341X4+0.193X5+0.371X6-0.059X7+0.058X8。将Z1、Z2、Z3与所对应的方差贡献率做内积,得到大蝎子草质量综合评价函数综合得分 (Z) 的表达式为Z=(42.916Z1+27.8Z2+18.531Z3)/89.246。贵州不同产地大蝎子草得分值及排序见表6。
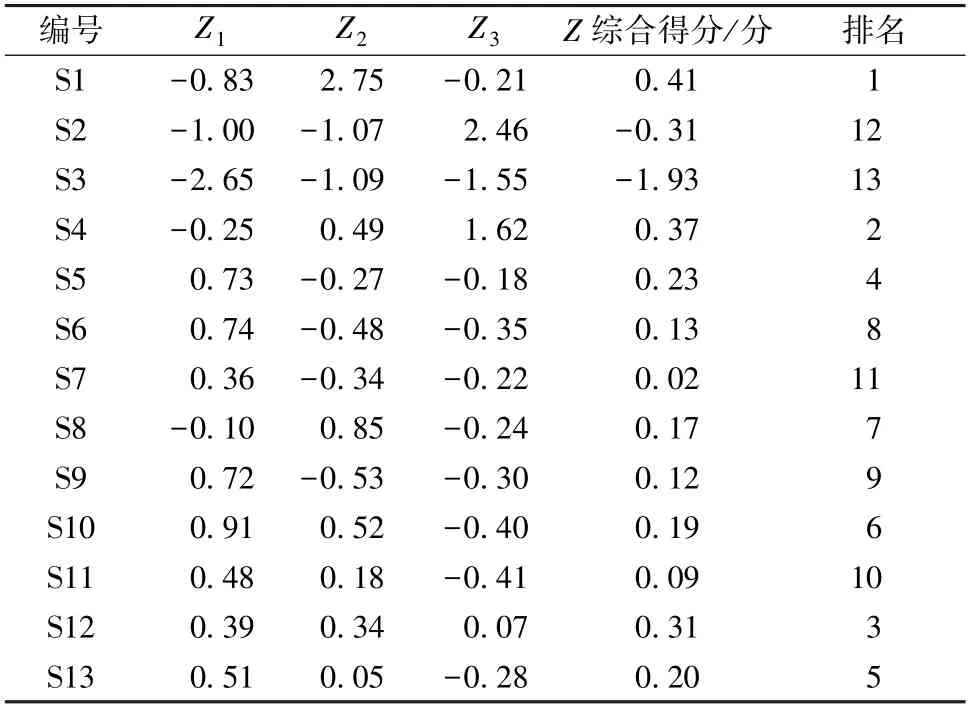
表6 大蝎子草得分值及排序Tab.6 Score values and ranking table of G.diversifolia
2.7 含量测定
2.7.1 线性关系考察 取“2.3.1” 项下对照品溶液适量,在“2.4” 项色谱条件下进样测定,以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,结果见表7,可知各成分线性关系良好。

表7 各成分线性关系Tab.7 Linear relationships of various constituents
2.7.2 精密度试验 精密称取大蝎子草粉末(S1) 1 g,按“2.3.2” 项下方法制备供试品溶液,在“2.4” 项色谱条件下进样测定6 次,测得对羟基肉桂酸、东莨菪内酯、紫云英苷峰面积RSD 分别为0.48%、0.32%、0.17%,表明仪器精密度良好。
2.7.3 稳定性试验 精密称取大蝎子草粉末(S1) 1 g,按“2.3.2” 项下方法制备供试品溶液,于0、2、4、6、8、12、24 h 在“2.4” 项色谱条件下进样测定,测得对羟基肉桂酸、东莨菪内酯、紫云英苷峰面积RSD 分别为1.13%、0.58%、0.31%,表明溶液在24 h 内稳定性良好。
2.7.4 重复性试验 精密称定大蝎子草粉末(S1) 6 份,按“2.3.2” 项下方法制备供试品溶液,在“2.4” 项色谱条件下进样测定,测得对羟基肉桂酸、东莨菪内酯、紫云英苷峰面积RSD 分别为1.59%、0.52%、0.30%,表明该方法重复性良好。
2.7.5 加样回收率试验 精密称定大蝎子草粉末(S1) 6 份,分别加入适量对羟基肉桂酸、东莨菪内酯、紫云英苷对照品,按“2.3.2” 项下方法制备供试品溶液,在“2.4” 项色谱条件下进样测定,计算回收率。结果,对羟基肉桂酸、东莨菪内酯、紫云英苷平均加样回收率 (RSD) 为101.90% (1.25%)、96.60% (2.13%)、95.10%(2.42%)。
2.7.6 样品含量测定 取13 批大蝎子草各1 g,按“2.3.2” 项下方法制备供试品溶液,在“2.4”项色谱条件下进样测定,外标法计算含量,结果见表8。由此可知,对羟基肉桂酸、东莨菪内酯、紫云英苷的平均含量分别为0.060 5、0.021 6、0.124 3 mg/g。结合2020 年版 《中国药典》[17],选取含量最高的化学成分紫云英苷做含量限定,即紫云英苷含量不得少于0.01%。
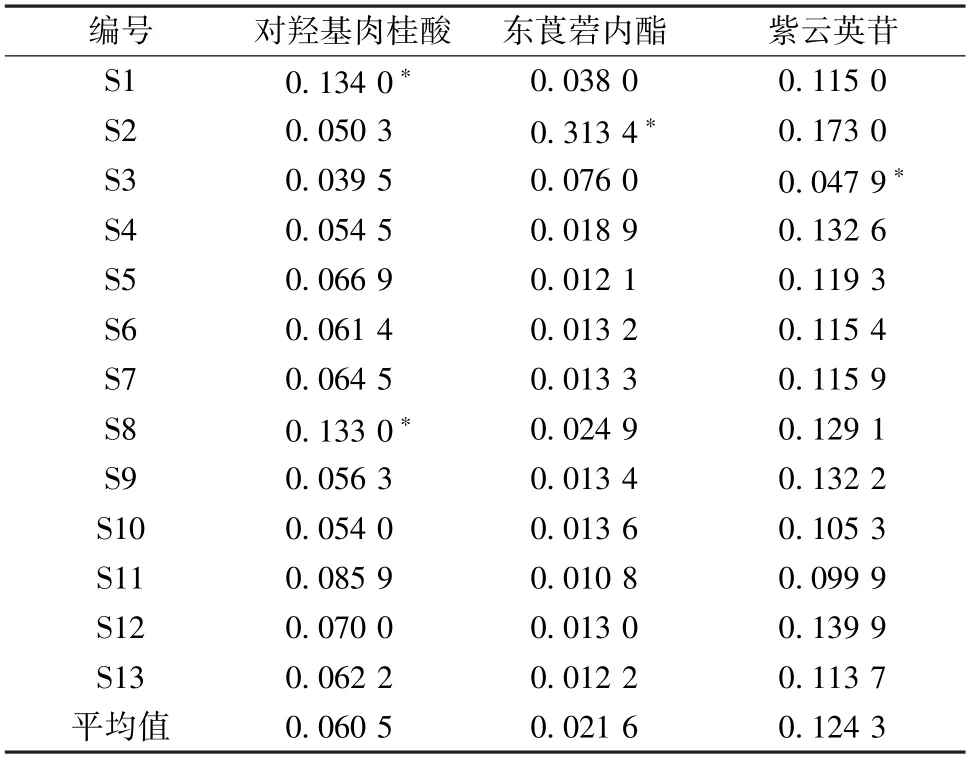
表8 大蝎子草含量测定结果(mg/g)Tab.8 Results of content determination for G.diversifolia(mg/g)
3 讨论
3.1 TLC 条件筛选 本研究考察了提取溶剂、纯化溶剂、展开剂、点样量,并且通过薄层板、温度、湿度、展开剂比例、点样方式对其耐用性进行考察,同时以对照品与不同批次、同一批次不同展开剂、不同展开比例对专属性进行考察,结果该方法具有良好的耐用性及专属性。最终确定了大蝎子草的TLC 展开条件。
3.2 色谱条件的选择 本研究分别考察了流动相(乙腈-水、甲醇-0.1% 甲酸水、乙腈-0.1% 甲酸水)、检测波长(254、260、290 nm)、柱温(25、30、35 ℃)、体积流量(0.8、1.0、1.2 mL/min),结果以乙腈-0.1%甲酸水系统,检测波长290 nm,体积流量1.2 mL/min,柱温30 ℃时色谱峰较多,且色谱峰峰形及分离效果较好。
3.3 质量标准起草 本研究对13 批不同产地的大蝎子草进行含量测定,初步拟定大蝎子草水分不得过13.0%,总灰分不得过21.0%,酸不溶性灰分不得过5.0%,水溶性浸出物(热浸法) 含量不得少于14.0%;并且以东莨菪内酯为对照建立TLC鉴别方法,对照品与杂质分离度良好,供试品色谱与对照品相应位置显相同的荧光斑点。
3.4 指纹图谱及含量测定 中药指纹图谱是评价中药最有效的方法之一[18]。本研究对13 批大蝎子草药材建立指纹图谱,共确定9 个共有峰,通过与对照品色谱图进行比对,共确定了3 种成分。并且通过指纹图谱相似度软件分析,13 批大蝎子草相似度在0.916~0.995 之间,表明不同地区大蝎子草所含成分存在差异性。聚类分析中,S1、S8 先被分出来聚为一类,其余样品聚为一类;S2~S4样品被分出来聚为一类,说明不同地域之间大蝎子草的成分差异较大。课题组从大蝎子草中分离得到了对羟基肉桂酸,紫云英苷、东莨菪内酯等成分,经查阅文献发现,其具有抗肿瘤、抗炎、抗氧化等药理活性[19-23]。因此,结合大蝎子草的功效,可将上述成分作为指标性成分以控制大蝎子草的质量。结果显示,对羟基肉桂酸、东莨菪内酯、紫云英苷的平均含量分别为0.060 5、0.021 6、0.124 3 mg/g。结合2020 年版《中国药典》 最终选取含量最高的化学成分紫云英苷做大蝎子草的含量限定,即紫云英苷含量不得少于0.01%。
4 结论
综上所述,本研究对大蝎子草药材进行了薄层色谱鉴别和水分、灰分、浸出物测定,补充完善并且拟定了大蝎子草的质量标准草案,并且利用指纹图谱数据分析方法结合主成分分析及聚类分析对不同产地大蝎子草药材进行评价,可为建立大蝎子草药材整体性质量评价体系提供参考;同时本次研究促进了大蝎子草的质量评价标准的提升,有利于推动其资源的开发与应用。
