淫羊藿苷对尾悬吊模拟失重诱导大鼠骨丢失的防护作用
2023-09-19白亚楠万美玉狄晓可张志斐李小娜
白亚楠,万美玉,狄晓可,张志斐,李小娜,李 洋
(华北理工大学药学院,河北 唐山 063210)
近年来国内外航天事业发展较快,但太空微重力环境却给航天人员的身体健康带来了严重威胁。已有较多研究证明微重力可以引起严重的骨丢失现象[1-2]。骨丢失是骨质疏松的病理特点之一,在微重力环境下,破骨细胞功能增强,成骨细胞活性降低[3],打破了骨重建动态平衡,随之还可能会带来骨微观结构的劣变,由此增加骨折的风险。因此,研究微重力环境下诱发骨质丢失的机制并找到相应的对抗策略,对于载人航天具有重要意义。
淫羊藿苷是小檗科淫羊藿属植物中的一种主要活性成分,对神经系统、骨骼系统、生殖系统、心血管系统都有着良好的药理作用。目前已有研究证实,淫羊藿苷具有骨保护作用,能够明显改善骨质疏松症状[4]。同时,在骨代谢过程中淫羊藿苷可发挥双重作用,不仅可以增加骨形成细胞蛋白的表达,促进骨保护素形成,还可以促进与成骨细胞分化相关因子的表达,从而起到抗骨质疏松的作用[5]。目前探究淫羊藿苷与失重性骨丢失之间关系的研究较少,淫羊藿苷对失重性骨丢失的作用尚不清楚。本研究拟采用尾悬吊模拟失重诱导大鼠骨丢失,测定淫羊藿苷对骨吸收与骨形成相关标志物指标水平及蛋白相对表达量、生物力学参数、骨密度及股骨空间结构的作用,以期为深入研究淫羊藿苷防治失重性骨丢失提供依据。
1 材料
1.1 动物 SPF 级成年雄性SD 大鼠,体质量(200±20) g,购自北京华阜康生物科技股份有限公司[实验动物生产许可证号SCXK (京) 2020-0004],饲养环境温度 (22±2)℃,相对湿度50%~70%,光照周期12 h/12 h,自由饮食。所有实验步骤均按照华北理工大学实验动物中心实验动物护理和使用指南进行 (伦理号LAEC-NCST-2020050)。
1.2 试剂与药物 淫羊藿苷(西安圣青生物科技有限公司,纯度≥98%,批号YYH2020-5-25);阿仑膦酸钠 (杭州默沙东制药有限公司,纯度≥98%,批号 20200522)。骨特异碱性磷酸酶(BALP)、抗酒石酸酸性磷酸酶(Trap)、骨钙素(OC)、尿钙(U-Ca)、尿磷(U-P)、肌酐(Cr)、脱氧吡啶啉(DPD)、Ⅰ型胶原的C-末端交联肽(CTX-Ⅰ)、Ⅰ型胶原的N-末端交联肽(NTX-Ⅰ)试剂盒 (南京建成生物工程研究所,批号20201008、20201007、20201008、20201010、20201007、20201008、20201008、20201010、20201009);β-actin、BMP-2、OPG、RANK、RANKL 抗体 (美国R&D 公司,批号20201201、20201211、20201203、20201205、20201210)。
1.3 仪器 ST16R 型高速冷冻离心机 (美国Thermo Fisher Scientific 公司);双能X 线骨密度仪、explore Locus SP 型Micro-CT 扫描仪(美国GE公司);858 Mini Bionix 型材料测试系统 (美国MTS 公司);7100 型全自动生化仪[日立高新技术(上海) 国际贸易有限公司];164-5050 型电泳仪、165-8001 型电泳槽、GelDoc XR 型凝胶成像仪(美国Bio-Rad 公司);DYCZ-40D 型转移槽(北京六一生物科技有限公司)。
2 方法
2.1 分组、造模及给药 大鼠随机分为空白组、模型组、阿仑膦酸钠组(2.0 mg/kg)、淫羊藿苷组(30 mg/kg),各组灌胃给予相应药物6 周,第3 周开始除空白组外,其余各组参照Morey-Holton提出的尾悬吊法[6]建立尾悬吊模型,在距大鼠尾根部4 cm 处用克式针平行于冠状面穿刺于尾骨,克式针两端弯成环后用回形针将尾部悬于笼顶,使鼠前肢踏于笼底,后肢悬空,身体纵轴与水平面成30°,身体可360°自由旋转。每个吊笼内悬吊1 只大鼠,空白组大鼠也置于同样鼠笼中,尾部不悬吊,可自由活动。尾悬吊4 周后全部处死。
2.2 样品制备 大鼠处死前2 d,禁食12 h,放至代谢笼中收集24 h 尿液,期间禁食,自由饮水。尿液4 ℃、1 200 r/min 离心10 min,吸取上清,于-20 ℃保存备用。实验结束后,乙醚麻醉大鼠,腹主动脉取全血,4 ℃静置30 min,4 ℃、2 000 r/min离心20 min,吸取血清[7],于-80 ℃保存备用。取血后,剥离大鼠股骨,将附着于股骨上的肌肉及组织处理干净,用浸泡过生理盐水的纱布将大鼠右侧股骨包裹后装入塑料袋中,置于-20 ℃保存,用以测定大鼠股骨的生物力学性能[8];左侧股骨浸泡于4 ℃的10%福尔马林中固定,2 d 后保存至4 ℃的70% 乙醇中,用以Micro-CT 扫描分析股骨微结构。
2.3 骨代谢指标检测 血清和尿液进行解冻,按照ELISA 试剂盒说明书检测血清BALP、Trap、OC以及尿液U-Ca、U-P、Cr、DPD、CTX-Ⅰ、NTX-Ⅰ水平[9]。
2.4 股骨骨密度检测 大鼠处死前3 d,用3%戊巴比妥钠(0.1 mL/100 g) 腹腔注射麻醉大鼠,四肢展开平置于骨密度仪平台上,扫描完毕后采用配套软件对股骨骨密度(BMD) 进行分析[10]。
2.5 股骨生物力学性能检测 取保存于-20 ℃冰箱中的大鼠右侧股骨,放置至室温,进行三点弯曲实验。以跨距20 mm,2 mm/min 速率下压股骨中段,直至股骨发生断裂,记录载荷-变形曲线[11]。计算相关生物力学指标,即骨应力、弹性模量、最大载荷、结构硬度及能量吸收。
2.6 股骨形态结构特征检测 采用Micro-CT 扫描仪沿长轴方向对股骨远端进行扫描,获取连续Micro-CT 图像,图像分辨率为1 024×1 024,像素点尺寸为20 μm×20 μm,层间距20 μm。扫描完成后,选取生长板下端1.5 mm 处并向下延伸100 个连续片段区域的骨小梁部分为感兴趣区域。对感兴趣区域进行三维重建,获取骨小梁三维结构图像并分析骨小梁如下空间结构参数[12],即骨组织比例(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)、结构模型指数(SMI) 及骨小梁连接密度(conn.D)。
2.7 分子对接 从PDB 和PubChem 平台分别获取靶点(BMP-2、OPG、RANK) 3D 结构和药物活性成分(阿仑膦酸钠、淫羊藿苷) 分子结构,通过Schrödinger Maestro 12.8、Pymol 软件进行分子对接,分析对接结果与结合能,评估受体与配体的对接情况[13]。
2.8 骨代谢相关蛋白表达检测 取适量股骨组织匀浆,采用BSA 法进行蛋白定量,蛋白样品进行SDS-PAGE 电泳,再经转膜、封闭、一抗和二抗孵育、显影等步骤,根据目的蛋白的分子量选择内参β-actin,采用Image J 软件分析各个条带的灰度值,计算目的蛋白相对表达量[14]。
2.9 统计学分析 通过SPSS 22.0 软件进行处理,数据以(±s) 表示,组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 淫羊藿苷对失重大鼠体质量的影响 如图1所示,在尾悬吊处理前,各组大鼠体质量均呈增加趋势。从第3 周开始,与空白组比较,模型组和各给药组大鼠体质量均呈现下降趋势。实验结束时,与空白组比较,模型组大鼠体质量均降低 (P<0.01);与模型组比较,阿仑膦酸钠组和淫羊藿苷组大鼠体质量无明显变化(P>0.05)。
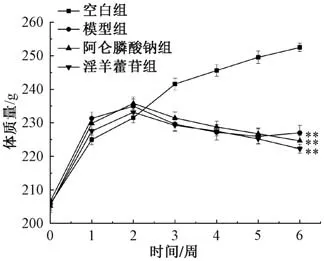
图1 6 周内各组大鼠体质量变化(±s,n=10)Fig.1 Changes of rat body mass in each groupwithin 6 weeks (±s,n=10)
3.2 淫羊藿苷对失重大鼠骨代谢指标的影响 如表1 所示,与空白组比较,模型组大鼠U-Ca/Cr、U-P/Cr、Trap、DPD、CTX-Ⅰ、NTX-Ⅰ水平均升高(P<0.01);BALP、OC 水平均降低 (P<0.01)。与模型组比较,阿仑膦酸钠组大鼠U-Ca/Cr、U-P/Cr、Trap、DPD、CTX-Ⅰ、NTX-Ⅰ水平降低(P<0.05,P<0.01),BALP、OC 水平无明显变化(P>0.05);淫羊藿苷组U-Ca/Cr、U-P/Cr、Trap、DPD、CTX-Ⅰ、NTX-Ⅰ水平降低(P<0.05,P<0.01),BALP、OC 水平升高(P<0.05,P<0.01)。
表1 淫羊藿苷对失重大鼠骨代谢指标的影响(±s,n=10)Tab.1 Effects of icariin on bone metabolism indices in weightless rats (±s,n=10)
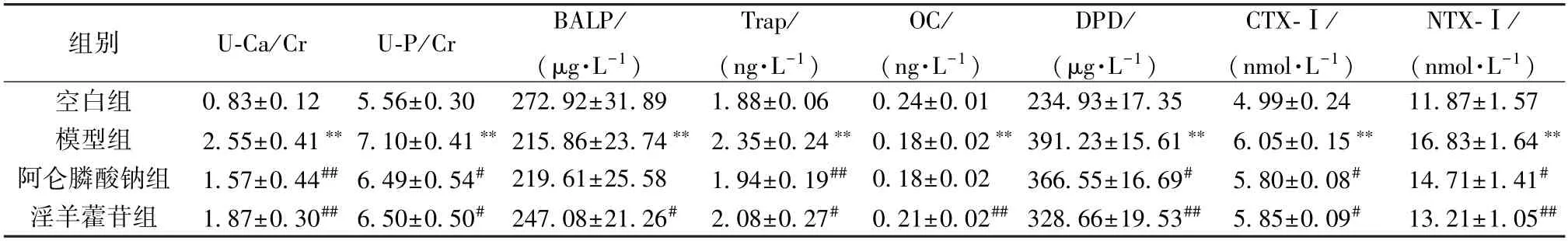
表1 淫羊藿苷对失重大鼠骨代谢指标的影响(±s,n=10)Tab.1 Effects of icariin on bone metabolism indices in weightless rats (±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别U-Ca/CrU-P/CrBALP/(μg·L-1)Trap/(ng·L-1)OC/(ng·L-1)DPD/(μg·L-1)CTX-Ⅰ/(nmol·L-1)NTX-Ⅰ/(nmol·L-1)空白组0.83±0.12 5.56±0.30 272.92±31.891.88±0.060.24±0.01 234.93±17.354.99±0.2411.87±1.57模型组2.55±0.41** 7.10±0.41** 215.86±23.74** 2.35±0.24** 0.18±0.02** 391.23±15.61** 6.05±0.15** 16.83±1.64**阿仑膦酸钠组 1.57±0.44## 6.49±0.54# 219.61±25.581.94±0.19## 0.18±0.02 366.55±16.69#5.80±0.08#14.71±1.41#淫羊藿苷组1.87±0.30## 6.50±0.50# 247.08±21.26# 2.08±0.27# 0.21±0.02## 328.66±19.53## 5.85±0.09#13.21±1.05##
3.3 淫羊藿苷对失重大鼠骨密度的影响 如图2所示,与空白组比较,模型组大鼠骨密度降低(P<0.01);与模型组比较,阿仑膦酸钠组和淫羊藿苷组大鼠骨密度均升高(P<0.01)。
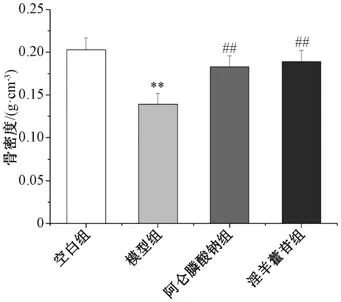
图2 淫羊藿苷对大鼠股骨骨密度的影响(±s,n=10)Fig.2 Effects of icariin on femoral bone mineral density in weightless rats (±s,n=10)
3.4 淫羊藿苷对失重大鼠股骨生物力学性能的影响 如表2 所示,与空白组比较,模型组大鼠股骨生物力学参数骨应力、弹性模量、最大载荷、结构硬度、能量吸收值均降低(P<0.01)。与模型组比较,阿仑膦酸钠组大鼠弹性模量及结构硬度水平升高(P<0.05,P<0.01);淫羊藿苷组大鼠骨应力、弹性模量及最大载荷水平升高 (P<0.05,P<0.01)。
表2 淫羊藿苷对失重大鼠股骨生物力学参数的影响(±s,n=10)Tab.2 Effects of icariin on biomechanical parameters of femur in weightless rats (±s,n=10)

表2 淫羊藿苷对失重大鼠股骨生物力学参数的影响(±s,n=10)Tab.2 Effects of icariin on biomechanical parameters of femur in weightless rats (±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别骨应力/MPa弹性模量/MPa最大载荷/N结构硬度/(N·mm)能量吸收/J空白组89.72±12.223 453.93±222.03112.06±9.62164.54±18.5184.66±5.84模型组64.43±6.32**2 353.06±154.08**74.62±7.65**98.01±15.39**77.65±4.00**阿仑膦酸钠组63.54±4.672 887.06±174.03##80.47±7.87125.45±17.45#74.52±3.96淫羊藿苷组75.42±9.30#3 152.89±206.10##94.36±7.74##97.38±16.5576.42±1.88
3.5 淫羊藿苷对失重大鼠股骨形态结构特征的影响 如图3 所示,空白组大鼠股骨骨小梁数量较多,排列紧密,质地均匀,股骨皮质骨较厚;模型组大鼠股骨骨小梁数量明显减少,且出现断裂现象,网状结构被破坏,排列无规则,空洞较大,股骨皮质骨明显变薄;与模型组比较,阿仑膦酸钠组和淫羊藿苷组大鼠股骨骨小梁数量增加,股骨皮质骨厚度增加,骨小梁连续性好。
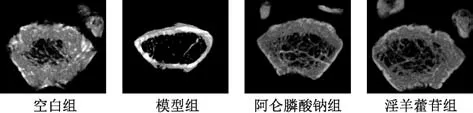
图3 各组大鼠感兴趣区域内骨小梁代表图Fig.3 Representative images of trabecular bone in the region of interest of rats in each group
如表3 所示,与空白组比较,模型组大鼠股骨远端骨小梁conn.D、BV/TV、Tb.N 和Tb.Th 值均降低(P<0.05,P<0.01),SMI 值升高(P<0.01)。与模型组比较,阿仑膦酸钠组大鼠conn.D、BV/TV、Tb.N 和Tb.Th 值升高(P<0.01),SMI 值降低(P<0.01);淫羊藿苷组大鼠Conn.D、BV/TV、Tb.N 值升高(P<0.01),SMI 值降低(P<0.01)。
表3 淫羊藿苷对失重大鼠股骨远端微结构影响(±s,n=10)Tab.3 Effects of icariin on the microstructure of the distal femur in weightless rats (±s,n=10)
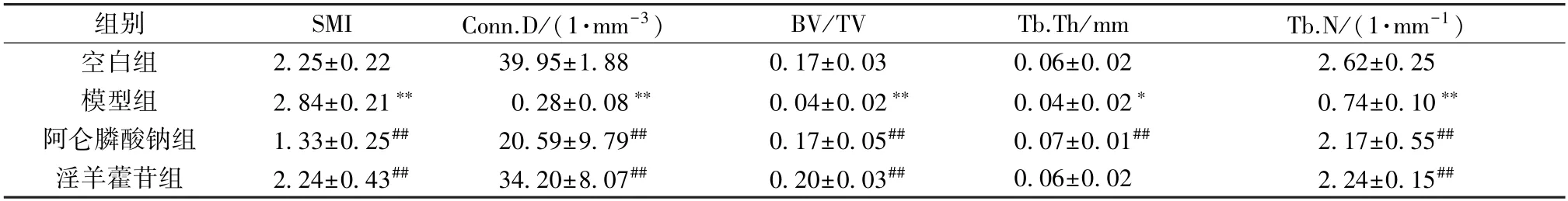
表3 淫羊藿苷对失重大鼠股骨远端微结构影响(±s,n=10)Tab.3 Effects of icariin on the microstructure of the distal femur in weightless rats (±s,n=10)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01。
组别SMIConn.D/(1·mm-3)BV/TVTb.Th/mmTb.N/(1·mm-1)空白组2.25±0.2239.95±1.880.17±0.030.06±0.022.62±0.25模型组2.84±0.21**0.28±0.08**0.04±0.02**0.04±0.02*0.74±0.10**阿仑膦酸钠组1.33±0.25##20.59±9.79##0.17±0.05##0.07±0.01##2.17±0.55##淫羊藿苷组2.24±0.43##34.20±8.07##0.20±0.03##0.06±0.022.24±0.15##
3.6 分子对接结果 将药物作为配体,靶点蛋白作为受体,进行分子对接,结果见图4,结合评分见表4。结果表明,淫羊藿苷与相关蛋白结合评分较阿仑膦酸钠更低,与靶点蛋白的匹配度更高,更易发生作用。
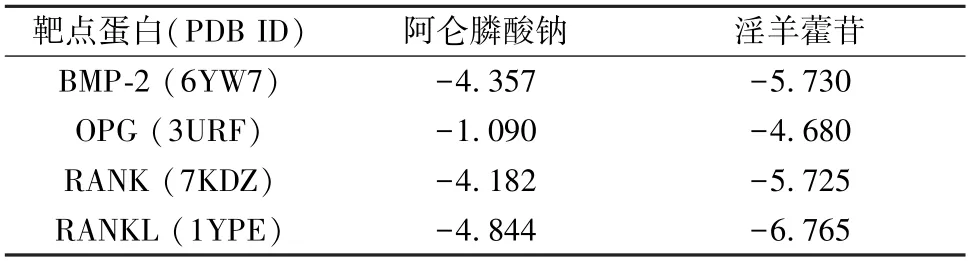
表4 阿仑膦酸钠、淫羊藿苷与相关蛋白分子对接结合评分(kcal/mol)Tab.4 Docking and binding score of alendronate,icariin and related protein molecules (kcal/mol)
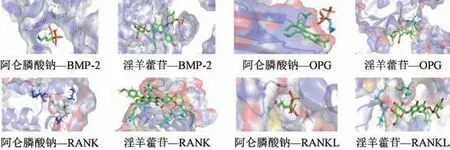
图4 阿仑膦酸钠、淫羊藿苷与相关蛋白分子对接结果Fig.4 Molecular docking results of alendronate sodium and icariin with related protein molecules
3.7 淫羊藿苷对失重大鼠骨代谢蛋白表达的影响 如图5 所示,与空白组比较,模型组大鼠股骨组织BMP-2、OPG 蛋白表达降低 (P<0.01),RANK、RANKL 蛋白表达升高(P<0.01);与模型组比较,阿仑膦酸钠组和淫羊藿苷组大鼠股骨组织BMP-2、OPG 蛋白表达升高(P<0.01),RANK、RANKL 蛋白表达降低(P<0.01)。
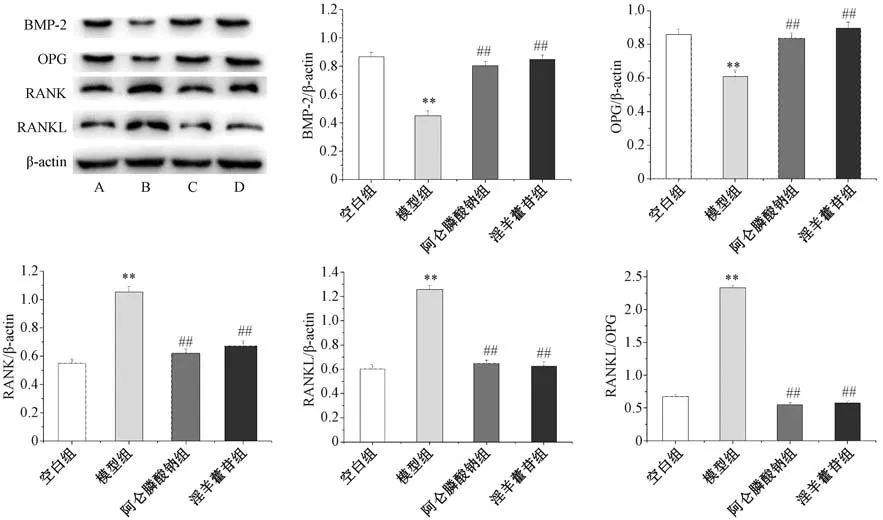
图5 淫羊藿苷对失重大鼠骨代谢蛋白表达的影响(±s,n=3)Fig.5 Effects of icariin on the expressions of bone metabolic proteins in weightless rats (±s,n=3)
4 讨论
在微重力环境下,机体骨钙代谢紊乱,承重骨发生明显的骨丢失现象并且难以恢复。本研究发现,尾悬吊致失重模型可能会影响大鼠的进食量与代谢,引起大鼠体质量的下降,这一结果也与之前研究结果相似[15]。淫羊藿苷组与阿仑膦酸钠组大鼠体质量虽高于模型组,但无统计学差异,可见药物干预不能改善尾悬吊带来的体质量下降现象。
人体骨骼在正常环境下,成骨细胞承担的骨形成和破骨细胞承担的骨吸收处于动态平衡,而在太空微重力环境中,骨骼几乎完全失去重力作用,会引起骨吸收的增加和骨形成的减少等情况[16]。微重力环境下,身体负重降低,骨吸收增加,使得体内大量钙、磷流失;成骨细胞分化能力减弱,骨转换降低,使得BMD 降低。本研究结果显示,与模型组比较,淫羊藿苷组大鼠骨吸收标志物U-Ca/Cr、U-P/Cr、Trap、DPD、CTX-Ⅰ及NTX-Ⅰ水平降低,骨形成标志物BALP、OC 水平升高,骨代谢指标与BMD 结果均表明,淫羊藿苷可有效改善尾悬吊致失重导致的大鼠骨吸收大于骨形成现象,进而降低骨折发生的风险。
骨力学性能是研究骨组织在外界作用力下的力学特征和受力后的生物学效应,它与骨折风险有直接联系,是评定骨强度质量的一种可靠方法,也是体现药物对骨质疏松治疗效果最直接、最重要的指标之一[17]。本研究结果显示,淫羊藿苷不仅可以降低骨转换率还可以改善骨的力学性能。大鼠生物力学参数的变化表明淫羊藿苷的干预可以使大鼠股骨骨硬度、弹性增加,从而降低骨折的发生机率。
BMP-2 为骨形态发生蛋白2,可诱导成骨细胞分化,而成骨细胞分泌的骨保护素OPG 可与RANKL 竞争性抑制破骨细胞的分化成熟,RANK与RANKL 结合可有效促进破骨细胞分化[18]。研究表明,RANKL/OPG 比值决定了破骨细胞的分化程度[19],比值降低表明破骨细胞分化受到抑制,骨吸收能力降低。分子对接可直观表现出药物与靶点蛋白的结合情况,评分越低代表着药物与靶点蛋白对接的结合能越低,发生作用的可能性越大。对接结果显示,相比于阿仑膦酸钠,淫羊藿苷与骨代谢相关蛋白结合更稳定,匹配程度更高。尾悬吊致大鼠失重打破了骨代谢平衡,导致成骨标志物OPG、BMP-2 表达降低,骨吸收因子RANK 与RANKL 表达升高,RANKL/OPG 比值上调,破骨细胞分化程度加大,从而使得大鼠股骨骨小梁数量减少,连接密度降低,厚度变薄。且对SMI 分析表明,模型组大鼠股骨已形成骨质疏松型结构[20]。
综上所述,本研究表明淫羊藿苷可在尾悬吊模拟失重条件下抑制破骨细胞活化,促进成骨细胞分化,提高骨转换率,增加股骨强度,缓解骨吸收大于骨形成现象,从而改善尾悬吊大鼠的骨丢失;淫羊藿苷可有效缓解骨吸收与骨形成的失衡,改善尾悬吊引起的骨丢失现象,该作用机制可能与调控OPG/RANK/RANKL 通路有关。
