甘草查尔酮A 对结肠癌细胞中氧化还原稳态调控的影响
2023-09-19丁舒飞蒋东晓邱璐琦张苏宏阮叶萍
丁舒飞,蒋东晓,邱璐琦,张苏宏,阮叶萍*
(1.浙江中医药大学,浙江 杭州 310053;2.浙江省中山医院,浙江 杭州 310005;3.苏州百遏医药科技有限公司,江苏 苏州 215000)
结肠癌是临床上常见的消化道恶性肿瘤,具有较高的发病率和死亡率[1]。据《中国大肠癌流行病学及其预防和筛查白皮书》 显示,我国大肠癌的发病率持续增长,且绝大部分患者被发现时已经是Ⅱ期或晚期。尽管临床上已采用早期筛查、手术、化疗等手段来治疗结肠癌,但是结肠癌致死的人数仍然很高[2],使得患者的生活质量未得到有效改善。
活性氧(reactive oxygen species,ROS) 是一种有力的致癌物,近年来研究发现ROS 抑制剂却能促进部分肿瘤的生长和转移[3-4]。正是因为肿瘤细胞较正常细胞具有较高的基础ROS 水平,使得肿瘤细胞更加依赖抗氧化系统,对ROS 水平的上升会更加敏感[5]。因此,以上调肿瘤ROS 水平为导向对寻找抗癌药物有着重要意义。
天然产物具有疗效高且副作用小的优势,是筛选抗癌药物的重要来源。甘草查尔酮A 是从甘草中提取的一种黄酮类化合物,药理活性广泛,目前其抗肿瘤活性最受关注。研究发现甘草查尔酮A能通过阻滞细胞周期和诱导细胞凋亡方式抑制多种肿瘤的生长[6-7],且能通过上调ROS 水平抑制结肠癌的生长[8],但具体作用靶点则并不明确。本研究将进一步验证甘草查尔酮A 的抗癌能力,并探究其诱导结肠癌细胞凋亡的作用靶点,以期为甘草查尔酮A 应用于临床提供理论依据。
1 材料
1.1 细胞株 人结肠癌细胞SW480、HCT116 均由苏州奥特铭医药科技有限公司赠予。HCT116 细胞和SW480 细胞均培养在含10%胎牛血清和1%双抗的DMEM 高糖培养基中,放置于37 ℃、5% CO2细胞培养箱中培养。
1.2 药物与试剂 甘草查尔酮A (成都普瑞法科技开发有限公司,货号BP0855,纯度≥98%)。DMEM 高糖培养基 (美国 Gibco 公司,货号C11995500BT);噻唑蓝 (methyl thiazolyl tetrazolium,MTT)、N-乙酰半胱氨酸(N-acetyl-Lcysteine,NAC) (美国Sigma 公司,货号M21282、A7250);FITC Annexin V 凋亡试剂盒(美国BD 公司,货号556547);Annexin V-APC/7-ADD 试剂盒(杭州联科生物技术股份有限公司,货号AP105);硫氧还蛋白还原酶1 (thioredoxin reductase 1,TrxR1) 重组蛋白 (美国 Abnova 公司,货号P3509);RIPA 裂解液、活性氧检测试剂盒、DHE探针 (上海碧云天生物技术有限公司,货号P0013C、S0033、S0063);cleaved-PARP 多克隆兔抗体、β-actin 多克隆兔抗体(武汉爱博泰克生物科技有限公司,货号A19612、AC038);Bcl-2 多克隆兔抗体、TrxR1 多克隆兔抗体、HRP 标记羊抗兔二抗、ECL 显色液、GAPDH 多克隆兔抗体(美国Affinity 公司,货号AF6139、DF8339、S0002、KF001、AF7021);还原型谷胱甘肽 (reduced glutathione,GSH) 含量检测试剂盒(北京索莱宝科技有限公司,货号BC1175);丁硫氨酸亚砜胺(buthionine sulfoximine,BSO)、谷胱甘肽还原酶(glutathione reductase,GR) (上海源叶生物科技有限公司,货号S51087、S10151)。
1.3 仪器 生物洁净工作台(苏州安泰空气技术有限公司,型号BCM-1000A);酶标仪 (美国BioTek 公司,型号Power Wave X340);台式高速冷冻离心机(德国Eppendorf 公司,型号Centrifuge 5430R);荧光倒置显微镜、光学显微镜(日本奥林巴斯公司,型号1X71、CX31);流式细胞仪(美国Beckman 公司,型号CytoFLEX S);电泳仪、化学发光凝胶成像系统(美国Bio-Rad 公司,型号Power Pac Basic 164-5050、ChemiDoc Touch)。
2 方法
2.1 MTT 法检测细胞存活率 取对数生长期结肠癌细胞,以每孔6 000 个的密度接种于96 孔板,设甘草查尔酮A 不同浓度梯度(0、5、10、20、30、40 μmol/L),每组3 个复孔。培养24 h 后弃原培养基,每孔加入100 μL MTT (0.5 mg/mL),继续孵育4 h,弃培养基,每孔避光加入150 μL DMSO 溶液,摇床上振荡10 min。于490 nm 波长处测各孔的光密度(OD) 值,计算细胞存活率。选用光学显微镜观察甘草查尔酮A 对结肠癌细胞形态的改变。
2.2 流式细胞术检测细胞凋亡率 取对数生长期结肠癌细胞,以每孔6×105个的密度接种于6 孔板,待细胞贴壁后分为3 组,分别为对照组和20、40 μmol/L 甘草查尔酮A 组。按分组进行加药处理,孵育24 h 后收集细胞,PBS 清洗1~2 次,按FITC Annexin V 凋亡试剂盒说明书操作,过300 目尼龙筛,上机检测。另设4 组,分别为对照组、40 μmol/L 甘草查尔酮A 组、40 μmol/L 甘草查尔酮A+5 mmol/L NAC 组、5 mmol/L NAC 组,其余操作同上。另设4 组,分别为对照组、20 μmol/L 甘草查尔酮A 组、20 μmol/L 甘草查尔酮A+10 mmol/L BSO 组、10 mmol/L BSO 组,其余操作同上。另设4 组,分别为NC 组、NC+20 μmol/L 甘草查尔酮A 组、TrxR1-shRNA 组、TrxR1-shRNA+20 μmol/L 甘草查尔酮A 组,细胞凋亡率按Annexin V-APC/7-ADD 试剂盒说明书进行操作,其余同上。
2.3 Western blot 法检测凋亡相关蛋白表达 取对数生长期结肠癌细胞,以每孔1×106个的密度接种于6 孔板,待细胞贴壁后分为3 组,分别为对照组和20、40 μmol/L 甘草查尔酮A 组。按分组进行加药处理,孵育24 h 后用RIPA 裂解液裂解并提取蛋白,BCA 定量试剂盒检测各组蛋白浓度。取等量蛋白上样,经SDS-PAGE 凝胶电泳分离,湿转到PVDF 膜。5%脱脂奶粉溶液封闭1 h,剪膜后加入相对应的一抗,于4 ℃孵育过夜,洗膜,加HRP标记羊抗兔二抗于37 ℃孵育2 h,洗膜,加电化学发光反应液,于化学发光数字成像系统显影,通过Image J 软件分析目的条带灰度值。以目标蛋白灰度值与内参蛋白灰度值的比值为蛋白相对表达。另设4 组,分别为对照组、40 μmol/L 甘草查尔酮A组、40 μmol/L 甘草查尔酮A+5 mmol/L NAC 组、5 mmol/L NAC 组,其余操作同上。
2.4 流式细胞术检测ROS 水平 取对数生长期HCT116 细胞,以每孔1×106个的密度接种于6 孔板,待细胞贴壁后分为3 组,分别为对照组和20、40 μmol/L 甘草查尔酮A 组。按分组进行加药处理,孵育24 h 后收集细胞,用不含胎牛血清的培养基稀释DCFH-DA,使终浓度为10 μmol/L,调整细胞密度为1×106~2×107/mL,置于细胞培养箱中孵育20 min。PBS 清洗细胞2~3 次后重悬细胞,过300 目尼龙筛网至流式管,选择流式细胞仪FITC-A 通道检测荧光强度。DHE 探针操作同DCFH-DA,选择流式细胞仪PC-5.5A 通道检测荧光强度。另设4 组,分别为对照组、40 μmol/L 甘草查尔酮A 组、40 μmol/L 甘草查尔酮A +5 mmol/L NAC 组、5 mmol/L NAC 组,其余操作同上。另设4 组,分别为NC 组、NC+20 μmol/L 甘草查尔酮A 组、TrxR1-shRNA 组、TrxR1-shRNA+20 μmol/L 甘草查尔酮A 组,采用DHE 探针检测ROS 水平,其余操作同上。
2.5 分子对接 通过PDB 数据库下载目标蛋白PDB 文件,PubChem 数据库下载小分子SDF 文件,通过Schrodinger 软件对蛋白和小分子分别进行预处理,将蛋白处理生成格点文件后再进行对接。
2.6 TrxR1 活性检测 通过DTNB 法,将NADPH预还原的重组TrxR1 蛋白(170 nmol/L) 与不同浓度甘草查尔酮A (0、5、10、20、40、80、100 μmol/L) 加入到96 孔板中,于室温下孵育0.5 h,加入50 μL 含DTNB (终浓度2 mmol/L) 和NADPH (终浓度0.2 mmol/L) 的TE 缓冲液于每孔中,立即检测前3 min 内在412 nm 波长处的吸光度的增加量。细胞中的TrxR1 活性利用胰岛素终点法进行测定。
2.7 GR 活性检测 将NADPH 还原的重组蛋白GR (0.25 U/mL) 与不同浓度甘草查尔酮A (0、5、10、20、40、80、100 μmol/L) 加入到96 孔板中,所有反应在TE 缓冲体系中进行,在室温下孵育0.5 h,加入50 μL 含氧化型谷胱甘肽(终浓度1 mmol/L) 和NADPH (终浓度0.4 mmol/L) 的TE 缓冲液,立即检测前3 min 内在340 nm 波长处的吸光度。细胞中的GR 活性利用谷胱甘肽还原酶试剂盒进行检测。
2.8 慢病毒感染实验 将HCT116 细胞接种至96孔板中,培养过夜,使感染前细胞汇合率在30%~50%之间。设置感染复数(multiplicity of Infection,MOI) 梯度值(0、1、5、10、20、40、80),选择最佳MOI 值。根据MOI 值稀释携带无关序列或TrxR1 沉默序列的慢病毒并加到96 孔板中,24 h后更换新鲜完全培养基,继续培养。感染72 h 后可在荧光显微镜下观察感染效率。再根据实验结果选择适宜的MOI 值,重复以上步骤并用嘌呤霉素筛选细胞,获取稳转株用于实验。其中MOI=慢病毒滴度×慢病毒体积/细胞数目。
2.9 细胞内GSH 水平检测 细胞以每孔1×106个的密度接种于6 孔板并培养过夜,待细胞贴壁后分为3 组,分别为对照组和20、40 μmol/L 甘草查尔酮A 组。按分组进行加药处理,孵育24 h 后,PBS 清洗2~3 次,加入3 倍细胞沉淀体积的试剂重悬细胞,反复冻融2~3 次,8 000 r/min 离心10 min,收集上清按GSH 含量检测试剂盒说明书检测GSH 水平。
2.10 统计学分析 通过Graph Pad Prism 8.0 和SPSS 17.0 软件进行处理,实验数据以(±s) 表示,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
3 结果
3.1 甘草查尔酮A 对细胞存活的影响 如图1A所示,给药24 h 后,与对照组(0 μmol/L 甘草查尔酮A) 比较,5~40 μmol/L 甘草查尔酮A 均能有效抑制HCT116 细胞和SW480 细胞的活性(P<0.05,P<0.01)。后续实验选择甘草查尔酮A 进行。如图1B 所示,与对照组(0 μmol/L 甘草查尔酮A) 比较,20、40 μmol/L 甘草查尔酮A 组HCT116 细胞和SW480 细胞均可见空泡化、变圆、体积变小的现象。
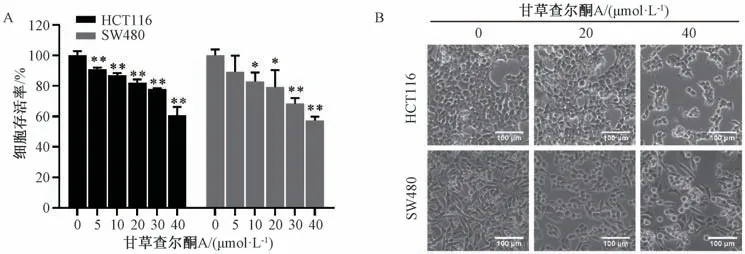
图1 甘草查尔酮A 对结肠癌细胞活性(A) 和形态(B) 的影响(±s,n=3)Fig.1 Effects of licochalcone A on viability (A) and morphology (B) of colon cancer cells (±s,n=3)
3.2 甘草查尔酮A 对结肠癌细胞凋亡的影响 如图2A 所示,与对照组(0 μmol/L 甘草查尔酮A)比较,HCT116 细胞和SW480 细胞经各浓度甘草查尔酮A 处理后,细胞凋亡率均升高(P<0.05,P<0.01)。如图2B~2C 所示,与对照组(0 μmol/L甘草查尔酮A) 比较,经20 μmol/L 甘草查尔酮A处理后,HCT116 细胞和SW480 细胞凋亡蛋白cleaved-PARP 表达升高 (P<0.05,P<0.01),SW480 细胞抗凋亡蛋白Bcl-2 表达降低(P<0.01);经40 μmol/L 甘草查尔酮A 处理后,HCT116 细胞和SW480 细胞cleaved-PARP 蛋白表达升高(P<0.05,P<0.01),Bcl-2 蛋白表达降低(P<0.01)。
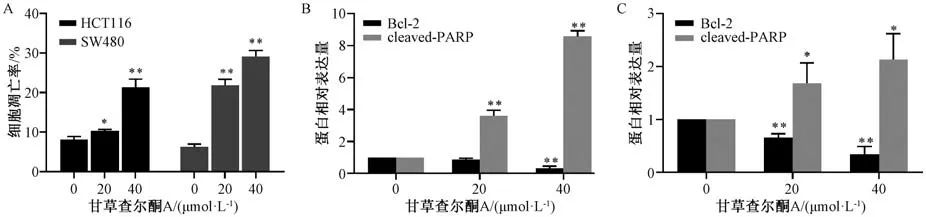
图2 甘草查尔酮A 对结肠癌细胞凋亡的影响(±s,n=3)Fig.2 Effects of licochalcone A on apoptosis of colon cancer cells (±s,n=3)
3.3 甘草查尔酮A 对结肠癌细胞ROS 水平的影响 如图3A~3B 所示,与对照组(0 μmol/L 甘草查尔酮A) 比较,HCT116 细胞和SW480 细胞在流式细胞仪FITC-A 通道和PC-5.5A 通道的荧光强度均有增强,ROS 水平均有所上升(P<0.01)。NAC是一种常见的ROS 抑制剂,如图3C~3D 所示,与单纯给予甘草查尔酮A 比较,甘草查尔酮A 联合NAC (预孵育6 h) 给药后两结肠癌细胞内的ROS水平下降(P<0.01)。说明ROS 抑制剂能逆转甘草查尔酮A 诱导的结肠癌细胞ROS 水平的上升。
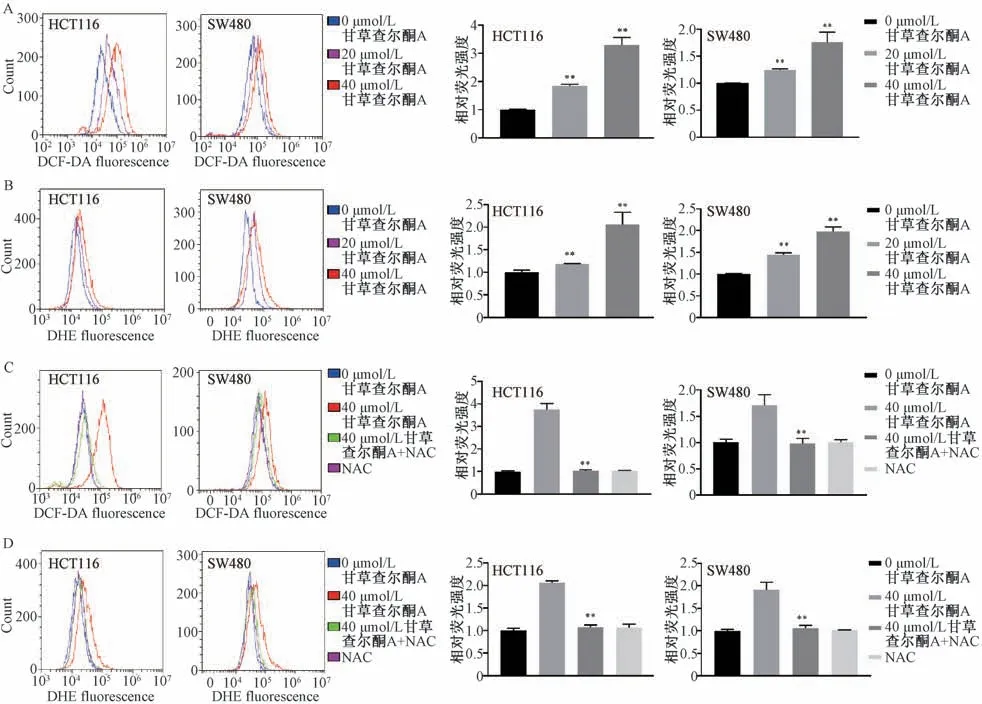
图3 甘草查尔酮A 对结肠癌细胞ROS 水平的影响(±s,n=3)Fig.3 Effects of licochalcone A on ROS level in colon cancer cell (±s,n=3)
3.4 ROS 抑制剂对甘草查尔酮A 诱导结肠癌细胞凋亡的影响 如图4 所示,与40 μmol/L 甘草查尔酮A 组比较,40 μmol/L 甘草查尔酮A+NAC 诱导的HCT116 细胞和SW480 细胞凋亡率降低 (P<0.01),cleaved-PARP 蛋白表达降低。
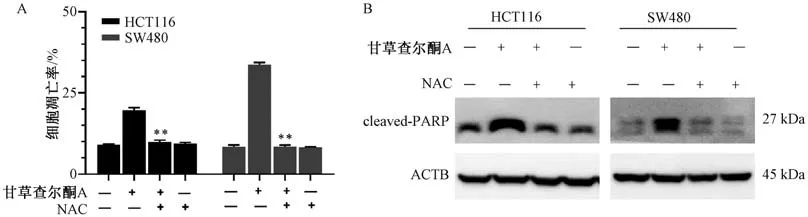
图4 ROS 抑制剂对甘草查尔酮A 诱导结肠癌细胞凋亡的影响(±s,n=3)Fig.4 Effects of ROS inhibitor on licochalcone A-induced apoptosis of colon cancer cells (±s,n=3)
3.5 甘草查尔酮A 对GR 和TrxR1 活性的影响酶学实验结果如图5A 所示,与对照组比较,5~100 μmol/L 甘草查尔酮A 均能抑制重组蛋白TrxR1的活性,并呈剂量依赖性(P<0.05,P<0.01),而对重组GR 蛋白活性则几乎无影响(P>0.05)。如图5B~5C 所示,与对照组(0 μmol/L 甘草查尔酮A) 比较,5~100 μmol/L 甘草查尔酮A 能有效抑制结肠癌细胞中TrxR1 活性 (P<0.05,P<0.01),而对结肠癌细胞中GR 活性无明显影响(P>0.05)。以上结果表明,甘草查尔酮A 能选择性地抑制还原蛋白TrxR1 的活性。
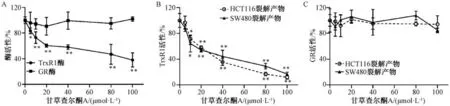
图5 甘草查尔酮A 对GR 和TrxR1 活性的影响(±s,n=3)Fig.5 Effects of licochalcone A on GR and TrxR1 activities (±s,n=3)
3.6 甘草查尔酮A 对TrxR1 蛋白表达的影响及分子对接验证 如图6A 所示,与对照组(0 μmol/L甘草查尔酮A) 比较,经甘草查尔酮A 处理后,HCT116 细胞和SW480 细胞TrxR1 蛋白表达无明显变化(P>0.05)。如图6B 所示,甘草查尔酮A 能和TrxR1 蛋白(PDB code 2ZZ0) 中的Trp 407 形成2 个氢键相互作用,甘草查尔酮A 的α,β 双键能进攻TrxR1 的Cys 498 残基并与Cys 498 残基相结合。
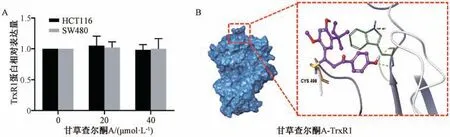
图6 甘草查尔酮A 对TrxR1 蛋白表达的影响(±s,n=3)Fig.6 Effects of licochalcone A on TrxR1 protein expression (±s,n=3)
3.7 沉默TrxR1 对甘草查尔酮A 干预HCT116 细胞ROS 水平的影响 如图7A 所示,shRNA 序列1(sh1,CACAGGATTAAGGCAACAAAT) 的沉默效果优于 shRNA 序列 2 (sh2,GCTGGATTTCTT GCTGGTATT) 和shRNA 序列3 (sh3,CTGTATTT ACTCCTTTGGAAT),因此选择sh1 探究沉默TrxR1对甘草查尔酮A 抗结肠癌作用的影响。如图7B 所示,与NC+20 μmol/L 甘草查尔酮A 组比较,沉默TrxR1 能促进甘草查尔酮A 上调HCT116 细胞ROS水平(P<0.01),对甘草查尔酮A 上调ROS 水平具有协同效果。
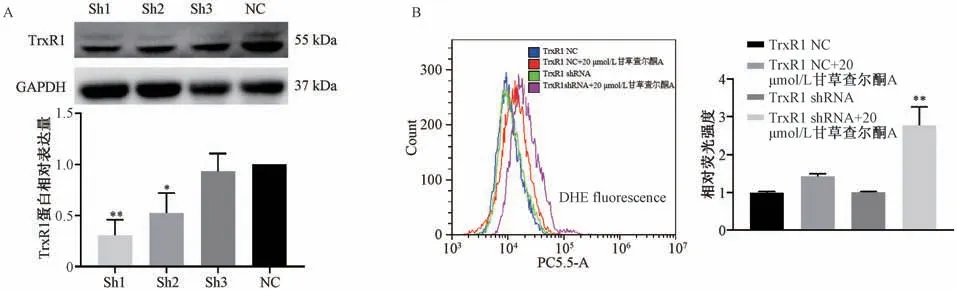
图7 沉默TrxR1 对甘草查尔酮A 干预HCT116 细胞ROS 水平的影响(±s,n=3)Fig.7 Effects of TrxR1 silencing on ROS level of licochalcone A-intervened HCT116 cells (±s,n=3)
3.8 沉默TrxR1 对甘草查尔酮A 干预HCT116 细胞活力和凋亡的影响 如图8 所示,与NC+20 μmol/L 甘草查尔酮A 组比较,沉默TrxR1 后甘草查尔酮A 诱导HCT116 细胞凋亡率升高 (P<0.01),细胞活力降低(P<0.05)。结果表明,沉默TrxR1 能促进甘草查尔酮A 诱导HCT116 细胞凋亡及抑制细胞活力。
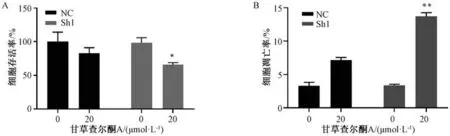
图8 沉默TrxR1 对甘草查尔酮A 干预HCT116 细胞活力(A) 和凋亡(B) 的影响(±s,n=3)Fig.8 Effects of TrxR1 silencing on cell viability (A) and apoptosis (B) of licochalcone A-intervened HCT116 cells (±s,n=3)
3.9 BSO 对甘草查尔酮A 诱导HCT116 细胞凋亡的影响 如图9A 所示,与对照组(0 μmol/L 甘草查尔酮A) 比较,甘草查尔酮A 不影响HCT116 细胞中GSH 水平(P>0.05)。如图9B 所示,与20 μmol/L 甘草查尔酮A 组比较,甘草查尔酮A 联合BSO (预孵育4 h) 能促进甘草查尔酮A 诱导HCT116 细胞发生凋亡(P<0.01)。
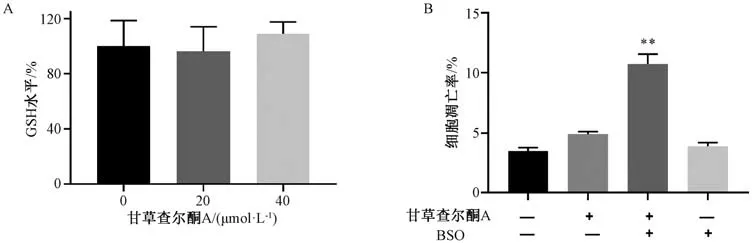
图9 BSO 对甘草查尔酮A 诱导HCT116 细胞凋亡的影响(±s,n=3)Fig.9 Effects of BSO on apoptosis of licochalcone A-induced HCT116 cells (±s,n=3)
4 讨论
本研究发现,甘草查尔酮A 能诱导HCT116 细胞和SW480 细胞发生凋亡并上调ROS 水平,ROS抑制剂能逆转甘草查尔酮A 引起的ROS 水平上升和促凋亡作用。甘草查尔酮A 能选择性地抑制TrxR1 蛋白活性,对TrxR1 蛋白表达几乎没有影响,且沉默TrxR1 使结肠癌细胞对甘草查尔酮A干预更加敏感,表明TrxR1 在甘草查尔酮A 抗结肠癌过程中发挥着重要作用。
谷胱甘肽系统和硫氧还蛋白系统是机体内防御氧化应激的关键抗氧化系统。近年来,研究发现哺乳动物的硫氧还蛋白系统和谷胱甘肽系统能够交叉提供电子,并互为后备系统[5,9]。当硫氧还蛋白系统中TrxR1 缺失时,使肿瘤对药物性谷胱甘肽缺乏高度敏感[10]。本研究发现,沉默TrxR1 对HCT116细胞ROS 水平的升高、细胞活性以及凋亡几乎没有影响,进一步说明了细胞内存在TrxR1 的备用系统,能绕过TrxR1 缺陷继续维持细胞内的氧化还原平衡。GSH 是谷胱甘肽系统中的抗氧化剂,能与氧化剂发生非酶促反应,抑制细胞内的氧化应激[11]。本研究发现,甘草查尔酮A 不影响GSH 水平,GSH 抑制剂BSO 则能协同甘草查尔酮A 诱导HCT116 细胞发生凋亡,间接说明了TrxR1 可介导甘草查尔酮A 诱导结肠癌细胞发生凋亡。
TrxR1 是一种NADPH 依赖的包含黄素腺嘌呤二核苷酸结构域的二聚体含硒酶,广泛分布于原核细胞和各类生物体细胞中。TrxR1 的表达与肿瘤的生长和预后密切相关[12-13],越来越多实验证明,通过靶向抑制TrxR1 活性可有效抑制多种肿瘤细胞的生长,如胃癌、肝癌、结肠癌等[14-16],且沉默TrxR1 能够增加药物对肿瘤细胞的杀伤作用[17]。本研究同样发现,沉默TrxR1 能够协同甘草查尔酮A 的抗结肠癌作用,可见TrxR1 是开发抗癌药物中非常有价值的靶点。TrxR1 的C 末端-Gly-Cys-Sec-Gly 是氧化还原活性位点[18]。研究发现,含有α,β-不饱和酮结构的化合物,容易和TrxR1 蛋白晶体结构(Sec 498 残基被Cys 498 残基) 的Cys 498 残基发生共价结合,如EF24 和B19[14,19]。本研究发现,含有上述结构的甘草查尔酮A 同样能与TrxR1蛋白晶体结构内的Cys 498 残基以共价键的形式结合。Sec 残基比典型的Cys 残基亲核性高3 个数量级,对亲电物种有着高度反应[20]。另有研究发现,含有上述结构的紫草素能抑制TrxR1 活性,对U498C TrxR1 (Sec 498 残基被Cys 498 残基) 活性几乎无影响[3]。说明TrxR1 活性的降低有可能与甘草查尔酮A 作用TrxR1 活性位点Sec 有关,而甘草查尔酮A 和Sec 的共价结合是否可逆则有待进一步研究。
综上所述,甘草查尔酮A 可能通过抑制TrxR1活性来破坏结肠癌细胞内的氧化还原稳态,进而诱导结肠癌细胞发生凋亡。本研究为甘草查尔酮A应用于结肠癌的治疗提供了理论依据,为抗结肠癌药物靶点的开发提供了新思路。
