妊娠期重金属中毒解毒剂治疗的研究进展
2023-09-19颜崇淮
林 崟,颜崇淮
(上海交通大学医学院附属新华医院 教育部和上海市环境与儿童健康重点实验室,上海 200092)
重金属(heavy metal)是指密度大于5g/cm3的金属元素,根据其对机体的毒性分为两类:一类是有毒重金属,一类属于必需微量元素。前者(铅、汞和镉等)在低浓度下即具有毒性,其毒性与剂量呈正相关;后者(锰、铁和铜等)在体内具有生理功能,例如铜、锌和锰作为超氧化物歧化酶(superoxide dismutase,SOD)的金属辅基可保护蛋白质、脂质等大分子及线粒体免受氧化损伤;铁参与形成血红蛋白,是构成多种酶的重要组成部分,但其过量也会对健康有害[1]。流行病学研究表明,重金属暴露与心血管疾病、不孕症、出生缺陷、癌症及糖尿病等疾病的发生显著相关。重金属可以长久地蓄积在体内,对孕产妇及儿童的健康结局产生不利影响,例如,妊娠期母体骨铅动员增强,继而影响儿童神经发育[2]。因此,在加强重金属暴露预防工作的同时,需从降低重金属的体内负荷、缓解重金属毒性两个方面着手以减轻重金属的健康效应。
大部分重金属在体内的排泄率很低,螯合剂(chelating agents,chelators)能结合并加速重金属的排出,在临床上已得到广泛使用。但现有的螯合剂不能逆转重金属中毒引起的损伤,部分螯合剂甚至可以通过胎盘或乳汁对胎儿及儿童的健康造成不利影响,而具备高度选择性、靶向分布等多种特性的新型金属螯合剂,目前仍处在实验阶段。联合使用多种螯合剂更有可能将有毒金属从不同的细胞/组织中动员出来,并可减轻毒性作用[3]。重金属主要通过产生自由基改变细胞内稳态,产生细胞毒性[4]。部分螯合剂和必需金属元素本身具有抗氧化作用,可用于重金属解毒。双功能抗氧化剂可通过螯合并清除引发过氧化的离子,阻止自由基等活性物质的形成,减轻大分子物质的氧化损伤,可能是治疗重金属中毒的新趋势。综上,将螯合剂与抗氧化剂和必需微量元素等多种解毒剂联合用于治疗不仅能够提高临床上重金属中毒的疗效,也可以降低毒副反应,可作为治疗妊娠期重金属中毒的新策略。
1 螯合剂与重金属中毒
1.1 螯合剂概述
螯合剂是一种具有两个或两个以上的配位原子的环形络合物,能与体内配体竞争性结合金属离子,形成稳定、无毒、水溶性的螯合物通过尿液及胆汁排泄[5],可用于治疗重金属中毒(见表1),以及地中海贫血等金属过载性疾病。螯合剂中的“螯”比喻多齿配体(有两个或两个以上配位原子的配体)像螃蟹用两只大钳紧紧夹住金属离子形成金属螯合物,疗效与血液pH值、稳定常数(即某种螯合剂对各种金属亲和力的顺序,以Ks表示)、脂水分配系数(评价螯合物亲水性或亲脂性的大小,以P表示)、配体间相对浓度及竞争关系等有关,见图1[5]。
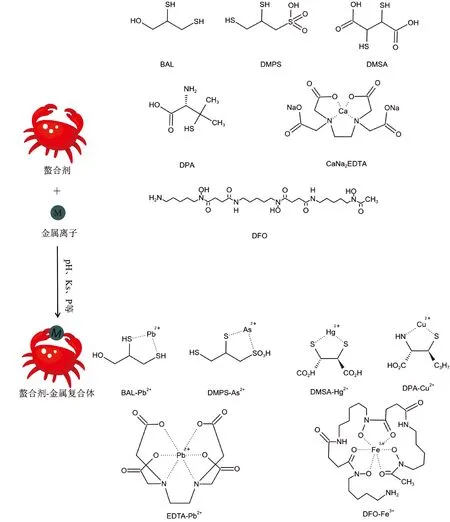
图1 螯合剂及螯合剂-金属复合体

表1 重金属中毒及对应的螯合剂治疗
1.2 螯合剂种类
临床上常用的螯合剂包括巯基螯合剂和氨羧螯合剂两大类[6],见表2。前者主要有二巯丙醇,又称英国抗路易气剂(British anti-Lewisite,BAL)、二巯基丙磺酸(dimercaptopropane sulfonate,DMPS)、二巯基丁二酸(dimercaptosuccinic acid,DMSA)和D-青霉胺(D-Penicillamine,DPA)等,通过提供巯基(-SH)并与金属原子/离子结合形成相对无害、稳定的环形配合物,从而经肾脏排泄;后者包括依地酸二钠钙(calcium disodium ethylenediamine tetraacetic acid,CaNa2EDTA)、去铁胺(deferoxamine,DFO)、去铁酮(deferiprone,DFP,L1)、地拉罗司(deferasirox,DFX)等,其含有氮原子和羧基(-COOH),二者均可提供多对电子与靶金属结合形成螯合物。
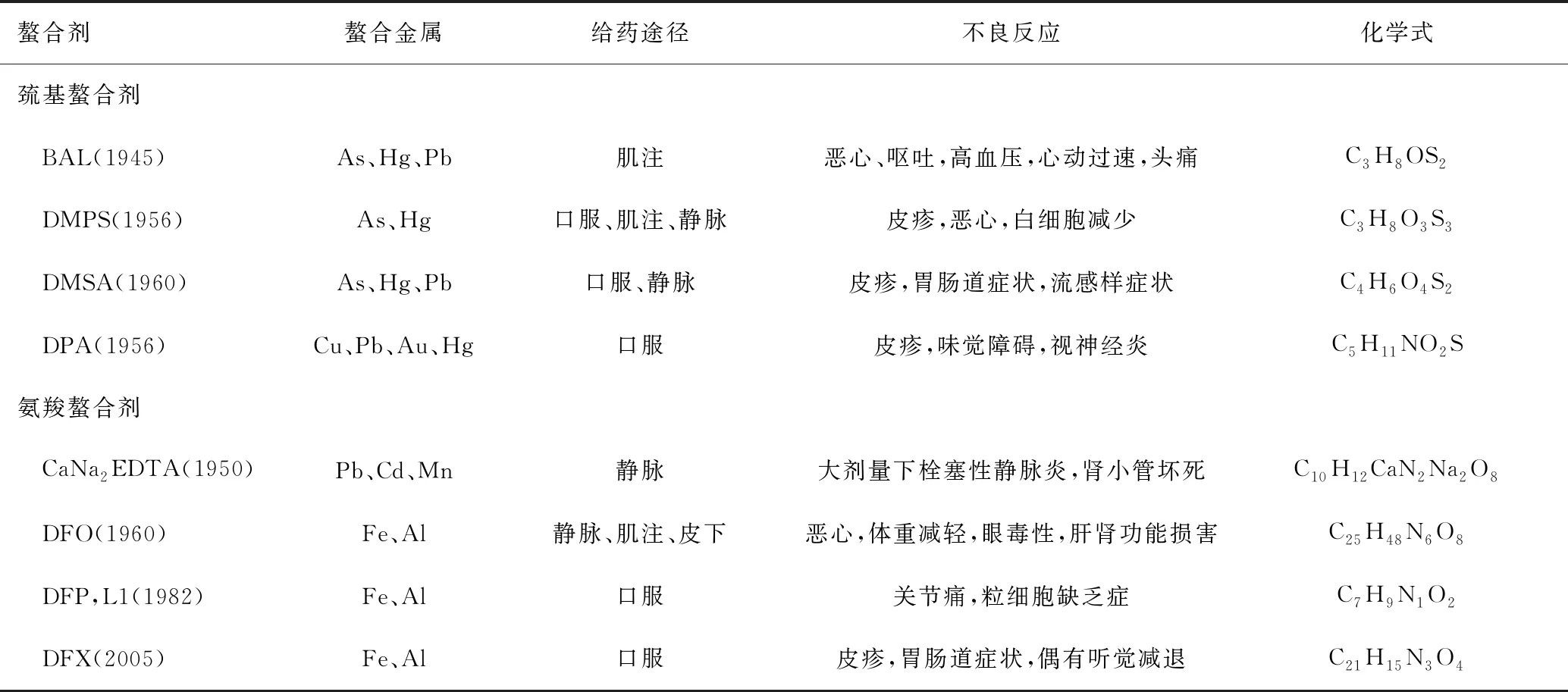
表2 临床上常用螯合剂的特性
1.2.1 巯基螯合剂
BAL最早用于治疗重金属中毒,包含两个巯基,属于二齿螯合剂。通常用于驱除体内的砷、铅和汞(无机汞,如HgCl2)。DMPS包含一个磺酸基(-HSO3)和两个硫醇基(-RSH),通常用于治疗砷、铅和汞中毒。DMSA也称为2,3-二巯基琥珀酸,包含两个羧基和两个巯基,用于治疗铅和汞的毒性。DMPS和DMSA是BAL的水溶性类似物,解毒效果较BAL强、毒性较小、副作用较少,不会导致重金属再分布到脑部。DPA是青霉素的代谢产物,含有巯基。DPA主要从体内去除多余的铜,常用于治疗威尔逊病(Wilson’s disease,WD),还用作为铅或砷中毒的二线或三线药物[3]。
1.2.2 氨羧螯合剂
CaNa2EDTA包括两个氮原子和四个羟基,属于六齿螯合剂,主要用于治疗铅中毒[7]。CaNa2EDTA容易与不含Ca2+的Na2EDTA混淆,后者会优先结合铅中毒患者血中Ca2+,造成严重的低钙血症,故不能用于治疗铅中毒,且Na2EDTA降低血钙浓度的速度过快,目前也不用于治疗高钙血症,主要作为采血管中的抗凝剂使用。而CaNa2EDTA中的Ca2+可以被稳定系数更高的金属离子(如Pb2+、Cd2+、Mn2+)置换出来(见表3),形成水溶性配合物,随后经肾脏排泄。

表3 CaNa2EDTA对各种金属离子的稳定常数
DFO是一种六齿铁螯合剂,包含25个碳原子和三个异羟肟酸基团,每个去铁胺分子可以结合1个铁原子。DFO与三价铁离子形成强键,对二价离子诸如Fe2+、Cu2+、Zn2+、Ca2+的亲和力很低。DFO与Fe3+和Al3+以1∶1比例结合,分别形成铁氧胺和铝氧胺化合物,它们是稳定的复合物,可以经胆汁和尿液有效地排出,用于β地中海贫血及其他铁过载状态患者的长期治疗,也用于治疗慢性肾脏病相关的铝中毒。除了DFO,目前临床上应用的铁螯合剂还包括DFP、DFX[8]。
1.3 妊娠期螯合治疗的安全性
根据美国食品药品管理局颁布的标准,CaNa2-EDTA属于妊娠期安全等级B级(在动物繁殖性的研究未见到药物对胎儿的不良影响,但没有在妊娠妇女中进行适当、有对照组的研究),BAL、DMSA、DFO及DFX属于C级(动物实验证明药物对胎儿有危害性,只有在权衡对孕妇的益处大于对胎儿的危害之后,方可使用),DPA和DFP属于D级(药物对人类胎儿有危害性,但在确有应用指征、且患者受益大于可能的风险时,严密观察谨慎使用)。临床上,中型或重型地中海贫血患者在孕前通过铁螯合剂行驱铁治疗,从而降低体内铁负荷,但DFP可引起胚胎死亡及胎儿畸形,因此地中海贫血的患者在DFP治疗期间和停药后至少6个月内应采取有效的避孕措施;DFP还可广泛地排泄至乳汁,如果驱铁治疗不可避免,应停止母乳喂养[8]。迄今为止,在妊娠期间接受另一种铁螯合剂DFO治疗的患者分娩的儿童均无畸形,但由于缺乏足够数据证实其在妊娠早期使用的安全性,孕早期不应使用DFO,只有在非不得已时才用药,临床上建议在妊娠20周后低剂量使用[8]。
现有的螯合剂还存在一定的不良反应,可引起恶心、头痛、血压升高等副作用。铜螯合剂青霉胺可能导致WD患者神经系统症状恶化,通过替换成曲恩汀(trientine,TTH)和四硫钼酸盐(tetrathiomolybdate)可减少副作用[9]。多数螯合剂缺乏特异性和选择性,在螯合目标金属元素的同时,也会螯合体内一些重要的微量元素,从而导致这些必需微量元素的缺乏。少数铅中毒患儿使用DMSA或CaNa2-EDTA时,血清锌会降低,造成患儿免疫力低下,出现感冒、发烧等表现,在驱铅治疗结束后,应注意监测微量元素并对其进行针对性补充[7]。另外,一些螯合剂可使有毒金属向脑和骨再分布,比如CaNa2-EDTA不能穿过细胞膜,仅能从细胞外液中去除铅,缺少从细胞内部螯合金属的能力,在严重铅中毒时,可使铅从其他组织重新分布到大脑,造成铅中毒性脑病。因此在螯合治疗前,进行利弊分析是至关重要的,在某些情况下使用螯合剂比不治疗引起的损害更大。
2 螯合治疗的进展
现有的螯合剂面临着非组织特异性、重金属驱排效果不理想、有毒金属向脑和骨再分布、排泄人体必需微量金属元素、不能修复已经造成的机体损伤等缺点,这些局限推动着新型螯合剂的发展[10]。8-羟基喹啉是具有强抗氧化性能的铁螯合剂,能够穿越血脑屏障,Zheng等[11]合成了几种带有8-羟基喹啉结构的新型抗氧化剂-铁螯合剂,表现出螯合Fe3+的高特异性及高抗氧化能力。羟基吡啶并酮(hydroxypyridinones,HOPOs)是各种螯合剂的出色结构单元,具有3-羟基-4-吡啶并酮(3,4-HOPO)的去铁酮,已经广泛用于治疗全世界的铁超载疾病。3,4-HOPO螯合剂具有较低的毒性,对三价金属离子特异性高,一些基于3,4-HOPO结构的新型螯合剂正在进行临床试验,可以高效清除铝(Al)和钚(Pu),具有广阔的应用前景,见图2[12]。
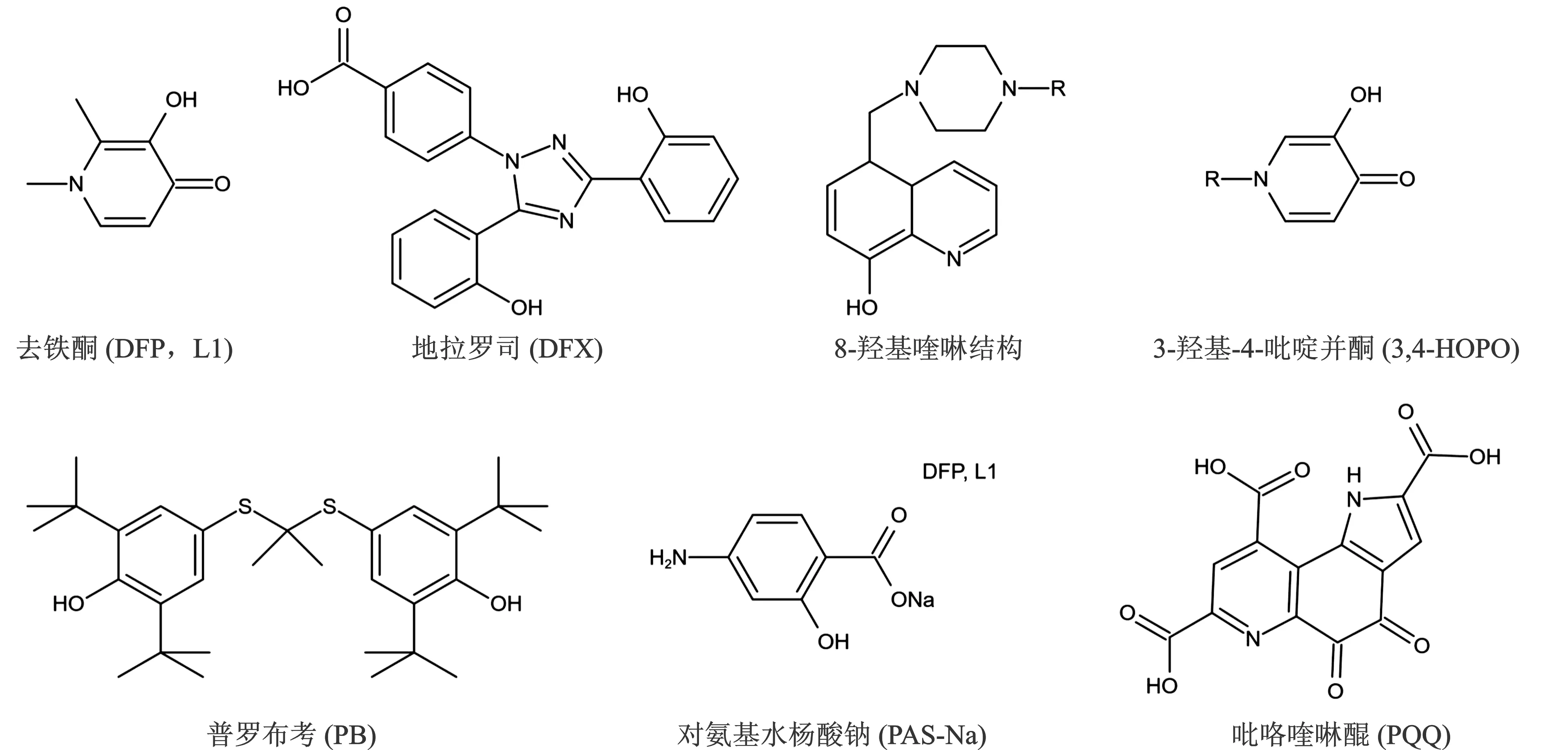
图2 螯合剂和抗氧化剂化学结构式
一项实验中研究者开发了3类DMSA衍生物,包括单异戊基DMSA(monoisoamyl DMSA,MiADMSA)、单甲基DMSA(monomethyl DMSA,MnDMSA)和单环己基DMSA(monocyclohexyl DMSA,MchDMSA),它们亲脂性强,毒性小,对细胞膜渗透性强,表现出比DMSA更好的重金属清除功效[13]。临床实践的新趋势是联合螯合疗法治疗,通过使用结构不同的螯合剂,可以更有效地去除有毒金属,例如DMSA与MiADMSA的共同给药在降低毒物浓度和减少氧化应激负担方面更有效,在妊娠晚期相对安全,并且不会对哺乳母鼠和子代造成不利影响[3]。《儿童高铅血症和铅中毒分级和处理原则》提出,临床上重度铅中毒儿童的治疗采用DMSA和CaNa2EDTA联合驱铅治疗。
3螯合剂联合抗氧化剂和必需微量元素用于重金属中毒的治疗进展
3.1 抗氧化治疗
重金属诱导机体发生氧化应激反应,引起DNA损伤、蛋白质结构改变和脂质过氧化,并抑制机体的正常生理功能,导致健康问题及疾病产生[6]。抗氧化剂通过螯合和清除等机制可以降低重金属的毒性作用,为孕产妇及儿童提供更完善的治疗效果(图3)。螯合剂辅助抗氧化剂可以提高螯合剂的疗效并减少毒副反应,如谷胱甘肽(glutathion,GSH)能够提高CaNa2EDTA的有效性,同时防止肾毒性[6]。与单独使用DMSA或大蒜素相比,DMSA与大蒜素的联合使用更显著地降低Swiss小鼠的骨铅水平,可以减轻骨铅动员对子代的神经毒性。最新的研究探索了包括内源性(含硫氨基酸、维生素、必需脂肪酸等)、外源性(食品和植物提取物、人工合成药物)在内的一系列抗氧化剂,它们在重金属中毒的综合治疗方面显示出许多有益效果。

图3 抗氧化剂通过螯合和清除等机制降低重金属的毒性作用
3.1.1 维生素
维生素有助于从受累的靶器官/组织调动蓄积的金属,从而减轻机体受到氧化应激损伤的风险。目前发现硫胺素(维生素B1)、抗坏血酸(维生素C)、α-生育酚(维生素E)和吡哆醇(维生素B6)等与金属螯合剂作为联合疗法给药时,可以提高妊娠期的临床治疗效果[13]。
3.1.2 含硫氨基酸
蛋氨酸是一种必需氨基酸,其结构中的硫基有助于清除有毒金属。N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)作为一种含硫抗氧化剂,可以刺激GSH的生物合成,从而清除活性氧并维持抗氧化剂/促氧化剂水平的稳态。牛磺酸已被报道用于治疗重金属中毒,与螯合剂共同使用可以减少血液和大脑中铅诱导的氧化应激,表现出巨大的治疗潜力[13]。
3.1.3 食品和植物提取物
黄酮类化合物广泛存在于自然界的植物中,在清除自由基离子方面具有潜在的抗氧化活性,从而最大限度地减少氧化应激的发生[4]。最有效的类黄酮化合物之一是槲皮素,它通过螯合与清除机制抑制氢过氧化物引起的DNA损伤。天然多酚类物质,如姜黄素等,不仅可以作为抗氧化剂终止自由基链反应,还可以作为氧化活性金属的有效螯合剂。吡咯喹啉醌(pyrroloquinoline quinone,PQQ)作为重要营养素在膳食中广泛存在,由于不能在哺乳动物中合成,饮食中缺乏PQQ会使机体产生类似维生素相关缺乏症的反应。PQQ具有促进机体生长和线粒体形成、抗氧化及增强免疫等功能,是一种氧化还原酶辅基,能有效地清除体内的自由基,减少自由基对人体的伤害,在重金属治疗方面具有良好的前景[14]。这些天然抗氧化剂可以抑制氧化、清除自由基,发挥螯合、还原和清除特性(表4)。与传统的螯合剂相比,天然来源的补充剂、食品和植物抗氧剂,由于其可负担性、实用性高和副作用小,可作为妊娠期的金属解毒剂使用。

表4 天然抗氧化剂解毒的机理及活性成分
3.1.4 人工合成药物
普罗布考(probucol,PB)最早用于降脂,是心脑血管疾病的二级预防用药, PB作为强抗氧化药物可以保护神经元免受损伤[27]。在昆明小鼠锰中毒模型中,PB通过自身抗氧化作用抑制了依赖caspase-3介导的线粒体凋亡通路(内源性)来降低脑内神经细胞的凋亡,进而改善锰对小鼠造成的氧化应激损伤和神经毒性等[28]。
对氨基水杨酸钠(sodium para-aminosalicylic acid,PAS-Na)是一种含有水杨酸基团的非甾体抗炎药,具有神经保护作用[29]。对1例使用PAS-Na治疗的慢性中度锰中毒患者长达17年的追踪观察发现,PAS-Na治疗慢性锰中毒的远期疗效较好。PAS-Na可经JNK/P38 MAPK途径对锰诱导的神经炎症产生拮抗作用。PSA-Na具有调节SD大鼠体内Fe2+、Cu2+、Zn2+等二价金属元素稳态的作用,过量锰暴露下可上调这些金属元素在动物体内的水平。近期研究还发现PAS-Na对铅诱导的神经毒性具有保护作用,通过调节ERK1/2-p90RSK/NF-κB通路,抑制大鼠海马神经炎症,改善染毒铅大鼠的学习记忆障碍[30]。
3.2 元素补充治疗
3.2.1 必需微量元素补充
螯合治疗在清除有毒和多余的金属离子的同时也会丢失一些必需微量元素,因此妊娠期间在螯合剂使用前后可通过检测尿、血等查看体内金属元素的含量,及时补充丢失的营养元素。这部分丢失的营养元素,如锌、硒、锰等必需微量元素还可发挥抗氧化功能,有助于排出有毒金属,同时维持正常身体功能所需的金属和辅因子的平衡。已被证明在铅暴露之前给予动物锌、硒补充剂具有保护作用;补充锌的铅暴露动物可以恢复SOD和δ-氨基乙酰丙酸脱水酶(δ -aminolevulinic acid dehydratase,ALAD)水平,而补充硒可以上调铅暴露动物肾脏和肝脏组织中SOD、GSH和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的水平[4]。
3.2.2 金属元素间竞争性抑制
金属间存在相互作用,主要表现为竞争性吸收,故利用金属间的拮抗作用减少某些重金属的吸收,有助于解毒。例如铁和锰共享同一个二价金属转运蛋白1(divalent metal transporter 1,DMT1),故补充铁有助于降低锰负荷[31]。铁、锌和铜在胃肠道中竞争性吸收,补充药理剂量的锌可减少铜元素吸收,锌剂通过诱导肠黏膜和肝细胞合成金属硫蛋白(metallothionein,MT),MT与铜有较高的亲合力,可用于治疗妊娠期的WD等铜过载性疾病[32]。
4 结语
随着城市化和工业化的发展,重金属污染日益严重,重金属暴露仍然是影响妇幼健康的一项重要公共卫生问题,因而,妊娠期重金属中毒的治疗非常重要。螯合剂能够迅速排出体内有毒重金属,但现有的螯合治疗毒副作用大,驱排效果不理想,可以透过母胎屏障影响胎儿和儿童健康,还会引起部分必需微量元素的丢失,打破体内金属元素稳态。必需微量元素的补充治疗有助于维持孕产妇及儿童体内金属元素的稳态,还可以通过金属间的相互作用降低妊娠期有毒金属的负荷。而基于现有螯合剂的局限,开发与设计新型螯合剂取得一定的进展。研究表明氧化应激损伤是多种重金属暴露引起机体组织病理损伤的共同机制,抗氧化治疗可以有效降低重金属的毒性作用,双功能抗氧化剂既能加速有毒金属的排泄,又可以降低氧化应激损伤,已经受到大家普遍重视。因此,螯合剂、抗氧化剂与必需微量元素等解毒剂的联合治疗可成为妊娠期重金属治疗的有效补充方案。
