全方位透视氢键在2023年高考命题中的体现
2023-09-19邵鸿孙晶
邵 鸿 孙 晶
(1.山东省临沂第十九中学 2.山东省日照市莒县第四中学)
氢键在教材中着墨不多,却是高考不可或缺的知识点.高考命题中常以选择题中的某个选项或选考题中一个小问的形式出现,命题常涉及两种或几种化合物比较其熔沸点或溶解性等.若对氢键知识了解不深刻,很容易陷入解题误区.本文对氢键的知识、高考命题呈现形式和答题模板进行阐释,供大家参考.
1 全方位透视氢键知识
1.1 氢键的形成
氢键是指与分子中电负性较大的原子(一般是指O、N、F)相结合的氢原子和另一个分子中电负性极大的原子间产生的作用力.
1.2 氢键的相关概念
1)特点:具有饱和性和方向性.
2)本质:静电作用.
3)表示方法:X—H…Y.
4)形成条件:
①电负性很大的原子(如N、O、F等);
②氢原子.
5)表示形式:X—H…Y,其中“—”是共价键,“…”是氢键.
1.3 氢键的强度
氢键介于范德华力与化学键之间,强度大小:范德华力<氢键<化学键.特别强调:氢键是特殊的分子间作用力,不属于化学键.
1.4 氢键的分类
1)分子间氢键(含N、O、F分子间)
分子与分子之间会存在氢键的作用,同种分子之间可以存在氢键,某些不同种分子之间也可能形成氢键,如HF 分子间(如图1)、NH3分子间(如图2)、H2O 分子间(如图3)、对羟基苯甲醛分子间(如图4).
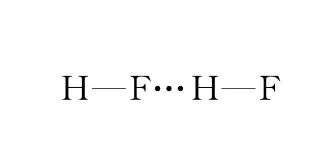
图1
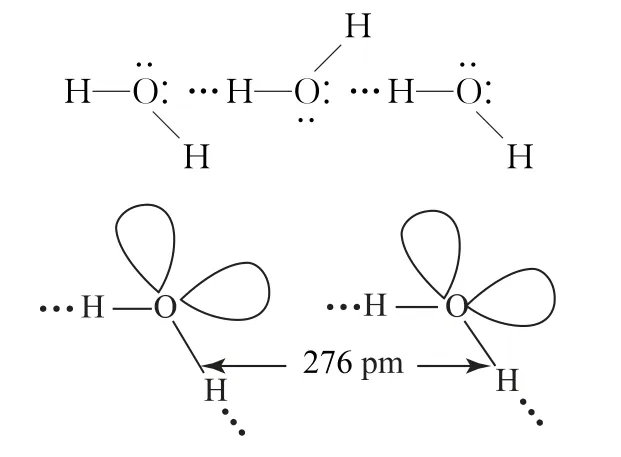
图3
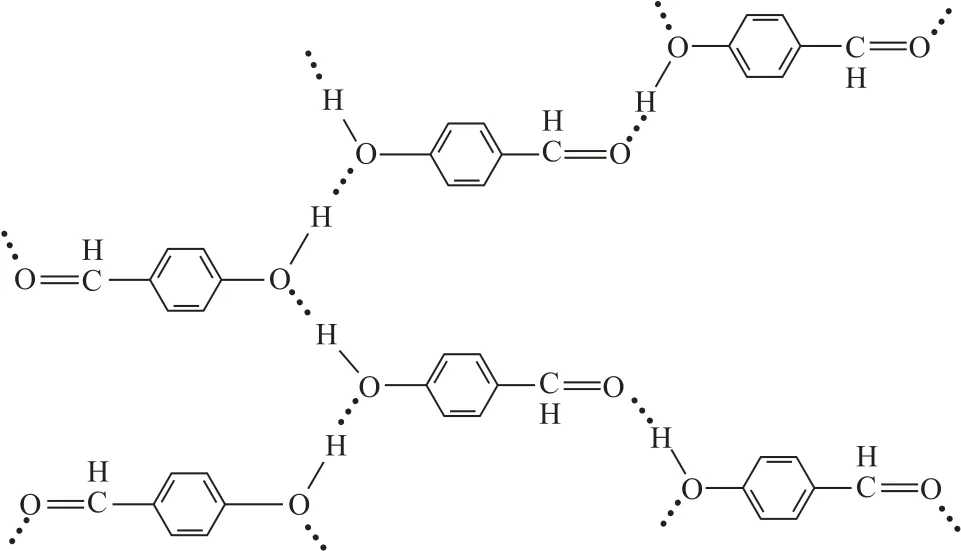
图4
2)分子内氢键
某些分子内,如邻羟基苯甲醛(如图5)、HNO3(如图6)可以形成分子内氢键.分子内氢键由于受环状结构的限制,X—H…Y 往往不能在同一直线上.
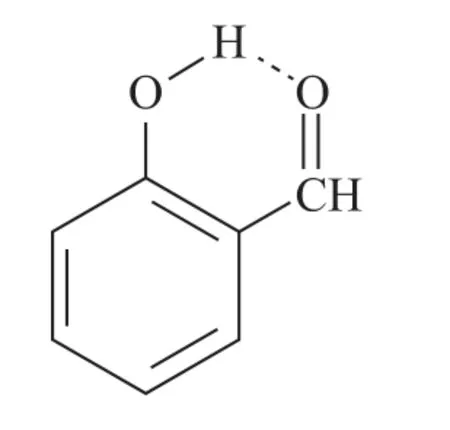
图5
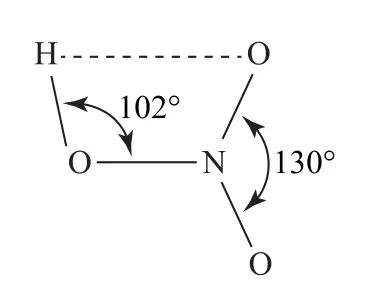
图6
1.5 氢键对物质性质的影响
1)氢键对物质熔点、沸点的影响
a)分子间存在氢键时,物质在熔化或气化时,除破坏普通的分子间作用力外,还需要破坏分子间的氢键,消耗更多的能量,所以存在分子间氢键的物质一般具有较高的熔点和沸点.
例如,第ⅤA~ⅦA 族元素的氢化物中,NH3、H2O 和HF的熔点、沸点比同主族相邻元素的氢化物的熔点、沸点高,这种反常现象是由于它们各自的分子间形成了氢键,第ⅣA~ⅦA 族元素简单氢化物的沸点变化趋势如图7所示.
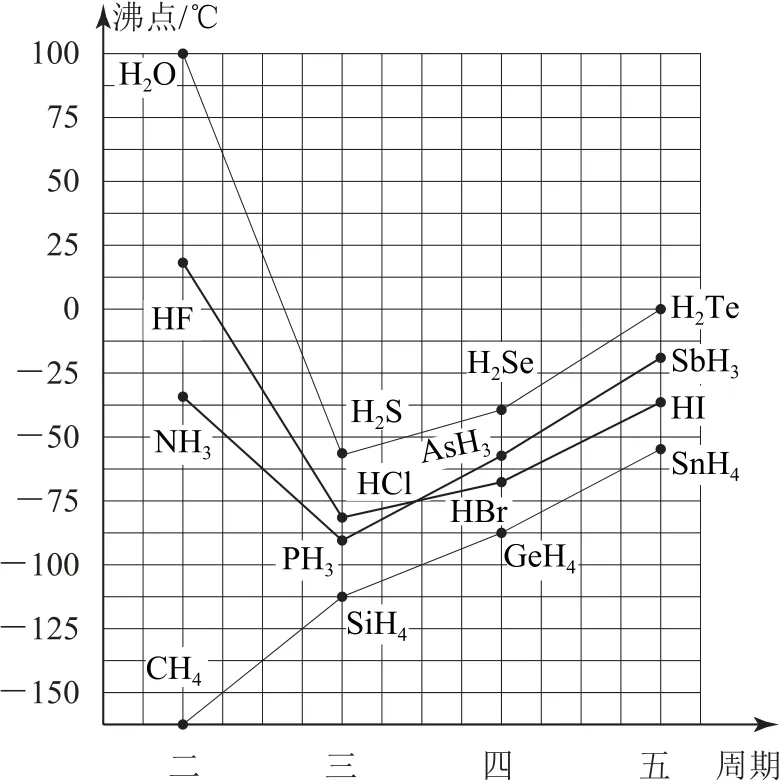
图7
b)对于互为同分异构体的物质,能形成分子内氢键的物质的熔点和沸点比能形成分子间氢键的物质的熔点和沸点低.如邻羟基苯甲酸能形成分子内氢键,而对羟基苯甲酸能形成分子间氢键,当对羟基苯甲酸熔化时,需要较多的能量克服分子间氢键,所以对羟基苯甲酸的熔点和沸点高于邻羟基苯甲酸的.
2)氢键对物质溶解性的影响
如果溶质与溶剂之间能形成氢键,则溶解性增大.氨分子与水分子间能形成氢键,且都是极性分子,所以NH3极易溶于水.低级的醇、醛、酮等可溶于水,都与它们的分子能与水分子间形成氢键有关.
3)氢键的存在引起密度的变化
由于水分子间的氢键,水结冰时,体积变大,密度变小,冰融化成水时,体积减小,密度变大.液体分子间若形成氢键,有可能发生缔合现象.例如液态HF,在通常条件下,除了正常简单的HF 分子外,还有通过氢键联系在一起的复杂分子(HF)n.其中n可以是2,3,4,….这种由若干个简单分子连成复杂分子而又不会改变原物质化学性质的现象,称为分子缔合.分子缔合会影响液体的密度.
注意:H2O 分子之间也有缔合现象.常温下,液态水中除了简单 H2O 分子之外,还有(H2O)2,(H2O)3,…,(H2O)n等缔合分子存在.降低温度,有利于水分子的缔合.温度降至0℃时,全部水分子结合成巨大的缔合物——冰.
4)氢键的存在对分子黏度的影响
分子间有氢键的液体,一般黏度较大.例如甘油、磷酸、浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为黏稠状液体.
2 氢键在2023年高考题中的呈现形式
2.1 判断氢化物和有机物的熔沸点
2.2 判断氢键的存在与规范表述
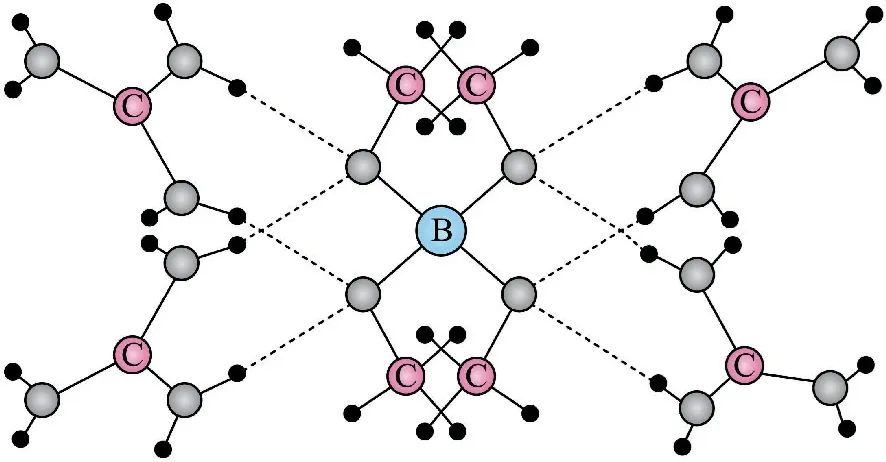
图8
A.该晶体中存在N—H…O 氢键
B.基态原子的第一电离能:C<N<O
C.基态原子未成对电子数:B<C<O<N
D.晶体中B、N 和O 原子轨道的杂化类型相同
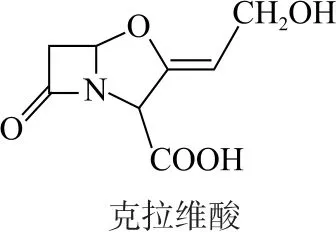
图9
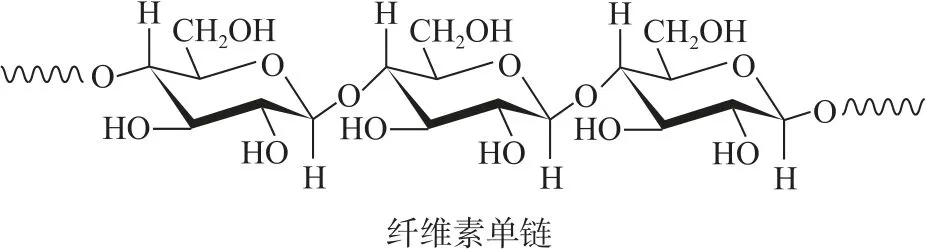
图10
图11
A.存在顺反异构
B.含有5种官能团
C.可形成分子内氢键和分子间氢键
D.1mol该有机物最多可以和1mol氢氧化钠溶液反应
2.3 考查氢键对物质溶解性的影响
A.纤维素是自然界分布广泛的一种多糖
B.纤维素难溶于水的主要原因是其链间有多个氢键
C.NaOH 提供OH-破坏纤维素链之间的氢键
D.低温降低了纤维素在NaOH 溶液中的溶解性
2.4 考查有机物分子内氢键的形成
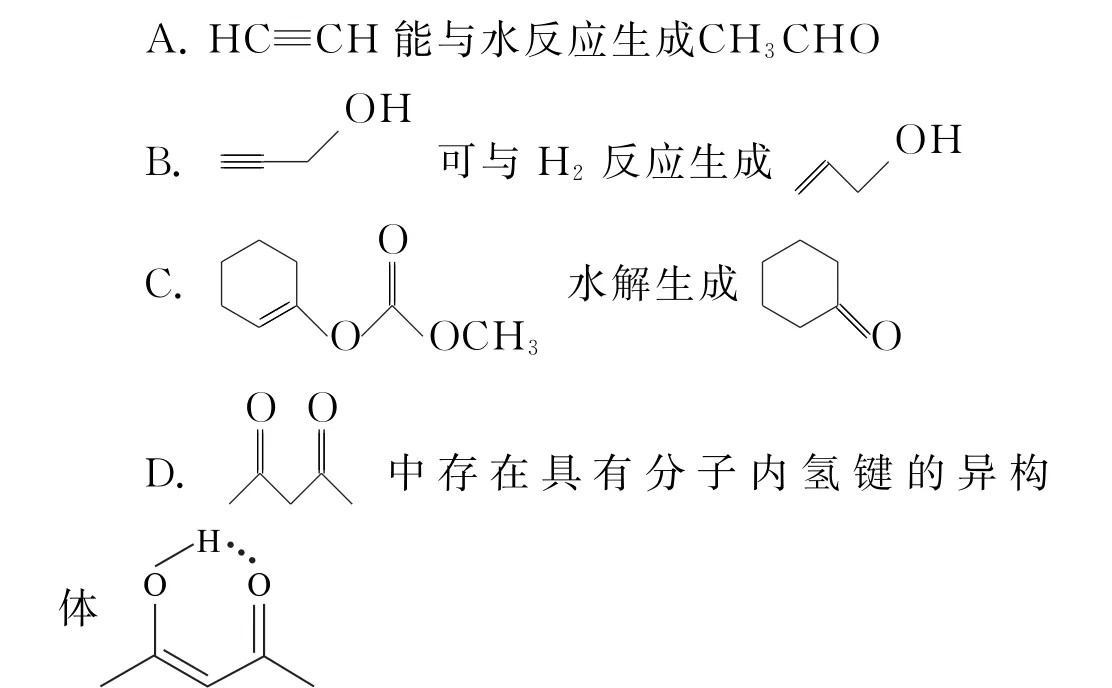
3 氢键答题策略与答题模板
3.1 氢键与熔、沸点
1)答题策略:分子形成分子间氢键会使物质熔沸点升高,而形成分子内氢键会使物质熔沸点降低.
2)答题模板:同为分子晶体,×××存在氢键,而×××仅存在较弱的范德华力.
例如,乙酸的沸点明显高于乙醛,其主要原因是:同为分子晶体,CH3COOH 存在分子间氢键,而乙醛仅存在较弱的范德华力.
再如,邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,原因是:邻羟基苯甲醛形成分子内氢键,而对羟基苯甲醛形成分子间氢键,分子间氢键使分子间作用力更大.
3.2 氢键与溶解性
1)答题策略:若溶质与溶剂之间能形成氢键,则溶解度增大,且氢键作用力越大,溶解性越好.
2)答题模板:×××与H2O 或其他溶剂(×××)分子间形成氢键.
例如,NH3极易溶于水的原因是:NH3与水分子间形成氢键.
(完)
