泥鳅肽制备及其脱色工艺优化
2023-09-19毛金蓉贺晓晴运立媛李茜张民
毛金蓉,贺晓晴,运立媛,2*,李茜,2,张民,2,3*
(1.天津农学院 食品科学与生物工程学院,天津 300392;2. 天津农学院 农产品加工中外联合研究中心,天津 300392;3. 天津科技大学 省部共建食品营养与安全国家重点实验室,天津 300457)
泥鳅(Misgurnus anguillicaudatus)是亚洲常见的淡水鱼类,主要分布于我国、日本、韩国等地[1],因其肉质细韧、营养价值高、味道鲜美等特点,广受消费者喜爱。据《中国药典》中记载,泥鳅被称为2 000 多年的传统药物[2]。随着市场需求的上升,我国的泥鳅产量也逐年递增,据《中国渔业统计年鉴》的报道,近年泥鳅产量以年均5.7%的速度持续增长[1],因此泥鳅的高值化发展成为目前研究的热点。关于泥鳅高值化产物多集中于泥鳅多糖[3]以及泥鳅凝集素[4],相对而言,泥鳅肽制备工艺研究的报道较少。
目前,国内外关于食物源多肽的制备及研究主要分为植物源及动物源[5],其制备方法多采用酶解法,该法反应条件温和、易操作、安全性较高,被广泛用于食物源多肽的制备。多肽制备量及氨基酸组成受酶解条件影响较大[6-7],其中包括蛋白酶种类、酶解温度、酶解时间、pH 值等条件。游丽君等[8]采用碱性蛋白酶,酶解9.42 h,获得肽得率为36.3%的泥鳅肽;聂凌鸿等[9]采用碱性蛋白酶,酶解4 h,获得肽得率为14.13%的泥鳅胶原蛋白肽。然而上述研究均未考虑各因素交互作用对蛋白酶酶活的影响,因此,本文在考虑蛋白酶酶活的基础上,优化泥鳅肽酶解工艺,以期为泥鳅肽制备提供参考。
在酶解过程中,水溶性色素也会被提取[10],因此经过酶解得到的肽大多色泽较暗[11],为适应市场,满足消费者需求,需对酶解后的肽进行脱色处理。活性炭是脱色工艺中常用的脱色剂之一,因其具有吸附效果好、对样品影响小、成本低等优点,在香螺肽[12]、梅花鹿胎盘寡肽[13]、小麦胚芽抗氧化肽[14]等肽类物质的脱色中广泛应用。
本研究以泥鳅为原料,经单因素试验筛选出最适蛋白酶后,采用单因素试验结合响应面试验优化酶解工艺以及脱色工艺,进而确定出适合产业化生产的酶解工艺参数以及脱色工艺参数,以期为泥鳅资源的高值化综合利用提供参考。
1 材料与方法
1.1 材料与试剂
泥鳅:市售;碱性蛋白酶(134.01 U/mg)、中性蛋白酶(39.20 U/mg)、胰蛋白酶(149.31 U/mg)、木瓜蛋白酶(136.28 U/mg)、风味蛋白酶(34.49 U/mg)、谷胱甘肽标准品(纯度≥98%):北京索莱宝科技有限公司;活性炭、三氯乙酸:天津市光复精细化工研究所。以上试剂均为分析纯。
1.2 仪器与设备
紫外分光光度计(TU-1810):北京普析通用仪器有限责任公司;恒温磁力搅拌水浴锅(HWS-28):上海一恒科学仪器有限公司;酶联免疫分析仪(AMR-100):杭州奥盛仪器有限公司。
1.3 试验方法
1.3.1 泥鳅粉制备
新鲜泥鳅去头去尾,绞为肉泥,于45 ℃烘箱干燥至恒重后粉碎,得到泥鳅粉,保存于干燥器中备用。泥鳅粉中的蛋白质含量采用GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法测定。
1.3.2 蛋白酶筛选
分别采用碱性蛋白酶、中性蛋白酶、风味蛋白酶、胰蛋白酶和木瓜蛋白酶对泥鳅粉进行酶解试验,其酶解条件根据各酶说明书确定相对适宜的条件(碱性蛋白酶:45 ℃,pH10.0;中性蛋白酶:50 ℃,pH6.5;风味蛋白酶:50 ℃,pH6;胰蛋白酶:37 ℃,pH8;木瓜蛋白酶:50 ℃,pH6.5),在各酶适宜的条件下,固定酶活为258 U/mL。酶解6 h 后,沸水浴灭酶10 min,冷却至室温,5 000 r/min 离心20 min,取上清液,测定并对比各酶酶解上清液水解度以及肽得率。
1.3.3 泥鳅肽制备单因素试验
结合1.3.2 筛选的蛋白酶,分别考察酶解温度(40、45、50、55、60 ℃)、pH 值(9.0、10.0、11.0、12.0、13.0)、酶解时间(30、60、90、120、150 min)、酶活(142、171、200、229、258 U/mL)、料液比[1∶4、1∶6、1∶8、1∶10、1∶12、1∶14(g/mL)]对肽得率的影响。本试验先通过单因素试验筛选出最佳酶解温度以及pH 值后,进行后续的响应面试验。
1.3.4 泥鳅肽制备响应面优化试验
根据单因素试验结果,结合Box-Behnken 中心组合试验设计,以酶解时间A、酶活B、料液比C 为自变量,以泥鳅肽得率Y1为响应值,建立三因素三水平试验,优化泥鳅肽酶解工艺。编码和水平因素如表1 所示。

表1 制备工艺Box-Behnken 试验因素与水平Table 1 Factors and levels of preparation process Box-Behnken test
1.3.5 水解度测定
采用甲醛滴定法测定酶解液水解度[15-16]。取酶解液3 mL,加入30 mL 蒸馏水,用0.05 mol/L NaOH 标准溶液滴定溶液体系至pH8.2,并维持1 min,记录消耗NaOH 的体积,缓慢加入6 mL 中性甲醛溶液后滴加4 滴酚酞指示剂,室温静置5 min,继续用0.05 mol/L NaOH标准溶液滴定溶液体系至pH9.2,并记录消耗NaOH的体积,水解度计算公式如下。
式中:M 为水解度,%;CNaOH为滴定所用NaOH 标准液浓度,mol/L;V1为样液滴定消耗NaOH 体积,mL;V0为空白组滴定消耗NaOH 体积,mL;0.014 为与1.00 mL 氢氧化钠标定溶液(CNaOH=1.000 mol/L)相当的氮的质量,g;3 为所加酶解液体积,mL;V 为水解液总体积,mL;N 为样品总含氮量,g。
1.3.6 肽得率测定
利用双缩脲法[17]测定酶解液的肽得率。酶解液肽含量测定:取3 mL 酶解液,加入3 mL 10%三氯乙酸,混匀,静置30 min,4 800 r/min 离心15 min,收集上清液。取4 mL 上清液于试管中,加入6 mL 双缩脲试剂,室温静置10 min 后于540 nm 下测定吸光度。谷胱甘肽标准品(0、0.2、0.4、0.6、0.8 mg/mL)以同样方法测定并绘制标准曲线,肽得率计算公式如下。
式中:W1为肽得率,%;m1为酶解液肽含量,mg/mL;m2为原料蛋白含量,mg;V 为水解液总体积,mL。
1.3.7 脱色剂筛选
分别探究活性炭与硅藻土两种脱色剂的脱色效果。于50 mL 酶解上清液中添加脱色剂,添加量为1.5%,温度50 ℃,pH6,脱色30 min 后测定肽保留率及脱色率并进行t 检验,根据显著性选择出最佳脱色剂。
1.3.8 脱色率测定
采用紫外分光光度计于190~400 nm 处对酶解液进行扫描,结果显示酶解液最大吸收波长为320 nm,在该波长下测定脱色液吸光度,脱色率计算公式如下[18]。
式中:W2为脱色率,%;A1为脱色前样品吸光度;A2为脱色后样品吸光度。
1.3.9 肽保留率测定
按照1.3.6 酶解液多肽含量的测定方法测定脱色前、后的酶解液中多肽含量,并按照下列公式计算肽保留率[19]。
式中:W3为肽保留率,%;B1为脱色前样品中多肽含量,mg/mL;B2为脱色后多肽含量,mg/mL。
1.3.10 脱色单因素试验
结合1.3.7 筛选的最优脱色剂,考察活性炭添加量(0.5%、1.5%、2.5%、3.5%、4.5%、5.5%)、脱色温度(30、40、50、60、70、80 ℃)、pH 值(3.0、4.0、5.0、6.0、7.0、8.0)、脱色时间(15、30、45、60、75、90 min)对脱色率以及肽保留率的影响。
1.3.11 脱色响应面试验
在单因素试验的基础上,根据Box-Behnken 的中心组合试验设计原理,以活性炭添加量(A')、脱色时间(B')、脱色温度(C')、pH 值(D')为影响因子,以脱色率(Y2)和肽保留率(Y3)为响应值,建立四因素三水平的试验,优化泥鳅酶解液脱色工艺条件,得到最佳酶解工艺组合参数。脱色工艺Box-Behnken 试验因素与水平见表2。

表2 脱色工艺Box-Behnken 试验因素与水平Table 2 Factors and levels of decolorization process Box-Behnken test
1.4 数据处理
每组试验重复3 次,数据分析采用Origin 2019、Design-Expert V8.0.6 及IBM SPSS Statistics 等软件。
2 结果与讨论
2.1 蛋白酶筛选结果
蛋白酶对泥鳅蛋白水解度及肽得率的影响见图1。
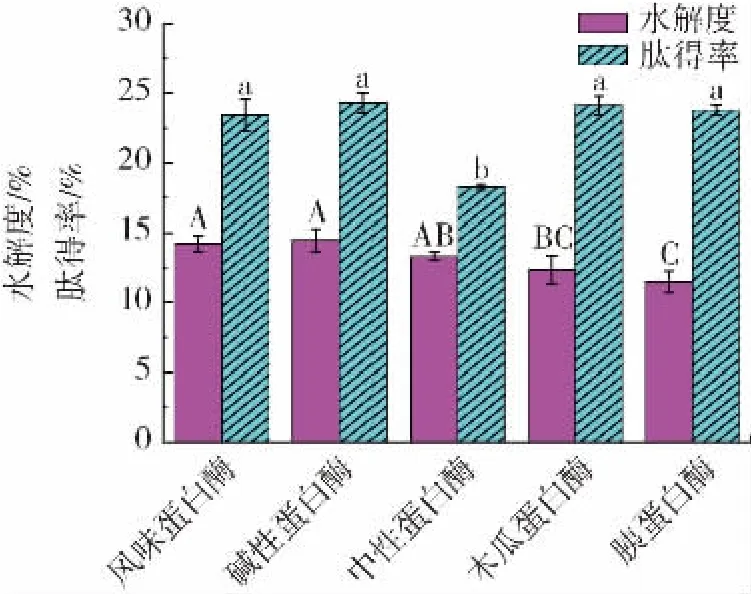
图1 蛋白酶对泥鳅肽得率及水解度的影响Fig.1 Effect of various proteases on yield and hydrolysis of loach peptides
由图1 可知,风味蛋白酶、碱性蛋白酶以及中性蛋白酶水解度无显著差异(P>0.05),但碱性蛋白酶水解度以及肽得率均最高,分别为14.48%、24.30%;中性蛋白酶肽得率(18.26%)显著低于风味蛋白酶(23.46%)和碱性蛋白酶(24.30%),碱性蛋白酶与风味蛋白酶肽得率无显著差异(P>0.05)。不同类型的蛋白酶水解度以及肽得率有所区别,这是由于蛋白酶在水解过程中具有专一性,不同蛋白酶有着不同的酶切位点,且主要酶切位点数量有差异,需根据实际的试验材料筛选出酶解效果最佳的蛋白酶[20]。碱性蛋白酶价格低于风味蛋白酶,且在相同酶活下,碱性蛋白酶的使用量少于风味蛋白酶,可从一定程度上降低生产成本,亦有相应研究表明,碱性蛋白酶酶解后的肽,其分子量小于风味蛋白酶酶解的肽[21]。因此,选择碱性蛋白酶为最适酶进行后续试验。
2.2 泥鳅肽制备单因素试验结果
2.2.1 酶解温度对泥鳅肽得率的影响
酶解温度对泥鳅肽得率的影响见图2。
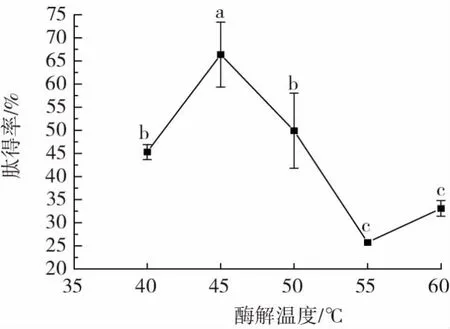
图2 酶解温度对泥鳅肽得率的影响Fig.2 Effect of enzymatic hydrolysis temperature on yield of loach peptides
由图2 可知,随着酶解温度的升高,泥鳅肽得率呈先上升后下降的趋势。酶解温度为45 ℃时,肽得率达到最大值,显著高于其他温度下的肽得率(P<0.05);当酶解温度超过45 ℃时,肽得率呈下降趋势,这可能是由于温度过高,部分蛋白酶活性降低,导致肽得率降低,故选择45 ℃为最佳酶解温度进行后续试验。
2.2.2 pH 值对泥鳅肽得率的影响
pH 值对泥鳅肽得率的影响见图3。

图3 pH 值对泥鳅肽得率的影响Fig.3 Effect of pH on yield of loach peptides
由图3 可知,随着溶液pH 值增加,泥鳅肽得率呈先上升后下降的趋势。当pH 值达到10.0 时,泥鳅肽得率显著高于pH9.0 时的肽得率(P<0.05),且泥鳅肽得率达到最大值;当pH 值大于10.0 时,泥鳅肽得率呈现逐渐下降的趋势,这可能是由于随着碱性的增强,酶活性逐渐降低;当pH 值为13.0 时,泥鳅肽得率迅速下降,这可能是由于过碱环境改变了蛋白酶空间构象,从而使蛋白酶失活[22]。故选择pH10.0 进行后续试验。
2.2.3 酶解时间对泥鳅肽得率的影响
酶解时间对泥鳅肽得率的影响见图4。
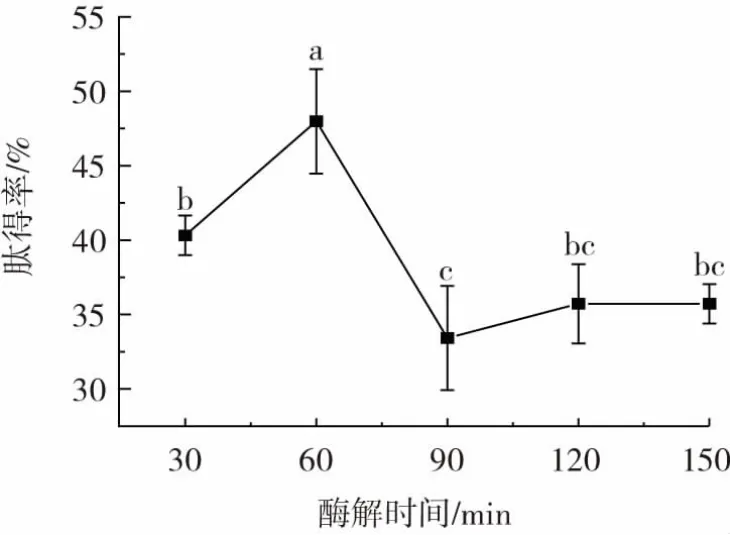
图4 酶解时间对泥鳅肽得率的影响Fig.4 Effect of enzymatic hydrolysis time on yield of loach peptides
由图4 可知,随着酶解时间的延长,肽得率整体呈先上升后下降的趋势。当酶解时间为60 min 时,泥鳅肽得率达到最大值。酶解时间超过60 min 时,随着酶解时间的延长,泥鳅肽得率整体呈下降趋势,推测原因可能是蛋白酶随着酶解时间延长,酶与肽反应,将肽进一步水解为氨基酸,使得泥鳅肽得率下降。酶解时间为90、120、150 min 时的肽得率无显著差异(P>0.05),故选择酶解时间30、60、90 min 进行后续响应面试验。
2.2.4 酶活对泥鳅肽得率的影响
酶活对泥鳅肽得率的影响见图5。
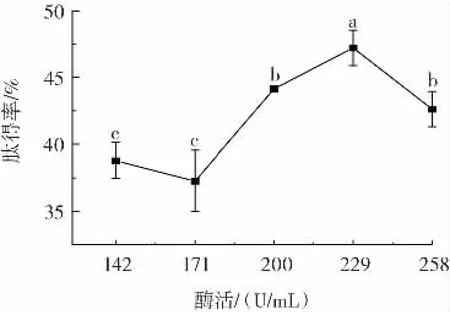
图5 酶活对泥鳅肽得率的影响Fig.5 Effect of enzyme activity on yield of loach peptides
由图5 可知,随着酶活的增加,泥鳅肽得率整体呈先上升后下降的趋势。酶活在142、171 U/mL 时,泥鳅肽得率无显著差异(P>0.05),而酶活在200、229、258 U/mL 时,肽得率均显著高于142 U/mL 和171 U/mL酶活下的肽得率。当酶活达到229 U/mL 时,肽得率达到最大值。
底物浓度一定时,酶解反应速度与酶活呈正相关,酶与底物结合形成中间产物,从而使得泥鳅蛋白酶解更为彻底,当酶活超过229 U/mL 时,泥鳅肽得率呈现下降趋势,推测可能是由于酶活过高,多余的蛋白酶与体系中的肽结合,将泥鳅肽进一步水解为氨基酸,从而导致泥鳅肽得率呈现下降趋势。故选择200、229、258 U/mL 进行响应面试验。
2.2.5 料液比对泥鳅肽得率的影响
料液比对泥鳅肽得率的影响见图6。

图6 料液比对泥鳅肽得率的影响Fig.6 Effect of material-liquid ratio on yield of loach peptides
由图6 可知,随着溶液体积的增加,泥鳅肽得率整体呈先上升后趋于平缓下降的趋势,当料液比为1∶12(g/mL)时,泥鳅肽得率达到最大值;当料液比为1∶14(g/mL)时,泥鳅肽得率有所降低,这可能是因为随着溶液体积的增大,底物浓度变低,增加了酶与底物接触的难度,使得泥鳅蛋白酶解不完全,难以被水解为泥鳅肽。料液比为1∶8(g/mL)时肽得率与料液比为1∶12(g/mL)时的肽得率无显著性差异(P>0.05),料液比过高会增加后续浓缩的时间以及成本,故综合考虑选择1∶6、1∶8、1∶10(g/mL)进行后续响应面试验。
2.2.6 泥鳅肽制备响应面优化试验结果
响应面试验设计及结果见表3,通过软件(Design-Expert V8.0.6)计算出回归方程,得出最佳制备工艺。
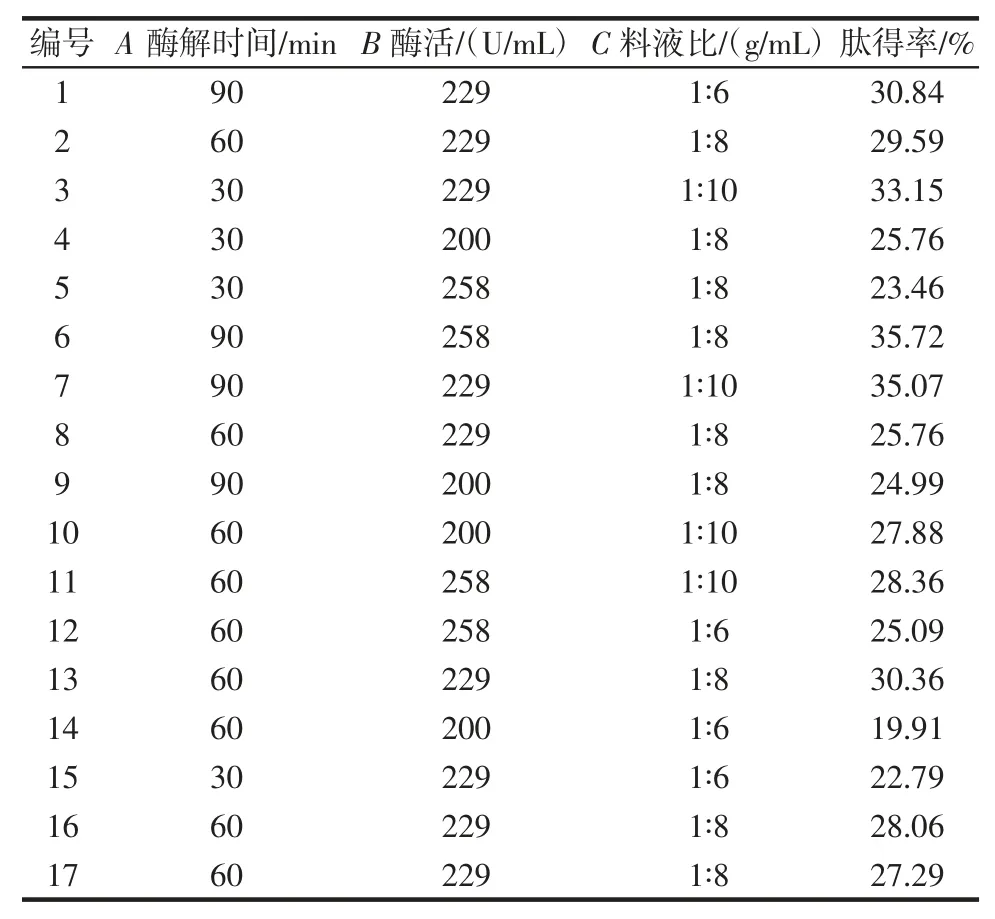
表3 泥鳅肽制备工艺优化响应面试验设计及结果Table 3 Response surface experimental design and results for preparation process optimization of loach peptides
各因素与泥鳅肽得率之间的二次多元回归方程为Y1=28.21+2.68A+1.76B+3.23C+3.26AB-1.54AC-1.18BC+2.21A2-2.94B2+0.043C2,该模型的方差分析见表4。

表4 肽得率的回归模型方差分析Table 4 Regression model analysis of variance for peptide yields
由表4 可以看出,该模型P<0.01,故回归模型极显著,失拟项P 值为0.848 8,表示失拟项不显著,模型相关系数R2为0.945 3>0.8,说明方程拟合度较好,可以用此模型对蛋白酶酶解泥鳅肽工艺进行优化。对泥鳅肽得率影响大小排序依次为料液比>酶解时间>酶活。
对回归模型进行响应面分析,结果见图7。

图7 各因素交互作用对泥鳅肽得率的影响Fig.7 Effect of interaction between factors on yield of loach peptides
由图7 可知3 个交互项(AB、AC、BC)之间的相互作用。通过Design-Expert V 8.0.6 得出最佳条件为碱性蛋白酶酶活248 U/mL、酶解时间90 min、料液比1∶10(g/mL),此条件下肽得率预测值为36.10%。
2.2.7 泥鳅肽制备验证试验
为了验证该响应面结果的可行性,在最优条件下进行3 次试验,所得泥鳅肽得率为(37.27±0.81)%,与预测值36.10%无显著性差异。结果表明该响应面模型能够较好地模拟试验过程和预测泥鳅肽得率。因此酶解工艺条件为碱性蛋白酶酶活248U/mL、酶解时间90 min、料液比1∶10(g/mL)。本研究与游丽君等[8]、聂凌鸿等[9]最优酶解工艺相比,在提高肽得率的同时,酶解时间显著缩短。
2.3 脱色剂选择结果
不同脱色剂对泥鳅肽酶解液脱色率以及肽保留率的影响见图8。
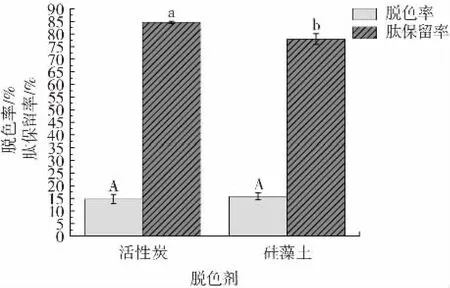
图8 不同脱色剂对泥鳅肽酶解液脱色率以及肽保留率的影响Fig.8 Effect of different decolorizing agents on decolorization and retention rates of loach peptides in enzymatic hydrolysates
由图8 可知,在相同的脱色条件下,活性炭脱色效果较好,其脱色率较硅藻土差异不显著(P>0.05),但肽保留率显著高于硅藻土(P<0.05),因此选择活性炭为脱色剂进行后续试验。
2.3.1 活性炭添加量对脱色率以及肽保留率的影响
活性炭添加量对脱色率以及肽保留率的影响见图9。

图9 活性炭添加量对脱色率以及肽保留率的影响Fig.9 Effect of activated carbon addition on decolorization rate and peptide retention rate
由图9 可知,随着活性炭添加量的增加,脱色率呈显著上升趋势(P<0.05),而肽保留率整体呈下降趋势。活性炭在脱色时,其特有的多孔结构能够物理吸附色素。活性炭的添加量增加虽然能够使脱色率逐渐上升,但其未与色素结合的多孔结构也能够吸附泥鳅肽,因此会使泥鳅肽的保留率降低[23]。综合肽保留率及脱色率的结果,选择活性炭添加量为1.5%、2.5%、3.5%进行后续响应面试验。
2.3.2 脱色时间对脱色率以及肽保留率的影响
脱色时间对脱色率以及肽保留率的影响见图10。

图10 脱色时间对脱色率以及肽保留率的影响Fig.10 Effect of decolorization time on decolorization and peptide retention rate
由图10 可知,随着脱色时间的延长,脱色率整体呈先上升后显著下降的趋势,脱色时间为90 min 时,肽保留率显著大于75 min 时的肽保留率(P<0.05);但此时脱色率显著小于75 min 时的脱色率(P<0.05),而75 min 时的肽保留率显著小于15、30、45、60 min 时的肽保留率。在一定时间内,随着脱色时间的延长,色素分子能够与活性炭表面充分接触,但在活性炭吸附过程中,色素分子与泥鳅肽存在竞争吸附关系,随着脱色时间延长,活性炭产生吸附解析,造成色素分子的释放,使脱色率下降,而体系中的泥鳅肽被吸附入活性炭多孔结构内部的可能性增加,从而使肽保留率呈现下降的趋势[24]。综合肽保留率及脱色率的结果,选择脱色时间为30、45、60 min 进行后续响应面试验。
2.3.3 脱色温度对脱色率以及肽保留率的影响
脱色温度对脱色率以及肽保留率的影响见图11。

图11 脱色温度对脱色率以及肽保留率的影响Fig.11 Effect of decolorization temperature on decolorization rate and peptide retention rate
由图11 可知,随着脱色温度的升高,脱色率呈先上升后下降的趋势,而肽保留率整体呈现逐渐下降的趋势。当脱色温度为30 ℃时,肽保留率显著大于40、50、60 ℃时的肽保留率(P<0.05),但此时脱色率显著小于40、50、60 ℃的脱色率(P<0.05)。
相关研究表明,活性炭脱色是吸热过程,温度升高的同时会使溶液体系黏度下降,有益于色素分子的扩散,使其更易于吸附到活性炭多孔组织内部,从而使脱色率增加,但温度过高时,亦会产生吸附解析现象,吸附到活性炭多孔中的色素会被释放出来[25],并且过高的温度会使泥鳅肽失活。综合肽保留率及脱色率的结果,选择脱色温度为40、50、60 ℃进行后续响应面试验。
2.3.4 pH 值对脱色率以及肽保留率的影响
pH 值对脱色率以及肽保留率的影响见图12。

图12 脱色pH 值对脱色率以及肽保留率的影响Fig.12 Effect of decolorization pH on decolorization rate and peptide retention rate
由图12 可知,随着pH 值的增加,肽保留率呈先显著上升后显著下降的趋势,脱色率整体呈现逐渐下降的趋势。当pH 值为3.0、4.0、5.0 时,脱色率以及肽得率显著高于pH6.0、7.0、8.0 时的脱色率及肽得率,说明活性炭在酸性条件下脱色率较高,而在中性及碱性条件下脱色效果较差,这可能是由于pH 值的变化,能够改变色素分子结构和电荷性质使其不易于被活性炭吸附,这与已有的报道结果相符[24],试验目的在于保证较高脱色率的同时肽保留率较高,故选择脱色pH 值为3.0、4.0、5.0 进行后续响应面试验。
2.3.5 脱色响应面优化试验结果
脱色响应面试验设计及结果如表5 所示。

表5 泥鳅肽脱色工艺优化响应面试验设计Table 5 Response surface experimental design for decolorization process optimization of loach peptides
通过软件,分析处理表5 中数据,可获得各因子与泥鳅肽脱色率以及肽保留率之间的二次多元回归方程:Y2=50.83+2.75A'-1.81B'-2.29C'-13.5D'+0.63A'B'-0.036A'C'+3.72A'D'+0.45B'C'-0.43B'D'-0.19C'D'-0.89A'2-0.16B'2+0.0.24C'2-5.56D'2;Y3=91.82 -2.09A' +0.75B' +5.33C'-0.061 0D'+2.24A'B'+8.16A'C'-1.3A'D'-1.77B'C'+3.81B'D'-0.84C'D'-9.73A'2+0.86B'2-6.12C'2-7.13D'2。
脱色率及肽保留率回归模型方差分析分别见表6和表7。

表6 脱色率的回归模型方差分析Table 6 Regression model ANOVA for decolorization rates
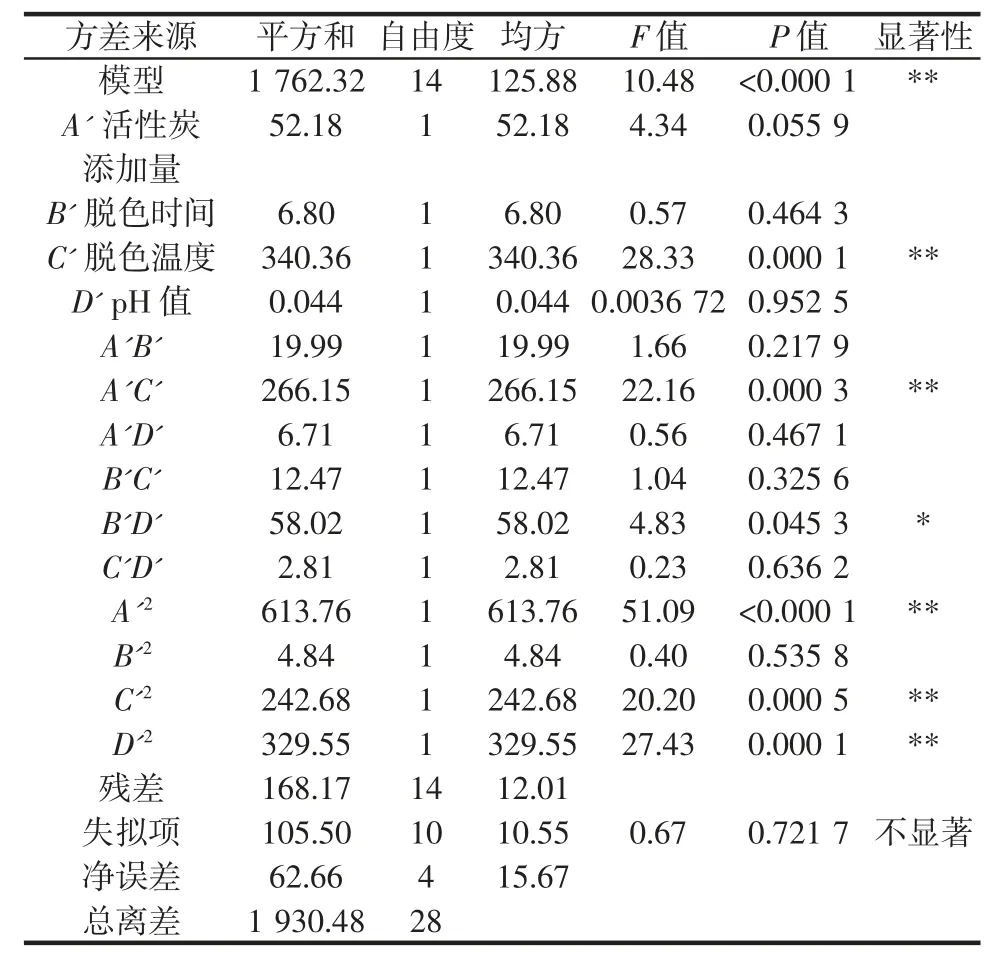
表7 肽保留率的回归模型方差分析Table 7 Regression model ANOVA for peptide retention rate
由表6 可知,脱色率回归模型的P 值<0.01,故回归模型极显著,失拟项P 值为0.071 2,表示为失拟项不显著,模型相关系数R2为0.953 2>0.8,说明方程拟合度较好,可以用此模型对泥鳅肽脱色工艺进行优化。模型中信噪比为16.636>4,说明试验具有较高的精确度。响应面变异系数为6.34%<10%,说明试验可靠性较高,具有一定实践指导意义。对脱色率影响大小排序依次为pH 值>活性炭添加量>脱色温度>脱色时间。
由表7 可知,肽保留率回归模型的P 值<0. 01,故回归模型极显著,失拟项P 值为0.721 7,表示为失拟项不显著,模型相关系数R2为0.912 9>0.8,说明方程拟合度较好,可以用此模型对泥鳅肽脱色工艺进行优化。在本研究模型中信噪比为13.037,说明试验具有较高的精确度。本试验的响应面变异系数为4.19%,说明试验可靠性较高,具有一定实践指导意义。对肽保留率影响大小排序依次为脱色温度>活性炭添加量>脱色时间>pH 值。
对回归模型进行响应面分析,结果见图13~图14。

图13 各因素交互作用对泥鳅肽脱色率的影响Fig.13 Effect of interaction between factors on decolorization rate of loach peptides

图14 各因素交互作用对泥鳅肽肽保留率的影响Fig.14 Effect of interaction between factors on retention rate of loach peptides
由图13~图14 可知各交互项(A'D'、B'D'、C'D')以及(A'C'、A'D'、C'D') 之间的相互作用。通过Design-Expert V8.0.6 得出最佳脱色条件为活性炭添加量2.47%、脱色时间30 min、脱色温度53.97 ℃、pH3.32。脱色率以及肽保留率预测值分别为57.78%和93.34%。
2.3.6 脱色验证试验
为方便实际操作,将最佳脱色条件修正为活性炭添加量2.5%、脱色时间30 min、脱色温度54 ℃、pH3.0,在此条件下进行3 次试验,所得脱色率以及肽保留率分别为(57.91±0.19)%以及(94.90±0.02)%,均与预测值无显著性差异。结果表明该响应面模型能够较好地模拟试验过程和预测脱色率以及肽保留率。因此最佳脱色条件为活性炭添加量2.5%、脱色时间30 min、脱色温度54 ℃、pH3。
3 结论
通过分析比较5 种不同酶制备的泥鳅肽水解度以及肽得率,选取了碱性蛋白酶进行后续的单因素以及响应面试验,获得最佳泥鳅肽制备参数:酶解温度45 ℃、pH10.0、酶解时间90 min、酶活248 U/mL、料液比1∶10 (g/mL);最佳脱色工艺参数:活性炭添加量2.5%、脱色时间30 min、脱色温度54 ℃、pH3.0。本研究所得泥鳅肽制备工艺及脱色工艺简单,可为规模化生产提供参考,且能够有效缩短泥鳅肽制备时间,提高酶解效率,有效改善泥鳅肽外观品质,为泥鳅肽制备及脱色工艺优化提供理论基础。
