藜麦淀粉和藜麦抗性淀粉的理化性质
2023-09-19牛海力卢柏志马朗天赵方佳刘小轩岳田利
牛海力,卢柏志,马朗天,赵方佳,刘小轩,岳田利*
(1. 西北大学 食品科学与工程学院,陕西 西安 710069;2. 陕西省营养健康食品个性制造工程实验室,陕西 西安 710069;3. 陕西省食品安全风险识别控制技术研究中心,陕西 西安 710069;4. 陕西省食品安全与营养健康创新转化平台,陕西 西安 710069)
藜麦为藜科藜属一年生草本植物,性喜强光,原产于南美洲安第斯山脉的哥伦比亚、秘鲁等中高海拔地区,有着6 000 多年的种植和食用历史。藜麦中含有丰富的营养素,如淀粉、蛋白质、膳食纤维、必需脂肪酸和微量元素等,被联合国粮农组织推荐为适宜人类的“全营养食品”。淀粉是藜麦的主要成分,占藜麦干物质含量的50%以上[1],其对食品的营养功能及加工特性具有重要作用。因此,藜麦淀粉(quinoa starch,QS)的理化性质很大程度上影响着藜麦粉的性质和藜麦淀粉制品的品质。但由于淀粉类物质常会引起血糖的升高,因此,抗性淀粉近年来引起了人们广泛的关注。
抗性淀粉(resistant starch,RS)是指不能在小肠内消化、吸收及降解,但能在结肠中被肠道菌群酵解的一类淀粉和淀粉类食品的总称。抗性淀粉具有许多良好的生理功能,如维持血糖稳定、增强免疫力和改善肠道环境等。根据抗酶机制不同,抗性淀粉主要分为5类:物理包埋淀粉(RS1),主要存在于谷物和种子中,由植物细胞壁和蛋白质基质包裹而形成;天然淀粉颗粒(RS2),是指一些具有特殊晶体结构和构象,从而不易被小肠消化吸收的淀粉颗粒;老化回生淀粉(RS3),主要是经过糊化和冷却老化过程后,直链淀粉互相缠绕形成的结构紧密的新结晶体;化学改性淀粉(RS4),是通过化学改性(如醋酸酯化、羧甲基醚化和磷酸交联化等)改变淀粉分子结构以及引入新的官能团而形成的一类淀粉;淀粉-脂质复合物(RS5),主要是通过淀粉与脂质的相互作用,形成直链淀粉/支链淀粉与脂肪酸/脂肪醇的单螺旋复合物。随着人们生活水平的提高,人们更加注重饮食结构的合理性,尤其是增加膳食纤维的摄入量,而抗性淀粉作为膳食纤维的一种,逐渐成为了食品工业的热门原料。近年来,藜麦由于其较高的营养价值也受到广泛关注,但目前关于藜麦抗性淀粉的研究鲜见报道。由于RS1 和RS2 为天然存在的两种抗性淀粉,含量低,稳定性较差,在食品工业中较不常用,因此,该文对比研究QS 和三型、四型、五型藜麦抗性淀粉(quinoa resistant starch,QRS)的理化性质,以期为科学指导QS 和藜麦抗性淀粉在精准食品制造中的应用、开发特定的益生元补充剂提供参考。
1 材料与方法
1.1 材料与试剂
白藜麦(种子为青藜一号):青海三江沃土生态农业科技有限公司;普鲁兰酶(1 000 U/mL,P9841):北京索莱宝科技有限公司;糖化酶(10 万U/mL,S10018)、胰蛋白酶(250 USPU/mg,S10032)、棕榈酸、十二烷基硫酸钠、考马斯亮蓝G-250、牛血清白蛋白、氢氧化钠、四硼酸钠、偏重亚硫酸钠、醋酸钠、乙醇、冰醋酸、盐酸、磷酸(均为分析纯):上海源叶生物科技有限公司。
1.2 仪器与设备
分析天平(BSA323S):赛多利斯科学仪器(北京)有限公司;恒温振荡水浴锅(SHZ-88A 型):苏州培英有限公司;电热鼓风干燥箱(101 型):上海科恒实业发展有限公司;离心机(L550):湖南湘仪实验室开发有限公司;紫外可见光分光光度计(UV-2600):岛津仪器苏州有限公司;液晶超声波清洗器(KS-5200DE):昆山洁力美超声仪器有限公司;高压灭菌锅(LDZX-50KBS):上海申安医疗器械厂;快速黏度分析仪(RVA 4500):瑞典波通仪器公司;流变仪(ANTON-PAAR/MCR302):安东帕商贸有限公司。
1.3 方法
1.3.1 QS 的提取
参考Li 等[2]的方法提取QS。将藜麦粉碎、过筛,得到藜麦粉。取100 g 藜麦粉加入1 L 四硼酸钠缓冲液(12.5 mmol/L,pH10.0,含0.5% 十二烷基硫酸钠和0.5% Na2S2O5),搅拌30 min 去除蛋白质和脂质,然后3 000×g离心10 min,去掉上层液体,用去离子水(1 L)洗涤残渣,继续在3 000×g离心10 min,随后将残渣分散在去离子水中,搅拌过夜,进一步去除蛋白质。淀粉浆用四层棉布过滤,并通过140 μm 尼龙网,随后将浆体3 000×g离心10 min,用小勺刮去淀粉层顶部的棕色层,此步骤重复6 次以去除棕色颗粒和十二烷基硫酸钠,得到的组分在35 ℃的烘箱中烘干12 h,所得淀粉即为QS,密封保存在塑料容器中。经测定,QS 中总淀粉含量为84.27%(质量分数)。
1.3.2 三型藜麦抗性淀粉(QRS3)的制备
参考Simesk 等[3]的方法制备QRS3。将QS 悬浮液(8 g/100 mL)在沸水浴中加热10 min,糊化后的淀粉在121 ℃高压灭菌锅中加热20 min 使之完全糊化,然后冷却至60 ℃,加入10 mL 0.5 mol/L 醋酸盐缓冲液(pH5.0)和普鲁兰酶(80 U/g 淀粉)。混合物在60 ℃的水浴锅中振荡8 h 进行酶解。酶解结束后,在沸水浴中加热10 min 使酶失活,随后将混合物转移至平皿中,在4 ℃放置24 h 进行淀粉老化,老化淀粉在60 ℃下烘干,然后粉碎。以上所有步骤重复进行1 次,所得淀粉为QRS3,密封保存于塑料容器中。
1.3.3 四型藜麦抗性淀粉(QRS4)的制备
根据Ashwar 等[4]的方法制备QRS4。将QS(50.0 g,干基)加入含有三偏磷酸钠5.94 g、三聚磷酸钠0.06 g和硫酸钠5.00 g 的水(70.0 g)中,用1 mol/L 氢氧化钠溶液调节pH 值至11.5,然后在45 ℃下搅拌反应混合物3 h,反应后pH 值降至10.8。加入1 mol/L 盐酸溶液调节反应混合物pH 值至6.5,并在1 500×g离心10 min。收集沉淀淀粉,用蒸馏水洗涤7 次。提纯后的产品在40 ℃下干燥过夜后细磨。
1.3.4 五型藜麦抗性淀粉(QRS5)的制备
根据Qin 等[5]的方法并稍加修改制备QRS5。将QS溶解于0.2 mol/L 醋酸钠缓冲液(pH5.0)中制备淀粉浆料(10 g/100 mL),然后在121 ℃高压灭菌锅中加热20 min,使淀粉完全糊化。将淀粉糊冷却至60 ℃,加入普鲁兰酶(80 U/g 淀粉),并在60 ℃水浴锅中振荡酶解12 h。随后混合物在沸水浴中加热10 min 使酶灭活,加入棕榈酸(10%,淀粉干基重)在90 ℃振荡水浴锅中保持1 h,将混合物冷却至25 ℃,继续搅拌2 h,2 000×g离心20 min 得到淀粉-脂质复合物,并用50%乙醇洗涤。此步骤重复3 次,以去除未络合的脂肪酸。在40 ℃烘箱中干燥样品12 h,并在常温下密封保存。
1.3.5 持水性测定
参考张绵松等[6]的方法,称取1.00 g(m1)样品分散于15 mL 蒸馏水中,分别置于45、55、65、75、85 ℃水浴中加热30 min,冷却至25 ℃后,3 000 r/min 离心15 min,弃去上清液,称量沉淀质量m2,持水性(H,%)按公式(1)计算。

1.3.6 透明度测定
参考徐忠等[7]的方法测定淀粉透明度,制备淀粉乳(1 g/100 mL),置于沸水浴中加热15 min,然后冷却至室温,使用蒸馏水作为空白对照,在620 nm 处测定样品吸光度。
1.3.7 冻融稳定性测定
参考杨双盼等[8]的方法并稍作修改,将淀粉配成淀粉乳(6 g/100 mL),在90 ℃的水浴锅中加热振荡30 min,取出后冷却至室温。取10 mL 淀粉糊于离心管中,记录淀粉糊的质量(C1),然后放入-20 ℃的冰箱内冷冻24 h 后取出。在室温条件下自然解冻,然后4 000 r/min 离心10 min,弃去上清液,称量沉淀物质量(C2),析水率(S,%)按公式(2)计算。

1.3.8 溶解度与膨胀度测定
参考Gao 等[9]的方法并做适当修改。称取0.1 g 淀粉样品(质量记作m)于试管内(空试管质量记作m1),加入10 mL 去离子水,振荡10 s,然后在95 ℃的振荡水浴锅中加热60 min。随后将试管冷却至室温,4 500 r/min离心20 min。将离心后的上清液倒入铝桶中(空铝桶质量记作m3),在80 ℃的烘箱中干燥至恒重,质量记作m4。将带有沉淀的试管在80 ℃干燥20 min,取出称质量记作m2。溶解度(W,%)和膨胀度(P,g/g)按公式(3)和公式(4)计算。
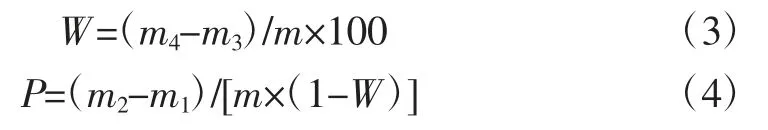
1.3.9 糊化特性
参考Lin 等[10]的方法,用快速黏度分析仪测定4种淀粉的糊化特性。称取3.0 g 样品(干基质量)于铝罐中,加入25.0 mL 蒸馏水,搅拌20~30 s 使其完全混合,然后放入快速黏度分析仪中进行检测。运行程序如下:以160 r/min 的速度搅拌淀粉浆,同时加热到50 ℃,保持1 min。然后在222 s 内加热至95 ℃,保持2.5 min,再在228 s 内冷却至50 ℃,保持2 min。
1.3.10 流变特性测定
参考Jan 等[11]的方法,制备淀粉乳(12 g/100 mL),在沸水浴中加热搅拌10 min 使其糊化,然后迅速将淀粉糊放置到流变仪样品盘上,对淀粉糊进行剪切速率扫描和频率扫描测试,表征淀粉样品的表观黏度和动态黏弹性参数。在剪切速率扫描中,设置探头与样品盘的间隙为98 μm,剪切速率由0.01 s-1升高至100 s-1。然后通过应变扫描测试来确定样品的线性黏弹性区域及应变值,最终设置测试应变为0.5%。频率扫描时,在角频率为0.1~100 rad/s 条件下,测定储能模量(G′)和损耗模量(G″)。
由于QRS3、QRS4 和QRS5 在沸水浴加热条件下不能糊化形成凝胶,因此本文只对QS 的流变特性进行分析。
1.3.11 淀粉碘吸收特性
参考程冰等[12]的方法,准确称取0.020 g 淀粉样品,加入0.5 mL 无水乙醇润湿,再加入1 mL 2 mol/L KOH 溶液,使样品充分溶解,然后加入10 mL 蒸馏水,用0.1 mol/L 盐酸溶液调节pH 值至6.5,使用蒸馏水定容至50 mL。准确移取10 mL 定容好的溶液,加入80 mL蒸馏水和2 mL 碘液(2 mg/mL I2和20 mg/mL KI),定容至100 mL,立即混匀,用紫外分光光度计在450~800 nm 波长条件下扫描,记录最大吸收波长。
1.3.12 体外消化性
参考程冰等[12]的方法并稍加修改,进行4 种淀粉体外消化性分析,并以葡萄糖标准溶液绘制标准曲线。样品测定具体方法:称取0.5 g 淀粉样品,加入20 mL乙酸钠缓冲液(0.2 mol/L,pH5.2),充分混合后,加入10 mL 现配的胰蛋白酶(110 U/mL)和40 μL 糖化酶(1 000 U/mL),然后放入37 ℃的恒温水浴锅中振荡酶解,分别于0、20、120 min 时取1 mL 酶解液加入4 mL无水乙醇终止反应,混合液在3 500 r/min 下离心2 min,取2 mL 上清液至25 mL 具塞试管中,加入1.5 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色,沸水浴加热5 min,取出后迅速流水冷却,以蒸馏水定容至25 mL,摇匀,在540 nm 下测量吸光度,根据公式(5)~(7)计算快速消化淀粉(rapid digestiable starch,RDS)、慢速消化淀粉(slowly digestiable starch,SDS)和抗性淀粉(RS)含量。葡萄糖溶液标准曲线方程为y=0.437 3x-0.044 9,R2=0.996 3。
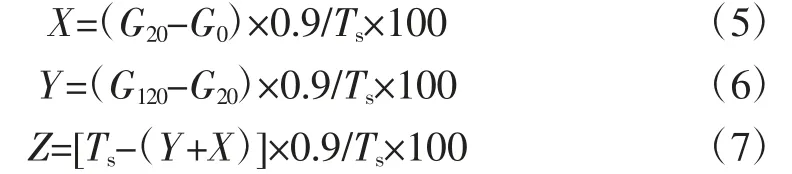
式中:X 为RDS 含量,%;Y 为SDS 含量,%;Z 为RS 含量,%;G0、G20、G120分别为混合液被酶解0、20 min和120 min 后产生的葡萄糖质量,mg;Ts为样品中的总淀粉含量,mg。
1.4 数据统计分析
采用Sigmaplot 12.5 软件作图,试验数据表示为平均值±标准差。数据统计分析采用Statistix 8.1(St Paul,MN) 软件包中Linear Models 程序进行,使用Tukey HSD 程序进行差异显著性(P<0.05)分析。
2 结果与分析
2.1 持水性
当淀粉与水混合加热时,随着温度接近糊化温度,淀粉结晶区的胶束中较弱的氢键被破坏,水分子能更好地侵入淀粉分子内部,与淀粉分子中暴露出的羟基形成氢键。因此,淀粉的持水性主要反映淀粉与水的结合程度以及对水分子的保持能力[6]。
QS 和QRS 的持水性结果见图1。
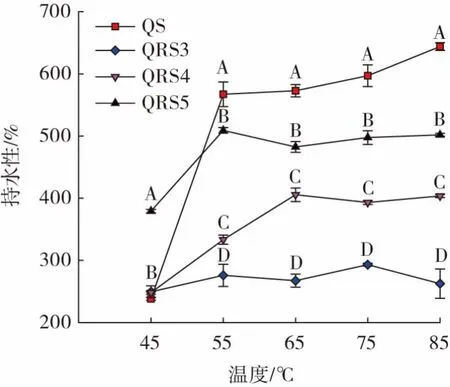
图1 藜麦淀粉与三型、四型、五型藜麦抗性淀粉的持水性Fig.1 Water holding capacities of quinoa starch and types 3,4,and 5 quinoa resistant starch samples
由图1 可知,在45~55 ℃时,QS、QRS4 和QRS5 的持水性均呈现明显的上升趋势,其中QS 的上升幅度最大,这是由于55 ℃接近QS 的糊化温度,因此QS 会大量吸水。随着温度继续升高,在55~85 ℃,QS 相比于其他3 种抗性淀粉,表现出最强的持水性,这是由于此时已超过QS 的糊化温度,更多的水分子进入淀粉晶体内部,淀粉分子中的氢键与水分子发生了高度水化作用,从而提高了QS 的持水性[13]。QRS5 的持水性仅小于QS,可能是由于淀粉中螺旋结构的非极性区域与脂类物质发生疏水相互作用,使得脂类的疏水部分分布在淀粉螺旋结构的内部,葡萄糖中的羟基分布在螺旋结构表面,使得QRS5 具有较高的持水性,但内部疏水空腔又使QRS5 的持水性低于QS[14]。QRS4 的持水性介于QS 和QRS3 之间,可能是由于引入新的磷酸交联键增强了淀粉分子的结构强度和稳定性,使水分子难以渗透到淀粉分子内部[15],但这种阻碍水分子的作用力低于QRS3。QRS3 在45~85 ℃时持水性最差,这可能是因为在淀粉老化过程中淀粉分子链重新排列形成高度紧密的结构,阻碍了淀粉分子与水形成氢键,导致了较弱的持水性[16]。同时。在此温度区间,QRS3 的持水性始终处于较低水平,也说明淀粉老化后很难再次糊化。
2.2 透明度
淀粉的透明度是淀粉制品的一种外观性质,合适的透明度可以改善食品的色泽,因此,透明度的高低是评判淀粉是否适合作为食品添加剂的一项重要指标。淀粉的透明度受淀粉吸水膨胀能力、分子结构、淀粉分子间的缔合程度以及淀粉中支链淀粉含量等多种因素的影响,通常,样品的吸光度越低,透光率越高,透明度也越高。
藜麦淀粉与三型、四型、五型藜麦抗性淀粉的透光率结果见表1。

表1 藜麦淀粉与三型、四型、五型藜麦抗性淀粉的透光率和析水率Table 1 Light transmittance and water segregation rates of quinoa starch and types 3,4,and 5 quinoa resistant starch samples
从表1 中可以看出,QRS3 的透光率最高,所以其透明度最好,QS 与QRS4、QRS5 透光率没有显著性差异(P>0.05)。QRS3 的透明度比QS 高,这是由于普鲁兰酶脱支作用破坏了淀粉颗粒表面和晶体区域,从而导致淀粉溶解度增加,当淀粉溶解度越大,淀粉糊溶解越均匀,透明度就越高[17]。由此可以看出,QRS3 适用于透明度较高的饮料产品,而QRS4 和QRS5 可以用于增加搅拌型酸奶的不透明度。
2.3 冻融稳定性
冻融稳定性反映淀粉分子在冷冻和解冻过程中保持原有性质的能力,也是评判淀粉是否适合制作冷冻食品的重要指标。在冻融过程中,淀粉分子会发生脱水收缩,游离水析出,因此可以用析水率间接表示淀粉的冻融稳定性,析水率越低,淀粉的冻融稳定性越好。
藜麦淀粉与三型、四型、五型藜麦抗性淀粉的析水率结果见表1。
从表1 中可以看出,4 种淀粉的析水率从大到小依次是QRS3、QRS4、QRS5 和QS,因此冻融稳定性最好的是QS,最差的是QRS3。淀粉的析水率与淀粉的持水性有关,一般淀粉的持水性越强,析水率越低,冻融稳定性越好。本研究中,析水率的结果与图1 中温度高于55 ℃时的持水性结果相一致,与尹乐斌等[18]关于豌豆淀粉和豌豆抗性淀粉的冻融稳定性结果相似。淀粉的冻融稳定性决定了淀粉制品在加工烹饪过程中的性质,冻融稳定性越好,其在食品领域的应用越广泛,因此与QRS 相比,QS 更适合制作冷冻食品。
2.4 溶解度与膨胀度
淀粉的溶解度和膨胀度反映淀粉与水相互作用的强弱,溶解度表示淀粉样品在水中溶解程度的大小,膨胀度则是其糊化过程中吸水特性和持水能力的体现。溶解度和膨胀度可以反映以淀粉为原料的制品(如粉条、粉丝)在蒸煮过程中的糊汤和膨胀情况,对其蒸煮特性尤为重要。
藜麦淀粉与三型、四型、五型藜麦抗性淀粉的溶解度和膨胀度结果见表2。
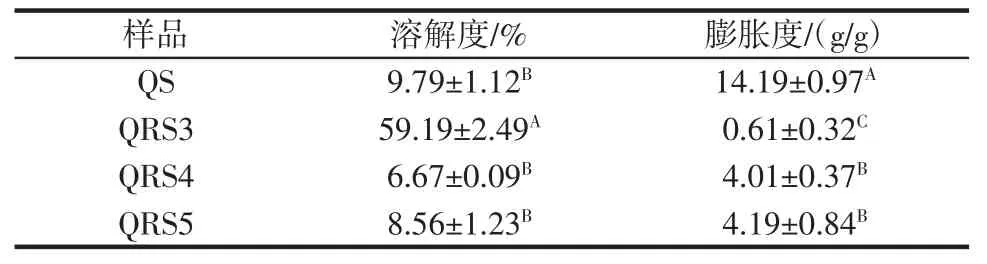
表2 藜麦淀粉与三型、四型、五型藜麦抗性淀粉的溶解度与膨胀度Table 2 Solubility and swelling power of quinoa starch and types 3,4,and 5 quinoa resistant starch samples
由表2 可以看出,QS 膨胀度显著高于其他QRS,表明QS 的分子间键的结合能力最弱,膨胀能力最强。QRS3 的溶解度最高,为59.19%,这是由于QRS3 制备过程中,还存在一些可溶性淀粉,增加了QRS3 的溶解度。QRS3 的膨胀度显著低于QS,是由于其颗粒内部结构较为紧密,难以吸水,导致膨胀度较小[19]。QRS4、QRS5 的溶解度略低于QS,但没有显著性差异(P>0.05)。QRS4 的溶解度稍降低是由于淀粉磷酸化增强了直链淀粉和支链淀粉分子之间的结合,且磷酸基共价键保留了淀粉颗粒的完整性,因此,淀粉颗粒紧密地结合在一起抵抗溶胀[20]。QRS5 的溶解度与膨胀度均降低,说明脂肪酸的存在能抑制淀粉颗粒的溶解和膨胀,减小直链淀粉的溶出。由于直链淀粉的螺旋结构内部非极性区域与脂肪酸尾部的碳链之间形成单螺旋包接结构,从而形成更大的疏水空间,对水分子的排斥作用增强[21],因此,QRS5 的溶解度与膨胀度降低。
2.5 糊化特性
图2 为4 种淀粉的糊化曲线。

图2 藜麦淀粉与三型、四型、五型藜麦抗性淀粉的糊化曲线Fig.2 Pasting curves of quinoa starch and types 3,4,and 5 quinoa resistant starch samples
由图2 可知,QS 初始黏度变化不大,原因是低温促进了淀粉颗粒的膨胀,随着温度升高,淀粉颗粒破裂,黏度迅速达到最大。在随后的冷却过程中,直链淀粉老化并重新排序,增加了最终黏度[22]。QRS3、QRS4和QRS5 的糊化曲线几乎呈直线,说明在50~95 ℃下,3 种RS 制备方法(糊化酶解回生、磷酸盐交联修饰、淀粉-脂质复合物形成)均抑制了淀粉的膨胀,不产生糊化黏度。结果表明,RS 对淀粉酶具有抗性,并且在常规食品加工过程中不会引起黏度变化。
2.6 流变学特性
淀粉糊的流变学特性对预测淀粉类食品加工过程中的结构特性具有重要意义。图3 为QS 的流变学特性曲线。

图3 藜麦淀粉的流变特性曲线Fig.3 Rheological properties of quinoa starch
从图3 可以看出,随着剪切速率的升高,藜麦淀粉糊的表观黏度逐渐下降,说明藜麦淀粉糊为假塑性流体,在剪切过程中,凝胶结构被破坏,淀粉分子内部的作用力变弱,导致了黏度的下降。
动态黏弹性参数中,储能模量(G′)是物质在每个变形的循坏中储存或可以恢复的能量,表示物质的弹性,损耗模量(G″)是每个变形周期消耗或损失的能量,表示物质的黏性[23]。从图3 可以看出,在整个角频率扫描范围中,QS 的G′数值始终大于G″,说明藜麦淀粉糊呈现出弱凝胶特性,且弹性性质占主导地位[24],这与Ahmed 等[25]的研究结果相一致。
2.7 碘吸收特性
直链淀粉与碘反应会形成有色复合物,该复合物在紫外吸收波长下的吸收峰范围、吸光度的大小以及最大吸收波长与淀粉的分子链长关系密切,因此碘吸收曲线常用来表征淀粉中直链淀粉或支链淀粉的分子链长和平均聚合度[26]。直链淀粉和支链淀粉的碘最大吸收峰分别为600~640 nm 和520~560 nm[26]。
图4 为藜麦淀粉与三型、四型、五型藜麦抗性淀粉的碘吸收曲线。
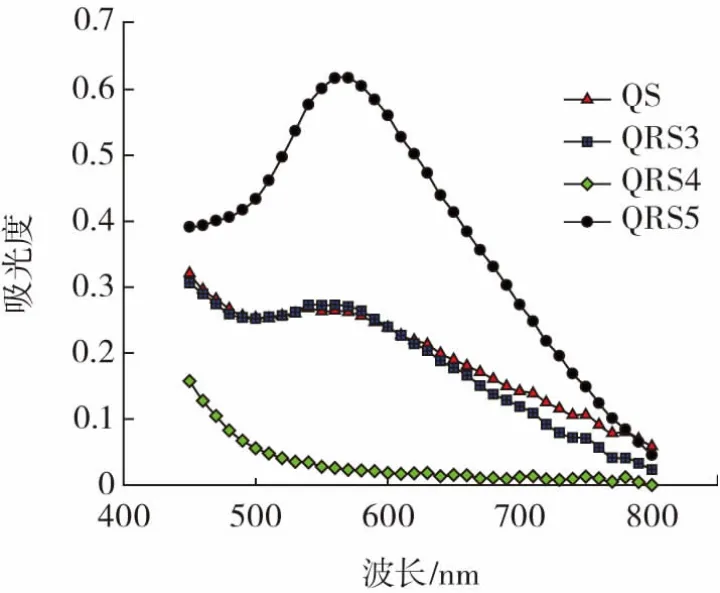
图4 藜麦淀粉与三型、四型、五型藜麦抗性淀粉的碘吸收曲线Fig.4 Iodine absorption curves of quinoa starch and types 3,4,and 5 quinoa resistant starch samples
从图4 可以看出,QS、QRS3 和QRS5 的碘最大吸收峰分别在552、556 nm 和566 nm,说明3 种淀粉均向支链淀粉吸收波长方向偏移,这是由于QS、QRS3 和QRS5 中直链淀粉含量低、聚合度较小,支链淀粉含量高、聚合度较大导致,支链淀粉与碘反应呈紫红色,因此,3 种淀粉的碘最大吸收峰在支链淀粉吸收范围内。QRS4 在450~800 nm 无明显吸收峰,可能是由于QRS4 的淀粉聚合度极小,导致显色不明显。QS 和QRS3 的碘吸收曲线分布情况相似,而QRS5 的碘吸收峰最窄,说明QRS5 分子量分布更集中[27]。QRS5 的碘吸收曲线在相同波长下的吸光度最大,说明QRS5 中直链淀粉含量高于QS,也高于其他类型的QRS[28]。
2.8 体外消化性
根据淀粉在人体内的消化特点,将淀粉按照酶解时间长短分为RDS、SDS 和RS。RDS 能在人体20 min内被消化并引起血糖升高。SDS 在人体20~120 min 内被缓慢消化并持续释放能量,缓慢提升血糖。RS 不能在人体内被消化但能在小肠内被微生物发酵,可以控制餐后血糖水平的提升,因此,RS 含量代表抗消化能力。
4 种淀粉的RDS、SDS 和RS 含量如表3 所示。
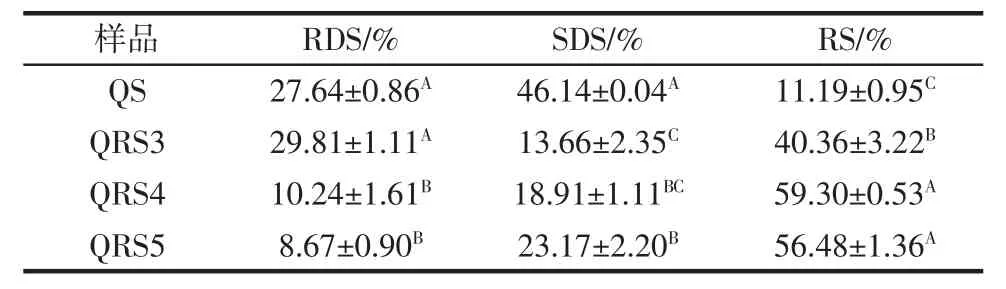
表3 藜麦淀粉与三型、四型、五型藜麦抗性淀粉的体外消化性Table 3 In vitro digestibility of quinoa starch and types 3,4,and 5 quinoa resistant starch samples
由表3 可知,将QS 制备成QRS3 后,RDS 含量没有发生显著变化,而SDS 含量下降,RS 含量上升,说明RS 主要由SDS 转变而来;将QS 制备成QRS4 和QRS5 后,RDS 和SDS 含量均有所下降,而RS 含量明显上升,说明磷酸化交联修饰和淀粉-脂质复合物形成中,部分RDS 和SDS 转变成了RS;QRS3、QRS4 和QRS5 的RS 含量远高于QS,说明3 种抗性淀粉具有良好的抗消化性。QRS3 中,由于普鲁兰酶的脱支作用产生了较多的直链淀粉,这些直链淀粉之间通过氢键相连,定向排列形成许多双螺旋微晶,该结构难以与消化酶的活性部位结合,因此赋予了QRS3 抗酶解的功能[16];QRS4 的抗消化性是由于引入的磷酸基团具有空间位阻作用,阻碍了酶与淀粉分子结合,使酶难以进入淀粉分子,从而降低了淀粉的酶解程度[29]。QRS5的抗消化性是棕榈酸进入淀粉疏水空腔并通过氢键与淀粉牢固结合,形成了更为致密、稳定的V-型螺旋状淀粉晶型结构,阻碍消化酶与淀粉发生作用,从而提高了RS 含量[30]。综上所述,QRS3、QRS4 和QRS5 均适合于开发抗消化的健康减肥类产品。
3 结论
藜麦是近年来逐渐兴起的一种营养全面的粮食作物,因此,QS 和QRS 在食品领域具有广阔的应用前景。本研究对比分析了QS、QRS3、QRS4 和QRS5 的理化性质,结果表明,与QRS 相比,QS 的持水性好、透明度高、冻融稳定性强,且具有弱凝胶特性,因此,QS 在冷冻食品的制作中具有显著的优势。QRS3 是淀粉糊化后经老化制备得到的抗性淀粉,其溶解度和透明度高,具有稳定的抗酶解特性,但冻融稳定性差,因此,QRS3 在常温食品中可以作为稳定的抗性淀粉来源。QRS4 是磷酸化交联的藜麦抗性淀粉,具有较好的抗酶解性,因此添加其到食品中,在优化食品感官性质的同时,还可以增加食品中益生元含量,提高食品的营养价值。QRS5 中形成了淀粉-脂质复合物,其持水性、冻融稳定性和抗酶解性较好,且直链淀粉含量较高,是冷冻食品中添加抗性淀粉的优质选择。以上研究结果表明,QS 与QRS3、QRS4、QRS5 表现出不同的理化特性,具有不同的应用范围。本研究结果可为QS、QRS 及其相关制品的开发应用提供理论依据。
