线粒体质量控制调控骨质疏松的研究机制进展*
2023-09-14胡艳东王永庆孙鲁宁
胡艳东,王永庆**,孙鲁宁
1南京医科大学第一附属医院,南京 210029;2南京医科大学 药学院,南京 211166
1 骨质疏松中的线粒体质量控制
线粒体与一系列生物过程有关,包括氧化还原平衡、钙稳态、能量产生、代谢和细胞死亡[1]。线粒体质量控制(mitochondrial quality control,MQC)是一种细胞内机制,旨在维持线粒体的结构完整性、功能稳定性和适应性,以确保细胞能够有效地执行其生物学功能。MQC 监测和维护线粒体的健康状态,并针对受损或功能异常的线粒体采取相应的修复或清除策略[2],其关键机制包括线粒体生物发生、线粒体的融合/分裂以及线粒体自噬。线粒体生物发生补充线粒体成分;线粒体融合/裂变通过调控线粒体网络,使线粒体正常运作并且适应细胞生长、分裂和损伤反应;线粒体自噬选择性地去除受损和功能失调的线粒体,维持线粒体群体的整体健康和功能[3]。
骨质疏松症(osteoporosis,OP)是一种全身性和代谢性骨病,随着人口老龄化的加剧,OP 已成为严重的公共卫生问题[4]。骨形成过程需要破骨细胞和成骨细胞的协同作用:破骨细胞是源自骨髓/单核细胞谱系的终末分化的多核细胞,主要负责骨吸收;成骨细胞来自骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),可矿化形成新的骨质。研究表明,OP 发展过程中常常伴有代谢过程的变化和线粒体功能障碍[5,6],原发性线粒体疾病中也普遍存在导致骨骼健康不良的危险因素[7]。线粒体质量控制失调会加剧线粒体功能障碍,因此,详细阐明线粒体质量控制机制,对于维持骨骼健康、使骨骼免受线粒体功能障碍的影响十分重要。
2 线粒体生物发生和骨质疏松
2.1 线粒体生物发生
线粒体生物发生是指预先存在的线粒体的生长和分裂,从而产生新的线粒体的过程[8]。过氧化物酶体增殖物激活受体γ 共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)是线粒体生物发生的“主要调节剂”,腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)和沉默信息调节因子(sirtuin,SIRT)通过磷酸化和脱乙酰化介导PGC-1α 的活性,后者激活核呼吸因子-1、核呼吸因子-2(nuclear respiratory factor 1/2,NRF-1/2)、过氧化物酶体增殖物激活受体-α(peroxisome proliferatoractivated receptor-α,PPAR-α)、雌激素相关受体(estrogen-related receptors,ERRs)等转录因子,刺激线粒体生物生成和呼吸,促进线粒体复制和转录、线粒体蛋白的合成以及新的线粒体生物发生[9]。其中,NRF1 和NRF2 促进线粒体转录因子A(mitochondrial transcription factor A,TFAM)的表达,TFAM 激活mtDNA 转录并且参与mtDNA 复制过程,是mtDNA 转录和复制的最终效应因子[10]。
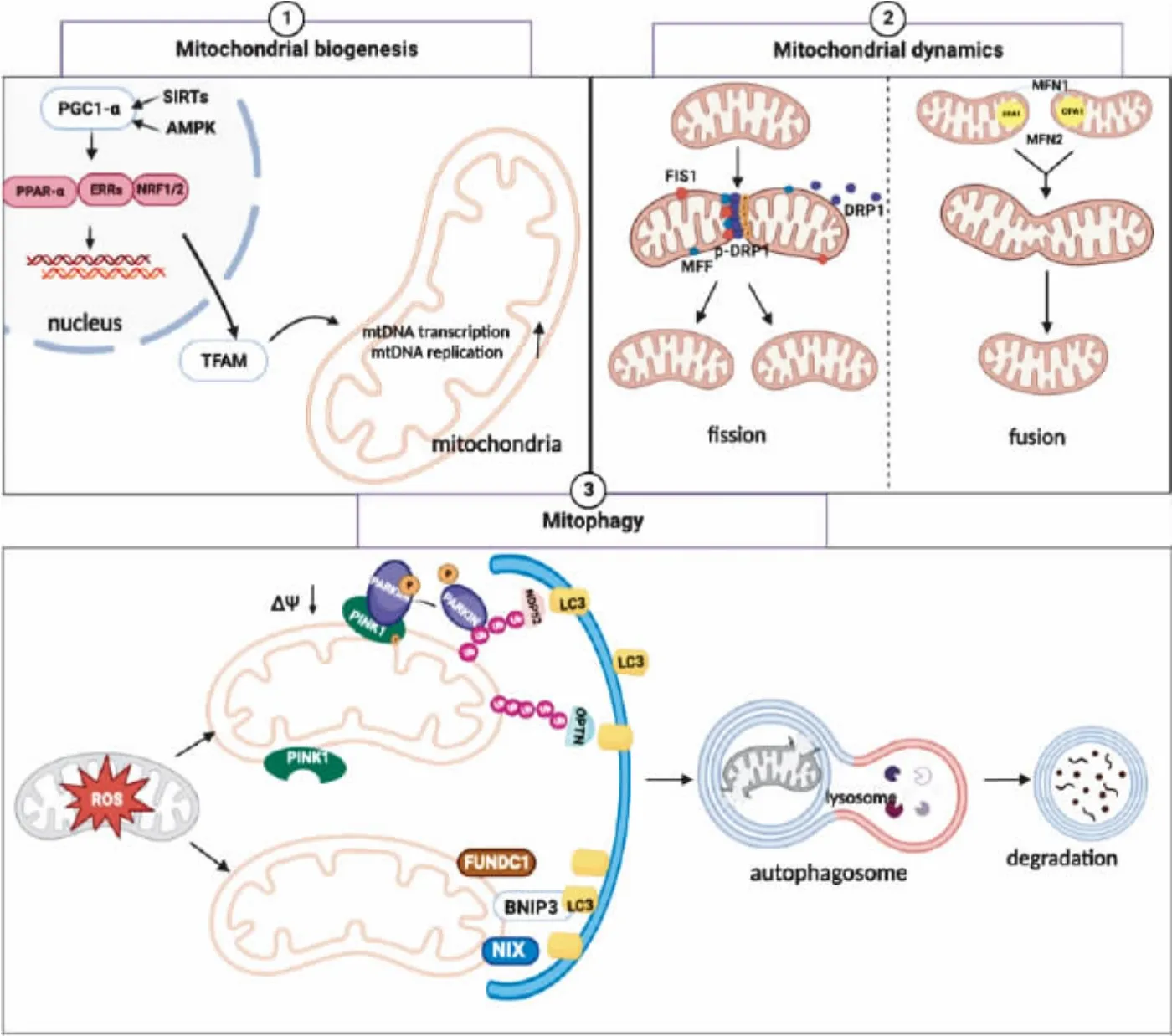
图1 线粒体质量控制作用机制(使用BioRender 绘制)
2.2 线粒体生物发生对成骨细胞的调控
BMSCs 分化为成骨细胞的过程以及成骨细胞的增殖分化中均伴随着线粒体生物发生的上调[11]。研究人员发现,在BMSCs 的成骨分化过程中,雌激素相关受体α(estrogen-related receptor α,ERRα)通过增加线粒体内谷氨酰胺酶的表达增强线粒体功能,在老年小鼠的BMSCs 中,PGC-1α 和ERRα的表达减少,但ERRα 的补偿作用可以挽救BMSCs的成骨能力[12]。MA J 等[13]的研究发现,白藜芦醇通过上调沉默信息调节因子1(silent information regulator 1,SIRT1)表达激活PGC-1α,线粒体生物发生增加,ATP 产生增多,从而促进了小鼠胚胎或骨细胞前体细胞(MC3T3-E1 细胞)的成骨分化。MÜLLER DIH 等[14]发现,转录因子PPAR-δ 参与调节线粒体代谢并增加线粒体呼吸,是成骨细胞分化和矿化所必需的。此外,过表达PGC-1α 能够抑制成骨细胞中由SIRT3 敲低引起的线粒体密度、膜电位和碱性磷酸酶活性降低[15]。TANG X[16]的研究显示,NaB 通过调节Nrf2/GSK-3β 信号通路激活PGC-1α和TFAM,增强线粒体氧化还原稳态、能量代谢以及线粒体抗氧化酶的活性,从而对骨具有保护作用。另外,线粒体DNA 聚合酶γ(DNA polymerase γ,Polg)在线粒体中起着关键作用,负责细胞中线粒体DNA的复制和修复。DOBSON PF 等[17]的研究表明,Polg突变导致成骨细胞线粒体呼吸链蛋白表达减少,引起线粒体功能障碍,加速骨质流失和骨形成的减少。综上所述,线粒体生物发生对于骨的形成具有重要意义。
2.3 线粒体生物发生对破骨细胞的调控
与PGC-1α 类似,PGC-1β 是线粒体生物形成的强激活剂,可调节能量代谢的多个方面。在破骨细胞形成过程中,SIRT3 通过调节AMPK-PGC-1β和ERRα 的表达,增强mRNA 和蛋白质水平[18]。ISHII KA 等[19]发现PGC-1β 和铁吸收协同促进线粒体生物合成以激活破骨细胞分化,PGC-1β 缺失则会抑制体外破骨细胞生成。WEI W 等[20]的研究也表明PGC1-β 与PPAR-γ 协同增强线粒体生物发生和破骨细胞功能。然而,ZHANG Y 等[21]认为破骨细胞谱系细胞中PGC-1β 缺失虽然会导致线粒体生物丰度和功能降低、破坏破骨细胞的细胞骨架组织和功能,但并不会影响破骨细胞生成。因此,对于线粒体生物发生对破骨细胞的功能调控仍需更多探索。
3 线粒体动力学和骨质疏松
3.1 线粒体的裂变和融合
线粒体是高度动态的细胞器,具有恒定的运动和形态变化,形成动态连续的网络,该过程被称为线粒体动力学,涉及线粒体融合和裂变以及线粒体分布[22]。线粒体裂变产生较小的细胞器,维持线粒体的数量、细胞极性并帮助消除受损的线粒体;线粒体融合促进线粒体内容物相互交换和连接,以提供足够的能量,减轻氧化损伤,保持膜电位[23]。裂变和融合之间的动态平衡对于维持最佳线粒体功能以及满足细胞特定能量代谢需求至关重要[24]。哺乳动物中,运动蛋白酶和动力蛋白沿着微管网络移动,将线粒体输送到需要ATP 的区域以及与线粒体功能相关的其他方面,如钙稳态[25]。
线粒体裂变主要依赖于细胞质中的动力相关蛋白1(dynamin-related protein 1,DRP1),在应激条件下,细胞质中的DRP1 被线粒体外膜上的线粒体裂变因子(mitochondrial fission factor,MFF)、线粒体裂变蛋白1(mitochondrial fission protein 1,FIS1)等线粒体动力学蛋白募集到裂变部位[26]。DRP1 是三磷酸鸟苷(guanosine triphosphate,GTP)酶,裂变时DRP1 在收缩位点周围聚集,形成环状结构,随后DRP1 以GTP 依赖的方式刺激线粒体膜收缩,促使线粒体内外线粒体膜破裂以及线粒体裂变,进而分离有缺陷的和去极化的线粒体[23]。
线粒体融合过程包括线粒体内外膜的结合。在哺乳动物细胞中协调这一过程的主要蛋白质是由核基因编码的,同属动力蛋白相关的GTP 酶家族,包括线粒体融和蛋白1 和2(mitofusin1/2,MFN1/2)和视神经萎缩蛋白1(optic atrophy 1,OPA1)。MFN1/2 相互连接束缚相邻的线粒体并介导外膜的融合。OPA1 具有N 末端结构域,该结构域内含有用于线粒体导入的线粒体靶向序列(mitochondrial targeting sequence,MTS),以及将MTS 锚定到线粒体内膜的跨膜结构域和卷曲螺旋结构域。因此,OPA1 参与线粒体内膜的融合,并保持线粒体结构和内膜的完整性[27]。
3.2 线粒体动力学对成骨细胞和破骨细胞的调控
BMSC 成骨分化能力减弱是导致骨质疏松发生的主要原因之一[28],研究表明,线粒体动力学在体内和体外干细胞的自我更新和分化中发挥关键作用。线粒体裂变参与维持BMSC 的干性[29]。最新的研究显示,在成骨过程中,线粒体裂变增加,导致小型线粒体增多以及线粒体衍生囊泡(mitochondrialderived vesicles,MDVs)增加,线粒体和MDVs 从成骨细胞中释放到胞外基质中,促进成骨祖细胞的成熟分化和骨形成。敲低OPA1 或者过表达FIS1 会增加线粒体裂变、MDVs 释放,并加速成骨过程,这充分说明了线粒体形态改变在骨形成当中的重要性[30]。体外研究表明,在肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的成骨细胞炎症模型中,DRP1发挥重要作用。线粒体分裂抑制剂1(mitochondrial division inhibitor 1,Mdivi-1)可以显著改善由DRP1上调引起的线粒体形态异常、线粒体功能障碍和成骨细胞损伤[31]。高葡萄糖会改变成骨细胞线粒体动力学,表现为成骨细胞内DRP1 表达减少、融合线粒体增加、碎片化线粒体减少,同时,线粒体生物发生减少,损害成骨细胞的迁移和趋化性[32]。在破骨细胞中,MFN1 和MFN2 的双重缺失导致雌性小鼠体内骨量增加,MFN2 的过表达可逆转破骨细胞生成缺陷,表明线粒体动力学对骨吸收有显著影响[33]。DRP1 在破骨细胞分化过程中通过活化T 细胞核因子1(nuclear factor of activated T cells 1,NFATC1)发挥重要作用,使用DRP1 抑制剂可有效防止体内脂多糖(lipopolysaccharide,LPS)或卵巢切除(ovariectomized,OVX)诱导的过度骨质流失[34]。线粒体的分裂和融合对于成骨细胞和破骨细胞的活性具有非常重要的影响,对线粒体动力学的干预成为了一种潜在的治疗骨质疏松症的策略。
4 线粒体自噬和骨质疏松
4.1 线粒体自噬的形成和分类
线粒体自噬是一种特殊形式的自噬,选择性分解受损线粒体并促进线粒体代谢,专门作用于降解受损或功能失调的线粒体[35]。根据吞噬囊泡与受损线粒体识别机制的不同可大致分为泛素依赖型及受体依赖型线粒体自噬[36]。
泛素依赖型线粒体自噬主要是指PTEN 诱导激酶1(PTEN-induced kinase 1,PINK1)和E3 泛素-蛋白连接酶(E3 ubiquitin-protein ligase,PARKIN)通过线粒体自噬激活参与维持线粒体质量的过程[37]。在正常生理情况下,PINKI 和PARKIN 通过MTS 持续靶向正常的线粒体。当线粒体损伤时,线粒体膜电位去极化阻止PINK1 进入内膜,随后PINK1 在线粒体外膜大量聚集磷酸化泛素,促进PARKIN 由胞浆向线粒体膜转位,激活线粒体自噬[38]。微管相关蛋白1 轻链 3(microtubule-associated protein light chain-3,LC3)是吞噬囊泡上的一种表面分子,它与泛素化蛋白如视神经病变诱导反应蛋白(optineurin,OPTN)、核点蛋白52(nuclear dot protein 52,NDP52)等与相互作用,诱导自噬体的形成,降解受损的线粒体[39]。
受体依赖型自噬由线粒体外膜上的含长链反向重复序列(long inverted repea,LIR)的线粒体自噬相关受体介导。缺氧状态下,BCL2 相互作用蛋白3(BCL2 interacting protein 3,BNIP3)和NIP3 样蛋白(NIP3-like protein X,NIX)能够与BCL-2 家族蛋白结合,通过抑制雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)或调节活性氧(reactive oxygen species,ROS)的产生来激活线粒体自噬。BNIP3 的N 端具有LIR 序列,可识别LC3 并与之直接结合,从而被吞噬囊泡识别并诱导线粒体自噬的发生。除BNIP3/NIX 途径外,含FUN14 结构域蛋白1(FUN14 domain-containing protein 1,FUNDC1)同样定位于线粒体外膜,通过其LIR 结构域与LC3 直接相互作用,直接诱导线粒体自噬[40]。
4.2 线粒体自噬对成骨细胞的调控
成骨细胞分化和成熟过程受到线粒体自噬的调节。线粒体自噬被抑制时会加剧糖尿病小鼠成骨能力的丧失和骨质流失[41],LEE SY 等[42]发现PINK1在骨质疏松症患者中下调,PINK1 缺失加剧了OVX诱导的小鼠骨质减少。同时,体外实验表明,PINK1能够调节成骨细胞分化,Pink1-/-成骨细胞线粒体质量减少、异常线粒体增加、受损线粒体的选择性清除减少,表明PINK1 在成骨细胞的线粒体生物发生和线粒体自噬中发挥作用。LIU X 等[43]表明线粒体自噬可清除受损的线粒体,防止成骨细胞凋亡。线粒体自噬参与骨质疏松的调节还与磷酸肌醇3-激酶(phosphoinositide 3-kinase,PI3K)和蛋白激酶B(protein kinase B,AKT)等信号有关。YANG X 等[44]的实验证明,白藜芦醇通过介导SIRT1 和PI3K/AKT/mTOR 信号通路增强线粒体自噬来预防地塞米松治疗大鼠的成骨细胞功能障碍和骨质疏松症。ZHAO B 等[45]发现益母草通过抑制PI3K/AKT/mTOR途径激活线粒体自噬防止BMSCs 中ROS 的产生,从而保护BMSCs 的增殖和分化免受氧化应激。
4.3 线粒体自噬对破骨细胞的调控
最新的研究表明,线粒体自噬在破骨细胞的分化中起着至关重要的作用。SIRT3 通过介导PINK1的去乙酰化作用,调节破骨细胞的线粒体自噬,从而促进破骨细胞的分化。使用SIRT3 抑制剂LC-0296 可以部分抑制破骨细胞功能,减弱由雌激素缺乏或衰老引起的骨吸收增加和骨量减少,从而预防骨质疏松的发生[46]。通常情况下,破骨细胞是终末分化的细胞,其寿命仅2 周左右,在此之后会发生凋亡。然而,最新的研究发现,成熟的破骨细胞还会通过分裂形成较小的子细胞,研究人员将其称为“osteomorphs”,它们能够与邻近的破骨细胞融合或自身融合,实现破骨细胞的循环[47]。在此基础上的研究发现,线粒体自噬能够促进破骨细胞分裂,增加“osteomorphs”的形成,抑制线粒体自噬会诱导破骨细胞凋亡[48]。线粒体自噬在破骨细胞的形成和存活中发挥重要作用,其与骨稳态之间的机制仍然需要进一步展开更深入的研究。
5 总结与展望
线粒体质量控制系统在维护线粒体完整性和骨稳态方面发挥着关键作用。线粒体氧化应激、线粒体裂变融合异常、线粒体生物发生减少以及线粒体过度自噬等因素都与骨质疏松的发生有关。调节线粒体质量控制相关因子的表达,可以提高成骨细胞的成骨能力和降低破骨细胞的破骨能力,从而达到治疗骨质疏松的目的。
目前,骨质疏松中线粒体质量控制的研究处于早期阶段,仍存在以下问题:①不同细胞类型中线粒体质量控制能力的变化、线粒体质量控制作用时间、程度以及周围微环境可能会对组织损伤和修复产生不同甚至相反的影响。因此,有必要确定成骨细胞和破骨细胞线粒体质量控制能力的改变对骨质疏松的影响。②线粒体质量控制各机制之间相互作用串扰,任何一个机制的变化都将影响其他机制,进而影响整个系统。③目前研究多集中于动物和细胞层面,临床应用仍然需要大量的实验研究证据,进一步开展相关机制及转化医学等方面的研究,面临着巨大的挑战。全面理解线粒体质量控制的机制,维持线粒体数量及质量的内稳态对于预防和治疗骨质疏松具有重要的临床意义,也为相关药物的研究和开发提供了新的方向。
