胡萝卜 4CL基因家族的鉴定及分析
2023-09-14张新业李文静闫训友王聪艳周志国
张新业,李文静,闫训友,郑 京,朱 姝,王聪艳,周志国
(1.廊坊师范学院 生命科学学院,河北廊坊 065000;2.河北省动物多样性重点实验室,河北廊坊 065000;3.廊坊市细胞工程与应用研究重点实验室,河北廊坊 065000)
木质素是构成植物细胞壁的重要大分子,能够起到机械支撑、保证水分运输的作用,并能协助植物抵御病虫害[1]。木质素作为非糖类膳食纤维,广泛分布于谷物、水果和蔬菜中,具有多种生理调节功能[2]。但木质素含量过高会导致肉质根类蔬菜“糠心”,并严重影响其食用和营养价值[3-4]。因此,木质素含量已成为肉根类蔬菜重要改良方向。
苯丙烷代谢是植物木质素单体及类黄酮合成的共同途径。4-香豆酰CoA连接酶(4-coumaroyl-CoA ligase,4CL)位于苯丙烷代谢末端,能够催化对香豆酸、咖啡酸、阿魏酸、芥子酸生成相应的辅酶A酯,是木质素和类黄酮合成的关键酶之一[5]。4CL氨基酸序列中存在2个保守的多肽序列-BoxⅠ(SSGTTGLPKGV)和BoxⅡ(GEICIRG),前者为AMP结合结构域,后者在催化反应过程中的作用未知[6]。植物中的4CL多以基因家族的形式存在,不同物种间4CL基因数目差异较大,根据参与物质合成途径的不同,可将其分为ClassⅠ和ClassⅡ两类,前者参与木质素单体合成,后者主要参与类黄酮的生物合成[7]。4CL基因表达水平的变化能够调节苯丙烷代谢及植物对逆境胁迫的响应。在拟南芥(Arabidopsisthaliana)中,成员At4CL1对4CL酶活的贡献较大,其功能缺失后导致木质素含量降低,而At4CL3的突变会减少类黄酮的积累[8]。柑橘(Citrusclementina)4CL1的表达水平与类黄酮含量呈显著正相关[9]。棉花(Gossypiumhirsutum)中Gh4CL7基因沉默后,木质素含量降低20%,在拟南芥中过表达Gh4CL7后,木质素含量提高10%,且Gh4CL7表达量的变化与植物抗旱性正相关[5]。禾谷镰刀菌(Fusariumgraminearum)侵染后会诱导小麦(Triticumaestivum)4CL1的表达,而棉花4CL的表达则能够响应链格孢菌(Alternariaalternata)诱导[10-11]。杨树(Populusdeltoides×Populuseuramericana)木质部导管中4CL的表达被抑制后,可引起木质素含量降低,但提高了其对干旱胁迫的敏感性[12]。Wen等[13]研究表明,轻度荫蔽胁迫能够诱导大豆(Glycinemax)4CL基因的表达,并提高4CL的酶活性。Xiong等[14]利用VIGS技术沉默棉花Gh4CL30基因后,引起类黄酮及木质素含量降低,而咖啡酸和阿魏酸等物质含量升高,并增强了棉花的黄萎病抗性。
胡萝卜(Daucuscarota)属伞形科2a生植物,其营养丰富,是一种广泛种植的根用蔬菜[15]。肉质根作为胡萝卜可食用部位,木质素含量过高会降低其口感及品质[16]。胡萝卜基因组测序的完成[17],为在全基因组水平上鉴定和挖掘木质素代谢相关基因奠定了基础。到目前为止,胡萝卜4CL(Dc4CL)基因家族缺乏研究。本研究拟从胡萝卜基因组中鉴定4CL基因,分析其理化性质、基因结构、蛋白保守结构域和进化关系等,并利用荧光定量PCR技术对其进行组织表达特性及胁迫响应分析,以期为阐明4CL在胡萝卜木质素生物合成中的作用提供参考。
1 材料与方法
1.1 试验材料
选用胡萝卜品种‘黑田五寸’为试验材料。于2021年8月7日,将‘黑田五寸’种子播种于廊坊师范学院校内试验基地(河北廊坊,39°31′N,116°41′E),生长约100 d后,采集胡萝卜叶片及肉质根,用于分析Dc4CL基因的组织表达模式。将‘黑田五寸’种子催芽后播种于含有培养基质(体积比为1∶3的蛭石和营养土)的塑料花盆内,置于廊坊师范学院人工气候室,培养条件为:光照时长14 h/d,光照强度300 μmol/(m2·s),昼/夜温度25/17 ℃。播种后50 d进行低温胁迫和盐胁迫处理。将胡萝卜幼苗转移至4 ℃培养箱中培养(其他条件同前),进行4 ℃低温胁迫,以正常温度培养作为对照。向花盆内浇灌600 mL 200 mmol/L NaCl溶液,进行盐胁迫处理,以蒸馏水处理作为对照。胁迫处理12 h后采集胡萝卜叶片,用于检测Dc4CL基因胁迫处理后的表达情况。试验均设3次重复。
1.2 Dc4CL基因的鉴定
研究中用到的胡萝卜基因组、CDS、蛋白质、GFF3等数据文件均下载自EnsemblPlants网站(http://plants.ensembl.org/index.html)。利用HMMER软件,根据Pfam数据库(http://pfam.xfam.org/)中AMP结合结构域(PF00501)的隐马尔可夫模型文件在胡萝卜蛋白数据库中进行筛选,初步获得Dc4CL基因。在Excel中剔除冗余序列,利用Pfam数据库和NCBI数据库中的 CD-Search工具对非冗余序列进行结构域分析,最终得到Dc4CL基因,根据其在染色体上的排列顺序进行命名和编号。
1.3 Dc4CL的生物信息学分析
利用在线工具ProtParam(https://web.expasy.org/protparam/)分析基因编码蛋白的残基数(aa)、分子质量和等电点;从EnsemblPlants网站获取Dc4CL基因位置及所在染色体长度,利用TBtools绘制染色体定位图[18];利用在线工具CELLO v.2.5(http://cello.life.nctu.edu.tw/)进行亚细胞定位预测[19];利用SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP- 4.1/)进行信号肽预测[20];利用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜区预测。
1.4 Dc4CL进化关系及结构分析
自EnsemblPlants网站下载水稻(Oryzasativa)、拟南芥、二穗短柄草(Brachypodiumdistachyon)、高粱(Sorghumbicolor)、大白菜(Brassicarapa)的4CL蛋白序列,利用CLUSTALW进行多序列比对,并通过MEGA6基于邻接法(Neighbor-joining)构建多物种系统进化树,自展值(Bootstrap)设为1 000,分析Dc4CL的系统进化关系。
将Dc4CL蛋白序列提交到MEME网站(https://meme-suite.org/meme/tools/meme),进行保守基序motif分析,并在Pfam数据库中对检测到的motif进行功能注释。
从基因组注释GFF3文件中提取Dc4CL的结构信息,利用在线软件Gene Structure Display Server(GSDS2.0)(http://gsds.gao-lab.org/) 绘制基因结构图[21]。
1.5 Dc4CL家族成员的表达分析
利用植物RNA提取试剂盒(天根公司,北京)分别提取胡萝卜叶片、肉质根及胁迫处理、对照材料的总RNA,电泳检测RNA质量,利用超微量分光光度计测定RNA浓度及纯度。利用GoScriptTMReverse Transcription System(Promega,USA)将各材料的总RNA反转录为 cDNA,适当稀释后,-20 ℃保存,备用。
利用NCBI数据库在线工具Primer-BLAST设计Dc4CL家族成员的定量引物,以胡萝卜DcActin基因[22]作为内参(表1),利用荧光定量PCR技术分析Dc4CL家族成员Dc4CL3、Dc4CL8、Dc4CL12的组织表达模式及胁迫响应情况。反应体系:2×Sybr Green qPCR Mix 10 μL,cDNA 1 μL,正、反向引物(10 μmol/L)各0.5 μL,ddH2O 8 μL。反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 20 s,72 ℃ 25 s,循环40次;55.0~95.0 ℃制作熔解曲线。利用2-ΔΔCt法计算基因相对表达量。

表1 引物信息
2 结果与分析
2.1 胡萝卜 4CL基因的鉴定及理化性质分析
在胡萝卜基因组中共鉴定到12个4CL基因,均匀分布于除9号染色体外的其余8条染色体上(图1),分别命名为Dc4CL1~Dc4CL12。Dc4CL基因ORF长度介于1 350~3 363 bp,编码蛋白质长度介于449~1 120 aa,Dc4CL蛋白分子质量和等电点分别为48.92~123.73 ku和 5.34~8.82。亚细胞定位预测结果表明,Dc4CL在细胞内的分布部位多样,细胞质膜、细胞质及细胞器(线粒体、叶绿体)均有定位。信号肽及跨膜区分析结果表明,Dc4CL蛋白均不含信号肽,Dc4CL3、 Dc4CL4、Dc4CL5中均存在2个跨膜区,分别位于100 aa和200~300 aa处,而在Dc4CL2和Dc4CL10中只存在1个跨膜区,位于100 aa处,其余的 Dc4CL成员则不含有跨膜区(表2,图2)。
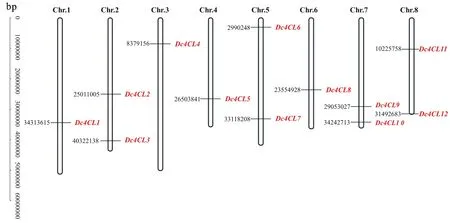
图1 Dc4CL基因染色体定位
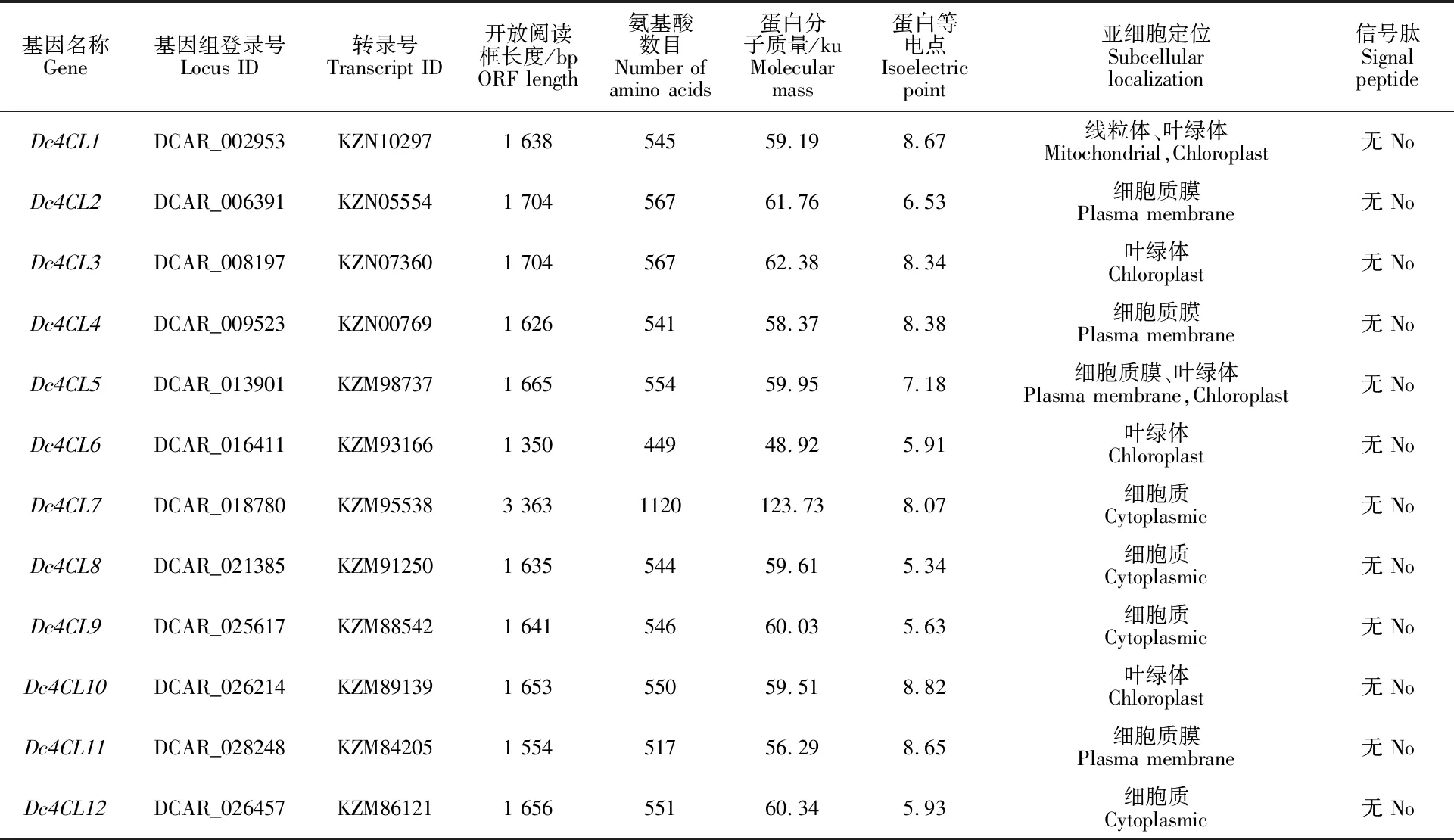
表2 胡萝卜 4CL基因基本信息
2.2 Dc4CL系统进化、基因结构及保守基序 分析
为了研究Dc4CL的系统进化关系,利用MEGA6软件,以来自胡萝卜、水稻、拟南芥、二穗短柄草、高粱、大白菜的4CL蛋白序列构建多物种系统进化树(图3)。该进化树中含有12个Dc4CL、5个Os4CL、3个At4CL、5个Bd4CL、5个Sb4CL和15个Br4CL。45个4CL蛋白可分为两个个类群:GroupⅠ、GroupⅡ。GroupⅠ包含9个Dc4CL成员(Dc4CL1、Dc4CL2、Dc4CL3、Dc4CL4、Dc4CL5、Dc4CL6、Dc4CL7、Dc4CL10、Dc4CL11)及8个Br4CL成员;GroupⅡ包含3个Dc4CL成员(Dc4CL8、Dc4CL9、Dc4CL12)及全部的Os4CL、At4CL、Bd4CL、Sb4CL及7个Br4CL蛋白。GroupⅠ中只包含胡萝卜及大白菜4CL蛋白成员,而GroupⅡ中4CL蛋白的物种来源丰富,既有单子叶植物,又有双子叶植物,但Dc4CL成员较少。
为了进一步阐明Dc4CL蛋白的保守基序及基因结构,分别利用MEME及GSDS鉴定Dc4CL中的保守基序,并绘制基因结构图(图4)。结果表明,Dc4CL蛋白中存在10个motif,分别为motif1~motif10。除Dc4CL6、Dc4CL11中含有8个motif外,其余成员均含有10个motif。Motif5中包含4CL蛋白保守序列BoxⅠ(SSGTTGLPKGV),motif2中包含保守序列BoxⅡ(GEICIRG),但不同成员在这两处的序列已发生变异。Motif1和3中分别包含催化活性位点-Lys-438、Gln-443、Lys-523,其中,Lys-438、Gln-443参与硫酯合成反应,而Lys-523参与半腺苷化反应[9,23]。其余鉴定到的motif则被注释为能够参与AMP结合过程;不同的Dc4CL基因结构差异明显,均含有内含子,外显子数目为4~11个,其中Dc4CL2外显子数目最少(4个),Dc4CL7外显子数目最多(11个)。
2.3 Dc4CL家族成员的表达分析
利用荧光定量PCR技术分析Dc4CL3、Dc4CL8、Dc4CL12的组织表达模式及其对盐胁迫和低温胁迫的响应情况。结果表明,Dc4CL3、Dc4CL12在胡萝卜叶片及肉质根中均有表达,且无显著差异,Dc4CL8则主要在叶片中表达(图5-A~5-C);200 mmol/L NaCl溶液处理12 h后,Dc4CL3、Dc4CL12表达量下降不明显,而Dc4CL8表达量显著下调,约为对照的31%;4 ℃处理12 h后,Dc4CL8表达量下降不显著,而Dc4CL3、Dc4CL12表达量下调,分别达到显著和极显著水平,约为对照的42%和23%(图5-D~ 5-F)。
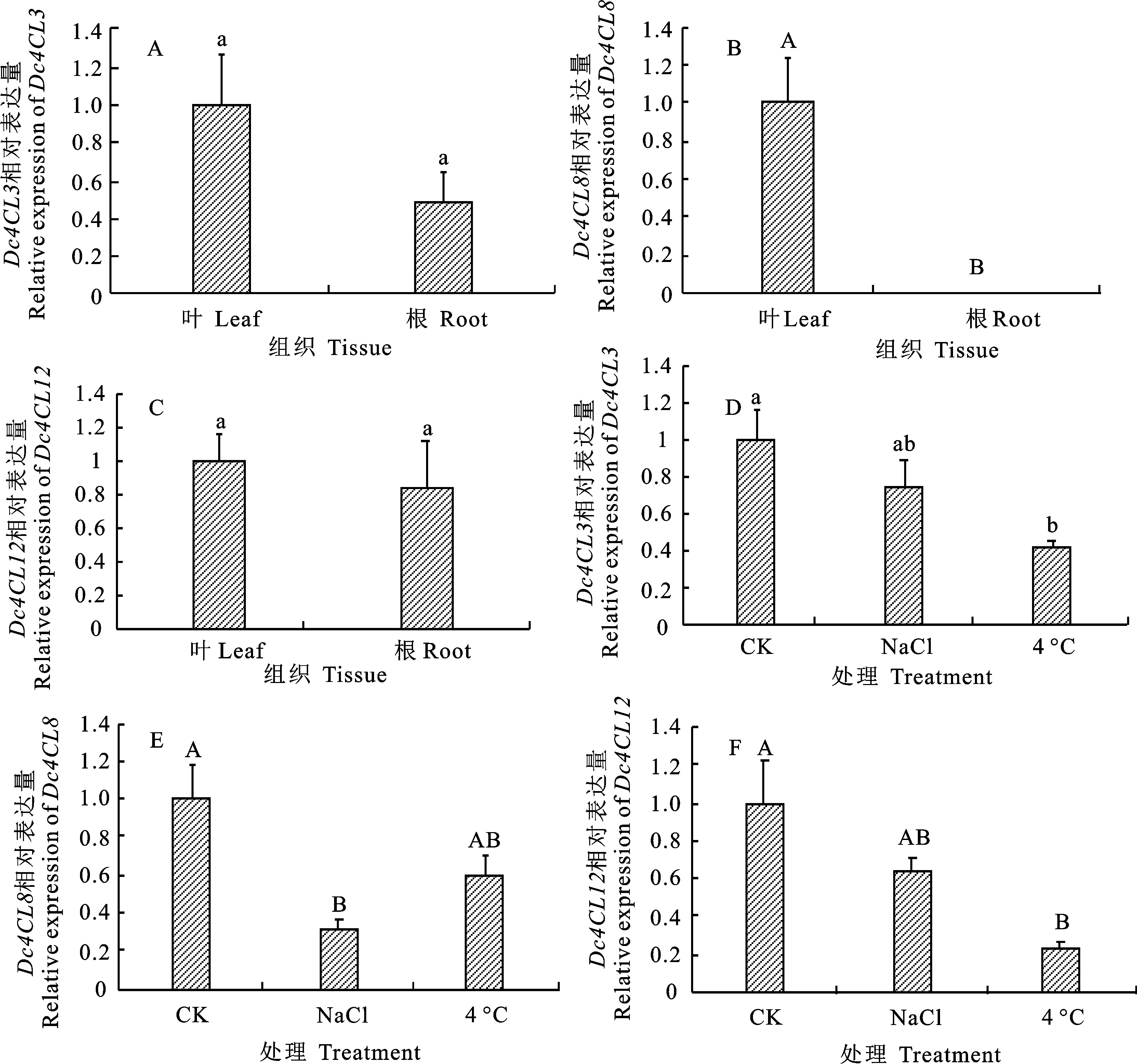
A~C. Dc4CL3、 Dc4CL8、 Dc4CL12组织表达模式分析;D~F. Dc4CL3、 Dc4CL8、 Dc4CL12胁迫响应分析;不同的大写字母表示差异极显著(P<0.01);不同的小写字母分别表示差异显著(P<0.05)
3 讨 论
木质素为植物生长发育所必需,并参与构成膳食纤维,调理人体健康状况,但其含量增加后,会导致细胞壁增厚,组织木质化程度增高,进而影响蔬菜作物的口感,并降低食用品质[24-25]。木质素的生物合成过程复杂,多种酶参与其中。4CL位于苯丙烷代谢的分支点,是将苯丙烷代谢引入木质素单体合成途径的关键酶,在植物木质素合成过程中具有重要作用[26]。
4CL基因家族已在毛果杨(Populustrichocarpa)[27]、水稻[28]、拟南芥[8]、柑橘[9]、水曲柳(Fraxinusmandschurica)[29]、棉花[5]及毛竹(Phyllostachysedulis)[7]等物种内被鉴定,成员数目为3~34个。本研究从胡萝卜基因组中共鉴定到12个Dc4CL基因,表明不同来源的4CL基因数目差异较大,这可能与不同物种在进化过程中经历的染色体加倍事件有关[7]。蛋白亚细胞定位情况是研究其生物学功能的基础。经预测,Dc4CL蛋白在细胞内的存在范围广泛,可分布于细胞质膜、细胞质及部分细胞器(叶绿体、线粒体)中,棉花4CL蛋白的分布范围亦很广泛[5],而柑橘4CL蛋白、毛竹4CL蛋白则仅分别定位于细胞质和过氧化物酶体中[7,9],这可能与4CL蛋白发挥功能的场所不同有关。在后续工作中,笔者还将通过试验手段对Dc4CL的亚细胞定位结果进行确认。蛋白质中跨膜区的存在往往表明该蛋白为膜蛋白,且在细胞内外信号传递过程中可能发挥一定的作用。跨膜区预测结果显示,Dc4CL3、Dc4CL4、Dc4CL5中均存在2个跨膜区,与苎麻Bn4CL3中跨膜区的数目及位置均一致[30]。序列分析表明,所有的Dc4CL蛋白均包含保守序列BoxⅠ(SSGTTGLPKGV)、BoxⅡ(GEICIRG)及3个保守的催化残基(Lys-438、Gln-443、Lys-523),并且不同的成员在BoxⅠ、BoxⅡ处的序列有所变化,这种现象在毛竹、钝鳞紫背苔(Plagiochasmaappendiculatum)及苎麻中均有出现,但其对Dc4CL的催化作用是否有影响还需通过试验进行分析[7,30-31]。前人研究通常将4CL分为ClassⅠ和ClassⅡ两个类群,二者在木质素及类黄酮合成过程中发挥的作用不同且有重叠[26,32]。本试验利用Dc4CL与其他物种的共45个4CL蛋白构建系统进化树,所有蛋白亦被分为两个类群,类群Ⅰ中含有9个Dc4CL成员,类群Ⅱ中含有3个Dc4CL成员。不过,另有研究表明4CL蛋白类群的划分可能会受到参与建树物种多寡的影响[8]。此外,Dc4CL的生物学功能未知,还需通过试验进行深入研究。
通过分析基因的表达模式,对研究其生物学功能具有重要意义[33]。4CL基因的物种来源不同,其组织表达模式亦有所不同。本研究表明,Dc4CL3、Dc4CL12在胡萝卜叶片及肉质根中均有表达,而Dc4CL8则主要在叶片中表达,推测Dc4CL8发挥功能的主要部位可能是叶片。水稻中5个4CL基因的表达在不同发育阶段有差异,但组织特异性不明显[28]。在水曲柳中鉴定到的12个4CL基因其表达具有明显的组织特异性[29]。毛竹的15个4CL基因中,有7个成员在各组织中均能检测到,为组成型表达,另外8个成员在不同组织间的表达量差异较大,具有一定的特异性[7]。前人研究表明,植物4CL基因能够响应逆境胁迫[6]。Sun等[5]研究了棉花4CL基因家族在冷、热、干旱和盐4种胁迫条件下的转录情况,发现有26个Gh4CL基因可受到一种或多种胁迫处理的诱导。桑树(Morusalba)4个4CL基因(Ma4CL1~Ma4CL4)的表达可受到UV诱导,但在NaCl胁迫后其根中Ma4CL4则下调表达[32]。低温处理可使黄瓜(Cucumissativus)4CL基因(CsaV3_7G031620、CsaV3_7G031610)表达升高[34]。盐胁迫处理6 h后,毛白杨(Populuspruinosa)4CL2基因表达升高,而在毛果杨中,该基因表达显著降低[35]。同一材料的不同4CL家族成员在应对胁迫条件时的响应可能存在差异。如对橙子(Citrussinensis)进行缺硼处理后,其Cs4CL1、Cs4CL2、Cs4CL3基因的表达变化情况各不相同[36]。另外,即使是同一植株的不同部位对同一胁迫条件的反应亦可能不同。如在接种大丽轮枝菌12 h后,棉花感病品种根中Gh4CL30基因的表达量有轻微升高,而在茎中该基因的表达量降低[14]。本研究对胡萝卜幼苗进行了盐胁迫和4 ℃胁迫处理,两种处理均可使Dc4CL3、Dc4CL8、Dc4CL12的表达量降低。本研究在全基因组水平上对胡萝卜4CL基因进行了鉴定,并对其进行了生物信息学分析及表达分析,对胡萝卜木质素含量的分子调控及遗传改良具有参考价值。
