棉花GhWLIM5在棉纤维发育中的功能分析
2023-09-13张世鹏刘文丽程昌豪李学宝李扬
张世鹏,刘文丽,程昌豪,李学宝,李扬
(华中师范大学 生命科学学院/遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
棉花为锦葵科棉属植物,是世界范围内重要的经济作物之一,可为纺织工业提供天然原料。目前,全球种植最为广泛的是四倍体的陆地棉(Gossypium hirsutum),其纤维产量占总棉花产量的90%,具有重要的经济价值[1]。棉花纤维是棉花胚珠表皮细胞分化而来的单细胞毛状突起,其发育过程是一个复杂而高度程序化的过程,可被分为4个相互重叠的时期:起始期、快速伸长期、次生壁生物合成期及脱水成熟期[2]。棉纤维细胞的发育起始于开花当天,大约持续至开花后5 d,只有20%~30%的胚珠表皮细胞可以分化形成最终的长纤维。起始期和伸长期之间并没有显著的时间节点,通常认为开花5 d后,棉纤维就已经进入了伸长期,并将持续至20 d。该时期是棉花纤维细胞的快速生长时期,决定着棉纤维的最终长度。在开花后16 d左右,棉纤维细胞开始大量合成纤维素,标志着棉纤维细胞发育进入了次生壁生物合成期,这个时期纤维素的合成与沉积量决定了成熟棉纤维的强度。这个过程通常持续到40 d,之后棉纤维发育进入到脱水成熟期[3]。
作为真核细胞细胞骨架重要组成成分之一,肌动蛋白细胞骨架广泛参与细胞的形态维持、细胞器的运动、细胞分裂、细胞迁移、物质的囊泡运输和细胞内信号转导等[4-6]。棉纤维正常生长发育依赖于细胞中肌动蛋白细胞骨架的动态行为,早期体外药学试验显示,肌动蛋白结合蛋白(F-Actin)在发育的纤维细胞中参与调控微管的定向[7]。而在纤维长绒极度缩短的ligon lintless突变体中,F-Actin 结构呈现不规则排列状态[8]。此外,抑制棉纤维伸长期优势表达的GhACT1基因的表达,会造成肌动蛋白细胞骨架变少,棉纤维伸长生长受到严重抑制[9]。
肌动蛋白细胞骨架的动态特征依赖于各种肌动蛋白结合蛋白的协同作用,它们通过结合、成核、封端、切割、解聚、成束、交联等方式参与形成不同形态的肌动蛋白骨架[10]。在棉花中,下调肌动蛋白解聚因子GhADF1的表达能够提高纤维中F-Actin的聚合度,同时提高棉纤维的长度和强度[11]。而过量表达GhPFN2能够增加纤维细胞的微丝密度及成束度,进而促进纤维细胞中早期纤维素的沉积[12]。
LIM蛋白是一类古老而保守的蛋白家族,大多包含1个或多个LIM结构域(C-X2-C-X16-23-HX2-C)-X2-(C-X16-21C-X2-3-(C/D/H)),参与蛋白与蛋白的相互作用[13]。植物中的LIM蛋白被分为4组。其中,亚族又可分为3个类型:PLIM、WLIM及XLIM[14]。迄今为止,大部分植物LIM蛋白都被认定为肌动蛋白结合蛋白,能够促进F-Actin的成束,调节肌动蛋白动态平衡,并保护F-Actin不发生解聚[15-18]。在棉花中,GhWLIM1a和GhXLIM6也均被报道参与棉纤维中F-Actin的成束反应[19-20]。先前研究表明,GhWLIM5蛋白在体外能够结合F-Actin并促进F-Actin成束,但其在棉纤维中的功能及其与其他LIM蛋白是否存在功能差异仍不清楚[21]。
本研究对GhWLIM5蛋白参与棉纤维发育中FActin成束调控进行深入探讨,并检测pH对GhWLIM5蛋白功能的影响,同时也比较不同LIM蛋白结合和促进F-Actin成束能力的差异,为深入理解LIM蛋白在棉纤维发育中的功能提供重要的科学依据。
1 材料和方法
1.1 试验材料
供试棉花品种为陆地棉(Goasypium hirsutum)珂字 312;蛋白表达载体为pET-28a;植物转化载体为pBI121;蛋白表达菌株为BL21;植物转化农杆菌菌株为LBA4404。
1.2 试验方法
1.2.1 载体构建 为构建GhWLIM5RNAi载体,约250 bp的GhWLIM5的CDS片段首先以反向重复的方式被克隆进pBluescript SK载体,然后通过双酶切定向连接方式克隆进pBI121载体(35S::GhWLIM5RNAi)或pBI101-TUA9载体(TUA9p::GhWLIM5RNAi),引物分别为GhWLIM5-L1、GhWLIM5-R1和GhWLIM5-L2、GhWLIM5-R2。为构建GhWLIM5和GhXLIM6原核表达载体,不含终止密码子的GhWLIM5、GhXLIM6的编码序列被克隆到pET-28a载体中,引物分别为Gh-WLIM5-EL、GhWLIM5-ER和GhXLIM6-EL、GhXLIM6-ER。
1.2.2 植物材料生长条件 棉花种子经浓硫酸脱绒后,28 ℃培养箱中浸泡1 d后,将露白种子于营养土中在23 ℃培养室中萌发育苗,16 h光照/8 h黑暗。待其生长至二叶期后,移植到大田继续培养。
1.2.3 高速共沉淀与低速共沉淀 将GhWLIM5和GhXLIM6原核表达载体转入大肠杆菌BL21(DE3),用以表达GhWLIM5和GhXLIM6蛋白。重组蛋白在天然条件下用Ni-NTA琼脂糖进行亲和纯化后,用截流大小为10 ku的超滤管将buffer置换为Exchanged buffer(100 mmol/L NaH2PO4、10 mmol/L Tris-HCl,pH值7.4)。
高速、低速共沉淀分析利用Cytoskeleton公司的Actin Binding Protein Biochem Kit进行。首先,将兔源肌动蛋白用General Actin buffer(5 mmol/L Tris-HCl、0.2 mmol/L CaCl2,pH值8.0)溶解至浓度为10 μmol/L,随后加入到Actin Polymerization buffer(5 mmol/L Tris-HCl、0.2 mmol/L CaCl2、0.2 mmol/L ATP、1.0 mmol/L DTT、2 mmol/L MgCl2,pH值8.0)中使G-Actin聚合成F-Actin。然后将不同浓度蛋白加入到预组装的F-Actin聚合体系中,于24 ℃条件下孵育30 min,于4 ℃进行离心1 h(高速共沉淀分析离心力为200 000 g,低速共沉淀分析离心力为14 000 g)。上清和沉淀分别收集,SDS PAGE电泳后用考马斯亮蓝G250进行染色分析。
1.2.4 棉纤维F-Actin染色观察 棉纤维F-Actin染色参照WANG等[17]方法进行。将胚珠在含有0.66 μmol/L Atto 488 phalloidin、0.1 mol/L PIPES(pH值7.0)、0.05% Triton X-100、1 mmol/L MgCl2、3 mmol/L DTT、0.3 mol/L PMSF、5 mmol/L EGTA和0.25%戊二醛的PBS中室温孵育10 min,漂洗干净后,将纤维从胚珠上切下并固定在载玻片上,加入抗荧光淬灭剂,盖上盖玻片,在激光共聚焦显微镜(徕卡,SP5)下进行观察。
1.2.5 胚珠体外培养 取开花前1 d棉桃,用75%酒精进行表面消毒1 min,然后用无菌水清洗干净。切开棉桃,取出胚珠置于BT培养基(含0.5 μmol/L IAA和0.5 μmol/L GA)中,30 ℃静置避光培养。
1.2.6 基因表达检测 利用天根RNApre Pure多糖多酚植物总RNA提取试剂盒提取各组织RNA,利用HiScript II 1st Strand cDNA synthesis Kit试剂盒将1 μg总RNA反转录成cDNA。以GhTUB作为内标进行qRT-PCR分析。qRT-PCR反应条件及基因表达水平计算方法参照文献[18]的方法进行。
1.3 数据分析
利用Image J软件进行微丝定量分析,将微丝图像骨骼化后统计图片的Skewness值,代表微丝成束度。使用称量台对总种子数大于100粒的质量进行统计,利用量尺对棉纤维长度进行统计,数据以平均值±标准差呈现;统计分析采用SPSS 13及Excel软件进行。
2 结果与分析
2.1 GhWLIM5 RNAi转基因棉花表型分析
为了探讨GhWLIM5在棉纤维发育中的功能,分别构建了35S启动子和纤维伸长期优势性启动子TUA9p启动的GhWLIM5RNAi载体,转化棉花并均获得了一些转基因棉花。其中,35S::Gh-WLIM5RNAi共2个株系,TUA9p::GhWLIM5共4个株系。对这些转基因棉花(T2)开花后9 d棉纤维中GhWLIM5的表达量进行检测,结果显示,在转基因棉花纤维中,GhWLIM5的表达量均发生显著下调(图1-A)。

图1 GhWLIM5 RNAi转基因棉花纤维表型分析Fig.1 Phenotype analysis of fiber GhWLIM5 RNAi transgenic cotton
表型观察发现,这些转基因棉花成熟纤维长度较野生型更短,而其种子大小则没有显著差异(图1-B、1-D)。每个株系随机选取50颗种子测量棉纤维长度,结果表明,除TUA9p::GhWLIM5RNAi株系3(TUA3)及35S::GhWLIM5RNAi株系1(35S1)外,其他转基因株系成熟棉纤维长度均较WT显著变短。测量和统计结果显示,转基因棉纤维长度较野生型相比均减少5%~15%,二者存在显著或极显著差异(图1-C)。
随后,选取了棉纤维品质4个常用性状(纤维长度、马克隆值、纤维强度及伸长率)对野生型及GhWLIM5RNAi转基因棉花成熟纤维进行了品质分析。由表1可知,转基因棉花纤维上半部分长度均短于野生型,这与手动测量分析结果基本吻合。同时,GhWLIM5RNAi转基因棉花(除TUA3外)纤维的强度值也比野生型降低了4.0%~8.9%(表1)。此外,马克隆值作为棉花的重要品质指标,能够有效地反映棉花纤维细度与成熟度[22-25],也间接反映了棉纤维细胞壁厚度。品质分析结果显示,野生型棉纤维马克隆值为5.44,而大多GhWLIM5RNAi转基因植株的棉纤维马克隆值则比野生型降低了2.0%~32.4%。这些结果暗示,GhWLIM5可能不仅参与棉纤维伸长生长,还影响棉纤维次生壁发育。

表1 野生型与GhWLIM5表达抑制棉花纤维品质分析Tab.1 Cotton fiber quality analysis of wild type and GhWLIM5 expression inhibited
为进一步检测纤维生长速度,本研究在体外进行胚珠培养,在快速伸长期测量纤维长度,结果如图2-A所示,在相同的培养环境下,野生型棉纤维细胞生长速度快于GhWLIM5RNAi转基因棉纤维细胞。培养12 d后野生型棉纤维细胞长度约为12.5 mm,而转基因植株(除TUA3外)棉纤维细胞长度在8.0~10.5 mm(图2-B)。在培养15、18 d后,转基因植株的棉纤维长度依然短于野生型(图2-C、D)。以上结果说明,抑制GhWLIM5的表达能够抑制棉纤维伸长生长,意味着GhWLIM5在棉纤维伸长生长过程中起着重要作用。

图2 GhWLIM5 RNAi转基因棉花胚珠离体培养纤维生长情况分析Fig.2 Fiber growth analysis of GhWLIM5 RNAi transgenic cotton ovules cultured in vitro
2.2 棉纤维F-Actin聚合度检测
先前研究表明,GhWLIM5蛋白在体外能够促进F-Actin丝束的聚合[21]。因此,本研究用Atto 488-鬼笔环肽对处于开花后12 d的野生型及GhWLIM5RNAi转基因植株棉纤维进行染色,分析GhWLIM5对棉纤维中F-Actin细胞骨架的影响。结果表明(图3),野生型棉纤维中,肌动蛋白丝束与棉纤维细胞生长方向平行,F-Actin丝束聚合度较高(图3-A);而无论是在35S::GhWLIM5RNAi还是在TUA9p::GhWLIM5RNAi转基因棉花中,F-Actin丝束的聚合程度都发生了下降(图3-B、C)。用Image J对F-Actin的Skewness值进行计算用以量化F-Actin的聚合度,结果显示,GhWLIM5抑制程度较高的转基因株系(35S2、TUA1、TUA2)棉纤维F-Actin的Skewness值显著低于野生型,且FActin聚合程度和GhWLIM5的表达量呈正相关(图3-D)。以上结果表明,GhWLIM5通过增加F-Actin的成束度调控棉纤维细胞内微丝骨架高级结构重排,进而促进棉纤维的伸长生长。

图3 GhWLIM5 RNAi转基因棉花纤维中的肌动蛋白细胞骨架Fig.3 Actin cytoskeleton in fibers of GhWLIM5 RNAi transgenic cotton
2.3 pH对LIM蛋白促进F-Actin成束能力的影响
有研究表明,LIM蛋白促进F-Actin成束的能力受到pH的影响[26]。为检测GhWLIM5的功能是否也受到pH的调节,本研究表达并纯化了GhWLIM5蛋白,并在体外进行了F-Actin聚合反应,利用低速共沉淀检测在不同pH环境下GhWLIM5促进FActin成束的能力。结果显示,在加入了相同量的GhWLIM5蛋白后,pH条件不一样F-Actin的聚合程度不同(图4-A)。测量与统计结果表明,当反应体系中无GhWLIM5时,不论在哪种pH条件下,均有约40%的F-Actin存在于沉淀中,说明pH不影响F-Actin的自身聚合能力。但在加入GhWLIM5后,在pH值为6.2时,处于沉淀中的F-Actin比例提高到约70%;当pH值升到7.0时,处于沉淀中的FActin比例降至50%左右;而当pH值升到7.4后,处于沉淀中的F-Actin比例降至和不加GhWLIM5时一样,均为40%左右(图4-B)。由此可见,GhWLIM5促进F-Actin成束的能力与pH环境密切相关,随着pH值的升高,GhWLIM5促进F-Actin成束的能力逐渐下降。

图4 低速共沉淀分析不同pH条件下GhWLIM5促进F-Actin成束能力Fig.4 Ability of GhWLIM5 promoting F-Actin bundles under different pH conditions by low-speed co-sedimentation
2.4 不同LIM蛋白结合F-Actin能力的比较
先前研究表明,不同LIM蛋白结合F-Actin的能力存在差异[15]。为比较GhWLIM5和XLIM家族的GhXLIM6对F-Actin的结合能力差异,将过量GhWLIM5和GhXLIM6蛋白分别与等量F-Actin孵育后进行高速共沉淀试验,检测二者与F-Actin的结合能力。结果显示,加入同等浓度F-Actin的情况下,经高速离心(200 000 g),GhXLIM6存在于沉淀中的比例明显高于GhWLIM5,说明GhWLIM5结合F-Actin的能力弱于GhXLIM6(图5-A)。
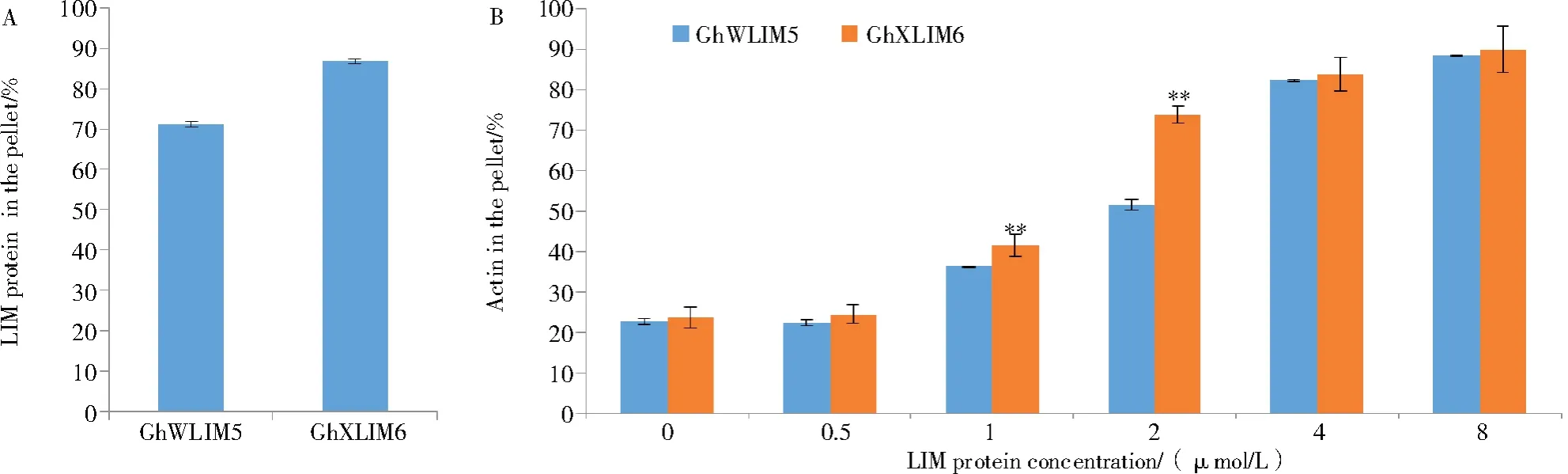
图5 不同LIM蛋白结合与促进F-Actin成束的能力比较Fig.5 Comparison of ability of different LIM proteins to bind and promote F-Actin bundles
进而,将不同浓度GhWLIM5和GhXLIM6蛋白与一定量的F-Actin进行体外聚合反应后,通过低速共沉淀检测它们促进F-Actin成束的能力。结果显示,添加到4 μmol/L的GhWLIM5可使70%的低聚合度的F-Actin聚合成高聚合度的F-Actin丝束,而达到同样的效果,GhXLIM6只需要添加到2 μmol/L,说明GhWLIM5促进F-Actin成束的能力不如GhXLIM6(图5-B)。
2.5 棉纤维中纤维素合酶表达水平比较
纤维品质分析结果显示,GhWLIM5RNAi转基因棉花成熟纤维断裂比强度低于野生型,说明抑制该基因的表达还会影响棉纤维次生壁的发育。成熟棉纤维中超过90%为纤维素,为进一步探索该基因是否能和XLIM一样调控棉纤维中纤维素合酶——GhCESA4/7/8的表达,进行了实时荧光定量PCR试验,结果表明,和野生型相比,在转基因棉花纤维中这些纤维素合酶基因的表达并未发生明显变化(图6),说明GhWLIM5可能不直接影响棉纤维次生壁发育。
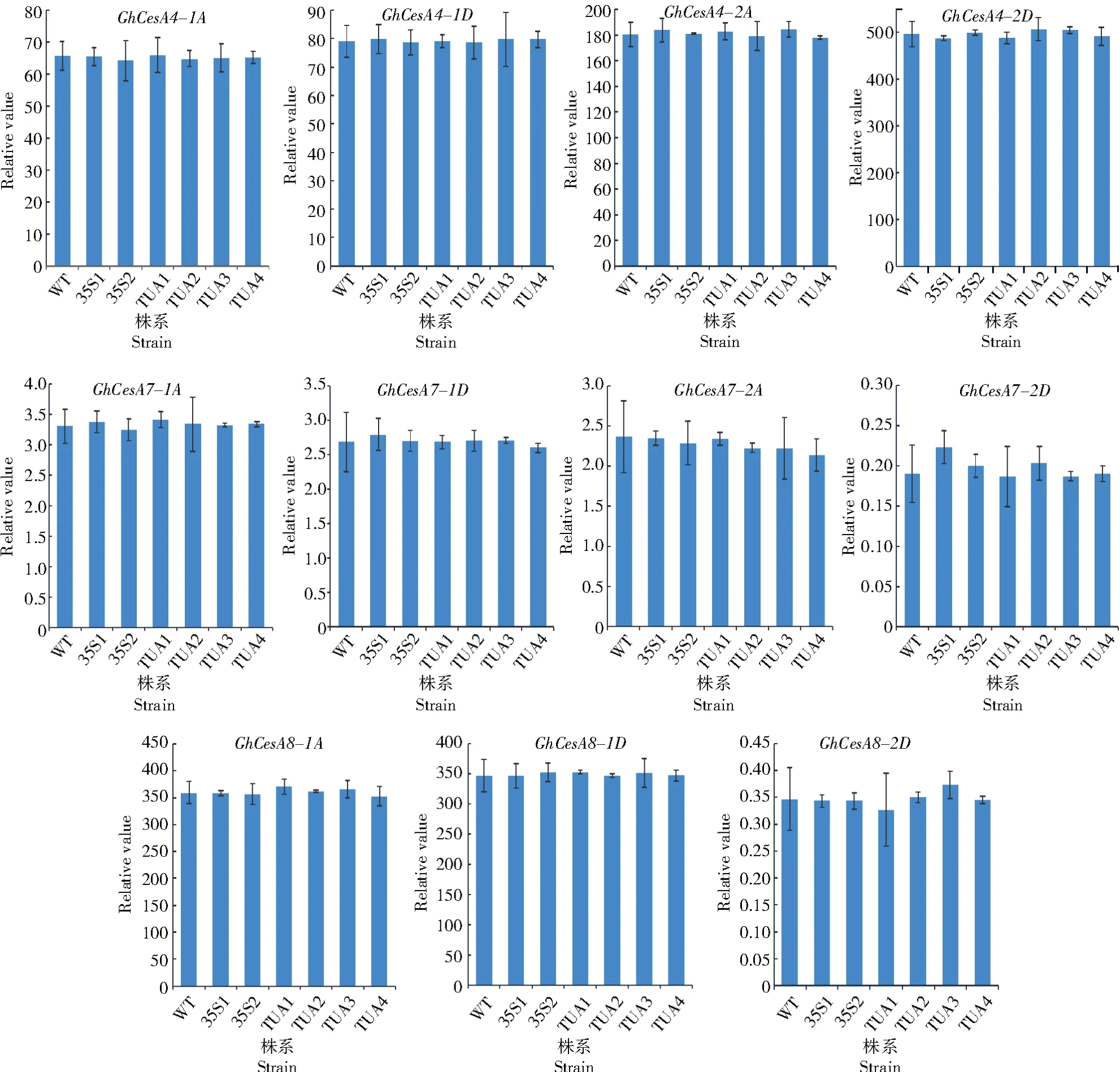
图6 次生壁相关纤维素合酶基因在GhWLIM5 RNAi转基因棉花纤维中的表达情况Fig.6 Expression of secondary wall related cellulose synthase genes in GhWLIM5 RNAi transgenic cotton fibers
3 结论与讨论
作为细胞内长距离运输的轨道,肌动蛋白细胞骨架在尖端或者极性生长的细胞中,如花粉管、根毛、棉纤维等,发挥着至关重要的作用[19-20,27-29]。先前研究表明,GhWLIM5在伸长期的纤维中优势表达,而这个时期是纤维细胞生长速度到达顶峰的阶段[21]。为了满足细胞快速生长的需求,该时期的纤维细胞需要高效的囊泡及细胞器的运输,也意味着需要更为高效的微丝重排。当具有促进F-Actin成束功能的GhWLIM5蛋白在棉纤维细胞中含量不足时,将直接降低细胞中微丝的成束能力,导致纤维细胞中囊泡及细胞器运输能力下降,抑制棉纤维生长。事实上,目前的研究也证实,在GhWLIM5RNAi转基因棉花中,GhWLIM5表达量越低,纤维细胞中微丝成束程度就越低,最终棉纤维长度越短。
先前研究表明,拟南芥和百合中的PLIM蛋白促进F-Actin成束的能力受到pH的影响,低pH环境更利于PLIM对F-Actin成束的促进作用;而拟南芥中WLIMs的活性与pH无关[15,17]。研究显示,在棉花中WLIM蛋白GhWLIM5促进F-Actin成束的能力受到pH的调节,这与拟南芥、百合中的PLIM的特性较为相似。而GhXLIM6则表现出与拟南芥中WLIM蛋白相似特性,对pH相对不敏感[26]。由此可见,在棉花纤维发育过程中,LIM蛋白的功能受到更为复杂地调控,同时兼有花粉管和根毛中存在的调控方式,这与棉花纤维生长呈现独特、向顶的扩散性生长模式是相一致的[30]。
此外,虽然抑制GhWLIM5也会引起棉纤维次生壁的发育受阻,但和GhXLIM6不同的是,GhWLIM5并不表现出直接调控次生壁基因的表达。这意味着棉花中不同LIM蛋白在棉纤维发育过程中出现一定的功能分化,WLIM类倾向于行使F-Actin成束蛋白的功能,而XLIM类则兼任FActin成束蛋白及转录因子2个角色。先前有研究表明,F-Actin和微管细胞骨架组织的活性变化不仅关系到纤维的伸长生长,还能够影响到棉纤维次生壁的合成。尤其是纤维细胞中较早形成的肌动蛋白束,能够促进微管重排及纤维素沉积[12]。而GhWLIM5在纤维发育起始及伸长期均有较高的表达量,意味着该蛋白在这2个时期对肌动蛋白丝束的聚合都有着重要的促进作用。在GhWLIM5RNAi转基因棉花纤维中,GhWLIM5的缺失直接导致在纤维生长的早期即发生了F-Actin聚合程度的下降,这可能造成纤维细胞中微管重排的紊乱和纤维素沉积的异常,这或许是GhWLIM5RNAi转基因棉花纤维细胞壁发育受影响的原因。
