FVL 突变对血友病患者临床表现的影响
2023-09-12王瑜WangYu王丽娥WangLi杜姗姗DuShanshan
王瑜(Wang Yu),王丽娥(Wang Li’e),杜姗姗(Du Shanshan)
1.青岛科技大学化工学院,青岛 266042;
2.扬州市江都人民医院药剂科,扬州 225200;
3.青岛市妇女儿童医院生殖中心,青岛 266004;
凝血因子Ⅴ莱顿(Factor ⅤLeiden,FⅤL)也称作FⅤG1691A,该突变是第 10 号外显子上Arg506Gln/R506Q的错义突变,将位于第1691 位的鸟嘌呤替换为腺嘌呤,同时影响到第506 位或第534 位从精氨酸到谷氨酸的修饰,已被证明是促血栓形成的重要诱因。FⅤL 突变导致的活化蛋白C抵抗(Activated Protein C Resistance,APCR)是引起静脉血栓栓塞症(Venous thromboembolism,VTE)的危险因素之一,凝血酶原(Prothrombin,PT)G20210A突变、FⅧ水平升高、外源性激素的使用、抗磷脂综合征、PS 缺乏与抗凝血酶缺乏等其他因素也可能引起APCR,FⅤL 突变则最为常见,约95%以上的APCR 由FⅤL 突变所致,FⅤL 携带者发生动脉血栓栓塞事件的风险是正常人群的1.21 倍,会增加血栓栓塞症事件的住院时间和复发率。FⅤL 突变在高加索人群中的携带频率为3%~15%,越来越多的证据表明这种在高加索人群中高流行率的FⅤL突变可能为调节血友病的临床表型带来进化上的生存优势,但该方面的研究鲜有报道。血友病A(Hemophilia A,HA)和血友病B(Hemophilia B,HB)分别是以缺乏FⅧ和FⅨ活性为特征的X 染色体隐性连锁出血性疾病,根据FⅧ或FⅨ活性水平可分为轻、中、重型血友病,同时可以借助关节肌肉出血,目标关节损伤等数据加以辅助明确分型。本文就FⅤL 与血友病相互作用的临床表现文献进行整理,并进一步分析了这种突变对血友病影响的可能作用机制,为临床血友病患者的治疗提供更多参考信息。
1 FVL 突变对血友病的患者临床表现的影响
1.1 FⅤL 改善血友病患者临床表型
在过去十几年间,一些体外和体内的研究表明,遗传性促栓基因突变对出血性疾病有潜在的有益影响。Marar TT 等[1]在抑制活化蛋白C(Activated Protein C,APC)活性的小鼠模型中发现,杂合子和纯合子FⅤL 可以显著增强FeCl3诱导的提睾肌动脉损伤模型中纤维蛋白形成和血小板活化,然而在FeCl3诱导的颈静脉损伤模型中表现不佳,我们可以推断FⅤL 对于出血具有一定选择性和局限性。Acharyya S 等[2]报告了一名接受FⅧ替代疗法的6 岁重型HA 男孩,尽管FⅧ凝血活性严重耗尽,依旧没有出现自发性出血或关节积血症状,推测可能是FⅤL杂合突变将该患者的血友病临床表型从重型转为轻型并降低凝血因子浓缩剂的使用量。Escuriola-EttingshausenC 和Nowak-Göttl U 等[3]小组成员针对多种促血栓形成因素对德国重型HA 儿童的临床表型前后进行了多次研究,每次都发现临床表型明显受到促栓危险因素共同遗传的影响,不仅包括FⅤL,其他如PTG20210A,MTHFRC677T也可以推迟携带者首次症状性出血发生的时间,随着研究的进一步的深入,他们发现FⅤL 和PTG20210A携带者除了改善重型血友病患者的年化出血率,也会显著降低携带者关节积血的发生率,然而这项研究还存在一些不足之处,例如研究对象存在的蛋白C(Protein C,PC)缺陷,FⅧ基因缺陷等没有考虑在内。López-Jiménez JJ 等[4]通过对50 例血友病患者生物标志物的出现频率分析处理后发现,亚甲基四氢叶酸还原酶( Methylene Tetra-Hydro-Folate Reductase,MTHFR)基因型与血友病性关节病的关联性更强,MTHFR677TT携带者表现出更多的关节病症状,而MTHFR 1298AC 携带者则表现出更高的关节病积液。有趣的是,El-Din Hamdy MS等[5]针对埃及9 例重型、52 例中型和39 例轻型HA 患者的研究证实杂合子FⅤL或PTG20210A对HA携带者的保护,显著缓解临床出血表现降低关节出血和受损率,并且这些基因突变在改善血友病患者出血表型方面具有叠加效应,但并没有观察到发病年龄的延迟。表1 总结了FⅤL 改善血友病患者临床表型的研究,支持了这些促栓基因突变对血友病临床表型的保护作用的假说。
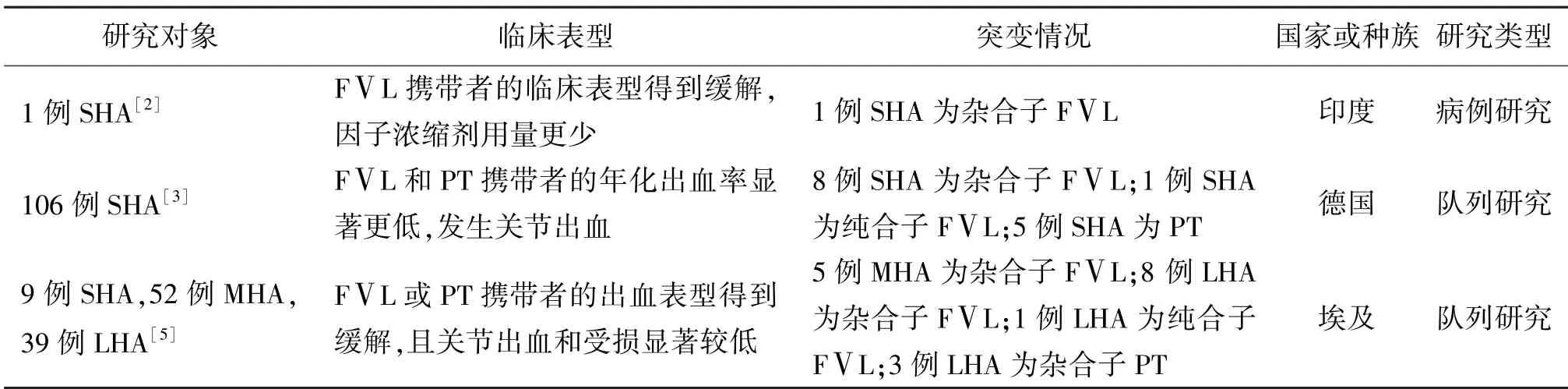
表1 FVL 改善血友病患者临床表型的研究分析和评估
1.2 FⅤL 未影响血友病患者临床表型
目前也有病例报道FⅤL 未能发现有益HA 患者的影响。在另一项评估F ⅤL、PT G20210A、MTHFR C677T 和MTHFR A1298C 突变对中重型HA 儿童年度因子消耗影响的研究中,未能发现高患病率的FⅤL 和PT G20210A 携带者与非携带者之间的因子浓缩剂消耗量存在差异,MTHFRA1298C携带者的因子浓缩剂消耗量没有减少,而与纯合子MTHFR C677T 携带者的因子浓缩剂消耗量呈负相关[6]。这份研究的局限性在于患者数量太少以至无法进行分层,也没有考虑直接影响出血频率的FⅧ和FⅨ基因突变。
在血友病中,因子活性通常与临床表型相关,但是有些重型血友病患者的出血量低于预期。已有资料显示,即便是凝血因子和基因突变相同的血友病患者,所呈现的临床表型也会存在很大差异[7],重型血友病患者可能经历更重的出血事件或仅有较轻的出血倾向。此类患者因子活性水平在1%以下,平均自发性出血次数为二三十次甚至更多,现有资料显示临床出血严重程度与凝固曲线波形分析和凝血活酶生成试验参数相关,而非与FⅧ水平有关,凝固曲线波形分析和凝血活酶生成试验更优于FⅧ水平识别临床重型出血者[8],另有数据证实在重型临床出血表现的血友病患者体内可以观察到凝血酶生成减少,与健康个体相比,在凝血酶峰高<49%和凝血酶潜能<72%的患者中观察到严重出血表现,并且与血友病严重程度无关,预示着凝血酶生成与出血程度相结合可能是一种用于预防性替代疗法个性化指导工具的更好选择[9]。然而,有同样低水平的FⅧ或FⅨ的患者每年流血次数为一两次甚至不流血,此类统称为非重型出血表现的血友病,对于非重型表现的血友病的分类至今仍是难点。血友病的关节出血最终可能导致关节损伤,研究发现非重型血友病患者的关节出血事件很少发生,虽然关节出血率较低,但较大比例的非重型成年血友病患者的关节核磁共振成像,19%、71%和71%患者的肘部、膝盖和脚踝处存在软组织变化,0%、20%和35%患者的肘部、膝盖和脚踝处存在骨软骨变化[10],有相关学者建议以探讨非重型血友病患者的关节状况为出发点,对非重型血友病进行分类。
相较于上文FⅤL 突变可以显著改善血友病患者的生存率,有研究显示生存优势似乎并不显著(表2),一部分原因可能是由于有些重型患者的临床表现存在相当大的异质性,随着研究的深入,这种表型差异的决定因素除了公认的残留凝血因子活性水平、凝血因子浓缩物的药代动力学参数和促血栓标记物外,还与低PC 水平,FⅧ、FⅦ基因的功能多态性有关。当前内含子22 和内含子1 倒位突变是重型HA 中的热点突变,约占全球病例数的一半,在伊拉克[11]、美国[12]等国家均有筛查数据支持,FⅧc.5999-277G>A 深度内含子突变则是近期的研究焦点[13],而FⅧc.353A>G 则被发现可以延长凝血时间[14],FⅦ353Q 则已被证实会影响重型血友病患者的表型[15],因此不同基因缺陷的血友病临床表型通常是不同的。

表2 FVL 未影响血友病患者临床表型的研究分析和评估
Chaves DG 等[16]研究结果显示与重型HA 患者高出血率组相比,关节和肌肉低出血率组的内源性凝血酶潜能和血浆FⅦ水平更高。目前的证据表明,这种促栓突变可能补偿低FⅧ或Ⅸ水平,引起更有效的凝血酶生成,并随后减轻临床症状。另一方面,这种促栓突变与其他获得性或遗传性促血栓性因素的关联可能会克服血友病患者的先天性出血倾向,从而增加血栓并发症的风险。
1.3 FⅤL 与血友病患者血栓形成
实际上血友病患者很少发生血栓性事件,多数血栓形成病例常与手术、恶性肿瘤、凝血因子浓缩物的替代治疗有关。如表3 数据显示,1 例伴有FⅤL杂合突变轻型HA 男孩在没有危险因素的情况下出现左枕叶陈旧性梗死[17],1 例FⅤL 突变HA 患者则是拔牙前使用重组人凝血FⅧ和氨甲环酸后发生急性心肌梗死[18],而另1 例FⅤL 突变轻型HB 患者则是接受髋关节置换术后发生VTE,后期接受高纯度FⅨ浓缩剂后,手术腿发生深静脉血栓栓塞[19]。事实并非完全如此,如1 例51 岁轻型HA 男性患者因冠状动脉旁路手术而接受FⅧ浓缩物后,发生急性心肌梗死[20],而另一例患者在使用重组凝血因子期间,非ST 段抬高性急性冠脉综合征演变为ST 段抬高性急性冠脉综合征[21],而这两例患者本身并非FⅤL 突变携带者。这里,我们可以推测FⅤL 突变对血友病患者是否会促血栓形成的临床表型是受多因素影响的,对于FⅤL 对血友病患者的潜在治疗意义还有待进一步研究。

表3 FVL 与血友病患者血栓形成的研究分析和评估
2 FVL 突变与血友病相关的药理作用
FⅤL 突变是引起91.01% APCR 的主要原因[22],目前与APCR 相关改善血友病临床表型主要有两种机制,包括FⅤL 突变在凝血级联激活过程中增加凝血酶生成,以及激活纤维蛋白溶解抑制物(Thrombin Activatable Fibrinolysis Inhibitor,TAFI)诱导的纤溶下调,针对这两种机制在血友病患者中的作用过程及相关临床表现本文将做以下具体分析(图1)。

图1 FVL 对凝血和纤溶过程的影响
2.1 FⅤL 突变促进凝血酶生成
APC 本身是一种强大的抗凝剂,可水解失活凝血级联反应中的FⅤa 和FⅧa,从而抑制Ⅹ酶原复合物和凝血酶原复合物(Prothrombin complex concentrate,PCC),FⅤ作为APC 辅因子,具有促凝与抗凝功能,与蛋白S(Protein S,PS)协同调节内在Ⅹ酶复合物中的FⅧa。当前血友病的治疗大多以促进血管损伤部位产生大量的凝血酶为目的,其中APC 抑制剂就是以延长PCC 的寿命,直接提高组织损伤部位的凝血酶生成而研制的。APC 裂解位点Arg506突变引起的APCR,使APC 不能有效地裂解和灭活FⅤa 和FⅧa,从而延长APC 对FⅧa 和FⅤa的裂解时间,现已证实FⅤ是轻中型HA 中促进凝血酶生成的关键因子,可以在FⅧ缺乏的血浆中挽救凝血酶的生成[23],促使已经形成的PT 有更多的时间发挥作用,增加凝血酶的生成。
Wilhelm AR 等[24]试验数据表明,FⅧR336Q/R562Q 突变在HA 体内卓越的止血功效得益于FⅧR336Q/R562Q 突变产生的APCR。这为FⅤL 引起的APCR 可以抑制FⅧa 的降解,从而延长某些HA 患者有限FⅧa 的存活时间提供了数据支持,同时也为血友病患者减少出血性事件的发生提供了理论基础。
2.2 FⅤL 突变诱导促纤溶下调
已报道的研究表明,凝血酶激活的TAFI 可能与血栓栓塞的风险增加有关[25],血浆TAFI 水平升高出现在肺血栓栓塞[26]、深静脉血栓[27]、中风[28]和VTE[29]。虽然也有不一致的研究结果,很可能与血栓类型和TAFI 基因多态性及种族差异有关。
APC 的促纤溶作用归因于APC 可以减弱PT激活和随后的TAFI 激活,而FⅤL 突变可以特异性减弱APC 的促纤溶作用并增强TAFI 的激活。TAFI是FⅤL 对抗纤溶作用的主要媒介物。体外研究表明,从纯合FⅤL 个体中制备的纤维蛋白凝块对APC 的原纤溶作用具有抗性。凝血酶本身就是TAFI 最有效的激活剂,而FⅤL 突变引起的APCR可以进一步加强凝血酶的生成能力,此时大量生成的凝血酶可以增强TAFI 激活效率,导致低纤溶状态,特异性增强血栓形成,使血友病患者出血状况得以缓解。
2.3 FⅤL 突变降低炎症表达
基质金属蛋白酶(Matrix Metalloproteinases,MMPs)是一族锌依赖性内肽酶,能够降解细胞外基质的各种蛋白质组分,已知MMPs 在保持黏膜完整性和调节多种病理过程如炎症、癌症和纤维化等方面具有重要作用,另有报告表明MMPs 可以加速颞下颌关节组织退化,并可能介导颞下颌关节疾病的疼痛。颞下颌关节退化和终末期疾病会导致持续性疼痛和严重的颌骨功能障碍[30]。如基质溶解素MMP3 是参与软骨退化的主要酶,现已发现该基因的多态性、年龄、白细胞介素1β 和肿瘤坏死因子与增加骨关节炎患者的MMP3 表达显著有关[31]。MMP12 被发现在类风湿性关节炎患者的滑膜组织中强表达,近期报告则显示MMP12 在牙周病、颞下颌关节功能障碍、正畸牙齿移动和口腔鳞状细胞癌组织中高表达[32]。
纤溶系统包括纤溶酶、纤溶酶原及各自的激活剂,除了本身的纤溶特性外,还可以通过蛋白水解酶降解细胞外基质并调节生长因子和MMPs 的激活。FⅤL突变特异性减弱APC 的促纤溶作用,降低对MMPs 的激活,这对于缓和血友病性关节病的炎症,缓解关节退化是有辅助作用的。
2.4 FⅧ对FⅤL 的影响
FⅤ可作为APC 的辅因子参与抑制FⅤa 和FⅧa的活性,因而可以说APC 是在PS 辅助下通过直接灭活FⅤa、FⅧa 和间接灭活依赖FⅤ辅因子的FⅧa 这三条途径发挥抗凝作用。FⅤ一旦被激活为FⅤa,充当FXa 的辅因子参与PCC 的形成,会进一步激活凝血途径。FⅤL 突变使FⅤa 无法被APC 水解灭活为FⅤ,增加患者体内FⅤa 水平,另一层面上限制了间接灭活依赖FⅤ辅因子的FⅧa 这条抗凝途径,导致血友病患者体内FⅧa 失活受到限制。FX 是凝血级联反应的关键交汇点,FXa 生成至纤维蛋白形成属于内源、外源凝血途径的共同通路,无论是FⅤa 还是FⅧa,最终目的都是为了激活FXa 促进生成凝血酶。FⅤL 突变直接或间接增加患者体内FⅤa 和FⅧa,一定程度上辅助促进凝血酶的生成。
3 问题与展望
分析文献可以看到,虽然FⅤL 突变的促VTE形成危险因素基本得到大多数学者认可,但在特定生理病理情况下可提供一定的优势,比如血友病。我们总结发现FⅤL 突变对某些血友病患者是有利于疾病发展的,包括FⅤL 突变通过使FⅤa 不易被APC 裂解,引起APCR,增加凝血酶生成和减轻纤溶活性;FⅤL 突变可以延迟血友病患者首次症状性出血时间,降低关节出血、受损事件的发生率,减少凝血因子浓缩剂用量,改善血友病患者临床表现。虽然在部分研究中并没有显示出携带FⅤL 突变的血友病有止血效果,但是可以通过凝血因子浓缩物消耗量,出血发作时间的延迟和关节病情况等数据辅助参考。此外,我们也有理由推测,这种促栓突变与其他获得性或遗传性亲血栓因素的关联可能克服先天性出血倾向,为血友病患者带来生存良助。
需要强调的是,此类文献数据存在一定局限性。例如实验数据的差异,小鼠品系、环境因素和个体差异等都可能会影响某些止血参数,更不能完全模拟FⅤL 携带的血友病患者。成人试验混杂因素则包括性别、年龄、经济和地理位置等,对于纳入的患者数量有限,以及研究设计中关于患者的选择和促栓因素分析的差异,也可以解释各研究结果的差异。此外,由于遗传性促栓危险因素不能解释所有临床表型的病例,不排除还有其他因素影响。对血友病的典型基因同质组进行多中心、大规模研究将有助于阐明遗传性血栓形成在这类患者的临床表型调节中的作用。
当前,对血友病患者采取预防治疗是防止出血和致残的最佳方案,特别是在病情初期,但血友病性关节病极为常见,甚至在预防初期、血友病携带者和轻型血友病患者中也有关节畸变的报道,即便是维持各凝血因子水平超持续在1%以上也并不能完全防止关节出血。因此,及早发现、及早预防、及早治疗显得格外重要。就现有资料而言,软骨炎症、软骨损伤和骨骼形成因素等少数候选者可能成为识别血友病患者早期关节损伤发生和进展的特定生物标记物。今后对血友病患者的治疗趋势可能包括避免外伤的预防治疗、FⅧ制剂的替代治疗、补充钙剂的营养治疗和适宜强度的康复治疗,以及对各类生物标记物的常规监测。
贡献声明王瑜负责文献检索、数据收集与分析、撰写文章和修改文章;王丽娥负责指导研究和审阅文章;杜姗姗负责指导研究和审阅文章
利益冲突所有作者均声明不存在利益冲突
