术前血清学联合影像学检查预测肝内胆管癌根治性切除术后患者生存获益的研究
2023-09-11陈家璐于小鹏唐玥陈晨邱应和吴泓宋天强何宇毛先海翟文龙程张军0李敬东梁宵2孙传东马凯林瑞新汤地耿智敏汤朝晖全志伟
陈家璐,于小鹏,2,唐玥,陈晨,邱应和,吴泓,宋天强,何宇,毛先海,翟文龙,程张军0,李敬东,梁宵2,孙传东,马凯,林瑞新,汤地,耿智敏,汤朝晖,全志伟
(1.上海交通大学医学院附属新华医院 普通外科,上海 200092;2.上海市第六人民医院 肿瘤科,上海 200030;3.西安交通大学第一附属医院 肝胆外科,陕西 西安 710061;4.中国人民解放军海军军医大学东方肝胆外科医院 胆道外科,上海200433;5.四川大学华西医院 肝脏外科与肝脏移植中心,四川 成都 610041;6.天津医科大学附属肿瘤医院 肝胆肿瘤科,天津 300060;7.中国人民解放军陆军军医大学西南医院 肝胆外科,重庆 400038;8.湖南省人民医院 肝胆外科,湖南长沙 410005;9.郑州大学第一附属医院 肝胆胰外科,河南 郑州 450052;10.东南大学附属中大医院 肝胆外科,南京210009;11.川北医学院附属医院 肝胆外科,四川 南充 637000;12.浙江大学医学院附属邵逸夫医院 肝胆胰外科,浙江 杭州 310020;13.青岛大学附属医院 肝胆胰外科,山东 青岛 266003;14.吉林大学白求恩第二医院 肝胆胰外科,吉林 长春 130041;15.中山大学附属第七医院 普外科,广东 深圳 528403)
方法:回顾性收集2010年1月—2021年12月于中国13家三甲医院行根治性切除的821例ICC患者的影像学与血清学检测资料。影像学指标包括:发现肝脏肿块、肝内胆管扩张、门静脉侵犯、淋巴结侵犯、腹水及结石;血清学指标包括:血红蛋白、白细胞计数、淋巴细胞计数、中性粒细胞计数、甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、CA125、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)、白蛋白(ALB)及凝血酶原时间(PT)。通过单因素与多因素Cox回归筛选目标变量,用目标变量构建CoxPH模型并绘制列线图,用Kaplan-Meier生存分析验证评分与患者预后的关系,通过受试者工作特征(ROC)曲线及校准曲线对模型预测效能进行评估。
结果:影像学发现腹水、肝内胆管扩张、淋巴结侵犯与血清学指标CEA>5 μg/L、CA19-9>37 U/mL、CA125>40 U/mL是独立预后因素(均P<0.05)。用该六个变量构建CoxPH模型,根据该模型所区分的高风险组患者术后1、3、5年生存率均明显低于低风险组患者(均P<0.05);所构建的列线图具有较好的区分度及有效性。ROC曲线显示,模型1、3、5年预测的曲线下面积分别为0.711、0.721、0.782;模型1、3、5年预测效能均高于独立指标的预测效能。
结论:由CA125、腹水、肝内胆管扩张、淋巴结侵犯、CEA、CA19-9这六个术前指标组成的预后模型能较好地对患者进行高低风险分层,并对ICC患者根治性切除术后生存获益进行较精准的个体化预测,对临床医生判断患者是否适宜行根治性切除具有指导意义。
肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)是发生于肝脏内部,位于肝内二级胆管至肝内最小胆管分支的被覆上皮及其胆管周围腺体发生的恶性肿瘤,其全球发病率正在上升[1]。由于其起病隐匿性与高度侵袭性,ICC患者往往确诊时已是晚期,失去了最佳手术时机,因此其5年生存率往往不足5%~10%[2],而接受根治性切除的患者5年生存率也不足40%[3]。早期预测术后收益和个体化的多学科诊治是ICC研究者目前面临的挑战。尽管过去几年中,在分子表征、手术管理和综合治疗方面取得了进展,但仍缺乏在早期对ICC患者预后的精确预测,缺乏对适宜行根治性切除术患者的筛选依据[4]。
探索早期预后指标,对辅助制定个体化治疗方案、改善患者预后具有重要意义。血清学检测是肿瘤学诊断中最便捷的诊断方式,其中包括血清肿瘤标记物检测[5]。糖类抗原19-9(CA19-9)作为ICC诊疗中最常用的肿瘤血清标记物,仍因存在假阳性或假阴性的可能而使用受限[6-7]。术前影像学检查是目前ICC术前最重要的诊断方式之一,除了可以判断肿瘤的位置外,还可根据大体分型推断其细胞起源及生物学特性,从而有利于制定个体化治疗策略[8]。单一依靠影像学检查虽能提升ICC诊断准确率,但往往不能对患者预后起到很好的预测作用。因此,为了实现术前的精准预测,往往需要复合指标的参与。Chen等[9]通过构建D-二聚体联合CA19-9的复合指标,对ICC行根治性切除的患者的淋巴结转移(lymph nodes metastasis,LNM)和预后实行较为精准的预测。另有学者[10]通过术前复合营养指标PNI预后营养指数(prognostic nutritional index,PNI)+胆红素白蛋白比值(albumin-bilirubin,ALBI)分 级分级对ICC患者实现有效生存预测。Maßmann等[11]将综合全身炎症评分确定为接受全身化疗的晚期ICC患者的独立预后风险评分,并将患者分为低风险和高风险组,以更好地指导治疗决策。这表明复合指标在ICC预后预测具有较好的应用前景。
目前,AJCC TNM分期系统是ICC最常用的分期系统,但该系统对手术预后预测效果有限[12]。许多学者[13-14]已建立了较准确的ICC患者预后预测模型,当前预后预测模型大多将病理因素等术后指标纳入,其对术前临床的指导价值往往有限。鉴于影像学与血清学资料获取的快捷性,两者相联合的复合指标在ICC预后预测领域的应用潜力尚待挖掘。本团队利用术前血清学与影像学指标构建ICC患者预后预测模型,旨在将预测预后的关口前移至术前,以指导评估患者是否适宜行根治性切除术及其术后生存获益情况。
1 资料与方法
1.1 一般资料
回顾性收集全国13家三甲医院2010年1月—2021年12月间行根治性切除的ICC患者1 473例,经入排标准筛选后入组821例,其中浙江大学附属邵逸夫医院167例、四川大学华西医院4例、西安交通大学第一附属医院152例、上海交通大学医学院附属新华医院18例、中国人民解放军海军军医大学东方肝胆医院122例、天津医科大学附属肿瘤医院90例、郑州大学第一附属医院5例、川北医学院附属医院29例、湖南省人民医院119例、中国人民解放军陆军军医大学西南医院55例、东南大学附属中大医院40例、青岛大学附属医院19例、中山大学附属第七医院1例。年龄范围20~80岁。纳入标准:⑴ 术后病理学确诊为ICC;⑵ 无其他系统肿瘤病史;⑶ 生存数据完整。排除标准:⑴ 术后经过其他治疗,如辅助化疗、TACE等;⑵ 术后生存时间≤1个月;⑶ 术前行新辅助治疗;⑷ 转移性肿瘤。本研究通过上海交通大学医学院附属新华医院伦理委员会审批(批号:XHEC-JDYXY-2018-002)。患者及家属术前均签署手术及相关知情同意书。
1.2 临床资料
符合纳入标准的821例患者中,以患者总生存时间和生存状态为结局指标,纳入术前特征共18项,其中影像学指标6项,血清学指标12项。影像学指标依据超声、CT及MRI的检查结果,三种检查中的一种阳性,即评判该指标为阳性,指标包括:发现肝脏肿块,肝内胆管扩张,门静脉侵犯,淋巴结侵犯,腹水,结石。血清学指标包括:血红蛋白,白细胞计数,淋巴细胞计数,中性粒细胞计数,甲胎蛋白(alpha-fetoprotein,AFP),癌胚抗原(carcinoembryonic antigen,CEA),CA19-9,癌抗原125(cancer antigen 125,CA125),丙氨酸氨基转移酶(alanine transaminase,ALT),总胆红素(total bilirubin,TBIL),白蛋白(albumin,ALB),凝血酶原时间(prothrombin time,PT)。
1.3 特征选择与模型建立
通过K最邻近法(K-nearest neighbor)算法进行缺失值填补。通过单因素Cox回归分析对18个临床变量进行初步筛选,保留P<0.05的变量进行多因素Cox回归分析,将满足P<0.05的特征纳入基于多变量CoxPH模型的构建。数据集按7∶3的比例随机分为训练数据集和测试数据集,其中训练集575例,测试集246例。
1.4 统计学处理
使用R语言(4.1.3版本)进行数据处理和绘图。连续性变量通过中位数(四分位数间距)表示,分类变量通过频率(百分比)表示。通过单因素和多因素Cox回归分析进行特征筛选与比例风险模型构建。通过Kaplan-Meier法绘制生存曲线,使用Log-rank检验比较生存情况。P<0.05认为差异有统计学意义。
2 结 果
2.1 单因素Cox回归分析初步筛选术前影像学与血清学指标
821例接受根治性切除的ICC患者的术前影像学指标与血清学指标(连续型变量以正常参考值分割,进行离散化处理[15])见表1。在纳入的共计18个特征中,单因素Cox回归分析结果显示,CA125、CEA、肝内胆管扩张、CA-199、ALB、淋巴结侵犯、结石、门静脉侵犯、ALT、腹水与ICC患者术后的预后因素(均HR>1且P<0.05)(图1A)。多因素Cox回归分析结果显示,CA125、腹水、肝内胆管扩张、淋巴结侵犯、CEA、CA19-9是ICC患者的独立预后因素(均P<0.05)(图1B)。

表1 患者基线表[n(%)]Table 1 Baseline characteristics of the patients [n (%)]

图1 预后因素森林图 A:单因素Cox回归分析;B:多因素Cox回归分析Figure 1 Forest plots of prognostic factors A: Univariate Cox regression analysis; B: Multivariate Cox regression analysis
2.2 基于CoxPH预后模型构建
将821例患者按7∶3的比例随机分为训练集和测试集,用CA125、腹水、肝内胆管扩张、淋巴结侵犯、CEA、CA19-9构建CoxPH模型。公式为:预后评分=0.45×肝内胆管扩张+0.31×淋巴结侵犯+0.82×腹水+0.29×CEA+0.27×CA19-9+0.61×CA125(权重值根据多因素Cox回归结果得出)。依据训练集的预后评分中位值(0.89)将训练集与测试集分为高风险组和低风险组,高风险组患者生存时间更短,死亡比例更高(图2)。对训练集、测试集、总数据集的高低风险组分别进行Kaplan-Meier生存分析,结果显示,高风险组患者的1、3、5年生存预后均明显差于低风险组患者(均P<0.05)(图3),提示高风险组患者行根治性切除后生存获益低于低风险组患者。绘制列线图见图4。从数据集中随机抽取1例患者(影像学未发现腹水、肝内胆管扩张或淋巴结侵犯,CEA<5 μg/L、CA19-9<37 U/mL、CA125<40 U/mL),结果显示其总生存时间超过1、3、5年的概率分别为0.896、0.687、0.521。
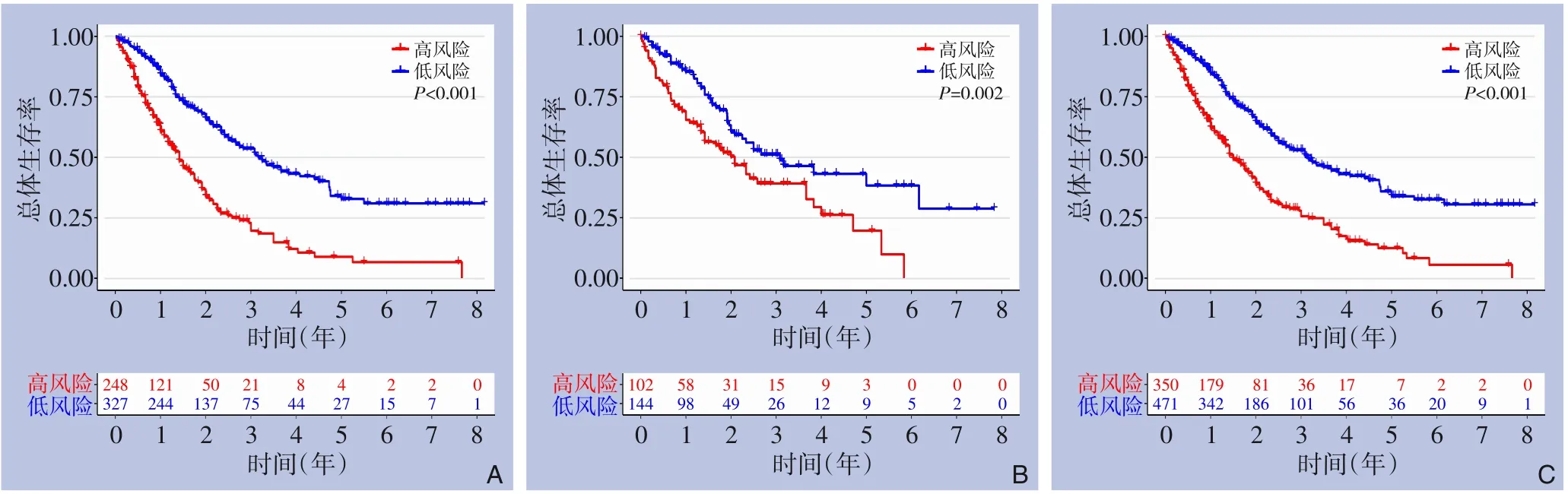
图3 Kaplan-Meier生存曲线图(曲线下图注表示术后相应年份存活的患者例数) A:训练集;B:测试集;C:总数据集Figure 3 Kaplan-Meier survival curves (The notes under the curve indicates the number of patients surviving after the corresponding postoperative years) A: Training set; B: Test set; C: Overall dataset
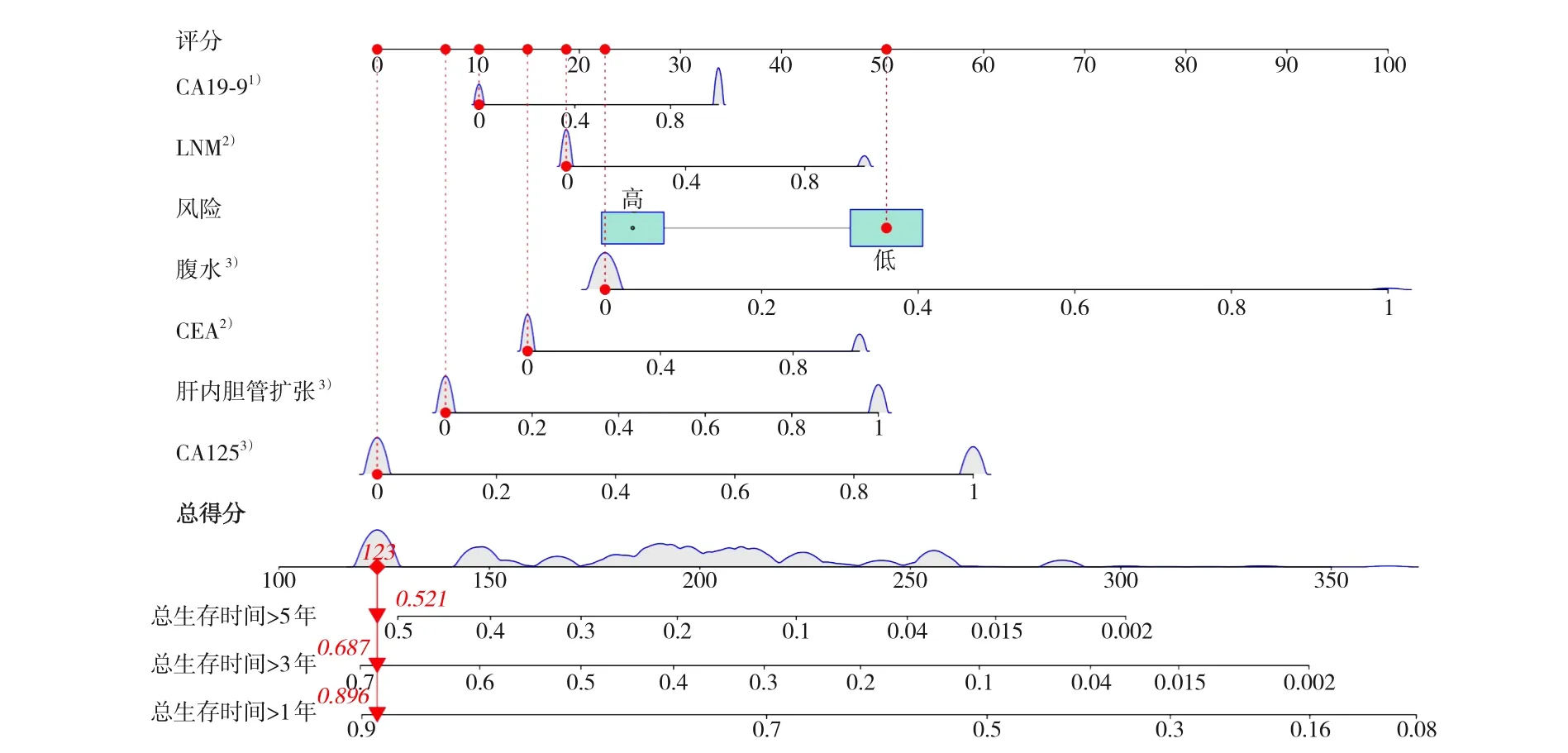
图4 基于6个临床指标的列线图(依据临床指标计算的总分数,对应可得到患者1、3、5年的生存概率) 注:1)P<0.05;2) P<0.01;3) P<0.001Figure 4 Nomogram based on the 6 clinical variables (based on the cumulative score calculated from clinical indicators,corresponding survival probabilities at 1,3,and 5 years can be obtained for patients) Note: 1) P<0.05; 2) P<0.01;3) P<0.001
2.3 模型预测效能评估
受试者工作特征(receiver operating characteristic,ROC)曲线显示,1、3、5年预测的曲线下面积(area under curve,AUC)分别为0.711(敏感度0.656、特异度0.661)、0.721(敏感度0.788、特异度0.580)、0.782(敏感度0.774、特异度0.769)(图5A)。以术后第1、3、5年数据为参考,绘制风险评分与参与模型构建的单个指标的ROC曲线,结果显示,风险评分的AUC大于各个指标独立预测的AUC,说明复合指标预测效能要好于独立指标的预测效能(图5B-E)。绘制列线图的对应校准曲线,结果显示预测效能良好(图6)。DCA曲线(decision curve analysis)显示风险评分预测效果最佳(图7A-C)。

图5 ROC曲线 A:预后模型的ROC曲线;B-D:依次为术后1、3、5年预后模型ROC曲线与单个指标的ROC曲线比较;E:时间依赖性ROC曲线Figure 5 ROC curves A: ROC curve of prognostic model; B-D: ROC curves of model comparing with ROC curves of individual variables at postoperative 1,3,and 5 years respectively; E: Time-dependent ROC curve

图6 校准曲线Figure 6 Calibration curve

图7 DCA曲线Figure 7 DCA curves
3 讨 论
根治性手术是早期ICC患者最重要的治疗方法,但由于早期缺乏临床症状,多数患者确诊已是晚期,失去了最佳手术机会[16]。由于其极强的侵袭性,ICC患者在接受根治性手术后,5年生存率仍然很低[17]。目前ICC研究者面临的最大难题之一是对ICC患者的预后进行早期预测以指导个体化的多学科诊治。因此,迫切需要更精准的预后标志物对可能从治疗中受益的患者实行早期预测,选择合适的患者行根治性切除,提升总体术后生存率。
寻找早期、便捷的预后指标,对协助制定最佳治疗方案、改善患者预后有重要意义。在ICC中,CA19-9是最常用的血清肿瘤标志物。然而,由于7%的个体为Lewis抗原阴性,没有或低产生CA19-9,同时CA19-9在良性和其他胃肠道恶性肿瘤中也经常升高,因此单独使用CA19-9往往敏感度和特异度不能让人满意[18-19]。CA125被发现在胆管癌患者的胆汁及血清中升高,并可用于胆管癌的诊断和预后评估[20-21]。CEA最常见上升于大肠癌,在ICC中特异度和敏感度有限,因此仅作为辅助指标[22]。鉴于单一肿瘤指标在疾病诊治中并非完全令人满意,临床上常用相关指标联合检测的方法以协助诊治。超声检查方便、时效、经济,是ICC一线的筛查手段,但其特异度差,易受多种因素影响,对ICC定性诊断尤为困难。螺旋CT扫描是目前被广泛应用于肝脏疾病诊断的影像学方法,具有扫描范围广和多期增强等特点,明显提高了诊断的准确性,CT和MRI联合诊断能进一步提高准确率[23]。目前已有诸多针对影像学图像构建预后预测模型的研究,这类研究需要结合机器学习的算法加以训练,往往预测效能较为优秀。但此类研究大都基于单一中心的,样本量有限,且影像学图像的批次效应更加显著,提取小样本的影像组学特征可能导致模型过拟合,加重了预测效能的不稳定性[12]。单独的影像组学模型可能不一定比临床模型有更好的预测性能,结合临床指标构建模型,既利用了影像组学特征的客观性,同时也利用了临床数据的多维性,将获得可靠的结果[24]。Zhang等[25]通过在CT图像中提取的放射组学特征,构建了用于预测ICC患者淋巴结转移情况的列线图,包括形状和大小特征以及纹理特征在内的24个放射组学特征。列线图表现优异(训练集AUC为0.98,两个验证队列为0.93和0.89),体现了影像组学强大的预测能力及挖掘潜力,但过多的变量在实际应用中欠缺便捷性。影像组学构建的模型往往具有较高的预测精度,但往往入组的都是单中心的影像数据,缺乏大宗数据支持[26-27]。同时影像数据存在中心之间的差异,如何减少甚至避免差异的出现是需要考虑的问题。除了更强大的算法出现,还可以将影像组学信息简单化,这样可以避免批次效应出现,也保留了影像组学的核心信息。为了应对这种情况,有学者将影像组学信息简化为影像组学评分,再利用评分这一单一指标与其他临床指标结合进行预测模型的构建。例如Liang等[28]使用由9个影像组学特征组成的影像组评分和临床分期构建的列线图可用于预测部分肝切除术后ICC的早期复发,取得良好的效果(训练集AUC为0.90,验证队列为0.86)。Chen等[29]通过年龄、γ-谷氨酰转肽酶和术前影像肿瘤数组成的列线图预测ICC微血管浸润情况,模型效果良好(训练集C指数=0.7622;验证集C指数=0.7591),这体现了将影像学资料简单化后联合其他指标可以起到不错的预测效果,同时兼顾了应用的便捷性。
本课题组将影像组学特征进行二分类化,减少了不同中心数据的批次效应,同时让预测模型更简便、贴合实际。往往术前血清学与影像学的应用更侧重于诊断方面,对预后的预测很少有研究报道。将术前影像学与血清学指标联合应用,对ICC患者预后预测的准确性将会进一步提高。
本研究利用ICC患者术前影像学资料和血清学检测资料提供了一个方便的工具,不仅可以预测患者接受根治性切除后的生存收益,筛选适合手术的患者,还可以在术前协助临床医生做出最佳的临床决策来改善患者预后。尽管许多研究侧重于ICC患者生存的预测,但很少有研究利用术前资料来对患者进行预后分层,因此对手术对象的选择及后续治疗的协助往往有限。而AJCC分期系统中的预测因素往往只能在患者接受手术后才能准确评估[13]。
为了实现术前ICC患者预后的精准评估,将影响临床决策的预测关口前移,筛选根治性切除术生存显著获益的患者,本研究纳入总计18项术前影像学与血清学指标,通过筛选后最终保留六项指标:CA125、腹水、肝内胆管扩张、淋巴结侵犯、CEA、CA19-9。将以上指标纳入模型的构建,将患者分层为预后高风险组与预后低风险组,并比较两组的生存情况,发现预后高风险组患者的生存情况更差。本组研究的结论对临床ICC患者的诊治有一定的指导意义,为适宜手术患者的筛选提供了依据。由于高风险的ICC患者术后长期存活率低,故在处理此类患者时应谨慎选择手术时机,优先选择低风险患者手术,高风险患者必要时辅以辅助治疗或新辅助治疗等。辅助化疗的获益人群选择始终是讨论的焦点,仅依靠术前影像学指标与血清学指标进行评定可能失之偏颇,结合术中情况及术后病理进行评判更有说服力。化疗仍然是ICC的标准一线辅助治疗方法,通过个体化临床特征,筛选辅助化疗获益群体十分重要。本团队此前的研究[30]证实了根治性切除术后辅助化疗组的生存率显著好于未行辅助化疗者,同时也针对辅助化疗的获益人群筛选进行了探索,通过纳入临床病理特征等术后指标结合术前与术中指标,对辅助化疗获益人群进行了准确预测。通过术前、术中、术后指标联合筛选术后辅助化疗可能获益的患者是有必要的,可以显著改善患者生存。术前指标虽然能对术后生存预测进行良好的预测,但辅助化疗的获益可能并不准确,还需要结合术中及术后病理指标进行进一步决策指导。本研究通过仅纳入术前指标的方式,将预测患者预后的窗口前移,最大程度保证了其对临床决策指导的实效性。本研究亦存在诸多不足,其一,预后高风险患者究竟是否行新辅助或辅助治疗后效果更好,其中化疗抑或联合治疗对预后改善更佳,仍需更进一步前瞻性研究以佐证;其次,本文虽为大宗多中心临床研究,但并未设立外部验证集,鉴于网络临床资源影像学资料往往缺失,同时人种差异不可忽视,本团队正持续收集相关资料,以求在时间维度上设立验证集对模型进行进一步验证。
综上所述,本研究通过较大宗的病例回顾性研究,对术前影像学检查联合术前血清学检查对ICC患者根治性切除术预后预测价值,进行了较为充分和详细的分析,结果提示由CA125、腹水、肝内胆管扩张、淋巴结侵犯、CEA、CA19-9组成的预后模型能较好地对患者进行高低风险分层并预测预后。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:陈家璐负责文献选题和文章思路设计、文献资料收集、解读与分析,以及文章初稿撰写和后续修改;于小鹏、唐玥负责文献内容审阅和修改;陈晨、邱应和、吴泓、宋天强、何宇、毛先海、翟文龙、程张军、李敬东、梁宵、孙传东、马凯、林瑞新、汤地、耿智敏负责前期多中心数据收集与整理;汤朝晖负责文献总体选题和设计、文章思路、文献稿件最终审阅定稿,解答学术问题,并最终同意论文发表;全志伟负责把控文献中关键性理论要点及稿件最终审阅定稿。
