番木瓜两性株高温条件下花性转变的转录组分析
2023-09-10周陈平杨敏郭金菊邝瑞彬李庆萌杨护黄炳雄魏岳荣
周陈平 杨敏 郭金菊 邝瑞彬 李庆萌 杨护 黄炳雄 魏岳荣

摘要:【目的】探索番木瓜两性株高温条件下花性转变的分子机制,筛选花性调控相关基因,为培育耐高温番木瓜新品种提供理论依据。【方法】以在高温环境(39~40 ℃)下采集的番木瓜两性株的雄花(雌蕊退化)和两性花(完全花)为试验材料,利用高效液相色谱法测定两者内源激素含量,利用RNA-seq 技术分析两者间的差异表达基因,并通过qRTPCR进行验证,用Plant CARE在线软件分析花发育相关基因启动子顺式元件。【结果】两性花乙烯合成前体1-氨基环丙烷羧酸(ACC)、吲哚-3-乙酸(IAA)、反式玉米素(tZ)、水杨酸(SA)、茉莉酸(JA)含量显著高于雄花,兩者脱落酸(ABA)和赤霉素A3(GA3)含量无显著差异。从转录组数据中共获得27 793 个表达基因,筛选到517 个差异表达基因(DEG),其中214 个基因在雄花中上调表达,303 个基因下调表达。这些差异表达基因主要富集到转录与调控、植物激素响应与信号转导、细胞分化与器官生长调控、质膜组分、氧化应激等GO条目和植物激素信号转导、植物-病原体相互作用、促丝裂原活化蛋白激酶信号通路等KEGG通路上。通过基因功能注释,筛选到70 个植物激素信号转导、响应、生物合成及代谢相关差异表达基因,其中52 个基因在雄花中下调表达,18 个基因上调表达。鉴定到ANT、ANT2、CIB1、HHO5、ZIP21、SAP 等6 个花发育相关差异表达基因,均在雄花中下调表达,其中SAP 基因在两性花中特异表达。除ANT2未查找到相应启动子序列外,ANT、CIB1、HHO5、SAP、ZIP21启动子含植物激素和逆境相关顺式作用元件。
选取17个花发育和植物激素相关差异表达基因进行qRT-PCR分析,结果与转录组数据一致。【结论】番木瓜两性株在高温条件下花性转变可能与花芽ACC、IAA、tZ、SA、JA含量下降及ANT、ANT2、CIB1、HHO5、SAP基因下调表达有关。
关键词:番木瓜;两性株;高温;性别转变;基因差异表达;植物激素
中图分类号:S667.9 文献标志码:A 文章编号:1009-9980(2023)03-0457-14
番木瓜(Carica papaya L.)植株性别分为雄株、雌株和两性株3 种类型,其中两性株果肉厚、品质优,与雌果相比,具有更高的商品价值和经济价值[1-4]。番木瓜的性别由一对性染色体控制,即:雌株基因型为XX,雄株基因型为XY,两性株基因型为XYh[5-6]。与遗传性较稳定的X染色体相比,雄性特异的Y 染色体(MSY)和两性特异的Yh 染色体(HSY)被高度甲基化或异染色质化,核酸多态性较高[7-8]。HSY 和MSY 染色体大约8.1 Mb,是番木瓜最大的1 号染色体,98.9%~99.6%的序列具有相似性,在非同源区段有1887 个插入缺失和21 088 个SNP,包含27 个差异基因,但大部分都不是性别决定基因[9-12]。其中,SVP-like 被认为是雌性抑制基因,在MSY染色体上含MADS-box 和K-box,而在HSY染色体上只含K-box,但至今尚无足够证据表明SVP-like参与番木瓜性别分化[3,13-14]。
植物性别决定存在两种机制,第一是遗传型性别决定,第二是环境型性别决定[15]。遗传因子主导番木瓜株性,外界环境影响花性转变,而花性转变主要决定于温度[16-17]。番木瓜的花性分化是在性别决定遗传因子的基础上进行雄性、雌性或两性性状的分化和发育,与外界因素有关,当内外因素有利于某一性别的发育时,就有可能产生跟性别决定遗传物质不一致的结果,在高温、干旱和缺氮等外界压力下,会导致番木瓜雌性不育[18]。番木瓜最适生长温度为26~32 ℃,当外界环境温度高于最适生长温度5 ℃以上时,就会对植物生长形成高温胁迫[1]。随外界环境由低温到高温,番木瓜两性株的花型从雌型两性花(雄蕊心皮化)转变为长圆形两性花(完全花),再转变为雄型两性花(雌蕊发育不全)和雄花(雌蕊完全退化),当环境温度过低时,番木瓜雄株也会形成两性花[2-3,19]。这可能与番木瓜花芽分化过程中植物激素浓度变化及稳态有关[20-21]。
中国番木瓜主产区属热带、南亚热带地区,高温季节时间长。番木瓜两性株在高温条件下性别转变导致间断结果和产量下降是制约番木瓜高效生产的主要因素之一。目前,有关高温导致番木瓜两性株性别转变的分子机制尚未完全阐明。笔者在本研究中基于番木瓜转录组数据,筛选番木瓜两性株雄花和两性花的差异表达基因,并分析两者的内源激素含量差异,为探索番木瓜两性株在高温条件下花性转变的分子调控机制提供新视角,为培育耐高温番木瓜新品种奠定理论依据。
1 材料和方法
1.1 材料及取样
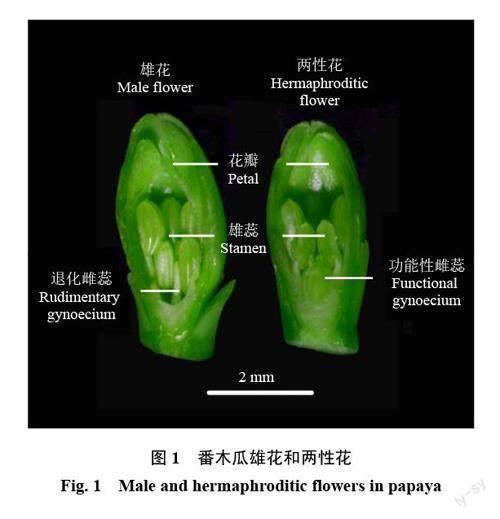
以广东省农业科学院果树研究所自主选育的番木瓜品种GZY3-6 两性株为研究对象。选取25 株长势相近的组培苗,2019 年3 月15 日定植于广东省农业科学院果树研究所番木瓜资源圃,常规栽培管理,生长状态良好。2019 年7 月16 日11:00—13:00(气温39~40 ℃)采集长度<5 mm的主花芽,利用体视镜区分雌蕊退化的雄花和有功能性雌蕊的两性花(图1),用液氮速冻后贮存于-80 ℃超低温冰箱备用。样品委托杭州联川生物技术股份有限公司进行转录组测序与分析。
1.2 内源激素含量测定
取25 mg 样品,加入1 mL 在-40 ℃下预冷的50%乙腈水溶液,匀浆4 min,冰水浴超声5 min,匀浆超声步骤重复3 次,4 ℃下12 000 r · min-1 离心15 min,取上清液,氮气吹干,加入80 μL 10%乙腈水溶液复溶,移至带滤膜的EP管中,4 ℃下12 000 r·min-1离心15 min,取上清液,利用EXIONLC System 超高效液相色谱仪和SCIEX 6500 QTRAP+三重四极杆质谱仪测定内源激素含量。设4 个生物学重复,每个生物学重复5~10个花芽。
色谱柱:Waters ACQUITY UPLC CSH C18(150 mm × 2.1 mm,1.7 μm)。流动相A:0.01%甲酸水溶液;流动相B:0.01%甲酸乙腈溶液。柱温40 ℃,样品盘4 ℃,进样量5 μL。离子源参数:温度475 ℃,离子喷雾电压4 500 V(正离子模式)/-4 500 V(负离子模式),离子源气体1、气体2 和帘气分别设置为30、30 和40 psi。通过SCIEX Analyst Work StationSoftware 1.6.3 和Sciex MultiQuant 3.0.3 软件采集质谱数据和定量分析。
1.3 转录组测序与分析
用TRIzol 提取番木瓜花芽总RNA,NanoDROPND-1000 对总RNA的浓度与纯度进行质控。使用Oligo(dT)磁珠富集带多聚腺苷酸mRNA,NEBFragmentation Module对mRNA随机打断,将片段化的mRNA 合成cDNA 第一条链,随后加入RNaseH和DNA polymerase Ⅰ合成cDNA 第二条链。加入dUTP Solution,将双链cDNA末端补齐为平末端,加A尾、连接测序接头。cDNA经消化后,在95 ℃预变性3 min,98 ℃变性15 s,共8个循环,60 ℃退火15 s,72 ℃延伸30 s,最后72 ℃延伸5 min,形成300 bp 左右的cDNA 文库。使用Illumina Novaseq 6000 进行测序,测序模式为PE150。设3 个生物学重复,每个生物学重复5~10 个花芽。
測序后获得原始序列(raw reads),通过cutadapt软件去除接头、重复序列、低质量序列,获得过滤序列(clean reads)。使用HISAT2 v2.0.4 将得到的过滤序列比对到番木瓜参考基因组(https://phytozome.jgi.doe.gov/pz/portal.html#!bulk?org=Org_Cpapaya)上,用String Tie 软件对基因或转录本进行初组装,用gffcompare 软件对转录本进行检测和组装注释。
利用FPKM(指每百万碱基对测序的转录本序列片段的每千碱基片段的预期数量)计算基因表达水平。通过p 值< 0.05 且|log2(fold change)| ≥ 1 为阈值筛选差异表达基因(DEG)。
1.4 差异表达基因的功能注释与富集分析
利用R包GOseq 软件进行GO(Gene Ontology)富集分析,获得生物学过程、细胞组成和分子功能的GO注释结果。利用KOBAS 软件对差异表达基因进行KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。以p 值<0.05 定义为GO项或KEGG通路显著富集。
1.5 花发育相关基因启动子顺式作用元件分析
从番木瓜参考基因组数据库中下载花发育相关基因的启动子序列(ATG 上游2000 bp 序列),用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)网站预测启动子序列的顺式作用元件,利用TBtools 软件对预测结果进行可视化绘图[22]。
1.6 实时荧光定量PCR(qRT-PCR)分析
选取17 个花发育和植物激素相关差异表达基因,用Primer Premier 5 软件设计特异引物(表1)。
参照周陈平等[23]的方法,使用天根RNAprep Pure 多糖多酚植物总RNA提取试剂盒提取总RNA,用EvoM-MLV RT Mix Kit with gDNA Clean for qPCR 试剂盒合成cDNA 作为PCR 模板,使用Bio-Rad CFX96仪进行扩增,反应体系和程序参照SYBR Green ProTaq HS实时荧光定量PCR试剂盒方法进行,以番木瓜肌动蛋白基因(CpActin)为内参基因。用2- ΔΔCt方法计算基因相对表达量。设3 个生物学重复,每个生物学重复5~10 个花芽。
2 结果与分析
2.1 雄花和两性花中ACC和内源激素含量分析
在番木瓜两性花中,乙烯合成前体1-氨基环丙烷羧酸(ACC)、吲哚-3-乙酸(IAA)、反式玉米素(tZ)、水杨酸(SA)、茉莉酸(JA)含量分别是雄花的2.08、1.40、1.81、4.07、1.93 倍,两者的脱落酸(ABA)和赤霉素A3(GA3)含量无显著差异(图2)。
2.2 雄花和两性花转录组分析
对番木瓜两性株雄花和两性花样品进行转录组测序,共获得45.17 Gb 原始数据,过滤后,样品的平均序列数量为7.41 Gb,Q20>99.9%,Q30>98.7%,与参考基因组比对率超过88.9%,其中约78.2%比对到基因组唯一序列(表2)。说明转录组测序结果可靠性和精准性较好,可进一步分析。
为分析雄花和两性花不同表达水平基因数量的分布情况,将基因表达水平划分为4 个等级,2 组样品在4 个等级中的基因数量分布情况相近(图3-A)。在2 组样品转录组数据中,共组装拼接得到27 793 个基因,不表达(FPKM<1)的基因数量约占33.9%,在100>FPKM ≥ 10 区间的基因数量最多,占比为39.2%,其次是10>FPKM ≥ 1 区间,占比为20.3%,FPKM ≥ 100 占比最少。在p 值<0.05 且|log2(fold change)| ≥ 1 的阈值条件下,在雄花和两性花中共鉴定得到517 个差异表达基因,其中214 个基因上调表达,303 个基因下调表达(图3-B)。
2.3 雄花和两性花中差异表达基因GO 注释与KEGG功能富集分析
对番木瓜两性株雄花和两性花中517 个差异表达基因进行GO功能富集分析,主要涉及生物学过程、细胞组成、分子功能。显著富集(p 值<0.05)在生物学过程的有85 项、细胞组成有11 项、分子功能有49 项。选择富集最显著的前50 项条目进行展示(表3)。在生物学过程中,大多数基因主要富集到转录与转录调控、植物激素响应与信号调控、细胞分化与器官生长调控、胁迫响应与调控等相关的GO条目中。在细胞组分中,以质膜、胞外区为主。在分子功能中,以转录调控区域DNA 结合转录调控、DNA 结合转录因子活性、DNA特异序列结合为主。
将番木瓜两性株雄花和两性花中差异表达基因比对到KEGG 数据库中,共富集到66 个KEGG 通路。以p 值<0.05 为标准,筛选差异表达基因显著富集的通路,包括植物激素信号转导、α-亚麻酸代谢、单萜类生物合成、亚麻酸代谢、ABC 转运蛋白、植物-病原体相互作用、谷胱甘肽代谢和促丝裂原活化蛋白激酶信号通路等8 个KEGG 通路(表4)。显著富集基因最多的是植物激素信号转导,其次是植物-病原体相互作用、促丝裂原活化蛋白激酶信号通路等。
2.4 雄花和两性花中植物激素相关差异表达基因分析
植物激素在花器官发育过程中发挥重要作用。
为分析番木瓜雄花和两性花中植物激素相关基因的表达情况,通过差异表达基因的功能注释,共鉴定到70 个植物激素相关差异表达基因(表5)。在这些基因中,有13 个基因参与脱落酸信号转导和响应生物学过程,其中10 个基因在雄花中下调表达,包括脱落酸受体基因PYL4;3 个基因上调表达,包括在雄花中特异表达基因RGGA。
有20 个差异表达基因参与生长素运输、信号转导、代谢、响应等生物学过程,除生长素转运基因WAG1 和生长素响应基因SUR48 外,其余18 个基因在雄花中均下调表达。在两性花中,生长素合成基因ILL3、GH3.1 和GH3.9 表达量分别是雄花的9.32、2.17、3.36 倍,4 个参与生长素转运的SAUR家族基因表达量是雄花的2.27~5.78倍。
细胞分裂素是细胞分化的重要植物激素。有9个差异表达基因参与细胞分裂素信号转导、代谢、响应和生物合成等生物学过程。在两性花中,细胞分裂素生物合成基因LOG3、LOG5、LOG5.1 表达量分别是雄花的2.39、2.06、34.06倍。
另外,参与乙烯、赤霉素、茉莉酸、水杨酸相关差异表达基因分别有8、4、13、3 个。在雄花中,赤霉素生物合成基因GA20OX1 和水杨酸代谢基因SAMT1的表达量分别是两性花的2.33 和5.78 倍。而在两性花中,茉莉酸生物合成基因LOX2、OPR3 和乙烯生物合成基因ACO1 表达量分别是雄花的4.17、5.54、2.20 倍。
2.5 雄花和两性花中花发育相关差异表达基因分析
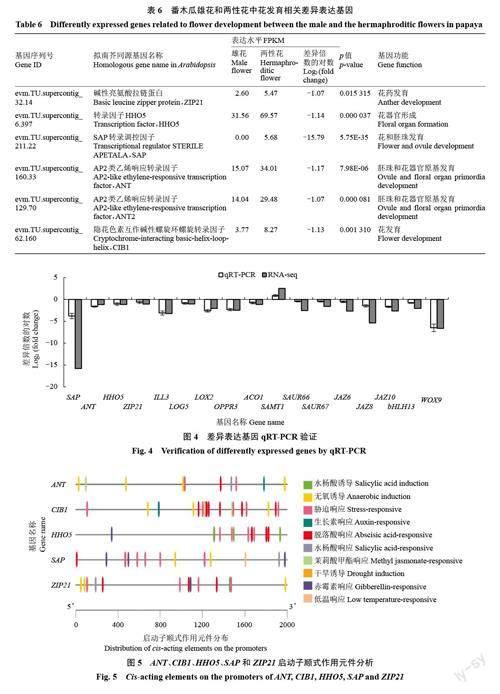
在番木瓜雄花和两性花中,共鉴定到6 个参与花发育相关基因。在两性花中,ANT、ANT2、CIB1、HHO5、ZIP21 基因表达量分别是雄花的2.27、2.08、2.17、2.22、2.08 倍,而参与花和胚珠发育的SAP基因在两性花中特异表达(表6)。
2.6 qRT-PCR验证差异表达基因
为验证番木瓜雄花和两性花转录组测序数据的准确性和有效性,选取17 个花发育和植物激素相关差异表达基因进行qRT-PCR 分析,其中4 个花发育相关基因(SAP、ANT、HHO5、ZIP21)、5 个植物激素生物合成基因(ILL3、LOG5、LOX2、OPPR3、ACO1)、2 个生长素运输基因(SAUR66、SAUR67)、5 个植物激素信号转导与响应基因(JAZ6、JAZ8、JAZ10、bHLH13、WOX9)在雄花中下调表达,1 个水杨酸代谢基因(SAMT1)上调表达(图4)。将所得的基因相对表达量值转化为log2(fold change),与转录组数据的log2(fold change)进行比较,两者上、下调表达趋势一致,表明转录组数据真实、可靠。
2.7 雄花和两性花中花发育相关基因启动子顺式作用元件预测
为了分析花发育相关基因ANT、ANT2、CIB1、HHO5、SAP、ZIP21(表6)的启动子元件的组成及可能的调控作用。除ANT2 基因未查找到相应启动子序列外,从番木瓜参考基因组数据库中下载其余5个基因启动子序列,采用PlantCARE 预测基因启动子顺式作用元件(图5)。这5 个基因启动子均含脱落酸响应和胁迫响应元件,此外,ANT 和CIB1 启动子含生长素响应、无氧诱导、茉莉酸甲酯响应、水杨酸诱导及响应元件,HHO5 启动子含茉莉酸甲酯响应、水杨酸响应与诱导元件,SAP启动子含无氧诱导、低温响应和赤霉素响应元件,ZIP21启动子含无氧诱导、生长素响应、茉莉酸甲酯响应和赤霉素响应元件。
3 讨论
性别分化除受遗传物质的调控外,环境条件也可以影响性别转变。高温是导致番木瓜两性株的花性向雄花转变的重要环境因素之一,但其分子调控机制尚不清楚。笔者在本研究中对在高温环境下采集的番木瓜两性株雄花和两性花进行转录组测序,转录组数据组装拼接得到27 793 个基因,共鉴定到517 个差异表达基因。KEGG 富集分析表明,植物激素响应及信号转导通路富集最显著,说明植物激素相关差异表达基因可能在番木瓜两性株高温趋雄过程中起到关键作用。
植物激素通过相互作用和串扰,直接或間接参与性别分化和组织形态发生,生长素、乙烯、细胞分裂素在植物性别分化中起到促进雌性化的作用,而赤霉素起到促雄作用[24-27]。孙思琼等[28]研究表明,外施赤霉素会增加甜瓜雄花两性株的雄花数量。然而,Han 等[29]对番木瓜两性株和雌株的花芽外施GA3,并未观察到花性转雄,反而增加花梗长度和花序分枝数量。在本研究中,番木瓜雄花和两性花GA3含量无显著差异,与前人的研究结果一致。说明赤霉素对不同物种间花性转变的作用存在差异。
而外施生長素(萘乙酸)[21]或乙烯利[30]可促进番木瓜雄株雌蕊的形成。在本研究中,生长素-氨基酸水解酶基因(ILL3)、吲哚乙酸氨基化合成酶基因(GH3.1、GH3.9)和1-氨基环丙烷-1-羧酸氧化酶基因(ACO1)在雄花中下调表达,导致雄花中生长素和乙烯的合成量减少。在拟南芥中,ANT是调控胚珠生长发育的关键基因,受生长素调控,同时介导生长素信号通路相关基因参与花器官形成[31-32];CIB1 基因编码蛋白则直接调控FT 基因表达,调节植物成花[33]。对ANT 和CIB1 基因启动子的顺式元件进行分析,结果表明,这两个基因的启动子含生长素响应元件,番木瓜两性株雄花中生长素积累量的减少,可能降低ANT、CIB1 基因表达量,导致雄花雌蕊发育不全。也有研究报道,外施细胞分裂素(氯吡苯脲)可促进猕猴桃雄株雌蕊的形成[34]。本研究中,雄花细胞分裂素核苷5-单磷酸盐磷酸核糖水解酶基因(LOG3、LOG5、LOG5.1)的下调表达,降低了雄花细胞分裂素的积累量,减缓雌蕊的分化。说明在高温环境下番木瓜两性株雌性不育的加剧与花芽生长素、乙烯和细胞分裂素合成量下降有关。
茉莉酸和水杨酸在植物生长发育及对高温、干旱、过量光、机械损伤等非生物胁迫响应中发挥重要作用[35-37]。在番茄中,JAI-1 基因功能缺失,导致雌性不育,防御反应能力下降[38]。在小麦和拟南芥中,opr3 突变体幼苗受高温胁迫后,成活率显著低于野生型[39]。外施水杨酸可明显提高番茄、马铃薯、小麦、水稻、葡萄等作物的耐高温能力[40-41]。在本研究中,参与茉莉酸合成的脂氧合酶2 基因(LOX2)、12-氧代植二烯酸还原酶3 基因(OPR3)在雄花中下调表达,而参与水杨酸代谢的水杨酸羧基甲基转移酶基因(SAMT1)在雄花中上调表达,导致雄花中茉莉酸和水杨酸积累的减少,从而降低雄花对高温耐受能力。番木瓜HHO5 基因启动子含茉莉酸甲酯响应、水杨酸响应元件,雄花中茉莉酸和水杨酸含量下降,可能减弱HHO5 基因的表达,影响雌蕊的发育。
SAP 转录因子属于F-box 蛋白,是E3 泛素连接酶复合物SKP1/Cullin/F-box 的组成部分,通过降解PPD蛋白来调节胚珠、花和花序发育[42]。SAP功能缺失会导致拟南芥胚珠、花和花序严重畸变[43]。干旱、高盐、低温等逆境胁迫会促使菠萝SAP 基因高效表达,影响花器官的大小[44]。龙眼SAP可能参与生长素和赤霉素等激素应答及非生物胁迫响应[45]。在本研究中,番木瓜SAP 基因在雄花中不表达(FPKM <1)。启动子顺式元件分析结果表明,SAP基因启动子含低温响应元件,说明SAP基因的表达受低温诱导,而在高温胁迫下,SAP基因转录活性可能被抑制,可能导致番木瓜雌蕊败育,促进雄花形成。
4 结论
对番木瓜两性株雄花和两性花进行转录组测序和分析,筛选到70 个植物激素相关差异表达基因和6 个花发育相关差异表达基因。番木瓜两性株在高温条件下的花性转变可能与花芽中植物激素生物合成、代谢和转运相关基因表达量的改变,导致ACC、IAA、tZ、SA、JA 积累的减少,从而降低花发育相关基因ANT、CIB1、HHO5 的表达量,以及高温抑制SAP基因的表达有关。
参考文献References:
[1] 熊月明,郭林榕,黄雄峰,张丽梅,林旗华. 不同栽培技术措施
对番木瓜两性株高温变性的抑制效应[J]. 福建农业学报,
2011,26(6):981-984.
XIONG Yueming,GUO Linrong,HUANG Xiongfeng,ZHANG
Limei,LIN Qihua. Effect of cultivation conditions on high temperature
gender alteration of hermaphroditic papaya (Carica papaya
L.) [J]. Fujian Journal of Agricultural Sciences,2011,26
(6):981-984.
[2] 李亚丽,沈文涛,言谱,周鹏. 番木瓜性别决定的研究进展[J].
广西农业科学,2009,40(2):198-202.
LI Yali,SHEN Wentao,YAN Pu,ZHOU Peng. Advance of sex
determination in papaya[J]. Guangxi Agricultural Sciences,
2009,40(2):198-202.
[3] ARYAL R,JAGADEESWARAN G,ZHENG Y,YU Q,SUNKAR
R,MING R. Sex specific expression and distribution of
small RNAs in papaya[J]. BMC Genomics,2014,15(1):20.
[4] ARYAL R,MING R. Sex determination in flowering plants:papaya
as a model system[J]. Plant Science,2014,217/218:56-62.
[5] LIU Z Y,MOOR P H,MA H,ACKERMAN C M,RAGIBA M,
YU Q Y,PEARL H M,KIM M S,CHARLTON J W,STILES J
L,ZEE F T,PATERSON A H,MING R. A primitive Y chromosome
in papaya marks incipient sex chromosome evolution[J].
Nature,2004,427(6972):348-352.
[6] MING R,YU Q Y,MOORE P H. Sex determination in papaya[J].
Seminars in Cell & Developmental Biology,2007,18(3):401-
408.
[7] ZHANG W L,WANG X,YU Q Y,MING R,JIANG J M. DNA
methylation and heterochromatinization in the male-specific region
of the primitive Y chromosome of papaya[J]. Genome Research,
2008,18(12):1938-1943.
[8] BERGERO R,CHARLESWORTH D. Preservation of the Y
transcriptome in a 10- million- year- old plant sex chromosome
system[J]. Current Biology,2011,21(17):1470-1474.
[9] VANBUREN R,WAI C M,ZHANG J S,HAN J,ARRO J,LIN
Z C,LIAO Z Y,YU Q Y,WANG M L,ZEE F,MOORE R C,
CHARLESWORTH D,MING R. Extremely low nucleotide diversity
in the X-linked region of papaya caused by a strong selective
sweep[J]. Genome Biology,2016,17(1):230.
[10] VANBUREN R,ZENG F C,CHEN C X,ZHANG J S,WAI C
M,HAN J,ARYAL R,GSCHWEND A R,WANG J P,NA J K,
HUANG L X,ZHANG L M,MIAO W J,GOU J Q,ARRO J,
GUYOT R,MOORE R C,WANG M L,ZEE F,CHARLESWORTH
D,MOORE P H,YU Q Y,MING R. Origin and domestication
of papaya Yh chromosome[J]. Genome Research,
2015,25(4):524-533.
[11] WANG J P,NA J K,YU Q Y,GSCHWEND A R,HAN J,ZENG
F C,ARYAL R,VANBUREN R,MURRAY J E,ZHANG W L,
NAVAJAS- P?REZ R,FELTUS F A,LEMKE C,TONG E J,
CHEN C X,WAI C M,SINGH R,WANG M L,MIN X J,
ALAM M,CHARLESWORTH D,MOORE P H,JIANG J M,
PATERSON A H,MING R. Sequencing papaya X and Yh chromosomes
reveals molecular basis of incipient sex chromosome
evolution[J]. Proceedings of the National Academy of Siences
of the United States of America,2012,109(34):13710-13715.
[12] YU Q Y,NAVAJAS- P?REZ R,TONG E,ROBERTSON J,
MOORE P H,PATERSON A H,MING R. Recent origin of dioecious
and gynodioecious Y chromosomes in papaya[J]. Tropical
Plant Biology,2008,1(1):49-57.
[13] LIAO Z Y,YU Q Y,MING R. Development of male- specific
markers and identification of sex reversal mutants in papaya[J].
Euphytica,2017,213(2):53.
[14] UENO H,URASAKI N,NATSUME S,YOSHIDA K,TARORA
K,SHUDO A,TERAUCHI R,MATSUMURA H. Genome
sequence comparison reveals a candidate gene involved in
male- hermaphrodite differentiation in papaya (Carica papaya)
trees[J]. Molecular Genetics and Genomics,2015,290(2):661-
670.
[15] PIFERRER F. Epigenetics of sex determination and gonadogenesis[
J]. Developmental Dynamics,2013,242(4):360-370.
[16] BARNAB?S B,J?GER K,FEH?R A. The effect of drought
and heat stress on reproductive processes in cereals[J]. Plant,
Cell and Environment,2008,31(1):11-38.
[17] REZAEI E E,WEBBER H,GAISER T,NAAB J,EWERT F.
Heat stress in cereals:Mechanisms and modelling[J]. European
Journal of Agronomy,2015,64:98-113.
[18] 李惠华,何健,苏明华,赖瑞云. 番木瓜性别分化研究进展(综
述)[J]. 亚热带植物科学,2008,37(4):64-68.
LI Huihua,HE Jian,SU Minghua,LAI Ruiyun. Review of studies
on sex differentiation in Carica papaya[J]. Subtropical Plant
Science,2008,37(4):64-68.
[19] LIN H,LIAO Z Y,ZHANG L M,YU Q Y. Transcriptome analysis
of the male- to- hermaphrodite sex reversal induced by low
temperature in papaya[J]. Tree Genetics & Genomes,2016,12
(5):94.
[20] 廖芬,唐文忠,周主贵,黄茂康,崔素芬,何全光. 番木瓜株性转
变与叶片内源激素平衡关系[J]. 西南农业学报,2013,26(2):
713-717.
LIAO Fen,TANG Wenzhong,ZHOU Zhugui,HUANG Maokang,
CUI Sufen,HE Quanguang. Endogenous hormonal balance
in papaya leaf during sex conversion of hermaphrodite papaya
(Carica papaya L.)[J]. Southwest China Journal of Agricultural
Scieneces,2013,26(2):713-717.
[21] ZHOU P,FATIMA M,MA X Y,LIU J,MING R. Auxin regulation
involved in gynoecium morphogenesis of papaya flowers[J].
Horticulture Research,2019,6(1):119.
[22] CHEN C J,CHEN H,ZHANG Y,THOMAS H R,FRANK M
H,HE Y H,XIA R. TBtools:An integrative toolkit developed
for interactive analyses of big biological data[J]. Molecular
Plant,2020,13(8):1194-1202.
[23] 周陳平,杨敏,郭金菊,邝瑞彬,杨护,黄炳雄,魏岳荣. 番木瓜
成熟过程中全基因组DNA 甲基化和转录组变化分析[J]. 园
艺学报,2022,49(3):519-532.
ZHOU Chenping,YANG Min,GUO Jinju,KUANG Ruibin,
YANG Hu,HUANG Bingxiong,WEI Yuerong. Dynamic changes
in DNA methylome and transcriptome patterns during papaya
fruit ripening[J]. Acta Horticulturae Sinica,2022,49(3):519-532.
[24] 周賡,陈宸,刘晓虹,卢向阳,田云,陈惠明. 黄瓜性别决定研究
进展[J]. 植物生理学报,2019,55(7):902-914.
ZHOU Geng,CHEN Chen,LIU Xiaohong,LU Xiangyang,
TIAN Yun,CHEN Huiming. Research progress of sex determination
in cucumber[J]. Plant Physiology Journal,2019,55(7):
902-914.
[25] HAMAD H,GEWAILY E,GHONEIM A,SHEHAB M,ELKHOLLY
N. Improvement ability of male parent by gibberellic
acid application to enhancing the outcrossing of cytoplasmic
male sterility rice lines[J]. Acta agriculturae Slovenica,2021,
117(3):1-11.
[26] LIU J,CHEN L Y,ZHOU P,LIAO Z Y,LIN H,YU Q Y,
MING R. Sex biased expression of hormone related genes at early
stage of sex differentiation in papaya flowers[J]. Horticulture
Research,2021,8(1):147.
[27] SHIRLEY N J,AUBERT M K,WILKINSON L G,BIRD D C,
LORA J,YANG X,TUCKER M R. Translating auxin responses
into ovules,seeds and yield:Insight from Arabidopsis and the
cereals[J]. Journal of Integrative Plant Biology,2019,61(3):
310-336.
[28] 孫思琼,王惠林,王志文,徐宝林. 赤霉素和乙烯利对甜瓜4
种性型分化的影响[J]. 中国瓜菜,2021,34(11):68-73.
SUN Siqiong,WANG Huilin,WANG Zhiwen,XU Baolin. Effects
of gibberellin and ethephon on sex differentiation in four
sex types of melon[J]. Chinese Cucurbits and Vegetables,2021,
34(11):68-73.
[29] HAN J,MURRAY J E,YU Q Y,MOORE P H,MING R. The
effects of gibberellic acid on sex expression and secondary sexual
characteristics in papaya[J]. HortScience,2014,49(3):378-
383.
[30] KUMAR A,JAISWAL V S. Sex reversal and fruit formation on
male plants of Carica Papaya L. by ethrel and chlorflurenol[J].
Proceedings Plant Sciences,1984,93(6):635-641.
[31] YAMAGUCHI N,JEONG C W,NOLE-WILSON S,KRIZEK B
A,WAGNER D. AINTEGUMENTA and AINTEGUMENTALIKE6/
PLETHORA3 induce LEAFY expression in response to
auxin to promote the onset of flower formation in Arabidopsis[J].
Plant Physiology,2016,170(1):283-293.
[32] KRIZEK B A,BLAKLEY I C,HO Y Y,FREESE N,LORAINE
A. The Arabidopsis transcription factor AINTEGUMENTA orchestrates
patterning genes and auxin signaling in the establishment
of floral growth and form[J]. Plant Journal,2020,103(2):
752-768.
[33] LIU Y W,LI X,MA D B,CHEN Z R,WANG J W,LIU H T.
CIB1 and CO interact to mediate CRY2-dependent regulation of
flowering[J]. EMBO Reports,2018,19(10):e45762.
[34] AKAGI T,HENRY I M,OHTANI H,MORIMOTO T,BEPPU
K,KATAOKA I,TAO R. A Y- encoded suppressor of feminization
arose via lineage- specific duplication of a cytokinin response
regulator in kiwifruit[J]. Plant Cell,2018,30(4):780-795.
[35] 陳金焕,田玉如,李艾佳,夏新莉,尹伟伦. 茉莉酸信号及其在
木本植物中的研究进展[J]. 中国科学(生命科学),2020,50
(2):215-226.
CHEN Jinhuan,TIAN Yuru,LI Aijia,XIA Xinli,YIN Weilun.
Jasmonic acid signaling and its research progress in woody
plants[J]. Scientia Sinnica Vitae,2020,50(2):215-226.
[36] BALFAG?N D,SENGUPTA S,G?MEZ-CADENAS A,FRITSCHI
F B,AZAD R K,MITTLER R,ZANDALINAS S I. Jasmonic
acid is required for plant acclimation to a combination of
high light and heat stress[J]. Plant Physiology,2019,181 (4):
1668-1682.
[37] KHAN F S,GAN Z M,LI E Q,REN M K,HU C G,ZHANG J
Z. Transcriptomic and physiological analysis reveals interplay
between salicylic acid and drought stress in citrus tree floral initiation[
J]. Planta,2021,255(1):24.
[38] LI L,LI C Y,HOWE G A. Genetic analysis of wound signaling
in tomato. Evidence for a dual role of jasmonic acid in defense
and female fertility[J]. Plant Physiology,2001,127(4):1414-
1417.
[39] TIAN X J,WANG F,ZHAO Y,LAN T Y,YU K Y,ZHANG L
Y,QIN Z,HU Z R,YAO Y Y,NI Z F,SUN Q X,ROSSI V,
PENG H R,XIN M M. Heat shock transcription factor A1b regulates
heat tolerance in wheat and Arabidopsis through OPR3 and
jasmonate signalling pathway[J]. Plant Biotechnology Journal,
2020,18(5):1109-1111.
[40] 孙军利,赵宝龙,郁松林. 外源水杨酸对高温胁迫下葡萄几种
抗氧化酶活性和抗氧化物含量的影响[J]. 植物生理学报,
2014,50(7):1014-1018.
SUN Junli,ZHAO Baolong,YU Songlin. Effect of exogenous
salicylic acid on antioxidant enzymes activities and antioxidants
contents in grape seedlings under high temperature stress[J].
Plant Physiology Journal,2014,50(7):1014-1018.
[41] JHA U C,NAYYAR H,SIDDIQUE K H M. Role of phytohormones
in regulating heat stress acclimation in agricultural
crops[J]. Journal of Plant Growth Regulation,2022,41(3):1041-
1064.
[42] WANG Z B,LI N,JIANG S,GONZALWZ N,HUANG X H,
WANG Y C,INZ? D,LI Y H. SCFSAP controls organ size by targeting
PPD proteins for degradation in Arabidopsis thaliana[J].
Nature Communications,2016,7(1):11192.
[43] BYZOVA M V,FRANKEN J,AARTS M G,DE ALMEIDAENGLER
J,ENGLER G,MARIANI C,VAN LOOKEREN C
M M,ANGENENT G C. Arabidopsis STERILE APETALA,a
multifunctional gene regulating inflorescence,flower,and ovule
development[J]. Genes & Development,1999,13(8):1002-1014
[44] 夏杨,周佳炜,苏初连,叶子,蒲金基,陈华蕊,张贺. 菠萝Ac-
SAP 转录因子对非生物胁迫和生物胁迫的应答响应[J]. 分子
植物育种,2019,17(3):739-745.
XIA Yang,ZHOU Jiawei,SU Chulian,YE Zi,PU Jinji,CHEN
Huarui,ZHANG He. Response of SAP transcription factor to
abiotic and biotic stress in Ananas comosus[J]. Molecular Plant
Breeding,2019,17(3):739-745.
[45] 韩婕,陈晓慧,申序,李晓斐,林玉玲,吴鹏飞,赖钟雄. 龙眼
SAP-PPD-KIX-TPL 信号途径基因家族的全基因组鉴定与表
达模式[J]. 应用与环境生物学报,2022,28(2):440-450.
HAN Jie,CHEN Xiaohui,SHEN Xu,LI Xiaofei,LIN Yuling,
WU Pengfei,LAI Zhongxiong. Genome-wide identification and
expression pattern of gene family of SAP-PPD-KIX-TPL signal
pathway in Dimocarpus longan Lour.[J]. Chinese Journal of Applied
and Environmental Biology,2022,28(2):440-450.
