含钛高炉渣浸出液中钛的协同萃取分离工艺及机理研究
2023-09-09胡久刚张谌虎
朱 山 ,吴 雨 ,胡久刚 ,张谌虎
(1.六盘水师范学院 化学与材料工程学院,贵州 六盘水 553000;2.中南大学 化学化工学院,湖南 长沙 410083)
钒钛磁铁矿含有大量的铁、钒、钛等有价金属,但存在成分复杂和嵌布粒度细等问题,资源回收利用困难,大量钛资源被丢弃,不仅浪费资源[1],且污染环境[2]。综合利用钒钛磁铁矿的关键在于对钒钛磁铁精矿中的钒、钛、铁进行综合回收利用,提升钛的回收利用率,然而钒钛磁铁矿中钛的回收利用一直是世界性难题,现有钒钛磁铁矿冶炼工艺多为高炉法和非高炉法,对钛的提取利用率低。
湿法处理含钛资源工艺主要为硫酸浸出工艺与盐酸浸出工艺,需要采用萃取剂对浸出液中的钛进行提取。文献中采用的萃取体系主要有TBP-正癸醇、N1923-异戊醇、D2EHPA(P204)+TOPO、N1923 +P204、FH-H2SO4-MIBK 等,均存在萃取平衡时间长(动力学慢)、钛的萃取率低、盐酸浓度高致设备腐蚀、水相和有机相分离困难等问题,限制了工业应用。
通过大量的文献调研可知,萃取剂TBP(磷酸三丁酯) +P204(D2EHPA)协同萃取体系可应用于浸出液中钛的萃取分离,且该萃取体系对于酸性介质中钛的萃取分离富集研究鲜有报道。基于此,本文采用TBP+P204 协同萃取体系对机械活化后的钒钛磁铁矿冶炼渣的浸出液(加入低浓度盐酸)中的钛进行萃取,并对萃取工艺进行优化,还采用斜率法对浸出机理进行探究,以期为实现钒钛磁铁矿冶炼渣中的钛资源的高效资源化提供试验和理论依据。
1 钒钛磁铁矿处理工艺
1.1 火法工艺
1.1.1 高炉法
高炉法是最早用于钒钛磁铁矿处理的工艺,也是迄今为止唯一可实现钒钛磁铁矿高炉渣大规模处理的工艺,基本工艺流程详见图1。由图1 可知,高炉法冶炼钒钛磁铁矿之前,需要经过选矿和磨矿后才能获得钒钛磁铁矿精矿,随后经过球团烧结,最后在1 600 ℃左右的高炉内直接还原熔炼,获得含钒铁水和含钛高炉渣。此工艺可实现铁、钒的回收利用,其中钒的提取率可达到70%以上[3];渣中TiO2含量可达20%~30%,增大了炉渣的黏度,导致高炉强化冶炼困难,而且浪费钛资源[4]。
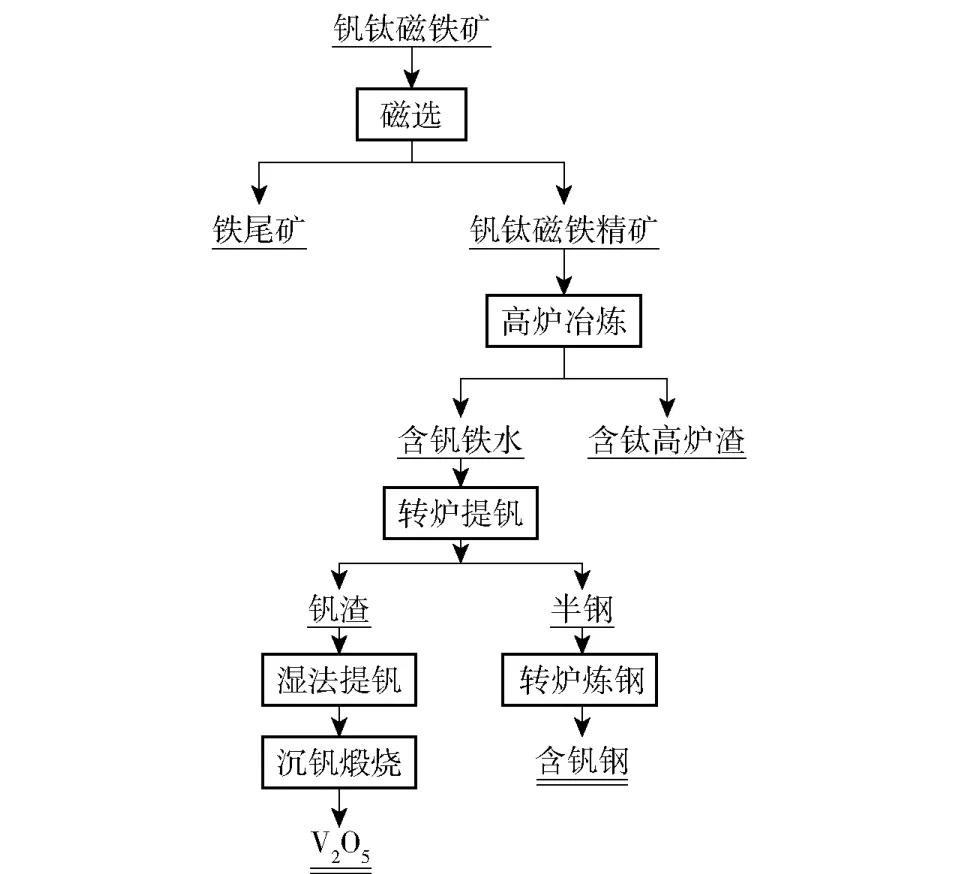
图1 高炉法处理钒钛磁铁矿工艺基本流程Fig.1 Thebasic process flow of vanadium titanium magnetite treatment by blast furnace
1.1.2 预还原-电炉熔分法(非高炉法)
20 世纪50 年代,芬兰开展了预还原-电炉熔分法(非高炉法)用于处理钒钛磁铁矿的研究,并实现了一定规模化生产,基本工艺流程如图2 所示。但是该工艺仍旧未能实现钒钛磁铁矿中钛的直接提取,且存在生产规模较小、技术不成熟的缺点[5]。
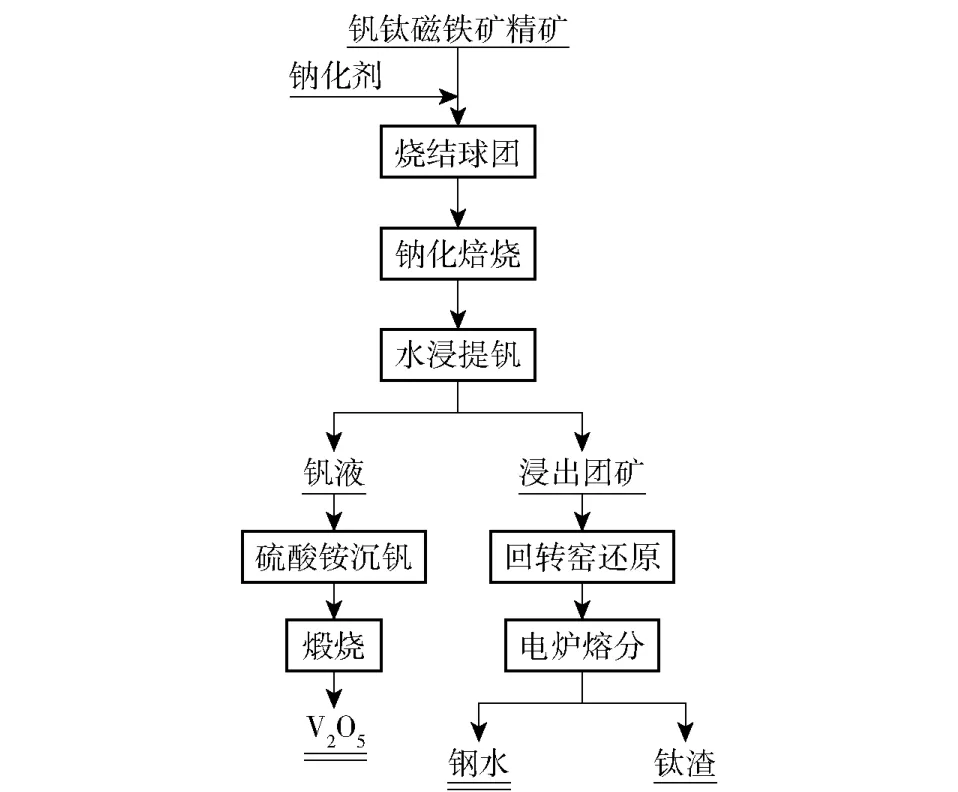
图2 钒钛磁铁矿预还原-电炉熔分提取有价金属工艺基本流程Fig.2 The basic process flow of vanadium titanomagnetite pre-reduction-electric furnace melting and extraction of valuable metals
综上所述,火法工艺处理钒钛磁铁矿存在反应平衡时间长、反应温度高、电消耗量大、生产成本高、有价金属回收率低、环境污染等问题,限制了其在工业上的广泛应用。
1.2 钛的湿法提取工艺
现有的硫酸浸出工艺与盐酸浸出工艺在后续浸出液的净化、分离富集工序存在诸多问题[6]。如毛雪华等[7]采用TBP-正癸醇协同萃取体系,探究了盐酸介质中钛的萃取,并通过红外光谱分析、粒度测定和电导等分析检测方法对萃取工艺进行了优化,萃取条件为盐酸浓度8 mol/L,萃取剂总浓度为0.15 mol/L,经3 级逆流萃取,钛的萃取率仅为50%左右。毛雪华等[8]采用N1923 伯胺类萃取剂和异戊醇所组成的协同萃取体系,对浸出液中的钛进行萃取,研究结果表明,增大盐酸的浓度和加入异戊醇能够提高钛的萃取率,萃取的最佳平衡时间为20 min,最佳萃取温度为室温,在高浓度的盐酸介质中,钛的萃取率达到80%左右。对该方法的萃取体系进行优化,钛的萃取率还会有提升空间。现有的钛萃取体系还有D2EHPA(P204) +TOPO[9]、N1923+P204[10]、FH-H2SO4-MIBK[11]、P507[12]、P204 +EHEHPA[13]、Alamine 336+二甲苯[14]、TBP[15]、P507[16]和P204[17]等,均存在萃取平衡时间长(动力学慢)、钛萃取率低、盐酸浓度高导致设备腐蚀、水相和有机相分相困难等问题,限制了现有溶剂萃取体系的工业应用。
2 试验介绍
2.1 试验原料及试剂
钒钛磁铁矿冶炼渣来自攀钢集团有限公司高炉水碎渣,最佳机械活化条件为球料比20∶1、活化时间170 min、球磨转速400 r/min;所用原料液为活化后的钒钛磁铁矿冶炼渣的盐酸浸出液,浸出条件为盐酸质量分数50%、浸出温度100 ℃、浸出时间120 min、液固比120∶1、搅拌强度600 r/min。
本文中所用萃取剂P204(AR,99%)和TBP(AR,99%)从阿拉丁试剂有限公司购买,稀释剂磺化煤油由重庆浩康医药化工有限公司提供。
2.2 含钛高炉渣浸出液的配制和萃取剂的配制
1)试验原液(水相)的配制。取一定量的浸出液(原始浸出液中钛含量为1.043 g/L)与一定量的盐酸按照一定量的比例进行混合并定容,得到萃取试验原液即水相备用。
2)萃取剂(有机相)的配制。先确定萃取剂总浓度以及P204 和TBP 物质的量比,称取一定质量的P204 和TBP,以磺化煤油为稀释剂,根据试验需要转移到相应容积的容量瓶内定容,摇匀放置备用。
2.3 萃取试验及分析计算方法
2.3.1 萃取试验方法
所有萃取过程在恒温水浴中进行。为了优化P204 和TBP 协同萃取体系的萃取工艺,采用单一变量法先后考察萃取剂摩尔分数及浓度、萃取时间、萃取相比、萃取温度、氯离子浓度对钛萃取率的影响。
2.3.2 计算方法
1)萃取剂摩尔分数的计算。由于萃取体系由P204 和TBP 组成,TBP 在萃取体系中具有重要作用,TBP 的摩尔分数计算公式见式(1)。
式中:X 为TBP 的摩尔分数;A 为TBP 物质的量,mol;B 为P204 物质的量,mol。
2)分配比、萃取率和协萃系数的计算。水相中钛离子浓度可使用电感耦合等离子体发射光谱仪法(即ICP-OES)测定,该法可对金属元素进行定性、定量分析。有机相中的离子浓度根据水相中萃取前后钛浓度的变化采用差减法计算得到。钛离子在有机相和水相中的分配比见式(2),萃取率的计算见式(3),协萃系数计算见式(4)。
式中:D 为协同萃取时的分配系数,即钛在有机相和水相中的浓度之比;X 为协同萃取体系中萃取剂TBP 的摩尔分数,1-X 为P204 的摩尔分数;DTBP为TBP 单独萃取钛时的分配系数;DP204是P204 单独萃取钛时的分配系数。
2.4 P204和TBP 协同萃取体系萃取钛的机理分析方法
萃取机理研究方法一般有饱和容量法、斜率法等。在所用的传统萃取机理研究方法中,斜率法应用最为广泛,该方法根据萃取化学反应的平衡常数测定萃合物的化学计量数。金属钛主要以TiO2+离子形态存在于盐酸浸出液中,萃取反应方程式可以表达为式(5),萃取平衡的表观常数K 可表达为式(6)[18]。
式中:[Cl-]和[TiO2+]分别为水相中氯离子和金属离子浓度;[HA](o)和[HB](o)分别代表有机相中萃取剂TBP 和P204 游离浓度;[[TiOCl2] [HA]x[HB]y](o)代表负载有机相中萃合物浓度;D 为钛离子在两相间的分配比。
对式(6)两边取对数,得式(7)。
若[Cl-]和萃取剂P204 浓度恒定,改变式(7)中萃取剂TBP 的浓度,以lgD 对lg[HA]o作图,应得到一条直线,其斜率等于x;若[Cl-]和萃取剂TBP 的浓度恒定,改变萃取剂P204 的浓度,以lgD对lg[HB]o作图,也应得到一条直线,其斜率为y。求得待定常数x、y,即可得出负载有机相中钛萃合物的组成。
3 结果与讨论
3.1 萃取剂的物质的量比及萃取剂总浓度对钛萃取分配比的影响
以机械活化后钒钛磁铁矿冶炼渣盐酸浸出液为萃取原料(水相),恒定萃取过程中有机相与水相的萃取相比(O/A)为1 ∶1,在水相氯离子浓度为8 mol/L的条件下,于30 ℃的恒温水浴中进行萃取10 min,取萃取剂的总浓度分别为0.15 mol/L 和1.5 mol/L,改变协同萃取体系中TBP 的摩尔分数,以考察萃取剂的总浓度和协同萃取剂之间的物质的量比对钛萃取分配比的影响,试验结果如图3 所示。
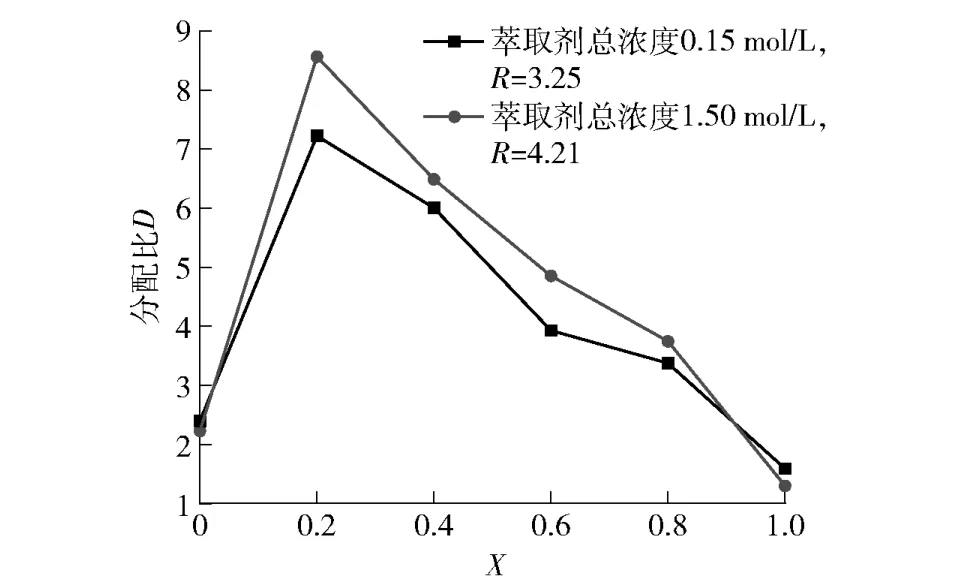
图3 协同萃取剂中萃取剂的摩尔分数及萃取剂总浓度对钛萃取分配比的影响Fig.3 The effects of the molar fraction of extractant and the total concentration of extractant in the synergistic extractant on the extraction partition ratio of titanium
由图3 可知,当萃取剂P204 和TBP 的总浓度CTBP+CP204=0.15 mol/L 时,钛的萃取分配比随着协同萃取体系中TBP 的摩尔分数的增大,先呈现增大随后又逐渐减小的趋势,当TBP 的摩尔分数为0.2时,萃取分配比达到最大值;当CTBP+CP204=1.5 mol/L 时,变化规律与CTBP+CP204=0.15 mol/L时相似,但分配比略有增加。当CTBP+CP204=0.15 mol/L 时,协萃系数,当CTBP+CP204=1.5 mol/L 时,协萃系数 R=从图3 中可以看出,萃取剂的总浓度越大,钛的萃取分配比越大。这是因为当浓度增大,有机相中可以参加萃取反应(配位或离子交换)的萃取剂分子数量增加,即钛的饱和萃取容量随着萃取剂浓度增大而增大,提高钛的萃取率,从而钛的萃取分配比也显著提高。当TBP 或P204 单独萃取钛时,萃取分配比均较小,而TBP 和P204 组成的协同萃取体系对钛的萃取分配比显著增大,能够对钛的萃取产生正协同效应,提高钛的萃取分离效果。虽然萃取剂总浓度增大,钛的萃取分配比有所增加,但增加幅度并不大,萃取剂的消耗量成倍增加,反而大幅增加了生产成本。因此,综合考虑萃取分离效果和经济成本,本文选择最佳的萃取剂总浓度为0.15 mol/L,TBP 摩尔分数选择0.2。
3.2 萃取平衡时间对钛萃取率的影响
以机械活化后钒钛磁铁矿冶炼渣盐酸浸出液为萃取原料(水相),在30 ℃的恒温水浴中磁力搅拌,恒定萃取过程中有机相与水相的萃取相比(O/A)为1∶1、萃取剂总浓度CTBP+CP204=0.15 mol/L、协同萃取体系中TBP 的摩尔分数为0.2、水相氯离子浓度为8 mol/L,在不同萃取平衡时间条件下进行萃取,考察萃取平衡时间对钛萃取率的影响。试验结果如图4 所示。
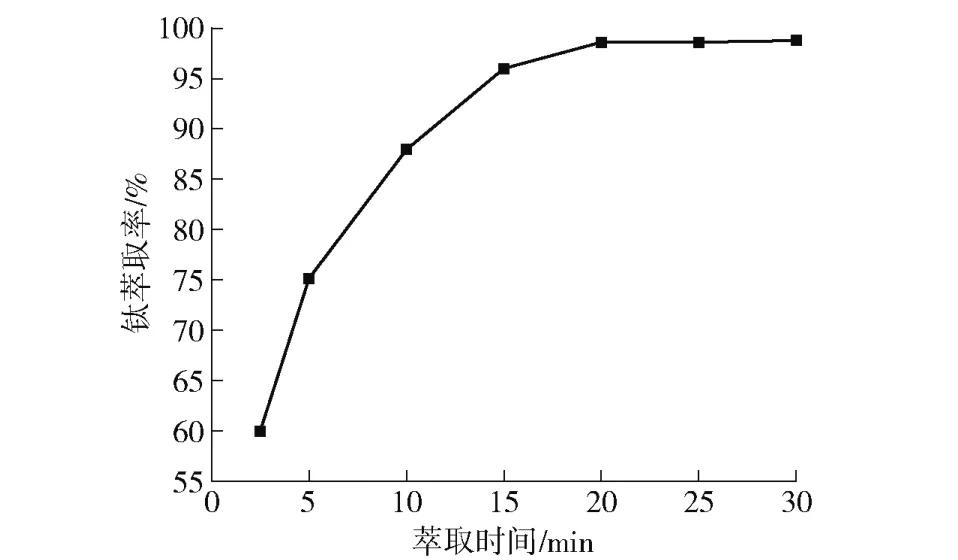
图4 萃取时间对钛萃取率的影响Fig.4 The effects of extraction equilibrium time on extraction rate of titanium
从图4 看出,钛的萃取率随着萃取时间的增加呈整体增大的趋势,前期的快速增长,后期趋于平缓。当萃取平衡时间为3~20 min 时,钛的萃取率随时间上升十分明显,20 min 后钛的萃取率基本没有变化。因此,为了提高钛的萃取率和生产效率,本文选择最佳的萃取平衡时间为20 min,此时钛的萃取率达到98%以上。
3.3 萃取相比对钛萃取率的影响
以机械活化后钒钛磁铁矿冶炼渣盐酸浸出液为萃取原料(水相),恒定萃取剂总浓度CTBP+CP204=0.15 mol/L、协同萃取体系中TBP 的摩尔分数为0.2、水相氯离子浓度为8 mol/L、萃取平衡时间为20 min,在不同萃取相比的条件下,于30 ℃的恒温水浴中进行萃取,考察萃取相比对钛萃取率的影响,试验结果如图5 所示。
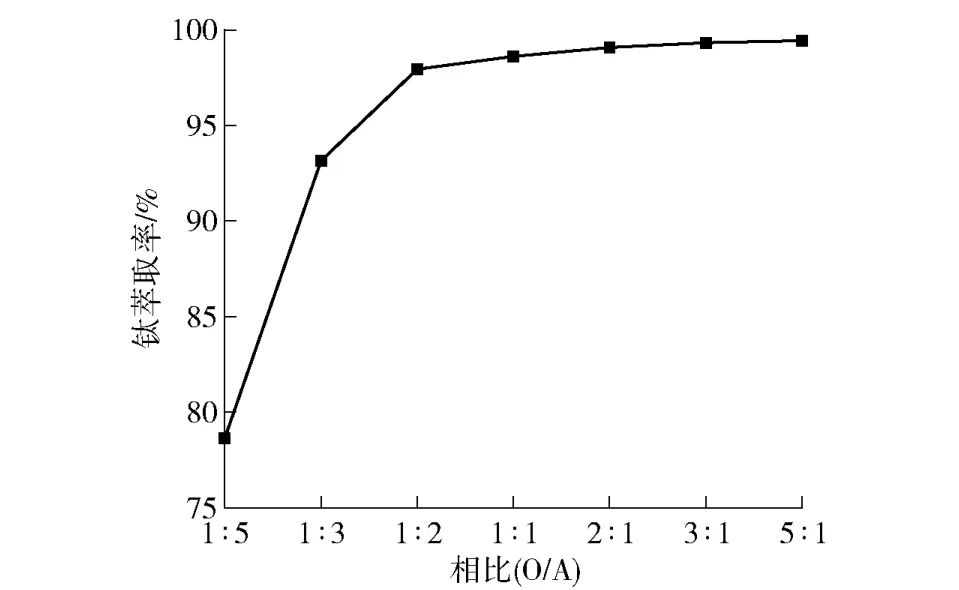
图5 萃取过程中相比(O/A)对钛萃取率的影响Fig.5 The effect of phase ratio (O/A) on titanium extraction rate during extraction
由图5 可以看出,随着萃取相比(O/A)的增大,钛的萃取率也逐渐增大。当相比O/A 为1∶5~1∶1时,钛的一级萃取率直线上升,之后再增大相比O/A,钛的一级萃取率虽然也呈现增大的趋势,曲线平缓,即增大幅度较小。这是由于随着相比O/A 的增大,有机相中能够与含钛离子(TiO2+)参与反应的萃取剂分子也逐渐增多,即能够萃取更多的TiO2+;当相比O/A 达到1∶1后,由于水相中的TiO2+有限,继续增大意义不大,一级萃取率增大幅度减小,且过高的相比O/A 会导致更多萃取剂的消耗,增加了生产成本。当相比O/A=1∶1时,钛的一级萃取率已达到98.63%,因此,综合考虑萃取分离效果和经济成本,选择萃取过程中有机相与水相的最佳相比(O/A)为1∶1。
3.4 萃取温度对钛萃取率的影响
萃取是通过金属离子与萃取剂分子之间通过配位、离子交换等实现的,其实质是化学反应过程,而温度对化学反应平衡和速率有重要的影响。以机械活化后钒钛磁铁矿冶炼渣盐酸浸出液为萃取原料(水相),恒定萃取剂总浓度 CTBP+CP204=0.15 mol/L、协同萃取体系中TBP 的摩尔分数为0.2、水相氯离子浓度为8 mol/L、萃取平衡时间为20 min、萃取相比O/A 为1∶1,在不同温度的恒温水浴中进行萃取,考察萃取温度对钛萃取率的影响。试验结果如图6 所示。
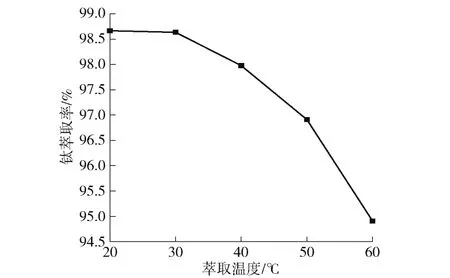
图6 萃取温度对钛萃取率的影响Fig.6 The effect of extraction temperature on extraction rate of titanium
由图6 可知,钛的萃取率随着萃取温度的升高显著下降,出现该现象的原因是由于该协萃体系萃取钛时是一个放热反应,这与文献中的报道是一致的[19]。温度升高,化学反应速率提高,温度越低,化学反应速率越低;同时,升高温度能够显著降低有机相和水相之间的表面张力,从而缩短萃取澄清分离的时间,以达到工业生产澄清速率的要求,有助于提高工业生产效率。且萃取温度从20 ℃升高的30 ℃,钛的萃取率仅从98.66% 降低到98.63%。因此,本文综合考虑萃取温度对萃取平衡时间、萃取效率和后续的澄清分离速率等因素,选择最佳萃取温度为30 ℃。
3.5 氯离子浓度对钛萃取性能的影响
以机械活化后钒钛磁铁矿冶炼渣盐酸浸出液为萃取原料(水相),恒定萃取剂总浓度CTBP+CP204=0.15 mol/L、协同萃取体系中TBP 的摩尔分数为0.2、萃取平衡时间为20 min、有机相与水相的萃取相比O/A 为1∶1,于30 ℃的恒温水浴中进行萃取,改变水相中氯离子总浓度,考察萃取原料(水相)中氯离子总浓度对钛萃取率的影响,试验结果如图7所示。
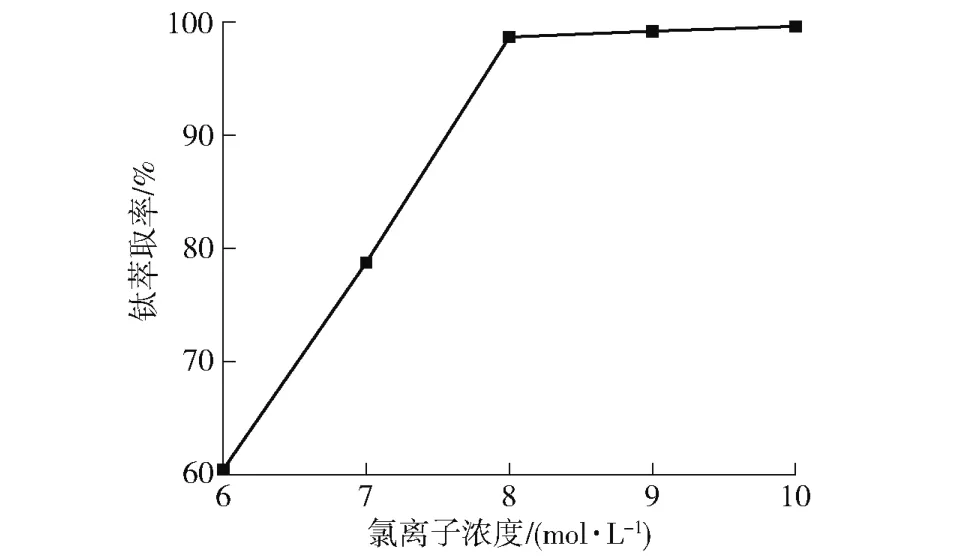
图7 水相中氯离子浓度对钛萃取率的影响Fig.7 The effect of chloride ion concentration in aqueous phase on extraction rate of titanium
由图7 所示,钛的萃取率随着水相中氯离子总浓度的增加而呈逐渐增大的趋势。以P204 和TBP组成的协萃体系萃取浸出液中的钛时,当水相中氯离子总浓度为6~8 mol/L 时,钛的萃取率随着水相中氯离子总浓度变化呈线性增大;当氯离子浓度大于8 mol/L后,继续增大水相中氯离子总浓度,钛的萃取率增幅减小,钛萃取率随氯离子浓度增大趋于平缓。原因可能是由于水相氯离子总浓度小于8 mol/L 时,水相总的含钛离子主要以游离的TiO2+存在,含钛离子以TiOCl2的形态进入萃合物中,因此萃取剂对钛的萃取能力随着氯离子浓度的增加而提高;水相氯离子总浓度大于8 mol/L 时,溶液中的TiO2+与水相中的Cl-形成一系列的配合物离子,水相的中钛主要以等形式存在[7],降低了TiO2+的活度,从而影响了钛的萃取。所以在含钛溶液中应适当升高氯离子的浓度,利于钛的萃取。当氯离子浓度过高时,钛萃取率增长趋缓,而且加入过多盐酸,造成资源的浪费,且增加了后续含氯废水的处理负担,经济成本增大。综上,选择最佳的氯离子总浓度为8 mol/L,此时钛的萃取率达到99%左右。
4 钛协同萃取机理验证
4.1 P204 浓度对钛萃取分配比的影响
以机械活化后钒钛磁铁矿冶炼渣盐酸浸出液为萃取原料(水相),恒定有机相和水相的相比(O/A)为1∶1、萃取时间为20 min、水相中氯离子总浓度为8 mol/L,于30 ℃的恒温水浴锅中进行萃取。当萃取剂TBP 的浓度为0.15 mol/L 时,改变P204 的浓度,考察P204(HB)浓度对钛萃取分配比的影响,结果如图8 所示。
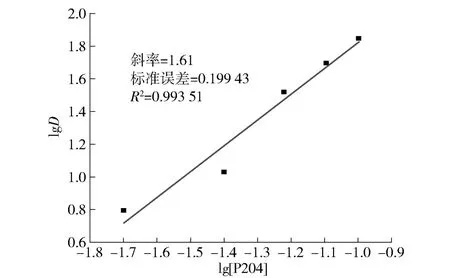
图8 P204 浓度对钛萃取分配比的影响Fig.8 The effect of P204 concentration on titanium extraction partition ratio
由图8 可以看出,以lgD 对lg[P204]作图,经线性拟合,其斜率为1.61,约等于2,表明萃合物分子中1 个含钛离子(TiO2+)与2 个P204 分子结合。
4.2 TBP 浓度对钛萃取分配比的影响
以机械活化后钒钛磁铁矿冶炼渣盐酸浸出液为萃取原料(水相),恒定有机相和水相的相比(O/A)为1∶1、萃取时间为20 min、水相中氯离子总浓度为8 mol/L,于30 ℃的恒温水浴锅中进行萃取。当萃取剂P204 的浓度为0.15 mol/L 时,改变TBP 的浓度,考察TBP 浓度对钛萃取分配比的影响,结果如图9 所示。
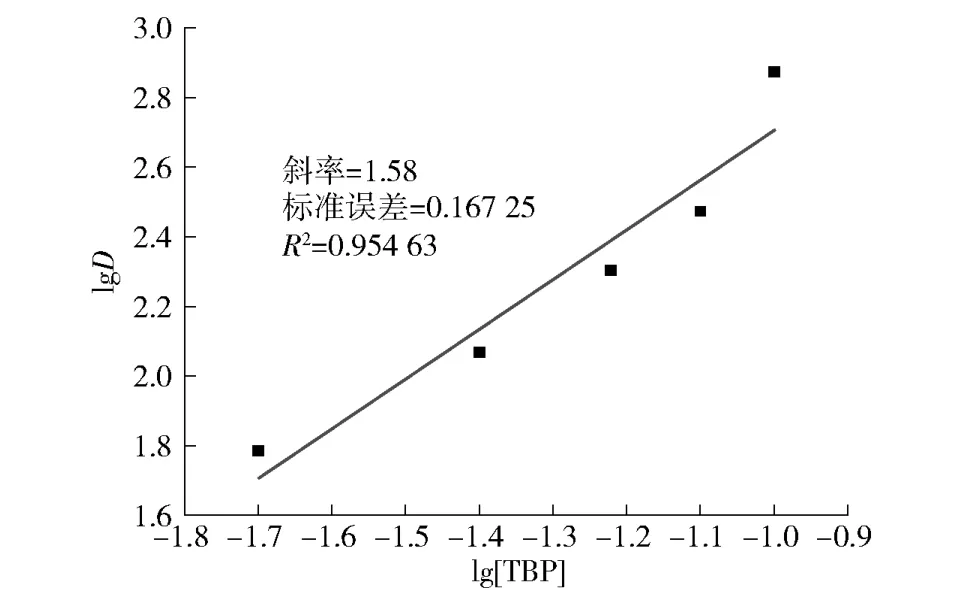
图9 TBP 浓度对钛萃取分配比的影响Fig.9 The effect of P204 concentration on titanium extraction partition ratio
由图9 可以看出,以lgD 对lg[TBP]作图,经线性拟合,其斜率为1.58,约等于2,表明萃合物分子中1 个含钛离子(TiO2+)与2 个TBP 分子结合。
4.3 验证结果
结合水相氯离子总浓度对钛萃取率的影响,表明萃取过程为溶剂化萃取机理,含钛离子以TiOCl2的形态进入萃合物中,得出P204 和TBP 协同萃取盐酸介质中的含钛离子(TiO2+)时,其萃合物组成可能为(TiOCl2)(HA)2(HB)2,其萃取化学反应式可改写为式(8)。
5 结论
以萃取剂P204 和磷酸三丁酯(TBP)组成的协同萃取体系,对钒钛磁铁矿高炉渣盐酸浸出液中钛进行萃取,通过考察萃取剂TBP 和P204 的物质的量比、萃取时间、萃取温度、萃取相比(O/A)、原料液中氯离子总浓度等因素对钛萃取率的影响,优化该萃取体系的萃取工艺条件,并采用斜率法对其萃取机理进行初步探究,得到如下结论。
1)TBP 或P204 单独萃取钛时,钛的萃取率均较低;当协同萃取体系中萃取剂的总浓度CTBP+CP204=0.15 mol/L,且TBP 的摩尔分数为0.2 时,钛的萃取率达到98%以上。
2)P204 和TBP 协同萃取体系萃取钛时,其最佳萃取工艺条件为萃取相比O/A 为1∶1、萃取时间为20 min、萃取温度为30 ℃、水相氯离子总浓度为8 mol/L。
3)P204 和TBP 协同萃取体系萃取钛的反应式是一个放热反应,萃取机理为溶剂化萃取,含钛离子以TiOCl2的形态进入萃合物中,结合斜率法研究结果,得出其萃合物组成可能为(TiOCl2)(HA)2(HB)2,其萃取化学反应式可以改写为:TiO2++2HA+2HB+2Cl-→(TiOCl2)(HA)2(HB)2。
