白城小黑杨遗传转化体系建立及其应用
2023-09-09何旭高源张群野周晨光李伟李爽
何旭 高源 张群野 周晨光 李伟 李爽
(东北林业大学林木遗传育种全国重点实验室,哈尔滨 150040)
杨树因其营养繁殖能力强,生长速度快,被广泛应用于制浆造纸工业,是我国重要的生态经济林栽培树种[1]。杨树品种众多,小黑杨(Populus simonii×P.nigra)具有较强的耐贫瘠、耐胁迫等优良特性[2]。经过长时间的种植选育,不同地区又形成了各具特色并更适应当地环境条件的不同类型小黑杨。其中,白城小黑杨(P.simonii×P.nigra‘Baicheng’)生长迅速,材性优良,对病虫害等生物胁迫以及寒害、干旱、盐碱等非生物胁迫具有极强的耐受性,在吉林、黑龙江等地区被广泛种植[3]。
随着现代基因工程技术的不断发展,组织培养和遗传转化已成为解析基因功能、克服木本植物育种困难、改良林木优良遗传性状的主要技术手段[4-5]。根据已有的以小黑杨叶片为材料的组织培养体系可将整个过程分为不定芽分化培养、丛生苗抽茎诱导、生根诱导3 个阶段[6]。不定芽分化培养通常选择植物激素6-BA(0.25~1.00 mg·L-1)和NAA(0.02~0.10 mg·L-1),丛生苗抽茎诱导通常选择6-BA(0.1~0.5 mg·L-1)和NAA(0.02~0.10 mg·L-1),生根诱导通常选择IBA(0.1~0.4 mg·L-1)和NAA(0.10~0.25 mg·L-1)。这些已有的针对植物激素种类及浓度2 方面的经验是建立更高效的组织培养体系非常有用的参考依据。在遗传转化方面,小黑杨作为黑杨派的杂交杨树,遗传转化较为困难,转化效率一般为1%左右,且目前关于遗传转化报道主要是通过叶盘法进行[7]。然而,目前还鲜见针对白城小黑杨遗传转化体系的相关报道。
本研究前期参考小黑杨已建立的组织培养体系对小黑杨、白城小黑杨和以长春小黑杨(P.simonii×P.nigra‘Changchun’)为母本、新疆阿勒泰欧洲黑杨(P.nigra)为父本杂交而形成的白林三号小黑 杨(P.simonii×P.nigra‘Bailin-3’)进 行 了 培养[6,8]。结果发现,小黑杨可以正常实现芽的分化和生根,且分化、生根效率较高;而白城小黑杨和白林三号小黑杨不能实现离体再生,并且这2种小黑杨在相同培养条件下的分化、抽茎、生根情况均不相同。由此推测,不同类型小黑杨需要不同组织培养条件实现其离体再生。此外,小黑杨遗传转化效率较低是一直以来难以克服的障碍,目前为止还没有适用于白城小黑杨的组织培养和遗传转化体系。这些技术限制严重制约着小黑杨高抗、优质林木新品种的创制[7,9]。因此,开发高效的、树种类型针对性强的组织培养及遗传转化体系,挖掘优良性状关键候选基因,是通过基因工程手段培育优质林木种质的关键途径。
本研究将以白城小黑杨组培苗茎段为外植体,从激素种类及浓度方面进行不定芽分化、丛生苗抽茎、生根诱导的培养条件摸索,建立适用于白城小黑杨的组织培养体系。并在此基础上,建立适用于该树种的农杆菌(Agrobacterium tumefaciens)介导的遗传转化体系。已有的研究表明,毛果杨(P.trichocarpa)PtrLBD39 转录因子是响应应拉木形成的关键因子[10]。本研究将利用建立的遗传转化体系创制该转录因子过量表达的白城小黑杨植株,验证遗传转化体系的可应用性的同时也为基因功能及作用机制的解析提供重要的遗传材料。
1 材料与方法
1.1 试验材料
试验材料为白城小黑杨组培苗,为东北林业大学林木遗传育种全国重点实验室赵曦阳教授惠赠。组培条件为:温度23~25 ℃,光强约40 μmol·m-2·s-1,光周期为16 h光照/8 h黑暗。
1.2 白城小黑杨组织培养各阶段培养基筛选
1.2.1 分化培养基筛选
以白城小黑杨组培苗的第2~3 节茎段作为外植体,剪取长度0.5~1.0 cm,以MS作为基本培养基(MS+30 g·L-1蔗糖+7 g·L-1琼脂,pH=5.8),挑选不同植物生长调节剂(PGRs):6-BA、NAA 和TDZ 诱导白城小黑杨不定芽的增殖分化,生长素NAA 质量浓度保持不变(0.1 mg·L-1),设置不同质量浓度细胞分裂素6-BA(0.1、0.2、0.3、0.4、0.5 mg·L-1)并在0.5 mg·L-16-BA 基 础 上 添 加0.001 mg·L-1TDZ共6 个试验处理,每个处理3 个培养皿,每个培养皿接种9 个茎段外植体,每个处理重复3 次,接种30 d后统计外植体不定芽的分化率。
1.2.2 抽茎培养基筛选
将诱导出的长约1.0 cm 不定芽接种到含细胞分裂素6-BA(0.1、0.2 mg·L-1)和生长素NAA(0.10、0.05 mg·L-1)共4 个处理的MS 基本培养基(MS+25 g·L-1蔗糖+7.15 g·L-1琼脂,pH=5.8)中进行茎的诱导。每个处理接种10 瓶,每瓶接种3 个不定芽,每个处理重复3次,接种30 d后统计不定芽抽茎的增值系数。
1.2.3 生根培养基的筛选
剪取1.5 cm 抽茎丛生苗的顶芽接种到含有不同 浓 度 生 长 素IBA(0.1、0.2、0.3、0.4 mg·L-1)及NAA(0、0.02 mg·L-1)的1/2 MS 培 养 基(1/2 MS+20 g·L-1蔗糖+5.5 g·L-1琼脂,pH=5.8)中诱导生根,共8个处理,每个处理接种20瓶,每瓶接种2株,每个处理重复3 次,接种25 d 后统计丛生苗的生根率。
1.3 白城小黑杨遗传转化体系建立
1.3.1 卡那霉素浓度筛选
为了确定农杆菌介导的遗传转化过程中卡那霉素的适宜浓度,在含有不同浓度梯度(0、10、20、30、40 mg·L-1)卡那霉素的最佳分化培养基中对白城小黑杨组培苗的茎段外植体进行卡那霉素敏感性的测定,共6个处理,每个处理接种3个培养皿,每个培养皿接种6 个外植体,每个处理重复3 次。接种4周后观察每个处理中不定芽的情况。
1.3.2 侵染时间筛选
将农杆菌菌液侵染过程时间设置为10、20、30 min 3 个处理,每个处理侵染50 个茎段外植体,每个处理重复3 次,统计选择培养产生抗性芽的数量。
1.3.3 农杆菌介导的白城小黑杨遗传转化体系优化
参考农杆菌介导的毛果杨遗传转化方案[11],对白城小黑杨遗传转化体系进行摸索。选择生长25 d 左右健壮的白城小黑杨组培苗的第2~3 节茎段作为外植体进行后续遗传转化。利用EHA105农杆菌感受态细胞、含有β-葡萄糖苷酸酶基因(GUS)报告基因的pBI121 植物表达载体质粒(pBI121-35S:GUS)、pBI121-35S:PtrLBD39 载体进行后续遗传转化体系建立。
农杆菌菌液制备:12:00对含有转化载体的农杆菌菌液进行划线培养;2 d 后17:00 挑取农杆菌菌落单克隆接种于含有20 mg·L-1利福平和20 mg·L-1卡那霉素的20 mL YEP 液体培养基(5 g·L-1氯化钠、16 g·L-1胰蛋白胨和10 g·L-1酵母提取物),28 ℃、180 r·min-1条件下培养约13 h至OD600≈0.90~1.10;将农杆菌菌液吸取1.5 mL转移至含有20 mg·L-1利福平和20 mg·L-1卡那霉素的50 mL YEP 液体培养基再次培养至OD600≈0.60;4 ℃、2 200 r·min-1离心10 min 进行菌体收集;将农杆菌菌体用30 mL悬 浮 液(1/2 MS+20 g·L-1蔗 糖+80 μmol·L-1AS,pH=5.2)悬浮稀释OD600≈0.40~0.45。
侵染、共培养、脱菌及选择培养:将切好的1 cm左右外植体茎段放进农杆菌悬浮液进行侵染,随后将其接种于共培养培养基中(含有80 μmol·L-1AS 的最佳分化培养基,pH=5.2)在黑暗条件下共培养48 h;共培养结束后用含有250 mg·L-1的头孢霉素的100 mL 无菌水清洗茎段外植体5 min,再用100 mL 无菌水清洗2 次,每次3 min,最后将用滤纸干燥后的茎段外植体接种于选择培养基中(含有30 mg·L-1卡那霉素和250 mg·L-1头孢霉素的最佳分化培养基,pH=5.8)进行抗性芽的筛选。
抽茎及生根筛选:选择培养基培养大约30 d后,将长有抗性芽的茎段外植体接种到抗性抽茎培养基中(含有20 mg·L-1卡那霉素和125 mg·L-1头孢霉素的最佳抽茎培养基,pH=5.8)诱导抽茎;在抗性抽茎培养基筛选15~30 d后,将抽出明显茎干的抗性芽接种到抗性生根培养基中(含有10 mg·L-1卡那霉素和100 mg·L-1头孢霉素的最佳生根培养基,pH=5.8);大约10 d 后能够看到植株生根的情况,待生根半个月后进行转基因植株的鉴定。
1.3.4 转基因植株的鉴定
GUS 染色:分别对转化的pBI121-35S:GUS 抗性生根植株以及白城小黑杨WT 野生型用GUS 染液进行染色及观察,并计算转化效率。
DNA 水平鉴定:剪取遗传转化的pBI121-35S:GUS 及pBI121-35S:PtrLBD39 白城小黑杨抗性生根苗的第3 片叶子提取基因组DNA,进行PCR 扩增鉴定(表1)。

表1 引物序列Table 1 Primer sequences
1.4 数据处理
数据分析采用SPSS 17.0 中的Duncan 多重检验对白城小黑杨不定芽再生率、抽茎增殖系数、生根率、阳性芽产生率进行差异显著性分析,P<0.05在统计学上具有显著差异。
2 结果与分析
2.1 白城小黑杨离体再生体系优化
2.1.1 白城小黑杨不定芽的诱导
以白城小黑杨茎段为外植体,MS 作为基本培养基(MS+30 g·L-1蔗糖+7 g·L-1琼脂,pH=5.8),选择3 种植物生长调节剂(6-BA、TDZ、NAA)分析不同生长调节剂下白城小黑杨茎段分化培养30 d 后不定芽的再生情况(表2)。结果表明,当生长素NAA 质量浓度不变时,持续增加细胞分裂素6-BA的质量浓度,白城小黑杨不定芽的分化程度随着6-BA 质量浓度的增加而提高(见图1A~E)。TDZ已被证明在较低的质量浓度下能够促进不定芽再生,并且芽再生的效率比其他细胞分裂素更高,但过量使用TDZ 则会对植物产生毒害作用[12]。当保持0.5 mg·L-16-BA 和0.1 mg·L-1NAA 质量浓度不变时,添加0.001 mg·L-1的TDZ,与处理5 相比,加入TDZ 后不定芽的分化率从86.4%增加到92.6%,并且处理6 的不定芽更茂密(见图1F),因此白城小黑杨不定芽诱导的最佳分化培养基为:MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA+0.001 mg·L-1TDZ。
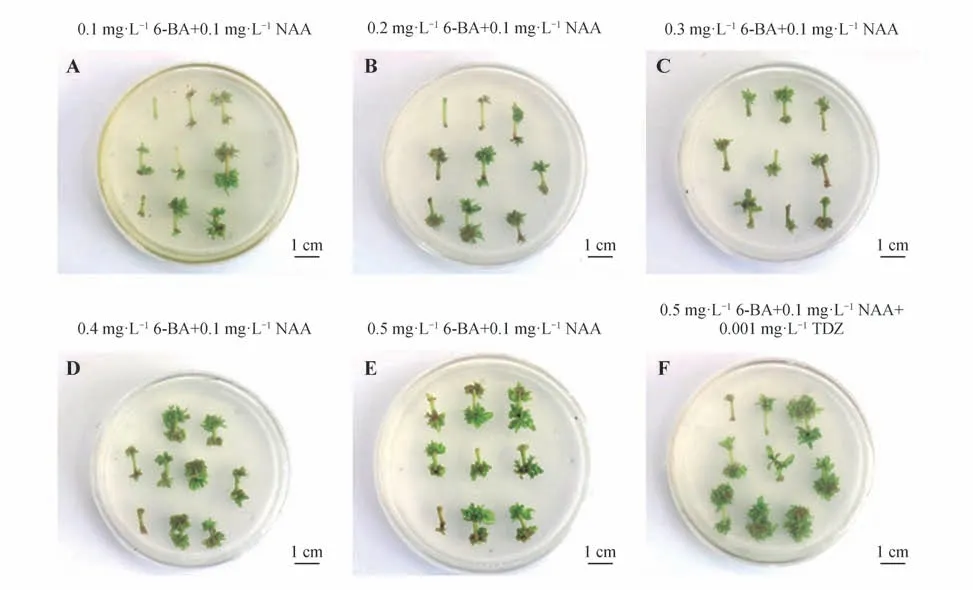
图1 不同激素处理下白城小黑杨茎段不定芽的再生Fig.1 Adventitious bud regeneration from stem of P.simonii×P. nigra ‘Baicheng’under different hormone treatments

表2 植物生长调节剂对白城小黑杨茎段不定芽再生率的影响Table 2 Effects of plant growth regulators(PGRs)on adventitious bud regeneration frequency from the stem of P.simonii×P. nigra ‘Baicheng’
2.1.2 白城小黑杨丛生苗抽茎的诱导
外植体经过分化诱导获得的不定芽多数没有明显的茎,需要诱导出明显的茎方可进行后续培养。有研究表明,TDZ 对于植物不定芽茎的伸长生长有一定的抑制作用[13]。因此,在白城小黑杨丛生芽抽茎诱导阶段本研究仅考虑了6-BA 和NAA。将生长健壮的不定芽接种至含有不同浓度外源激素的抽茎诱导培养基中,培养30 d 后统计其增殖系数。结果表明:细胞分裂素6-BA 质量浓度保持不变时,配合较低质量浓度的生长素NAA能够提高外植体的抽茎增殖系数;而当生长素NAA 质量浓度保持不变时,适量提高细胞分裂素6-BA的质量浓度也可以提高丛生不定芽的抽茎增殖系数(表3)。处理3 的平均抽茎系数可以达到6.5,显著高于其他处理,抽茎程度及长势均优于其他处理(见图2)。因此白城小黑杨抽茎培养基为:MS+0.2 mg·L-16-BA+0.05 mg·L-1NAA。

图2 不同激素处理下白城小黑杨丛生苗的抽茎诱导Fig.2 Stem induction of clustered plantlets of P.simonii×P. nigra ‘Baicheng’under different hormone treatments

表3 植物生长调节剂对白城小黑杨抽茎增殖系数的影响Table 3 Effects of plant growth regulators(PGRs)on stem proliferation coefficient of P.simonii×P.nigra ‘Baicheng’
2.1.3 白城小黑杨丛生苗的生根诱导
将已经抽茎且生长健壮的丛生苗的顶芽接种到含有不同质量浓度生长素IBA 和NAA 的生根培养基中,生根培养25 d 后统计各个处理的生根率。结果表明:不同外源激素处理下白城小黑杨幼苗均可以生根,生根率为72.5%~100.0%。当生长素NAA 质量浓度保持不变时,生根率随着IBA 质量浓度的增加而增加;与同时使用IBA 和NAA 2 种激素处理相比,仅使用IBA 处理的生根率均高于同时使用这2 种生长素的生根率,处理8 使用0.4 mg·L-1的IBA 处理,生根率可以达到100%(见表4),并且该处理的根长和根的数量也要优于其他处理(见图3)。因此白城小黑杨最佳生根培养基为:1/2 MS+0.4 mg·L-1IBA。

图3 不同激素处理下白城小黑杨丛生苗的生根诱导Fig.3 Rooting induction of clustered plantlets of P.simonii × P. nigra cv.‘Baicheng’under different hormone treatments A.1.0.1 mg·L-1 IBA;1+.0.1 mg·L-1 IBA+0.02 mg·L-1 NAA;2.0.2 mg·L-1 IBA;2+.0.2 mg·L-1 IBA+0.02 mg·L-1 NAA;B.3.0.3 mg·L-1 IBA;3+.0.3 mg·L-1 IBA+0.02 mg·L-1 NAA;4.0.4 mg·L-1 IBA;4+.0.4 mg·L-1 IBA+0.02 mg·L-1 NAA
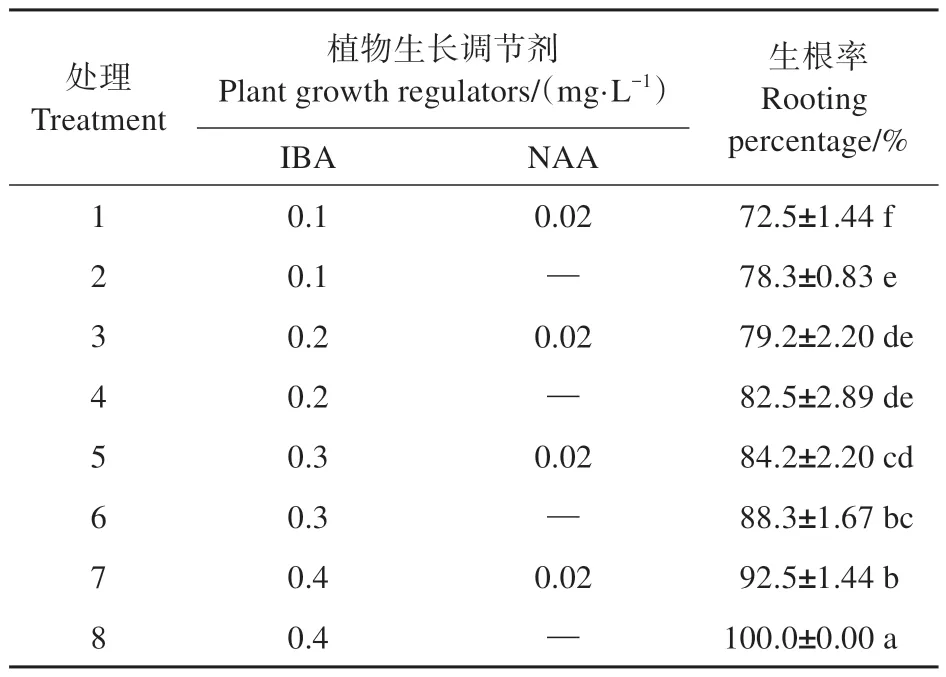
表4 植物生长调节剂对白城小黑杨生根率的影响Table 4 Effects of plant growth regulators(PGRs)onrooting rate of P.simonii×P. nigra ‘Baicheng’
综上所述,本研究以白城小黑杨组培苗茎段为外植体,成功建立了有效的组织培养体系。包括 不 定 芽 的 诱 导(30 d,MS+0.5 mg·L-16-BA+0.1 mg·L-1NAA+0.001 mg·L-1TDZ)、不定芽抽茎诱 导(15~30 d,MS+0.2 mg·L-16-BA +0.05 mg·L-1NAA)、生根诱导(25 d,1/2 MS+0.4 mg·L-1IBA)3个过程(见图4)。

图4 白城小黑杨茎段外植体的组织培养过程A.不定芽诱导4周;B.抽茎诱导30 d;C~D.生根诱导25 dFig.4 Tissue culture processes of P.simonii×P. nigra‘Baicheng’stem A.Adventitious bud induction for four weeks;B.Stem induction for 30 d;C-D.Rooting induction for 25 d
2.2 白城小黑杨遗传转化体系建立
2.2.1 卡那霉素及侵染时间筛选
为了确定白城小黑杨用于遗传转化的卡那霉素最适质量浓度,将白城小黑杨茎段外植体接种到含有不同质量浓度卡那霉素的最佳分化培养基中培养30 d。结果表明:白城小黑杨茎段外植体对卡那霉素较为敏感,随着卡那霉素质量浓度的增加,茎段外植体的分化程度随之降低,当卡那霉素质量浓度为30 mg·L-1时能够完全抑制其不定芽的生长,因此白城小黑杨茎段外植体用于遗传转化的卡那霉素临界质量浓度为30 mg·L-1(见图5)。

图5 不同质量浓度卡那霉素下茎段分化情况Fig.5 Differentiation of stem explants under different concentrations of kanamycin
基于以上培养条件的优化,利用根癌农杆菌菌株选择琥珀碱型C58背景的EHA105农杆菌菌株通过遗传转化pBI121-35S:GUS对白城小黑杨遗传转化体系进行建立,该载体由35S组成型启动子介导过量表达β-葡萄糖苷酸酶基因(GUS)。由于农杆菌侵染时间是植物遗传转化过程中非常重要的因素之一,侵染时间太短会导致农杆菌无法将T-DNA 插入到植物的基因组中,侵染时间过长则会引起农杆菌的毒害作用影响植株分化效率。经过对比不同侵染时间对分化效率的影响发现,当农杆菌侵染时间为10、30 min 时,GUS 染色鉴定出的阳性芽产生率较低,分别为8.0%和6.7%,而当农杆菌侵染20 min 时,阳性芽产生率为13.3%,显著高于其他2个处理(见表5)。因此,白城小黑杨遗传转化最适农杆菌侵染时间为20 min。
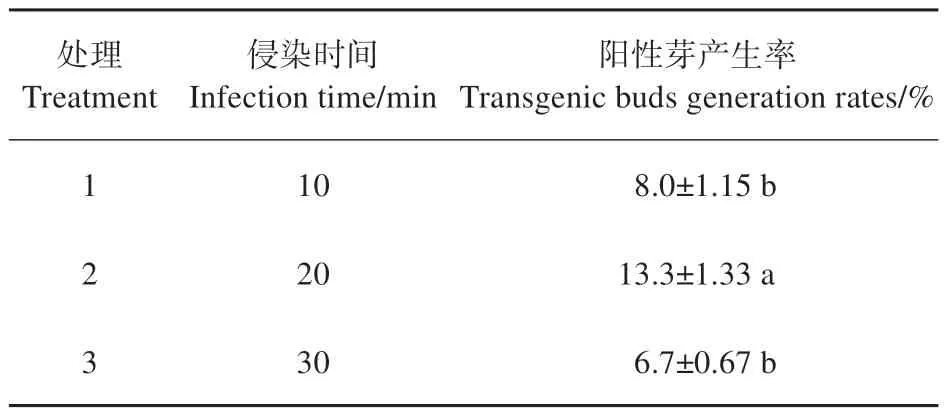
表5 侵染时间对阳性芽产生率的影响Table 5 Effects of infection time on transgenic buds generation rates
2.2.2 pBI121-35S:GUS遗传转化及鉴定
白城小黑杨遗传转化流程如图6所示,农杆菌菌液侵染后共培养2 d,头孢水脱菌后将外植体接种到选择培养基中直接诱导抗性芽,大约30 d 后可以看到茎段外植体两端伤口处分化出抗性芽,剪取抗性芽至抗性抽茎培养基中抽茎诱导15~30 d后,将已经抽茎的抗性丛生苗接种至抗性生根培养基中,抗性苗生根诱导10 d 可以观察到生根情况,诱导25 d 后对抗性植株进行GUS 染色及PCR鉴定(图7)。

图6 白城小黑杨遗传转化流程A.共培养阶段;B.选择培养阶段;C.抗性芽诱导;D.抗性丛生苗抽茎诱导;E.抗性生根诱导;F.阳性转基因植株Fig.6 Transformation process of P.simonii × P. nigra‘Baicheng’A.Co-cultivation;B.Selective cultivation;C.Kanamycin-resistance bud induction;D.Stem induction of kanamycin-resistance clustered plantlets;E.Rooting induction of kanamycin-resistance plants;F.Positive transgenic plants
2.2.3 应拉木形成关键调控因子转基因植株创制
为了验证本研究建立的遗传转化系统的可靠性,在白城小黑杨中成功过量表达了调控应拉木形成的关键调控因子PtrLBD39基因。通过农杆菌侵染、抗性芽诱导、抗性丛生苗抽茎诱导及抗性生根筛选过程后(图8A~F),分别提取待检测抗性植株和野生型叶片的基因组DNA,使用载体特异引物35SP1-F和PtrLBD39-R引物进行PCR扩增,基因组鉴定结果如图8G所示,抗性植株(第2~6泳道)和阳性质粒对照(第1泳道)的目的条带一致,而设置的2组阴性对照(第7和第8泳道)则没有观察到任何条带,最终获得了5株转基因植株,这表明PtrLBD39重组质粒已经整合到白城小黑杨的基因组中。

图8 白城小黑杨遗传转化PtrLBD39及其PCR鉴定A.共培养阶段;B.选择培养阶段;C.抗性芽诱导;D.抗性丛生苗诱导;E.抗性生根诱导;F.阳性转基因植株;G.转基因植株PCR 鉴定(M.DNA marker DL1000;1.pBI121-35S:PtrLBD39质粒为模板的阳性对照;2~6.抗性植株叶片基因组DNA为模板的样品;7.野生型白城小黑杨叶片DNA为模板的阴性对照;8.ddH2O为模板的阴性对照)Fig.8 Transformation and PCR identification of PtrLBD39 in P.simonii×P. nigra‘Baicheng’A.Co-cultivate stage;B.Selective stage;C.Kanamycin-resistant bud induction;D.Kanamycin-resistant clustered plantlets induction;E.Kanamycinresistant rooting induction;F.Positive transgenic plants;G.Identification of transgenic plants(M.DNA marker DL1000;1.Positive control with pBI121-35S:PtrLBD39 plasmid as PCR template;2-6.Samples with leaf genome DNA of kanamycin-resistant plantlets as PCR template;7.Control with leaf DNA of wild-type plantlet as PCR template;8.Negative control with ddH2O as PCR template)
综上所述,本研究以白城小黑杨组培苗茎段为外植体,成功建立了白城小黑杨遗传转化体系,整个转化周期为55~85 d。具体流程如图9 所示,第1 天12:00 对含有目的基因载体的农杆菌菌液划线培养2 d,第3 天17:00 挑取单克隆接种至含有20 mg·L-1利福平和卡那霉素的20 mL YEP 液体培养基中,28 ℃、180 r·min-1条件下培养约13 h 至小摇菌液OD600≈0.90~1.10;吸取1.5 mL 小摇菌液至含有20 mg·L-1利福平和卡那霉素的50 mL YEP液体培养基中,28℃、200 r·min-1条件下培养6~7 h至大摇菌液OD600≈0.60;将大摇菌液转移至50 mL离心管中,4 ℃、2 200 r·min-1离心10 min 进行菌体收集;配置30 mL 悬浮液悬浮稀释菌体OD600≈0.40~0.45;选择生长健壮的白城小黑杨组培苗的第2~3 节茎段作为外植体进行后续遗传转化,切取长度约1 cm 的茎段外植体置于共培养培养基中,所有茎段切好后将外植体全部转移至制备好的农杆菌菌液中侵染20 min,漏勺过滤菌液后用镊子转移外植体到共培养培养基中,黑暗条件下共培养48 h;共培养结束后用含有250 mg·L-1头孢霉素的100 mL 无菌水对外植体脱菌5 min,再用100 mL 无菌水清洗2 次,每次3 min,随后将漏勺过滤后的茎段外植体接种于选择培养基中诱导抗性芽约30 d;将分化的抗性芽接种至抗性抽茎培养基中抽茎诱导15~30 d,剪取抽茎的抗性丛生苗接种至抗性生根培养基中,抗性生根诱导10 d 左右即可观察到生根情况,抗性生根诱导25 d 后对抗性植株进行转基因植株的鉴定,最终获得阳性转基因植株。
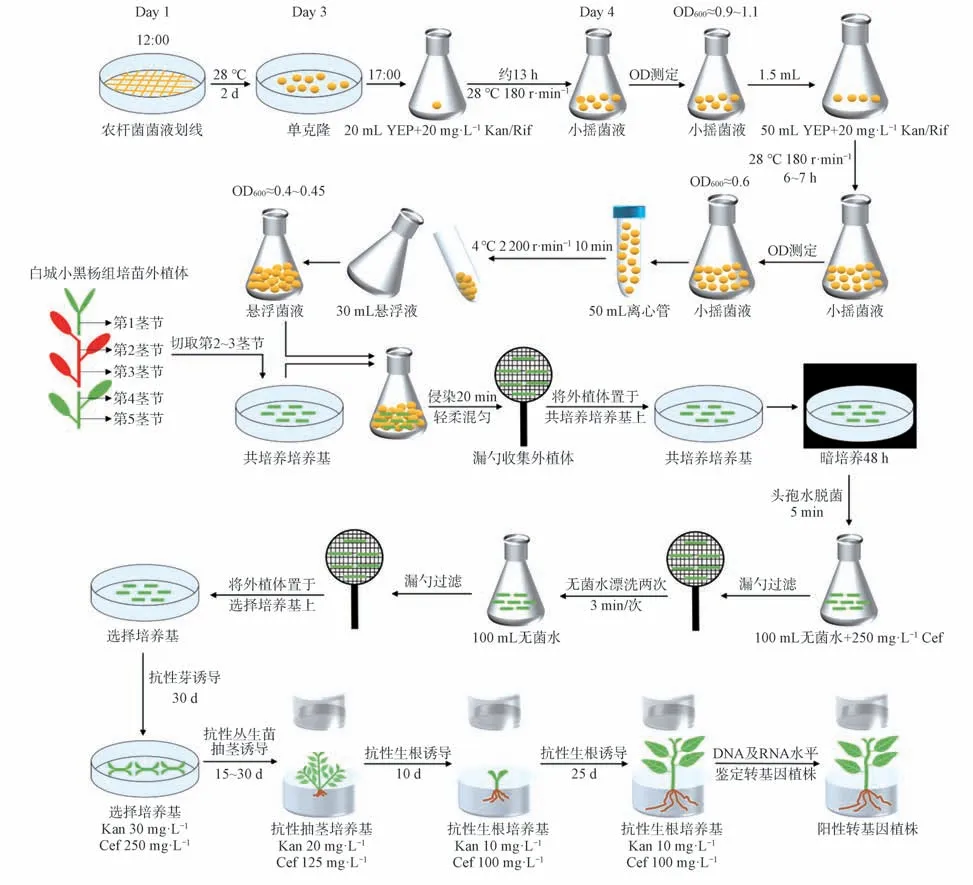
图9 白城小黑杨遗传转化流程图Fig.9 Flow chart of genetic transformation of P.simonii×P. nigra ‘Baicheng’
3 讨论
3.1 不同类型小黑杨的组织培养体系有所差异
小黑杨为小叶杨(P.simonii)和欧洲黑杨(P.nigra)的杂交杨,因其适应性强、生长周期短等特点被视为良种选育的优质树种。经过长期的选育驯化,各地又形成了不同类型小黑杨,如白城小黑杨、白林三号小黑杨、昭盟小黑杨(P.×simonira Chon-Lin“Zhao”)、小黑杨花粉植株等[3,8,14-15]。植物组织培养是在保持优良性状前提下对植株进行快速、大量扩繁的重要途经,也是农杆菌介导的遗传转化系统建立的基础,因而建立高效的小黑杨组织培养体系十分重要。已经有研究人员对传统的小黑杨建立了组织培养体系[6];小黑杨花粉植株组培技术也有相关报道,是由花药诱导愈伤后培育离体再生植株,但诱导率较低,很难在短时间内获得离体再生植株[7,9,15]。然而,关于白城小黑杨组织培养体系鲜见相关报道。本研究前期参考已有报道的小黑杨组培体系对白城小黑杨、白林三号小黑杨进行了培养,结果发现这2种小黑杨均不能实现离体再生,并且2种小黑杨在相同的培养条件下出现的分化、抽茎、生根情况均不相同,然而传统类型小黑杨对照植株可以正常的分化、生根[6]。由此可知,不同类型小黑杨需要不同组织培养条件实现其离体再生。因此,需要建立具有树种类型针对性的小黑杨组织培养体系。
3.2 白城小黑杨的组织培养体系
已有研究表明,茎段因具有丰富且活跃的维管分生组织使其不定芽诱导再生效率更高,并且茎段比叶片更易抵御后期遗传转化农杆菌所造成的伤害[16-17]。因此,茎段是组织培养中更具优势的外植体材料。此外,相比于经过愈伤组织再分化诱导不定芽产生,器官直接再生法可有效避免突变的发生,产生的不定芽遗传稳定性更具优势。因此,本研究选择组培苗茎段为外植体、通过器官直接再生法诱导不定芽的产生来建立白城小黑杨的组织培养体系。在不定芽诱导等组织培养过程中,植物生长调节剂发挥着重要的作用,细胞分裂素和生长素的比值能够影响植物细胞的分裂与分化。高浓度的细胞分裂素促进不定芽的产生,而高浓度的生长素则促进植物生根[18]。绝大多数木本植物在诱导不定芽阶段同时添加细胞分裂素6-BA 和生长素NAA 的效果较好。TDZ 是一种类似细胞分裂素的化合物,已在林木组织培养中证明是一种高效的植物生长调节剂,低浓度的TDZ 有利于林木不定芽的诱导,其工作质量浓度常为0.002~0.200 mg·L-1[19]。本研究利用6-BA、NAA、TDZ 3种植物激素,建立了比较高效的不定芽诱导体系,不定芽分化率可达92.6%。然而,诱导产生的不定芽绝大多数仅仅是一个芽点,无明显的茎,这样的芽无法诱导生根,导致无法再生成完整植株。因此,获得的不定芽需要经过抽茎的诱导长出明显的茎干。本研究发现低浓度的6-BA 和NAA 即可诱导白城小黑杨不定芽抽茎。在生根阶段时,白城小黑杨在IBA 的作用下即可成功发根,生根率可达100%。
3.3 白城小黑杨的遗传转化体系
遗传转化技术是林木基因功能解析及良种创制的有效途径,对于大多数杨树尤其是杂交杨的遗传转化仍然存在困难[20]。小黑杨的遗传转化效率低一直是难以克服的技术瓶颈,农杆菌介导的遗传转化虽然操作简单,但其中许多因素可能会影响转化效率,如抗生素的最适临界浓度、菌液浓度及侵染时间等[21]。本研究对白城小黑杨分化阶段进行了卡那霉素耐受性筛选,确定了分化阶段卡那霉素临界浓度为30 mg·L-1,同时确定了最适转化时间为20 min。整个转化过程包括摇菌、侵染菌液制备、侵染、共培养、脱菌、分化诱导、抽茎诱导、生根诱导。在遗传转化的分化诱导阶段利用卡那霉素对抗性芽进行了较长时间的筛选,在抽茎和生根阶段的卡那霉素浓度可在前期基础上适度降低,以加速植株生长并缩短转化周期[11,22-24]。
3.4 白城小黑杨遗传转化体系的应用
LBD39 转录因子是调控应拉木形成的重要因子,在毛果杨中敲除该基因及其同源基因,导致应拉木的形成受到明显抑制,植株木质素含量增加18%[10]。而应拉木因木质素含量较低,非常适合制浆造纸。因此,该基因的过量表达转基因植株很可能具有木质素含量降低的应拉木特性。本研究利用建立的适用于白城小黑杨的农杆菌介导的遗传转化体系成功创制了该转录因子的过量表达转基因植株,说明该转化体系具有一定的可应用性,但转基因植株的木材材性性状还有待进一步检测分析。
4 结论
综上所述,本研究建立了适用于白城小黑杨的组织培养体系及农杆菌介导的遗传转化系统。然而,在遗传转化pBI121-35S:GUS和pBI121-35S:PtrLBD39 时,转化效率分别为2.0%和3.3%,虽然高于小黑杨一般为1%的转化效率[7,9],但是仍然有很大的提高空间。在遗传转化的抗性不定芽筛选阶段,阳性不定芽的分化率为13.3%,若能保证获得的阳性不定芽全部再生成完整植株即可实现13.3%的转化效率。因此,提高阳性不定芽的再生效率将是日后优化遗传转化体系、提高转化效率、突破小黑杨转化困难这一困境的重要方向。
