红带锥蝽性别决定基因doublesex的克隆及表达分析
2023-09-08田芸嘉郭云海李元元
田芸嘉,郭云海,张 仪,朱 丹,李元元,刘 琴
(中国疾病预防控制中心寄生虫病预防控制所(国家热带病研究中心) 国家卫生健康委员会寄生虫病原与媒介生物学重点实验室 世界卫生组织热带病合作中心 国家级热带病国际联合研究中心,上海 200025)
性别分化通常是由性别决定级联通路上的关键基因、两性差异表达基因、发育相关基因互作和调控。昆虫的性别决定是由复杂的基因调控网络控制的,尽管上游的初始信号和决定因子部分各物种之间并不保守,变异较大;但最下游都有保守的双性基因(doublesex,dsx)。Dsx基因具有两种特征性的结构域:N端保守的DNA结合结构域(DM结构域/OD1)以及C末端特异的二聚化结构域(OD2)[1]。Dsx基因最早在果蝇中被解析,它出现在从低等到高等不同动物的性别决定基因中[2]。Dsx基因的保守结构预示了它功能的保守性。最近的研究表明,dsx仅在需要细胞通过功能或形态表现其性别特征时才表达,这种dsx表达的时空调控机制在已研究的所有节肢动物物种(如金小蜂、褐飞虱等)中均有建立,因此,dsx被视为节肢动物性别决定机制的中心环节[3-4]。
据报道,在完全变态的昆虫纲动物中dsx基因主要通过特异性剪接,从而产生雄性和雌性特异性dsx蛋白质而实现性别调控机制[5]。例如,dsx基因最早在黑腹果蝇(Drosophilamelanogaster)中发现(Dmdsx),其在雌雄个体中都表达,但受到不同的调控发生性别特异的可变剪接,生成雌雄特异的DmdsxF和DmdsxM[6]。Dmdsx的前体mRNA(pre—mRNA)由6个外显子构成,在外显子4上存在6个由13个核苷酸组成的重复元件(dsxRE),该元件是外显子剪接增强子[6]。在已研究的大多数双翅目昆虫中,调控同源基因dsx的可变剪接的分子机制与果蝇一样,例如冈比亚按蚊的dsx基因编码两个选择性剪接的转录物,AgdsxF和AgdsxM,控制两性的分化[7]。鳞翅目可变剪接的机制与果蝇并不相同,其不含有dsxRE。例如,家蚕(Bombyxmori)的dsx通过特异性剪接外显子3和4产生雌性dsxF,特异性剪接外显子2和外显子5产生雄性dsxM,而雌性特异性的BmdsxF被证明是其默认可变剪接的产物[8]。在鞘翅目中,赤拟谷盗(Triboliumcastaneum)Tcdsx的前体mRNA特异性剪接成三个雌性剪接体(TcdsxF1、TcdsxF2和TcdsxF3)和一个雄性特异性TcdsxM剪接体,雌性特异性外显子和相邻的内含子序列中发现了可能参与Tcdsx前体mRNA性别特异性剪接的顺式调控元件[9]。在膜翅目中,蜜蜂(Apismellifera)的Amdsx经过可变剪接产生了一种雄性特异的AmdsxM,两种雌性特异的AmdsxF和一种雌雄共有的AmdsxC,雌性dsx剪接是默认的,而雄性剪接体通过抑制雌性的剪接而产生的,并且其可变剪接受到基因Amfem的调控[10]。
然而,在对半变态的昆虫dsx基因研究结果表明,其dsx并不存在特异性剪接。例如,半翅目的长红锥蝽(Rhodniusprolixus)有三种Rpdsx亚型,一个雌性特异性dsx(Rpdsx1)和两个雄性特异性dsx(Rpdsx2和Rpdsx3),但雌雄的dsx并不存在特异性剪接[11]。烟粉虱(Bemisiatabaci)的dsx基因编码28个异构体,但其缺乏性别特异性剪接异构体[12]。虱目的雌雄人虱均有两种dsx亚型(Phdsx1和Phdsx2),均在两性中表达。这些结果提示了性别特异性dsx剪接可能出现在昆虫进化的早期,而半变态的两性之间的dsx异构体可能发生性别特异性剪接的丧失。
目前半变态的昆虫的dsx性别调控机制仍不清楚,因此,本研究分离并鉴定了红带锥蝽dsx基因,分析了其在红带锥蝽不同发育阶段及雌雄的表达谱,以期为解析红带锥蝽dsx性别调控机制奠定基础。
1 材料和方法
1.1 红带锥蝽饲养 选用饲养于中国疾病预防控制中心寄生虫病预防控制所(国家热带病研究中心)红带锥蝽广东顺德株[13],实验室传代14代。红带锥蝽卵及各个发育期饲养条件均为:温度(28±1)℃、相对湿度(70±5)%、恒温恒湿培养箱中12 h光照和12 h黑暗。饲血每周一次,均为昆明鼠体。
1.2 总RNA 提取和 cDNA 合成 分别收集红带锥蝽卵、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期龄若虫、雌性成虫和雄性成虫。使用QIAGEN公司的RNeasy Mini Kit(No.74104)试剂盒对样本进行总RNA提取。其中卵、幼虫与成虫均为1只。各样品总RNA经酶标仪NanoDrop ND-2000(美国NanoDrop公司)定量检测后,用TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)逆转录试剂盒去除基因组DNA并合成cDNA,产物于-20℃冰箱保存备用。
1.3 克隆TrdsxB基因的全长ORF序列 使用Primer Premier 5.0 软件对Trdsx进行引物设计,得到引物TrdsxBF1与TrdsxBR1(表1),送生工生物工程(上海)股份有限公司合成,并稀释到10 μmol/mL的浓度备用。以12.5 μL全式金公司的2×EasyTaq®PCR SuperMix、10 μL无核酸酶灭菌水、0.5 μL模板DNA、1 μL上游引物、1 μL下游引物为标准体系对Trdsx基因进行PCR扩增。所得产物经1%琼脂糖凝胶电泳后切胶回收,使用全式金公司的pEASY®-T1 Cloning Kit进行TA克隆。克隆样品送测序公司测序分析。

表1 红带锥蝽TrdsxB基因克隆与表达检测参数与引物信息Table 1 Primers and programs for gene cloning and expression detection of TrdsxB in T.rubrofasciata
1.4TrdsxB序列比对 在NCBI上导出三种模式动物的dsx氨基酸序列:黑腹果蝇(Drosophilamelanogaster,GenBank登录号:AHN57219)、长红锥蝽(Rhodnius prolixus,GenBank登录号:QGB21101)、烟粉虱(Bemisiatabaci,GenBank登录号:AWC26116),使用MEGA 6.0软件进行多重氨基酸序列比对。比对参数:空位开放(gap opening penalty)15,空位延伸(gap extension penalty)6.66,延迟趋异序30%,蛋白质加权矩阵Gonnet。
1.5 系统发育树分析 我们选择昆虫纲下不同目属的dsx蛋白同系物氨基酸序列建立进化树,包括蜻蜓目的长叶异痣蟌(Ischnuraelegans,GenBank登录号:XP046401714.1)、稀少追逐蜓(Ladonafulva,GenBank登录号:KAG8238589.1),蚤目的猫栉头蚤(Ctenocephalidesfelis,GenBank登录号:XP026469487.1),蜚蠊目的隐尾蠊(Cryptocercus punctulatus,GenBank登录号:BCX65400.1)、德国小蠊(Blattellagermanica,GenBank登录号:QGB21106.1),双翅目的黑腹果蝇(Drosophila melanogaster,GenBank登录号:NP524272.4)、昆士兰实蝇(Bactroceratryoni,GenBank登录号:AAB99947.1),鳞翅目的家蚕(Bombyx mori,GenBank登录号:NP001104815.1)、舞毒蛾(Lymantriadispar,GenBank登录号:BAN82532.1)、美凤蝶(Papiliomemnon,GenBank登录号:BAX24553.1)、冬尺蠖蛾(Operophterabrumata,GenBank登录号:KOB69684.1),膜翅目的西方蜜蜂(Apismellifera,GenBank登录号:NP001128408.1),半翅目的温带臭虫(Cimex lectularius,GenBank登录号:XP014241968.1)、球蚜(Adelgescooleyi,GenBank登录号:XP050436429.1)、葡萄根瘤蚜(Daktulosphaira vitifoliae,GenBank登录号:XP050519863.1)。使用MEGA6.0软件进行多重蛋白序列比对后,使用邻接法(neighbor-joining,NJ)进行类聚分析,Bootstrap法评估结果可信度(1000次重复),以甲壳纲的中国对虾(Penaeuschinensis,GenBank登录号:AUT13216.1)作为外群建立进化树进行分析。
1.6TrdsxB在红带锥蝽不同发育阶段的表达水平分析 使用所得的cDNA序列为模板设计出qTrdsxBF与qTrdsxBR两条引物(表1),采用相对定量的方法对红带锥蝽不同发育阶段的Trdsx基因表达水平进行测定。实验使用Bio-Rad C1000荧光定量PCR仪、全式金Green qPCR SuperMix。反应体系如下:Green qPCR SuperMix 10 μL、10 mmol/L 正、反向引物各0.5 μL、稀释10倍的cDNA 1 μL、无核酸酶灭菌水补足到20 μL。每个样品以及阴性对照做3组平行重复,另外再做3个无模板的阴性对照。反应结束后,对Ct值采用2-△△Ct法进行处理,从而定量分析dsx基因在红带锥蝽不同时期的表达水平,并进行LSD多重比较检验,根据数据作柱形图。
2 结果
2.1TrdsxB的鉴定与分子结构特点 分别以雌雄成蝽cDNA为模板,使用两条引物对TrdsxB全序列进行PCR扩增并克隆鉴定,根据测序结果进行序列拼接后得到该基因全长开放性读码框序列,命名为TrdsxB,其基因提交GenBank(GenBank登录号:OQ168410)。TrdsxB长度为948 nt,编码315个氨基酸。通过与红带锥蝽基因组(GenBank 登录号:PRJNA516044)比对,得到TrdsxB相应外显子和内含子的数目、分布等信息。TrdsxB基因位于12号常染色体,基因横跨约30 kb长度,mRNA由4个外显子构成(图1),起始密码子位于第1个外显子,终止密码子位于第 4 个外显子。
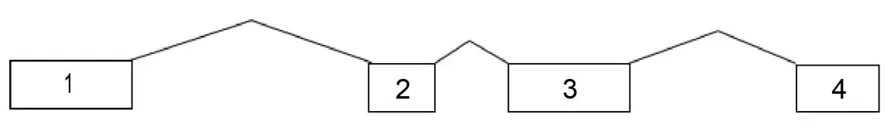
图1 Trdsx基因结构Fig.1 Trdsx gene structure
2.2TrdsxB结构域预测与其他物种同源蛋白的比较TrdsxB基因的分子排列形式与已知物种的dsx基因分子排列类似,存在一个与所有Dmrt性别基因共有的保守多聚化结构域(DM)和一个泛素相关(ubiquitin-associated,UBA)结构域(图2)。我们通过在线motif预测工具meme(http://meme.nbcr.net/meme/)分析了TrdsxB基因序列,得到部分motifs,结果图见图2。
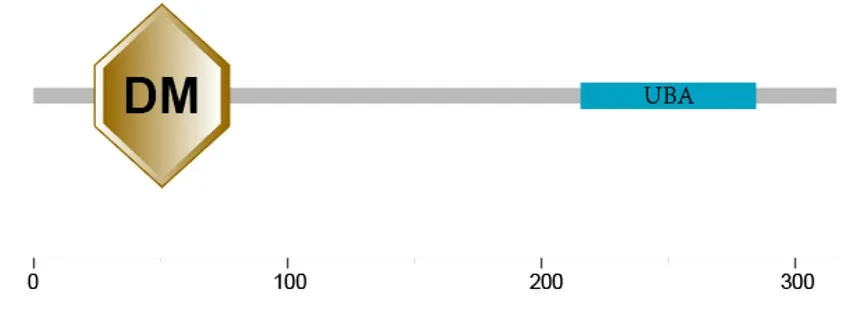
图2 Trdsx蛋白一级结构图Fig.2 Primary structure of Trdsx protein
通过与Dmdsx、Btdsx、RPdsx蛋白比较,我们发现Trdsx DM结构域中同样存在较为保守的OD1结构域和一定特异的OD2结构域。其中OD1结构域包含了一个锌指结构(atypical zinc-finger domain)[14],具有保守的锌螯合残基C2H2C4(图3)。连接OD1与OD2的区域在同属半翅目的红带锥蝽、长红锥蝽、烟粉虱之间较为相近,这个区域主要富含精氨酸、亮氨酸与谷氨酸(图3)。

图3 红带锥蝽、长红锥蝽、烟粉虱和黑腹果蝇dsx 蛋白的多重序列比对Fig.3 Multiple sequence alignment of dsx proteins of T.rubrofasciata,R.prolixus,B.tabaci and D.melanogaster
2.3Trdsx系统进化树特点 将不同种类昆虫dsx基因编码的氨基酸挑选出来并拼接后,以甲壳纲的中国对虾作为外群绘制系统发育树。结果显示,半翅目种群与蜻蜓目、蚤目、蜚蠊目、双翅目、鳞翅目、膜翅目等六个目属的进化距离均较远,其中蜻蜓目与蚤目的进化距离较近属于同一分支。在半翅目中红带锥蝽与葡萄根瘤蚜在同一分支中,亲缘性较近(图4)。
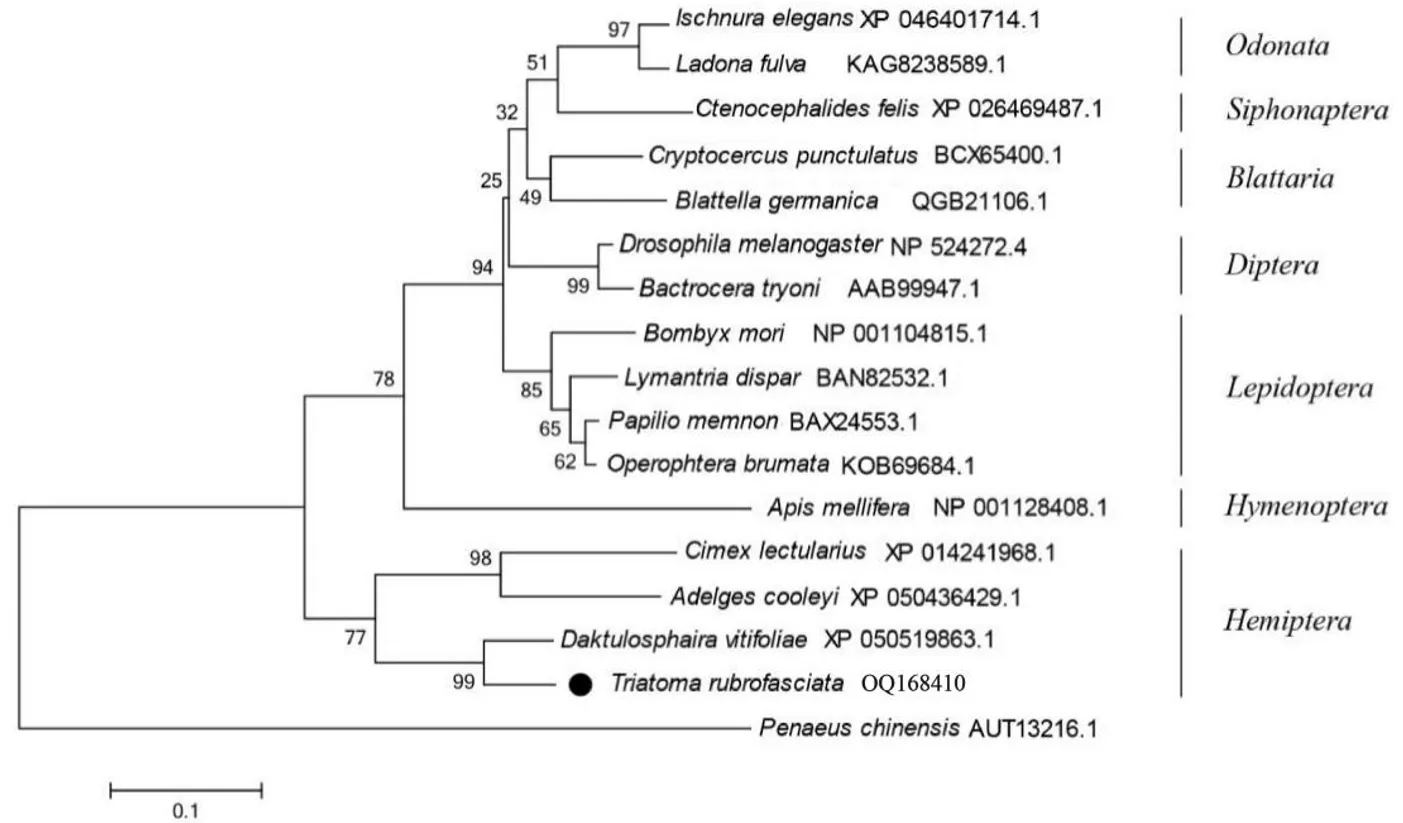
图4 不同昆虫dsx蛋白进化树Fig.4 Dsx protein phylogenetic tree of different insect species
2.4TrdsxB的表达特点 使用qTrdsxBF与qTrdsxBR两条引物,以红带锥蝽cDNA作为模板研究红带锥蝽TrdsxB基因在不同发育阶段的表达水平。结果显示,胚胎时期TrdsxB大量表达,之后表达量降低,四期若虫的表达量最低,然后再逐渐升高。且雄性与雌性之间的表达量存在差异(图5)。
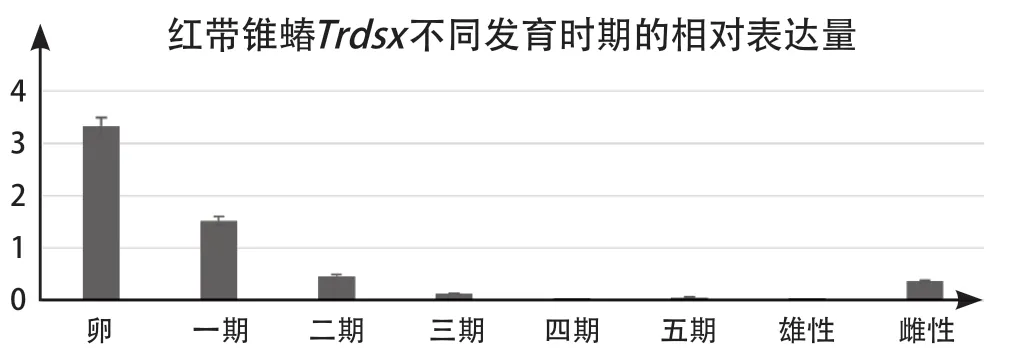
图5 红带锥蝽Trdsx不同发育时期的相对表达量(图中数据为平均值±标准误差,分别以卵表达量为基准)Fig.5 The relative expression of TrdsxB at different developmental stages (the data in the figure is mean±standard error,were based on egg expression)
3 讨论
美洲锥虫病,又称恰加斯病(Chagas disease),是一种由鞭毛体原虫-克氏锥虫引起的人畜共患热带病。根据最新的估测,目前在拉丁美洲大约有700万人感染美洲锥虫病,有1亿人处于风险之中。在最近的几十年内,美洲锥虫病流行病学发生重大变化,输入性的美洲锥虫病在欧洲的许多地区以及日本、澳大利亚、新西兰等国家均有报道[15-18],已经成为重要的全球性公共卫生问题。红带锥蝽是已记录的被证实能自然感染克氏锥虫,是克氏锥虫能在其体内定殖的锥蝽之一[19]。在已记录的151种可传播美洲锥虫病的锥蝽中,红带锥蝽是已知的全球范围内分布最为广泛的一种锥蝽。近年来,红带锥蝽已被证实在我国沿海地区广泛分布[20]。最新的研究证实,红带锥蝽不仅可以作为克式锥虫和布氏锥虫的传播媒介,还可以自然感染T.lewisi和T.conorhini两种锥虫,且T.lewisi和T.conorhini均可感染人。目前在泰国、马来西亚、巴西、冈比亚、印度等地均有人感染T.lewisi和T.conorhini的病例报道[21]。另有研究表明,T.lewisi对人类特异性血清载脂蛋白诱导的锥虫溶解具有天然抵抗力,由此可见红带锥蝽传播的T.lewisi可能是一个被低估,被忽视的感染人的病原体[21]。目前我国存在极少量的输入性锥虫病,未有相关的本地锥虫病病例出现,但红带锥蝽的存在依然给我国锥虫病的防控增加了许多风险和挑战。对红带锥蝽的防制无疑是预防和控制锥虫病等疾病最有效的措施之一,目前对病媒的防制主要依赖于杀虫剂的使用,然而过度和持续使用杀虫剂导致了昆虫抗药性的增强,并存在环境污染的可能[22-24],因此生物防制是更为适合的方式。随着生物信息学的发展与比较基因组学的兴起,越来越多的昆虫基因组被报道,加快了性别调控机制研究的步伐[25-26]。通过同源基因比对,可以帮助大家快速的找到性别调控级联通路上同源的关键基因,还可以挖掘新物种中性别调控通路上其他的侯选关键基因[27-28]。因此,本研究参考已发布的红带锥蝽的全基因组[29]数据,对红带锥蝽性别决定基因TrdsxB进行了克隆与鉴定。
本研究结果显示,TrdsxB中存在4个外显子,但并不存在特异性剪接,该结果与具有多种选择性剪接模式的双翅目昆虫(如冈比亚按蚊[30]、果蝇[31]等)、鳞翅目昆虫(如家蚕[32])以及鞘翅目昆虫(如赤拟谷盗[33])不同,但与同属半翅目且雌雄的dsx并不存在特异性剪接的长红锥蝽[34]一致。关于昆虫的性别调控通路的研究显示,dsx蛋白拥有共同的氨基端与雌雄特异的羧基端。雌雄共同的氨基端包含DNA结合结构域(DM domain)、中间蛋白寡聚结构域(dimer domain)[35]。本研究所得的TrdsxB也符合这一特征,存在一个与所有Dmrt性别基因共有的保守多聚化结构域和一个泛素相关(UBA)结构域[36]。其中DM结构域包含了一个具有保守的锌螯合残基C2H2C4的锌指结构,该结构与家蚕中雄性特异性的CCCH型锌指结构不同[32],属于C2H2型,关于该结构是否属于能与RNA结合的特殊锌指结构还有待研究[37-38]。UBA结构域则是一个初级的α螺旋结构,具有三螺旋束结构,是参与泛素介导的蛋白水解的蛋白质中常见的序列基序,用于与DNA相互作用。早期胚胎性别决定原始信号激活级联基因性别特异选择性剪切,级联基因性别特异产物调控个体分化为雄性或者雌性[39]。在对TrdsxB所预测的motifs中存在与卵黄形成相关的结构域,该结构域同样存在于家蚕中,可以激活雌性家蚕的信息素结合蛋白(pheromone-binding protein,pbp)异性表达,抑制雄性信息素结合蛋白特异性基因的表达[40],而模式生物果蝇的Dmdsx所编码的蛋白会与卵黄蛋白基因(Yp)结合调控卵黄蛋白基因的表达[6]。由此,本研究推测Trdsx基因与雌性的发育也许存在更为紧密的关联,这种功能的差异或许与该基因中所存在的卵母细胞分化功能域相关。
同时,RT-PCR结果显示,本次研究所得的TrdsxB基因在雌雄两种成虫中均有表达,且雌性表达量高于雄性,提示Trdsx对红带锥蝽的性别具有重要的作用。各个发育阶段的Trdsx表达水平结果显示,Trdsx在早期胚胎中就出现了表达且表达量极高,之后表达量逐渐降低直到四期若虫后再逐渐升高,同样的表达方式也存在于冈比亚按蚊的AngdsxM[30]和烟粉虱的Btdsx[41]中,间接提示dsx可能在早期属于一种母体基因(maternal gene)。进化树结果显示,本研究所鉴定的TrdsxB与已知的半翅目属的蚜虫dsx之间具有较高的同源性。由此可见,部分半翅目昆虫的dsx基因能为红带锥蝽的Trdsx基因研究提供参考,为后期红带锥蝽性别决定机制的研究指明了方向。
本研究将红带锥蝽性别调控机制研究的doublesex基因作为突破口,对其进行克隆,同源性分析并通过定量分析其时空表达的差异性,为进一步研究红带锥蝽性别调控机制奠定基础,进而为探索和开发红带锥蝽防制策略提供新的思路。
