鸡源血清4型禽腺病毒的分离鉴定与组织灭活苗免疫效果研究
2023-09-08葛春艳李佳暖
李 婧,葛春艳,李佳暖
(1.山东畜牧兽医职业学院,潍坊 261061;2.威海市文登区畜牧兽医技术服务中心,威海 264400)
禽腺病毒(Fowl adenovirus,FAdV)属于腺病毒科禽腺病毒属,是鸡、鸭、鹅等禽类体内的常见病毒。根据群特异性抗原的不同可将FAV分为Ⅰ、Ⅱ、Ⅲ 3个群,Ⅰ群禽腺病毒主要引起鸡的心包积液综合征和包涵体肝炎;Ⅱ群禽腺病毒主要引起火鸡出血性肠炎和鸡脾脏肿大;Ⅲ群禽腺病毒主要引起鸡的产蛋下降综合征。其中Ⅰ群又可分为A、B、C、D、E 5个种和12个血清型[1]。我国流行的血清型主要为FAV-11、FAV-4、FAV-8a、FAV-8b[2]。
心包积液综合征(hydropericardium hepatitis syndrome,HHS)主要是由FAV-4引起的一种原发性传染病,其典型特征为3~5周龄肉鸡突然死亡,并伴有心包积液和肝炎,死亡率可达20%~60%[3-4]。该病于1987年在巴基斯坦的安卡拉地区首次发生(安卡拉病),随后在多个国家呈暴发性流行。我国自2013年起出现该病的报道,2015年6月份以来,该病在我国大面积流行,主要集中在山东、河南、河北、辽宁、安徽、吉林等地区[5]。除肉鸡外,也可见于杂交鸡、麻鸡、种鸡和蛋鸡,肉鸭也有发生。本病既可垂直传播,又可水平传播,鸡感染后可终身带毒,并间歇性排毒,该病是当前国内鸡养殖户最为关注的疫病之一。
2018年9月山东某鸡场32日龄肉鸡发病,临床初步诊断为心包积液综合征,本研究从临床发病鸡的肝脏、脾脏等病料组织中分离到1株病毒,并对分离株进行鉴定、分析,最后确诊此次病原为血清4型禽腺病毒,为控制病情还试验了肝组织灭活苗的预防与控制效果,本研究为该病的防控提供了一定的实验依据。
1 材料与方法
1.1 病料采集、实验动物与主要试验材料 病料取自山东某鸡场送检的疑似禽腺病毒感染的白羽肉鸡。SPF鸡胚与SPF鸡均购自山东省农业科学院济南家禽研究所。病毒基因组DNA/RNA提取试剂盒、PCR通用rTaq试剂盒、凝胶回收试剂盒、质粒小提试剂盒、DL2000 DNA Marker等购自天根生化科技(北京)有限公司;克隆用宿主菌E.coliDH5α和载体pMD18-T购自宝生物工程(大连)有限公司。
1.2 病料PCR检测 根据GenBank已发表的FAV基因序列(EU177544),针对其Hexon基因设计并合成1对特异性引物(F:5'-CTTCCCCAAT CCCAACCAG-3',R:5'-TAGTGATGMCGSGA CATCAT-3'),以病鸡肝脏、脾脏等组织样品所提取DNA为模板,进行PCR检测,预期扩增长度500 bp。
1.3 病毒的分离与传代 取病变明显的肝组织约2.0 g,置于无菌研磨器中,研磨过程中加入5 mL PBS,反复冻融3次,4℃、3000 ×g离心15 min,上清液用0.22 μm的细菌滤器过滤,经卵黄囊接种于9日龄SPF鸡胚,0.2 mL/胚,37℃孵育,弃掉24 h以内死亡的鸡胚,无菌收集72 ~120 h死亡的鸡胚尿囊液及120 h未死亡鸡胚尿囊液,按照上述方法盲传3代,-80℃保存备用,观察鸡胚病理变化。按常规方法对第3代鸡胚尿囊液分离病毒进行鸡红细胞凝集试验,按常规方法进行鸡胚半数致死量(50% egg lethal dose,ELD50)测定。
1.4 分离株序列鉴定和遗传进化分析 利用PCR或RTPCR方法进行IBDV、CIAV、REV的检测[7-8],排除混合感染情况。按1.2方法对分离株DNA进行PCR扩增,回收扩增产物,送生工生物工程(上海)股份有限公司进行序列测定。将测得的Hexon基因序列与GenBank数据库进行比对,并利用MEGA6.0生物学软件进行遗传进化分析,构建遗传进化树。
1.5 动物回归试验 将10只7日龄SPF雏鸡平均分为两组,实验组肌肉注射分离毒株第三代鸡胚尿囊液0.2 mL/只(104.5ELD50/0.2 mL),对照组注射等量的灭菌生理盐水,每日观察并记录各组鸡的临床表现以及发病死亡情况,解剖死亡鸡,观察病理变化。
1.6 免疫保护试验
1.6.1 组织灭活苗制备 无菌采集病死鸡肝脏,按1∶5比例加入灭菌生理盐水,高速匀浆后过滤,滤液中加入终浓度3 mL/L的甲醛溶液,37℃、24 h震荡灭活,无菌检验合格后,接种10只7日龄鸡,2 mL/只,观察5 d后接种鸡均健活为合格。加入等量生理盐水混匀后分装备用。
1.6.2 抗体效价检测与疫苗免疫攻毒保护试验 将40只7日龄SPF雏鸡平均分成2组,实验组腿部肌肉注射组织灭活疫苗0.2 mL/只,对照组注射灭菌生理盐水0.2 mL/只,在免疫后第4、7、14、21 d各取5只实验鸡、对照鸡翅静脉采血0.5 mL,分离血清,以10倍浓缩的分离株灭活抗原为检测抗原,通过琼扩试验检测抗体;采血后实验组肌肉注射分离病毒0.2 mL/只(104.5ELD50/0.2 mL),对照组注射等量灭菌生理盐水,观察并记录死亡情况。
1.6.3 紧急接种保护试验 自采集病料的发病鸡群(25日龄,发病5 d)随机抽取200只尚未发病鸡,平均分为2组,分别隔离饲养3 d,两组各有部分鸡只表现精神沉郁、食欲减退等症状,其中实验组通过胸部肌肉注射紧急接种组织灭活疫苗1 mL/只,对照组接种等量生理盐水,两组同时给予电解多维及维生素C等抗应激药物,观察并记录死亡情况。
2 结果
2.1 病料PCR检测结果 对病变组织进行血清4型FAdVHexon基因PCR扩增,结果显示在肝脏、脾脏组织中均扩增出与预期大小相符的特异性条带(图1)。

图1 FAV-4目的基因PCR扩增Fig.1 The PCR product of FAV-4 target gene
2.2 病毒分离传代结果 接种鸡胚均在接种后72~120 h内死亡,死亡鸡胚表现发育受阻,全身充血、出血,肝脏肿大、质地变脆。常规方法检测尿囊液不能凝集鸡、鸭红细胞。按Reed-Muench法计算,该分离毒株对鸡胚的ELD50为10-4.5/0.2 mL。
2.3Hexon基因同源性分析 将测序得到的Hexon基因序列与GenBank上登录的12个血清型进行同源性比对和系统进化分析,结果发现分离毒株与FAdV-4参考毒株同源性为99%,与近年来国内流行的FAV-4毒株亲缘关系较近,处于一个分支上,与FAdV 1~3、5~11血清型参考毒株亲缘关系较远(图2)。以上试验结果表明该分离株为FAdV-4血清型,将其命名为FAdV-4血清型LH株。
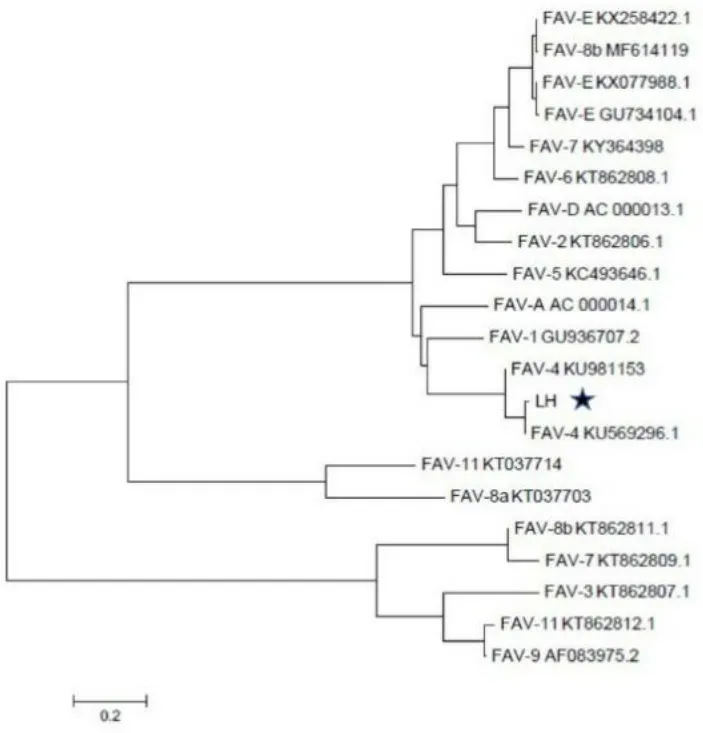
图2 分离毒株(LH)与参考株的Hexon基因遗传进化分析Fig.2 Phylogenetic tree based on the Hexon gene of the isolated virus (LH) and the reference strain
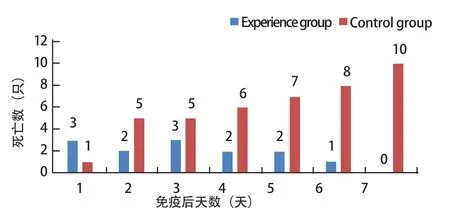
图3 两组死亡情况对照Fig.3 Comparison of mortality between the two groups
2.4 动物回归试验结果 人工接种雏鸡后,第2 d开始出现死亡,剖检可见有心包积液,肝脏出血肿大,肾脏肿大出血,与临床感染鸡症状病变相似,并可再次分离到该病毒。对照组无明显变化。表明鸡胚接种获得的分离株(LH株)即为引起临床发病的病原。
2.5 抗体效价检测与疫苗免疫攻毒保护试验结果 抗体效价检测结果显示,免疫后14 d才可检测到琼扩抗体,至21 d抗体阳性率达100%。但攻毒保护试验结果显示,免疫后4 d即可产生一定保护(25%),随后保护率逐渐上升,免疫后14 d可产生较强保护(80%),免疫后21 d攻毒,免疫组鸡只无发病、死亡,表现100%保护,表明组织灭活疫苗对于预防本病具有较好的效果,在免疫后14 d即可产生足够保护(80%),21 d可产生完全保护;而且还可产生早期保护,在抗体能检测到甚至产生之前,疫苗即可提供一定保护作用(表1)。以上结果提示在FAdV-4感染发病初期可通过组织灭活疫苗紧急控制本病。
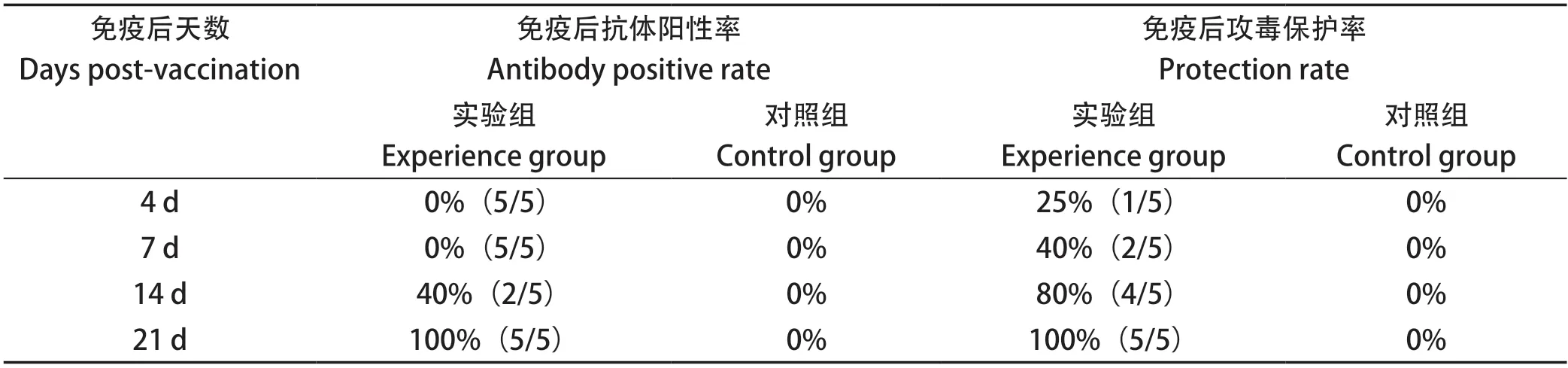
表1 免疫后抗体阳性率与攻毒保护试验结果Table 1 The positive rate of antibody and the results of protective test
2.6 紧急接种保护结果 实验组紧急免疫后统计死亡数显示,免疫当天死亡数高于对照组,此后一直低于对照组,且3 d后呈现明显下降趋势,6 d左右病情得到完全控制;对照组死亡数量持续上升(图4)。分析该结果表明,在发病初期(有症状,但暂无死亡)紧急接种组织灭活疫苗,免疫初期由于应激反应导致发病数与死亡数有一定上升后免疫效果持续增强,6 d左右可完全控制本病。
3 讨论
自2015年6月份以来,由腺病毒引起的心包积液综合征在我国多个省份大面积暴发并呈区域性流行,给我国养禽业造成了巨大的经济损失。FAdV-4是鸡HHS的主要病原[4-6],但也有报道称禽腺病毒的1、2、4和8型均能引起心包积液综合征,且近年来山东等地的优势血清型以8b为主[9]。本研究中分离株LH为FAdV-Ⅰ群C种、血清4型,且同源性与近年来国内报道的毒株极为相似,表明LH株仍为国内普通流行株。
HHS多在发病3~5 d达到死亡高峰,并持续7~10 d,可造成较大损失,目前本病防治困难,国内尚无商品化疫苗用于预防[10-11,15];因病鸡肝脏受损,肝功能紊乱,常规的药物治疗效果不佳[13];据报道,卵黄抗体治疗具有较好的疗效[12-13],但该病周期长,有时能持续1个月以上,卵黄抗体作用多为7~10 d,不能完全控制该病[9]。
本实验发现组织灭活疫苗对于预防与控制该病均具有良好的效果,免疫后4 d即可产生保护,21 d即可产生完全保护,可用于该病的预防接种;对发病鸡群进行紧急接种,可在6 d左右完全控制该病。
