CSF3R和行动控制对应激与健康饮食关系的调节作用:应激影响健康行为的个体化模型的初步证据*
2023-09-08胡月琴王理中甘怡群
胡月琴 王理中 陈 钢 甘怡群
CSF3R和行动控制对应激与健康饮食关系的调节作用:应激影响健康行为的个体化模型的初步证据*
胡月琴1王理中2陈 钢2甘怡群3
(1北京师范大学心理学部, 北京 100875) (2微基因深圳早知道科技有限公司, 深圳 518042) (3北京大学心理与认知科学学院暨北京市行为与健康重点实验室, 北京 100871)
应激在饮食方面的反应因人而异; 有些人在应激下喜欢多吃甜食和其他高热量食物, 而另一些人则没有这样的倾向。这可能与两种类型的迷走神经系统功能优势性有关:向营养型或兴奋型。本研究以14675位中国成年人为样本, 结合健康行动过程模型和迷走神经支配性理论, 发现应激显著预测了健康饮食意向的减少, 以及随后健康饮食行为的减少。CSF3R基因rs4076431及其连锁位点rs4498771, rs10752589, rs9660229调节了应激与健康饮食意向之间的关系, 而行动控制调节了健康饮食意向与健康饮食行为之间的关系。以rs4076431为例, 应激与健康饮食意向之间的负向关系在AA基因型(向营养型)中比在G等位基因携带者(兴奋型)中更强。行动控制分数越高, 健康饮食行为越多, 而且该行为越少受到应激和健康饮食意向的影响。基于这些结果我们提出了应激影响健康行为的个体化模型, 应激下的健康管理应考虑生理、行为、情境等多个层面的影响因素。
健康饮食, 感知应激, 基因, 迷走神经支配性
1 引言
不健康的饮食可能是人们应对应激的一种方式。目前应激过度导致肥胖的现象已经引起公众关注(Kim et al., 2016; Shuck et al., 2021)。大量研究表明, 应激与饮食摄入的变化有关(综述见Hill et al., 2021)。尽管人们通常将应激与暴饮暴食联系在一起, 但对饮食与应激之间关系的研究结果却不一致。虽然一些研究发现应激会增加食物摄入量(例如, Wardle et al., 2000), 但另外的研究发现, 食物消耗量会减少(例如, Stone & Brownell, 1994; Torres & Nowson, 2007)。那么是什么决定了人们对应激的不同反应?目前在健康心理学领域, 针对应激和健康行为的关联的研究虽然比较丰富(Heuse et al., 2021; Payne et al., 2005), 但最近的一项元分析突显了研究结果的不一致性。该元分析发现, 由于总体研究的显著异质性, 应激与总体食物摄入之间的关系只有很小的正性影响(Hill et al., 2021)。对应激的饮食反应的个体差异似乎是观察到的异质性的主要原因。个体差异模型假设应激对饮食的影响是由学习历史、态度或生物学上的个体差异所决定的, 但个体差异作为调节变量的研究尚不多见(Ruf et al., 2022)。本文的创新之处就是从基因的生物学差异以及行动控制的人格差异来探讨影响应激与食物摄入关系的调节因子。本研究试图将应激和迷走神经支配性理论整合到健康行动过程模型(Health Action Process Approach, HAPA; Schwarzer et al., 2011)的框架下, 探讨应激和健康饮食的关系及其个体差异, 从而为应激下的健康管理实践提供理论支撑和干预方向。
1.1 应激和健康饮食
近年来, 随着国民生活水平和健康意识的提升, 应激对健康行为的影响开始受到研究者和公众的关注(例如, Fodor et al., 2014)。由于应激对健康行为的影响高度依赖于所讨论的健康行为(Stults- Kolehmainen & Sinha, 2014), 有必要将讨论聚焦在特定的健康行为, 如饮食行为。
健康饮食可以定义为对健康有益或至少没有有害影响的食物摄入模式(Stevenson, 2017)。目前对于不健康饮食的基本特征已达成共识, 这些特征包括加工食品、含糖饮料、反式脂肪和饱和脂肪以及添加的盐和糖的摄入量较高, 新鲜水果、蔬菜、坚果和全谷物的摄入量较低(de Ridder et al., 2017; Willett, 1994)。那么健康饮食的建议通常需要什么呢?尽管膳食习惯有文化差异, 但各国的建议非常相似, 83个国家制定了官方膳食指南(Food & Agricultural Organization of the UN, 2015), 通常要求多样化和均衡的饮食(在80%的指南中提到)、蔬菜和水果含量高(94%)、低脂肪(93%)、低糖(86%)和低盐(96%)。健康饮食还富含多不饱和脂肪酸、全谷物和纤维、低脂或脱脂乳制品、鱼、豆类和坚果, 而精制谷物和饱和脂肪酸则含量低。然而, 在健康饮食的测量中, 大部分以测量蔬菜和水果摄入为主, 而较少包括低脂肪(93%)、低糖(86%)和低盐(de Ridder et al., 2017)。
最近关于应激与饮食行为的研究有所增加(例如, Fodor et al., 2014), 然而结果却并不一致(例如, AraizaLobel, 2018; Siegrist & Rödel, 2006)。目前检索到唯一的元分析(Hill et al., 2021)发现应激与不健康食品的消费增加有关(Hedges'= 0.116), 同时与健康食品的消费减少有关(Hedges'= −0.111)。Payne等(2005)的研究表明, 应激对锻炼有不利影响, 对水果和蔬菜的消费并没有影响, 但他们也发现应激会影响人们食用糖果和零食的意愿和实际摄入。应激和饮食关联背后的原因可能有多种。人们可能会将食物作为舒适的来源, 无意或有意地将其作为应对应激的策略, 因此会在应激下吃得更多(AraizaLobel, 2018; Groesz et al., 2012); 另一种可能性是在应激下需要消耗更多的能量, 比如Liu等(2017)根据18项食物频率问卷(FFQ), 发现从事高强度工作的男性比从事低强度工作的男性从高脂肪食物中消耗的卡路里更多。
1.2 应激与健康行动过程模型
以往研究探讨了应激与健康行为之间的直接关系, 但尚未结合健康行为的理论模型研究应激影响健康行为的作用机制。健康行动过程模型(HAPA)致力于解释健康行为的发展, HAPA和应激模型的结合可能进一步阐明应激与健康行为的关系。
HAPA (Schwarzer & Hamilton, 2020)将健康行为改变分为两个阶段:意向阶段和意志阶段。意向阶段的结果是意向的形成, 可以定义为个人表现出特定行为以实现预期目标的动机。元分析已经证实了意向和包括健康饮食在内的各种健康行为之间的正相关关系(例如, Armitage & Conner, 2001)。然而, 意向似乎仍然不足以改变行为(Webb & Sheeran, 2007)。根据HAPA, 形成意向的个体进入意志阶段, 在这个阶段, 制定行动计划和应对计划被认为是克服行动障碍、实现目标行为的有效自我调节策略。
有大量的研究表明, 应激对饮食意图有直接的影响。一项2007年的综述发现, 应激会促使人们增加对高热量、高脂肪和高糖分的食物的渴望(Torres & Nowson, 2007)。另一项2019年的研究则发现, 感知应激与健康饮食意图的负相关性Klatzkin et al., 2019)。Reichenberger等(2021)的研究用生态瞬时评估进一步探讨了应激和饮食意图之间的中介机制, 发现应激会降低身体自我调节的能力, 从而导致人们渴望不健康的食物。
在HAPA模型中, 主要的引起意向或动机的因素是对风险的感知和对结果的期望。然而, 鉴于目前应激对健康行为的影响已经在业界有普遍共识(Shuck et al., 2021), 应激应该被视为健康行为意向的重要阻碍因素(Groesz et al., 2012)。然而目前HAPA模型中尚未纳入应激的影响。高应激的特点是时间压力、目标冲突和意向不稳定(Lazarus, 1995)。在这种情况下, 与富含水果和蔬菜的健康膳食相比, 人们可能更喜欢省时、方便, 迅速提供热量和改善情绪的快餐解决方案。因此在意向阶段, 应激可能会影响人们健康饮食的意愿, 使人们更倾向于摄入高糖高脂的不健康食物。在意志阶段, 应激构成了个体实施健康行动的障碍, 而行动控制通过采用适当的自我调节, 可以帮助克服这些障碍(Sniehotta, 2009)。
行动控制的概念来源于自我调节过程。自我调节是指为改变行为而做出的各种努力(Baumeister et al., 2018)。自我监控、标准意识和努力均属于自我调节过程。Sniehotta等(2005)把这三个自我调节过程称为行动控制(action control)。行动控制可以被视为意志阶段最接近行为的预测因子(Sniehotta et al., 2005)。一些研究表明, 行动控制可以影响意向−行为关系, 是促成健康行为改变的有效个人资源(例如, Schwarzer et al., 2007; Sniehatta et al., 2005)。
1.3 应激与迷走神经系统支配性理论
应激和不健康饮食之间的个体差异可能与人的下丘脑系统的进化有关。Gellhorn (1967)的一个古老术语“向营养型 vs. 兴奋型” (trophotropic vs. ergotropic)将副交感神经系统标记为向营养型系统, 将交感神经系统标记为兴奋型系统。Porges (1992)重新定义了这个术语, 以代表个体对环境应激反应的差异:向营养型主要指迷走神经功能, 它们是再生和恢复的基础; 而兴奋型个体更倾向于为战斗或逃跑反应做好准备, 从而抑制饥饿和产生饱腹感。迷走神经功能的适应价值仍存在争议(Porges, 1995)。尽管如此, 研究普遍认为以向营养型系统为主导的个体在应激下更倾向于在下丘脑−垂体−肾上腺轴(hypothalamic−pituitary−adrenal axis; HPA轴)上有更低的激活, 具有迷走神经系统支配的症状:食物摄入增加, 并引起体重的增加(Everly & Lating, 2019)。相反, 兴奋型的个体在应激下更倾向于HPA的过度激活, 交感神经活动增加:食物摄入减少和体重减少(McLaughlin et al., 2015)。
迷走调节支配理论尝试用迷走调节支配解释上述应激反应的个体差异。迷走神经中有一部分神经纤维是副交感纤维, 就是内脏运动副交感纤维, 是迷走神经的主要组成成分, 它分布于胸腹腔的器官, 比如气管、支气管、肺、心脏等以及腹腔内的器官, 比如肝、胰、脾、肾、肾上腺、胃和横结肠之间的消化系统, 调整这些器官的活动。具有较高迷走调节支配的个体的认知和情绪反应倾向于更适应各种应激源(Porges, 2007)。较高的迷走神经支配性降低了对慢性逆境的不良反应, 及其导致心理疾病的风险(Kogan et al., 2012)。此外, 较高的迷走调节支配也预示着更好地从心理社会应激中恢复(Souza et al., 2007)。相反, 迷走神经支配性的下降与心血管、内分泌和免疫标记物的应激后恢复受损有正相关; 并预测了未来与应激相关的健康状况(如肥胖)的易感性(Kogan et al., 2012; McLaughlin et al., 2015)。迷走调节支配被用来测量个人的特征, 这些发现进一步加强了以前对更大的迷走调节支配和调节情绪能力之间的关联(Souza et al., 2007)。因此, 在高水平的慢性应激条件下, 迷走调节支配的差异被认为是导致个体对应激复原力的一个重要因素(McLaughlin et al., 2015; Smeets, 2010)。然而, 我们对高水平的慢性应激条件下迷走神经支配性个体差异的潜在分子机制知之甚少。
此外, HAPA模型尚未考虑个体差异的影响, 尽管人格(Diop et al., 2021)、童年经历(Pilkington et al., 2021)、社会环境等(Peeters, 2018)都被证明与健康饮食有关, 但基因是最原始和基本的个体差异, 因此通过研究基因差异对应激下健康饮食的影响来发展个体化的HAPA模型尤其有意义。近年来的研究发现神经肽Y (NPY)调节了迷走神经(副交感神经)活动与更应激复原力的关系。NPY基因在应激调控中具有潜在的迷走神经功能(Chang et al., 2016)。
CSF3R (集落刺激因子3受体)是一种蛋白质编码基因。与CSF3R相关的疾病包括嗜中性粒细胞增多症、遗传性和中性粒细胞减少症、严重先天性常染色体隐性遗传病等。其相关途径包括自噬途径和RNA聚合酶I启动子开放。大脑在对应激事件的认知、情绪和行为反应中起着核心作用。然而, 不可能从健康受试者的大脑相关区域获取RNA样本。Sullivan等研究者(2006)评估了中枢神经系统(CNS)和外周血中基因表达的可比性, 发现在转录组水平上, 全血与多个CNS组织具有显著的基因表达相似性。然而, 尚不清楚外周血细胞中的基因表达是否是CNS组织中基因表达的有用替代物(Sullivan et al., 2006)。免疫系统与中枢神经系统和内分泌系统双向沟通。急性心理应激会增加循环炎症因子(Steptoe et al., 2007), 而慢性心理应激与免疫功能失调有关(Glaser & Kiecolt-Glaser, 2005)。外周血白细胞通过产生大量生物活性分子, 包括细胞因子, 在应激诱导的炎症和免疫反应中发挥作用。其中一些直接刺激HPA轴(Chesnokova & Melmed, 2002), 或表达应激介质的特异性受体, 如激素、神经递质、生长因子和细胞因子。尽管外周血白细胞中的基因表达谱不能直接映射中枢神经系统的反应, 但它可能有助于间接评估各种应激源诱导的复杂全身反应。因此, CSF3R的基因调控作用近年来也被关注(Kawai et al., 2007)。不同的CSF3R基因型可能有不同的表达水平, 因此导致不同的细胞因子产生应激反应。因此, 研究CSF3R基因型可能有助于客观评估心理应激反应。
1.4 本研究的目的和假设
HAPA关注健康行为启动和维持的风险感知, 但尚未纳入个体和环境因素。我们的模型强调了一个重要的情境因素, 即应激。此外, 我们还增加了与迷走神经系统支配性关系密切的基因型, 作为意向阶段个体差异的调节因子。由于在经典HAPA模型中, 行动控制是意志阶段一个重要调节因子, 我们在模型中也纳入了行动控制的个体差异作为意志阶段的调节变量。因此, 我们提出了针对应激的个体化健康行动模型。请参考图1。

图1 个体化健康应对应激模型
本研究旨在提出和验证关于应激与健康饮食之间关系的新理论。根据健康行为应对应激的个体化模型, 我们认为个体在应激下的健康饮食行为可能会发生变化, 但这种变化取决于特定的个人特征和健康饮食意愿。在个体化健康应对应激的意向阶段, 应激迷走支配性及其基因基础都可能对健康饮食行为构成阻碍。CSF3R被用作候选基因, 因为它在迷走功能支配性中具有被证实的影响(Kawai et al., 2007)。我们假设:该基因能够解释个体对应激的反应差异; 也就是说, 在个体化健康应对应激的意向阶段, 在面对应激时, 携带特定等位基因的人可能比其他人更容易降低健康的饮食意向。在个体化健康应对应激的意志阶段, 行动控制的个体特征起了重要的调节作用:行动控制低的个体, 更容易把不健康的饮食意向付诸行为。我们在全国范围内对中国成年人进行了大量抽样调查, 以检验上述假设。
2 方法
2.1 受试者
我们从微基因的客户群中招募了14675名被试。作为微基因个人基因组服务的一部分(Kang et al., 2020), 他们都完成了基因芯片(约700000个变异位点)基因分型检测(38%使用Affymetrix WeGene V1基因芯片, 62%使用Illumina Infinium Global Screening Array-24 v2.0 BeadChip基因芯片)。受试者提供知情同意, 并通过微基因在线平台(微信社交媒体渠道、移动应用和网站)在线参与研究。受试者可以通过向客户服务账户发送电子邮件选择退出研究。微基因的客户涵盖18岁以上的人群, 在年龄、地区和职业方面具有代表性。完成研究后, 每位受试者在微基因账户中获得500积分奖励。纳入标准包括中国汉族及通过5道效度题目。所有程序都符合相关国家和机构人体实验委员会的伦理标准, 以及经2008年修订的1975年《赫尔辛基宣言》。所有程序均经北京大学人类和动物受试者保护委员会(ID#2018-10-03e)和中国人类遗传资源管理办公室([2021]CJ2171)的批准。
所有受试者的平均年龄为28.17岁(标准差:7.09; 范围:18~65岁)。有6363名男性参与者(43.4%)和8267名女性参与者(56.3%); 45例(0.3%)数据缺失。在受试者中, 3601人(24.5%)拥有硕士或以上学位, 8614人(58.7%)拥有学士学位, 1597人(10.9%)拥有大专学历, 817人(5.6%)具有高中文化, 其余46人(0.3%)的文化程度在高中以下。
2.2 材料
应激。中文版压力知觉量表(Chinese Perceived Stress Scale, CPSS)是评估个体应激的一种量表, 适合于各种类型的人群评估应激知觉。该量表由Cohen等(1983)编制, 并经杨廷忠和黄汉腾 (2003)汉化修订。该量表具备良好的信度和效度。量表具有两个维度, 分别是紧张感和失控感, 最后统计量表的总得分, 得分越高说明被试的心理压力越明显。包括10个项目(例如“最近一个月您因为发生了一些意料不到的事情而感到心烦的频度”)。受访者使用1~5级李克特量表, 其中1表示从来没有, 5表示很经常, 以表明每个相关项目对他们造成应激的频度。在本研究中该量表的内部一致性系数为0.869。
饮食意向和行为。采用Schwarzer和Luszczynska (2008)的HAPA变量评估量表测量饮食意向和行为。其中健康饮食意向通过两个健康饮食意向相关的项目进行评估(如“我打算定期吃水果和蔬菜”。)。项目采用1~4级李克特量表, 范围从1 (完全不正确)到4 (完全正确)。另外两个项目测量了实际的健康饮食行为(“你平均每天吃多少份水果/蔬菜?”)。为了帮助参与者准确地做出反应, 解释了一份大小的示例。所有这些量表都在之前的研究中报告了满意的信度和效度。在本研究中该量表的内部一致性系数为0.935。
行动控制。采用Sniehotta等(2005)编制的量表测量对健康行为的行动控制。该工具由6个项目组成, 涉及在过去的4周里个体的自我监控、标准意识和自我监管努力等。比如“在过去的四周里, 我一直都知道我规定的饮食计划”, “ 尽力按照我的标准行事。”等。项目均采用1~6级李克特量表, 范围从1 (完全不正确)到6 (完全正确)。在本研究中该量表的内部一致性系数为0.749。
2.3 基因分型、质量控制和插补
被试的唾液样本按照微基因的方案进行基因分型。基于性别不匹配(去除15人)、个体缺失程度不成比例(>5%, 所有个体均满足)、亲缘关系证据(从KING确定的二级范围内的每对个体中删除一个, 去除141人; (Manichaikul et al., 2010)、近交系数高于0.2或低于−0.2 (也称为杂合度F统计量, 所有个体均满足这一标准)、非汉族(通过主成分分析和二维聚类分析评估千人基因组项目Phase3数据; Bycroft et al., 2018; 共去除284人)等条件把部分个体排除在进一步分析之外。用于SNP)的质量控制参数如下:SNP缺失度 > 0.02 (共去除 53, 209 SNP); SNP偏离哈代−温伯格平衡 < 1e-5 (共去除7, 349 SNP)。根据千人基因组项目Phase3 v5参考单倍型, 使用带默认参数(滑动窗大小为10 Mb, 步长为3 Mb)的Eagle/Minimac4对基因型数据进行插补。通过去除插补质量(即Minimac R2)小于0.3 (去除35, 588, 204 SNP)、MAF小于1% (去除 5, 409, 717 SNP)或缺失率大于2%的SNP (去除0 SNP), 实现插补后过滤。最终有14675人、包含6, 838, 420 SNP的数据集被纳入基因相关研究。
2.4 统计分析
根据图1中的假设模型, 我们首先用线性回归考察应激和健康饮食意向和行为的关系, 并根据HAPA模型的建议检验健康饮食意向在应激和健康饮食行为之间的中介作用。然后, 我们使用有交互的多元回归分别研究了CSF3R基因在应激和健康饮食意向之间的调节作用(图1中第一阶段的调节)以及行动控制在健康饮食意向和健康饮食行为之间的调节作用(图1中第二阶段的调节)。此外, 由于整个模型的基础是意向中介模型, 在中介模型之上又添加了调节因子, 因此我们也将用回归和Bootstrap检验有调节的中介作用。为了确保严谨性并排除其他解释, 将人口分层信息(如性别、年龄和教育程度)作为协变量进行控制。为了提高可重复性, 样本被随机分成两半, 并在适用的情况下进行交互验证。本研究的分析使用SPSS的PROCESS宏包和R完成。
3 结果
3.1 描述性统计
本文涉及变量的描述性统计以及相关关系如表1所示。所有研究变量的数据缺失率在0%~3.4%之间, 均少于5%, 故在后续分析中适合采用pairwise方法处理缺失值。基因变量和其他变量由不同测量方法获得, 不存在共同方法偏差的问题, 其他变量采用部分题反向计分等方式控制共同方法偏差(周浩, 龙立荣, 2004)。应激、健康饮食意向、健康饮食行为和行动控制之间相关均显著,< 0.001。基因(以SNP rs4076431为例)和上述变量相关均不显著,> 0.05。人口统计学变量性别、年龄、教育程度和上述变量均表现出显著相关, 因此在接下来的统计模型中将作为协变量加以控制。
3.2 应激与健康行为过程
根据HAPA假设, 首先检验意向在应激和行为之间的中介作用。表2中的回归模型1表明应激显著预测了健康意向, 应激越大, 健康意向越低,= −0.034,= 0.002,< 0.001, 95% CI = [−0.038, −0.030]。分半验证的结果与上述结论一致, 应激对意向的预测效应在两个分半样本中都显著,= −0.037,< 0.001,= −0.031,< 0.001。模型2用应激和健康意向同时预测健康行为, 结果表明意向的效应显著, 意向越强, 行为分数越高,= 0.645,= 0.005,< 0.001, 95% CI = [0.636, 0.654], 应激的直接效应显著,= −0.008,= 0.001,< 0.001, 95% CI = [−0.010, −0.006]。分半验证时, 意向对行为的预测效果也在两个样本中都显著,= 0.633,< 0.001,= 0.656,< 0.001。Bootstrap中介检验发现应激通过意向的间接效应也显著, 高应激预测了健康意向的下降, 健康意向的下降进而预测了健康饮食行为的下降,= −0.022,= 0.002, 95% CI = [−0.025, −0.019]。

表1 描述性统计和相关矩阵
注:基因为二分变量, 以SNP rs4076431为例, 1 = AA型, 占49.8%, 2 = G携带者, 占46.9%。性别为二分变量, 1 = 男性, 占43.4%, 2 = 女性, 占56.3%。基因和性别与其他变量的相关为点二列相关。*< 0.05,**< 0.01,***< 0.001。
3.3 应激健康行为过程的个体差异
接着检验基因的调节作用。我们使用回归分析来检验CSF3R的4个SNP (rs4076431、rs10752589、rs9660229和rs4498771)在应激分数和健康饮食之间的调节作用。这里使用4个SNP, 是因为这4个SNP处于相邻的基因组且它们之间存在很强的连锁关系, 连锁程度均大于0.8, 属于强连锁区域。又由于使用这4个SNP的结果显示出相同的模式, 我们只展示来自rs4076431的结果。
表2中的模型3发现基因显著调节了应激对意向的影响, 即应激×基因的交互作用显著,= 0.013,= 0.004,< 0.01, 95% CI = [0.004, 0.021]。应激与基因的交互作用在分半验证中仍然显著, 在一半样本中,= 0.013,= 0.006,= 0.036, 在另一半样本中,= 0.013,= 0.006,= 0.040。简单斜率分析发现, 对于纯合子AA基因型, 应激对意向的作用为= −0.041,= 0.003,< 0.001, 95% CI = [−0.047, −0.035], 对于G等位基因携带者(纯合子GG和杂合子GA), 应激对意向的作用为= −0.029,= 0.003,< 0.001, 95% CI = [−0.034, −0.022], 两者比较, 应激对健康意向的负性作用在AA基因型中更大。模型4以健康行为作为结果指标, 发现应激和基因的交互作用对健康饮食行为的影响是显著的,= 0.008,= 0.004,= 0.034, 但是当模型5加入健康饮食意向后该调节效应消失, 支持了健康饮食意向的中介作用, 即基因调节了应激对健康饮食意向的影响, 健康饮食意向进而影响健康饮食行为。Bootstrap有调节的中介检验(SPSS插件PROCESS宏包中的模型7)发现基因显著调节了应激对健康饮食行为的间接效用,= 0.008,= 0.003, 95% CI [0.002, 0.014]。其中在AA基因型中, 应激通过意向对健康饮食行为的间接作用为B = −0.027,= 0.002, 95% CI [−0.031, −0.023]; 在G携带者中, 应激通过意向对健康饮食行为的间接作用为B = −0.018,= 0.002, 95% CI [−0.023, −0.014]。可见AA基因型中, 应激对健康饮食行为的间接负面影响更大。
最后检验行动控制的调节作用。模型6表明意向×控制的交互作用显著,= −0.066,= 0.003,< 0.001, 95% CI = [−0.072, −0.059], 支持了控制在健康意向和健康行为之间的调节作用。上述健康饮食意向与行动控制的交互作用在分半验证中仍然显著, 在一半样本中,= −0.076,= 0.005,< 0.001, 在另一半样本中,= −0.058,= 0.004,< 0.001。简单斜率分析表明, 对于行动控制分数较低的个体(控制=3), 意向对行为的作用为= 0.670,= 0.006,< 0.001, 95% CI = [0.658, 0.681], 对于行动控制分数中等的个体(控制=4), 意向对行为的作用为= 0.603,= 0.005,< 0.001, 95% CI = [0.593, 0.612], 对于行动控制分数较高的个体(控制=6), 意向对行为的作用为= 0.469,= 0.008,< 0.001, 95% CI = [0.454, 0.485]。即行动控制分数越高, 健康饮食行为受到意向的影响更弱。Bootstrap有调节的中介检验(SPSS插件PROCESS宏包中的模型14)发现行动控制显著调节了应激对健康饮食行为的间接效用,= 0.0023,= 0.0002, 95% CI [0.0018, 0.0027]。其中在行动控制分数较低的个体中, 应激通过意向对健康饮食行为的间接作用为B = −0.023,= 0.002, 95% CI [−0.026, −0.020]; 在控制分数中等的个体中, 应激通过意向对健康饮食行为的间接作用为B = −0.021,= 0.001, 95% CI [−0.023, −0.018]; 在控制分数较高的个体中, 应激通过意向对健康饮食行为的间接作用为B = −0.016,= 0.001, 95% CI [−0.018, −0.014]。
图2展示了上述两个调节作用。其中基因在从应激到健康饮食意向的路径中起调节作用, 应激对意向的影响在基因型AA中更大(交互作用, 实线斜率大于虚线)。行动控制在从健康饮食意向到健康饮食行为的路径中起调节作用, 行动控制分数更高的个体健康行为更多(行动控制的主效应, 虚线高于实线), 而且饮食行为较少受到饮食意愿的影响(交互作用, 虚线斜率小于实线)。

表2 回归分析验证假设的中介和调节作用
注:意向代表健康饮食意向、行为代表健康饮食行为、控制代表行动控制。所有模型均控制了性别、年龄、教育程度。模型1~2检验意向在应激和行为之间的中介作用, 模型3~5检验基因在意向阶段的调节作用, 模型6检验行动控制在意志阶段的调节作用。*< 0.05,**< 0.01,***< 0.001。
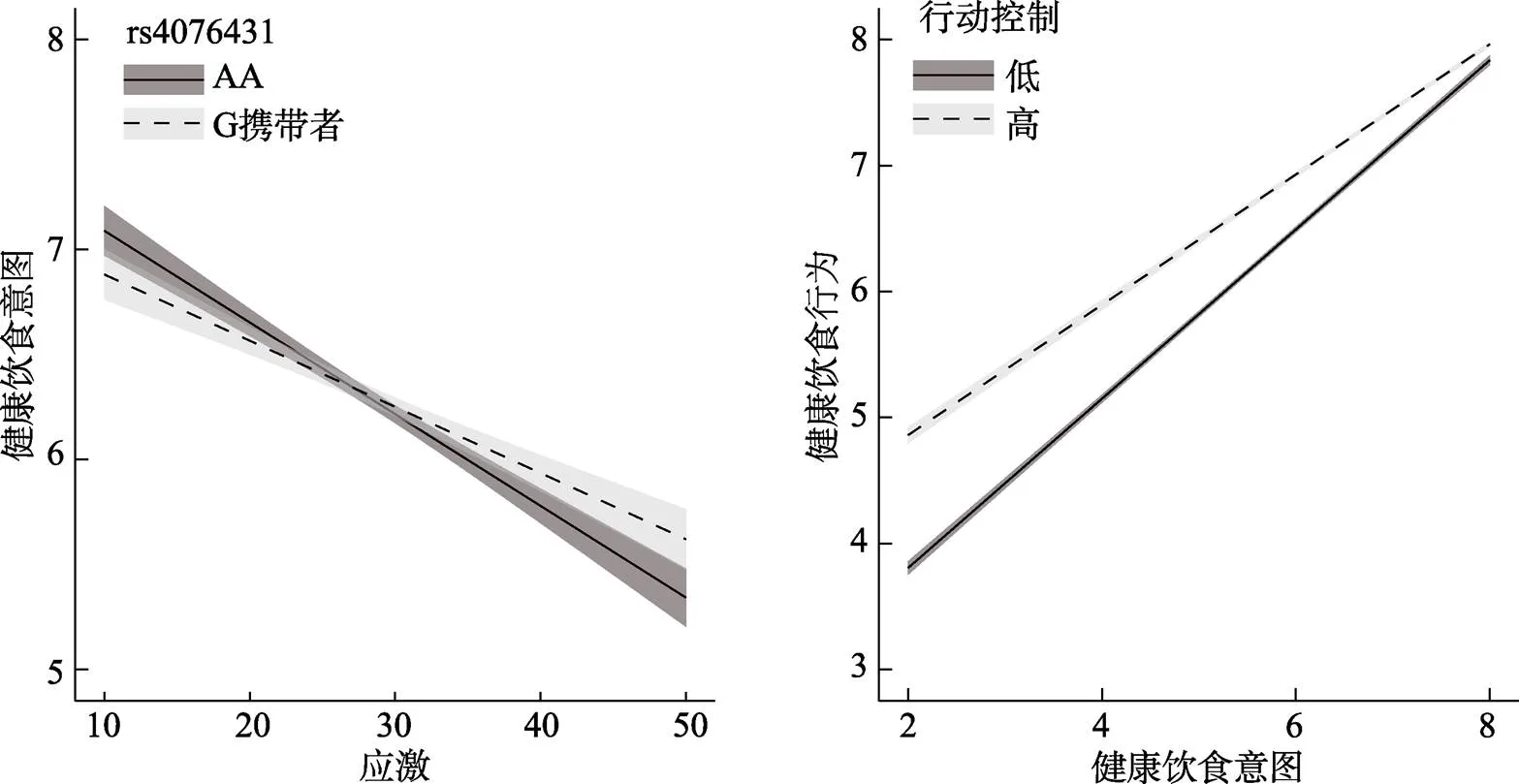
图2 基因和行动控制在应激−健康饮食意向−健康饮食行为中介路径中的调节作用
4 讨论
4.1 重要结果的解释
本研究的目的是将HAPA与迷走神经系统支配性理论相结合, 以探讨应激、基因和行动控制影响健康行为的机制。研究结果显示, 在14675名中国汉族成年人中, 应激通过影响健康饮食意向进而影响健康饮食行为的中介模型得到支持。在健康行动过程模型的意向阶段, CSF3R基因调节了应激与健康饮食意向之间的关系。AA等位基因携带者(假设对应于向营养型), 应激和健康饮食之间存在显著负相关。对于G等位基因携带者(假设对应于兴奋型), 应激与健康饮食之间的相关较小。而在健康行动过程模型的意志阶段, 行动控制在从健康饮食意向到健康饮食行为的路径中起调节作用, 行动控制分数更高的个体的饮食行为较少受到饮食意愿的影响。所有结果均通过了分半交叉验证。
对于基因对应激的调节作用, 与其他研究(Krueger& Chang, 2008; van der Zwaluw et al., 2009; van Strien et al., 2010)一致, 我们发现了支持基因−环境(G×E)相互作用的证据。当与风险基因型(CSF3R AA纯合子)相结合时, 不良环境(高应激)对不健康饮食有更高风险。值得注意的是, 无论是AA基因型还是G携带者, 应激与健康饮食意向之间均呈现负性关系,这与元分析(Hill et al., 2021)中的大部分前人研究一致。应激越大, 健康饮食意愿越低。另外值得关注的是, 本研究中基因仅调节了从应激到意图的阶段, 对后半段从意图到行为的阶段并未发现显著的调节效应, 这与HAPA模型中被经常关注和讨论的意志阶段的障碍相符, 从健康意图的产生到实施健康行为需要通过计划和行为控制跨过很多阻碍, 基因通常效应量较小, 较难对这个阶段产生影响。
本研究聚焦的CSF3R是影响细胞因子受体表达的基因, 是与慢性心理应激反应密切相关的基因(Kawai et al., 2007; Le Niculescu et al., 2011)。然而, 关于该基因作为个体差异指标参与健康饮食的心理学过程的研究很少。本研究将HAPA理论和迷走支配性理论应用于应激下的进食问题, 其结果在基因层面上部分解释了应激阻碍健康饮食的个体差异。这里需要说明的是, 基因作为个体差异变量的效应量通常并不大, 在本研究中也是如此, 因此对于结果的推广要尤为慎重。本研究希望把基因作为应激影响健康行为的个体化模型的一个起点, 未来可以在生理、行为、家庭、社会等各层面纳入更多更有效的个体差异因素。
对于行动控制的调节作用, 虽然本研究支持了行动控制在健康饮食意向和健康饮食行为之间的调节作用, 但与传统HAPA模型的预测不同, 高水平的行动控制更多地表现为对健康饮食行为的提升, 而不是对健康饮食意向和行为差距的弥合。如果考虑从应激到意向再到行为的整个过程, 高行动控制的个体比低行动控制的个体的健康饮食行为受到应激的负面影响更小。
4.2 理论创新性和应用价值
本研究拓展了若干前人理论的应用范围。如应激韧性的理论模型, 前人研究发现具有有效应对能力的个体在经历了适度的应激后, 可以保持其心理力量(Garmezy, 2016)。本研究将应激韧性应用于健康饮食, 并发现当感知应激水平高时, 一些人可能会被激励去开发更多的积极资源, 从而调节饮食行为, 而另一些人则可能以不健康饮食的方式应对。针对这种个体差异, 我们的研究结果也扩展了之前对CSF3R多态性的G×E研究结果, 验证了CSF3R在应激中的重要功能, 并证实了具有某些CSF3R基因型的个体在应激中更不容易坚持健康的饮食习惯。这与Chang等(2016)的研究一致, 不同等位基因的调节作用在于其对应激的应对方式不同, 遗传因素在这个路径上发挥了作用。与其他基因型相比, 某些基因型更能抵抗应激对健康饮食的消极影响, 这也表明健康的饮食行为是应激适应性的重要指标。
除了对前人研究的应用拓展, 本研究的主要理论创新是将应激韧性理论, HAPA, 与遗传个体差异相结合, 提出了针对应激的个体化健康行动模型。在HAPA的框架下, 我们发现应激主要在意向阶段对健康行为起阻碍作用, 基因型调节了应激在意向阶段的作用, 行动计划在意向阶段也有很强的主效应, 并在意志阶段调节了健康意向对健康行为的作用。据此, 我们提出了新的理论:应激影响健康行为的个体化模型, 其目的是通过结合HAPA和迷走神经支配性理论来填补关于应激与不健康饮食之间关系的理论空缺。这是首个在健康行为改变模型中纳入情境因素应激, 并考虑基因生物学基础的研究。这打破了健康行为改变模型通常聚焦于个体行为层面的传统, 在行为层面(行动控制)之外, 尝试从更底层的生理层面(基因)和更宏观的环境层面(应激)多方考虑影响健康行为选择的机制。
我们提出的模型不仅包含了应激暴露水平, 还包含了以基因型为例的个体差异来参与健康饮食过程。这个模型的发展丰富了健康行为过程模型(图1)。具体来说, 本研究中提出的应激的个体化健康行动模型解释了应激后出现健康行为消极结果的情况, 从而将人与环境的互动引入健康行为过程模型。此外, 应激的个体化健康行动模型对应激与健康行为的关系的形状及其促进因素进行了细致的描述。基因型可能在个人层面上调节风险和复原力(Feder et al., 2009)。我们的模型和实证结果为解释应激与健康行为的关系提供了遗传基础, 它意味着基因差异可能部分地解释了为什么只有一些人在应激暴露下发展出了不健康的饮食行为, 而另一些人则没有(Phoolka & Kaur, 2012)。
此外, 本研究在一个全国性的大样本中, 检验了应激和健康饮食之间的关系, 取得了稳健的结果,并对结果进行交叉验证, 从而使基因、应激和健康饮食之间的关系更加坚实。我们的结果验证了CSF3R与应激的相互作用与健康饮食行为的维持和破坏之间的关联, 这种在应激后仍然可以维持健康饮食的行为体现了对应激的韧性, 因此本研究也用大样本为心理韧性理论提供了一个重要证据。
这一结果也具有重要的现实意义。近年来, 随着人们对基因与健康关系的深入研究, 越来越多的人开始重视个体化健康饮食干预。不同基因个体的饮食需求和反应可能存在差异, 因此, 制定基于个体基因信息的健康饮食方案可以帮助人们更好地保持健康。目前基于个体基因信息的健康饮食干预手段已经很常见(Mullins et al., 2020)。在代谢基因、营养相关基因等的基础上, 本研究的结果提示我们增加迷走神经支配性基因对健康饮食方案的参考价值。对于兴奋型为主的个体, 由于应激与不健康饮食的关联性较低, 以应激为目标的干预或许并不能达到效果, 应寻找其他干预靶点帮助这些人健康饮食, 如适量增加蛋白质和膳食纤维的摄入, 鼓励增加水果和蔬菜的摄入, 并减少高糖高脂的食物。而对于营养型为主的个体, 由于应激水平与不健康饮食的关联性, 干预的目标可以是减少应激水平并改善饮食习惯。此外, 最近由O'Connor等(2015)开发的一项干预措施提供了一种有希望的方法。这种方法沿用了Adriaanse等(2009)用健康零食替代不健康零食的干预思路, 要求参与者想象自己在压力情况下选择健康零食计划并实施, 如感到担忧时吃一个苹果。随机对照实验支持了这种干预方法的有效性, 与对照组相比, 实验组参与者随后的日常压力不再与不健康零食相关联, 并且在压力大的日子里确实吃了更多的健康零食(O'Connor et al., 2015)。这种干预的目的不是为了减少压力引起的不健康饮食本身, 而是帮助人们提前计划, 增加他们在压力下选择健康食物的可能性, 颇具借鉴意义。
4.3 局限性和未来建议
目前的研究有几个局限性。首先, 我们得到的基因结果是基于中国汉族人的, 这可能会限制我们研究的普遍性。有必要进一步研究不同族群共享和非共享的遗传特征, 这可能有助于未来整合遗传−心理特质关联研究。另外, 由于涉及CSF3R的研究较少, 本研究中基因的效应量也较小, 未来的研究需要重复我们的发现, 如增加更多的候选基因并使用更多样化的样本(Chabris et al., 2015), 也需要更多的研究来确立迷走调节类型支配性与CSF3R基因型的关系。其次, 由于自我报告的局限性, 这些研究数据本质上是相关性的, 应该谨慎地推断应激与饮食行为的因果关系。需要说明的是, 我们选择的环境应激变量是自我的应激感知水平, 可能与客观应激有所差异, 这其中已经包含了个体应对能力的因素(Cohen et al., 1983)。未来的研究应该考虑对应激变量进行更全面的评估。如生态瞬时评估(EMA)允许通过在现实生活中每天多次重复评估行为(如食物摄入)、经历(如感知压力)和生理参数来研究复杂的心理、行为和生理过程(Smyth & Stone, 2003)。鉴于饮食是一种每天多次重复发生的健康行为(Dunton, 2018), EMA似乎特别适合研究应激与食物摄入量之间的复杂关系。它通过最小化回忆偏差、最大化生态有效性和捕捉人内过程和随时间和跨环境变化的变化, 规避了传统方法的缺点(例如, 回顾性自我报告和实验室任务) (封丹珺, 石林, 2004; Ruf et al., 2022; Shiffman et al., 2008)。此外, 虽然本研究控制了年龄、性别、教育程度等人口统计学变量, 但并没有纳入BMI指数。而已有研究发现BMI更高的个体在承受应激时往往会消耗更多的食物(O'Connor et al., 2008)。本研究由于超过一半被试未报告BMI, 无法分析该变量对模型的影响, 未来研究应该考虑将BMI纳入模型。最后, 虽然健康饮食是健康行为的重要指标, 但它只是健康行为的一个方面。由于HAPA模型主要用于解释产生健康行为的意向和行动, 本研究只测量健康饮食, 且用到的健康饮食问卷指标较为粗糙。具体来说, 前言提的模型主要是从食物能量出发, 应激下需要消耗能量来应对可能的威胁, 会增加高糖高脂饮食而导致肥胖问题, 但是在测量健康饮食行为时, 却因循既往健康饮食的做法, 只测了水果和蔬菜的食用情况。未来涉及应激与饮食的研究, 应当包括高糖高脂饮食的测量, 还应该在测量中考虑饮食多样化和均衡, 比如只吃水果和蔬菜这种不均衡的饮食结构也并不健康, 此外, 还可以考虑其他的健康行为, 如锻炼, 以进一步验证所提出的理论模型。我们预期应激影响健康行为的现象应该是普遍存在的, 而针对每个健康行为, 可能会有相同或不同的调节因子。
Adriaanse, M. A., de Ridder, D. T. D., & de Wit, J.. F. (2009). Finding the critical cue: Implementation intentions to change one's diet work best when tailored to personally relevant reasons for unhealthy eating., 60−71.
Araiza, A. M.& Lobel, M.(2018)Stress and eating: Definitions, findings, explanations, and implications(4), e12378.
Armitage, C. J., & Conner, M. (2001). Efficacy of the theory of planned behaviour: A meta-analytic review.,(4), 471−499.
Baumeister, R. F., Tice, D. M., & Vohs, K. D. (2018). The strength model of self-regulation: Conclusions from the second decade of willpower research.(2), 141−145.
Bycroft, C., Freeman, C., Petkova, D., Band, G., Elliott, L. T., Sharp, K., ... Marchini, J. (2018). The UK Biobank resource with deep phenotyping and genomic data.(7726), 203−209.
Chabris, C. F., Lee, J. J., Cesarini, D., Benjamin, D. J., & Laibson, D. I. (2015). The fourth law of behavior genetics.,(4), 304−312.
Chang, H. A., Fang, W. H., Chang, T. C., Huang, S. Y., & Chang, C. C. (2016). Association of neuropeptide Y promoter polymorphism (rs16147) with perceived stress and cardiac vagal outflow in humans.31683.
Chesnokova, V., & Melmed, S. (2002). Minireview: Neuro- immuno-endocrine modulation of the hypothalamic- pituitary-adrenal (HPA) axis by gp130 signaling molecules.(5), 1571−1574.
Cohen, S., Kamarck, T., & Mermelstein, R. (1983). A global measure of perceived stress.,(4), 385−396.
de Ridder, D., Kroese, F., Evers, C., Adriaanse, M., & Gillebaart, M. (2017). Healthy diet: Health impact, prevalence, correlates, and interventions.(8), 907−941.
Diop, M., Epstein, D., & Ruiz-Adame, M. (2021). Personality traits associated with healthy diet and obesity: A systematic review.,(Suppl. 3), ckab164.446.
Dunton, G. F. (2018). Sustaining health-protective behaviors such as physical activity and healthy eating.(7), 639−640.
Everly, G. S., & Lating, J. M. (2019). The anatomy and physiology of the human stress response. In(pp. 19−56). Springer, New York, NY.
Feder, A., Nestler, E. J., & Charney, D. S. (2009). Psychobiology and molecular genetics of resilience.(6), 446−457.
Feng, D. & Shi, L. (2004). Introduction of ecological momentary assessment and other methods for measuring coping ways.(3), 6−12.
[封丹珺, 石林. (2004). 应对方式的生态瞬时评估法及其他测量方法简介.(3), 6−12.]
Fodor, D. P., Antoni, C. H., Wiedemann, A. U., & Burkert, S. (2014). Healthy eating at different risk levels for job stress: Testing a moderated mediation.,(2), 259−267.
Food and Agricultural Organization. (2015).. Retrieved from htpp://www.fao.org/ nutrition/education/food-dietary-guidelines/home/en/
Garmezy, N. (2016). Resiliency and vulnerability to adverse developmental outcomes associated with Poverty.(4), 416−430.
Gellhorn, E. (1967).. University of Minnesota Press.
Glaser, R., & Kiecolt-Glaser, J. K. (2005). Stress-induced immune dysfunction: Implications for health.(3), 243−251.
Groesz, L. M., McCoy, S., Carl, J., Saslow, L., Stewart, J., Adler, N., ... Epel, E. (2012). What is eating you? Stress and the drive to eat.,(2), 717−721.
Heuse, S., Gekeler,., & Fodor, D. (2021). The role of physical exercise as a personal resource against job stress.,(4), 1251−1260.
Hill, D.Conner, M.Clancy, F.Moss, R.Wilding, S.Bristow, M.O'Connor, D. B.(2021).Stress and eating behaviours in healthy adults: A systematic review and meta-analysis280304
Kang, K., Sun, X., Wang, L., Yao, X., Tang, S., Deng, J., ... Chen, G. (2020). Direct-to-consumer genetic testing in China and its role in GWAS discovery and replication.. doi: 10.1007/s40484-020-0209-2
Kawai, T., Morita, K., Masuda, K., Nishida, K., Shikishima, M., Ohta, M., ... Rokutan, K. (2007). Gene expression signature in peripheral blood cells from medical students exposed to chronic psychological stress.,(3), 147−155.
Kim, B. M., Lee, B. E., Park, H. S., Kim, Y. J., Suh, Y. J., Kim, J. Y., ... Ha, E. H. (2016). Long working hours and overweight and obesity in working adults.,(1), 1−9.
Klatzkin, R. R., Baldassaro, A., & Rashid, S. (2019). Physiological responses to acute stress and the drive to eat: The impact of perceived life stress., 393−399.
Kogan, A. V., Allen, J. J., & Weihs, K. L. (2012). Cardiac vagal control as a prospective predictor of anxiety in women diagnosed with breast cancer.(1), 105−111.
Krueger, P. M., & Chang, V. W. (2008). Being poor and coping with stress: Health behaviors and the risk of death.,(5), 889−896.
Lazarus, R. S. (1995). Psychological stress in the workplace. In R. Crandall & P. L. Perrewé (Eds.),(pp. 3−14). CRC Press.
Le-Niculescu, H., Balaraman, Y., Patel, S. D., Ayalew, M., Gupta, J., Kuczenski, R., ... Niculescu, A. B. (2011). Convergent functional genomics of anxiety disorders: Translational identification of genes, biomarkers, pathways and mechanisms.,(5), e9.
Liu, Y., Song, Y., Koopmann, J., Wang, M., Chang, C. H. D., & Shi, J. (2017). Eating your feelings? Testing a model of employees’ work-related stressors, sleep quality, and unhealthy eating.,(8), 1237−1258.
Manichaikul, A., Mychaleckyj, J. C., Rich, S. S., Daly, K., Sale, M., & Chen, W.-M. (2010). Robust relationship inference in genome-wide association studies.,(22), 2867−2873.
McLaughlin, K. A., Rith-Najarian, L., Dirks, M. A., & Sheridan, M. A. (2015). Low vagal tone magnifies the association between psychosocial stress exposure and internalizing psychopathology in adolescents.(2), 314−328.
Mullins, V. A., Bresette, W., Johnstone, L., Hallmark, B., & Chilton, F. H. (2020). Genomics in personalized nutrition: Can you “eat for your genes”?(10), 3118.
O'Connor, D. B., Armitage, C. J., & Ferguson, E. (2015). Randomized test of an implementation intention‐based tool to reduce stress‐induced eating.(3), 331−343.
O'Connor, D. B., Jones, F., Conner, M., McMillan, B., & Ferguson, E. (2008). Effects of daily hassles and eating style on eating behavior.(1S), S20−31.
Payne, N., Jones, F., & Harris, P. R. (2005). The impact of job strain on the predictive validity of the theory of planned behaviour: An investigation of exercise and healthy eating.,(1), 115−131.
Peeters, A. (2018). Obesity and the future of food policies that promote healthy diets. Nature(7), 430−437.
Phoolka, E. S., & Kaur, N. (2012). Adversity Quotient: A new paradigm to explore.(4), 67−78.
Pilkington, P. D., Bishop, A., & Younan, R. (2021). Adverse childhood experiences and early maladaptive schemas in adulthood: A systematic review and meta‐analysis.(3), 569−584.
Porges, S. W. (1992). Vagal tone: A physiologic marker of stress vulnerability.,(3), 498−504.
Porges, S. W. (1995). Cardiac vagal tone: A physiological index of stress.,(2), 225−233.
Porges, S. W. (2007). The polyvagal perspective.(2)116−143.
Reichenberger, J., Pannicke,., Arend, A. K., Petrowski, K., & Blechert, J. (2021). Does stress eat away at you or make you eat? EMA measures of stress predict day to day food craving and perceived food intake as a function of trait stress-eating.(2), 129−147.
Ruf, A., Neubauer, A.., Koch, E. D., Ebner, P. U., Reif, A., & Matura, S. (2022). Individual differences in the dietary response to stress in ecological momentary assessment: Does the individual‐difference model need expansion?doi: 10.1111/aphw.12400
Schwarzer, R., & Hamilton, K. (2020). Changing behavior using the health action process approach., 89−103.
Schwarzer, R., & Luszczynska, A. (2008). How to overcome health-compromising behaviors: The health action process approach.,(2), 141−151.
Schwarzer, R., Lippke, S., & Luszczynska, A. (2011). Mechanisms of health behavior change in persons with chronic illness or disability: The health action process approach (HAPA).,(3), 161−170.
Schwarzer, R., Schüz,., Ziegelmann, J. P., Lippke, S., Luszczynska, A., & Scholz, U. (2007). Adoption and maintenance of four health behaviors: Theory-guided longitudinal studies on dental flossing, seat belt use, dietary behavior, and physical activity.,, 156 −166.
Shiffman, S., Stone, A. A., & Hufford, M. R. (2008). Ecological momentary assessment.,, 1−32.
Shuck,., Hart, J., Walker, K., & Keith, R. (2021). Work determinants of health: New directions for research and practice in human resource development.. doi: 10.1002/hrdq.21468
Siegrist, J., & Rödel, A. (2006). Work stress and health risk behavior.,(6), 473−481.
Smeets, T. (2010). Autonomic and hypothalamic−pituitary− adrenal stress resilience: Impact of cardiac vagal tone.(2), 290−295.
Smyth, J. M., & Stone, A. A. (2003). Ecological momentary assessment research in behavioral medicine(1), 35−52.
Sniehotta, F. F. (2009). Towards a theory of intentional behaviour change: Plans, planning, and self-regulation.,, 261−273.
Sniehotta, F. F., Scholz, U., & Schwarzer, R. (2005). Bridging the intention-behaviour gap: Planning, self-efficacy and action control in the adoption and maintenance of physical exercise.,(2), 143−160.
Souza, G. G. L., Mendonça-de-Souza, A. C. F., Barros, E. M., Coutinho, E. F. S., Oliveira, L., Mendlowicz, M. V., ... Volchan, E. (2007). Resilience and vagal tone predict cardiac recovery from acute social stress.(4), 368−374.
Steptoe, A., Hamer, M., & Chida, Y. (2007). The effects of acute psychological stress on circulating inflammatory factors in humans: A review and meta-analysis., 21(7), 901−912.
Stevenson, R. J. (2017). Psychological correlates of habitual diet in healthy adults.(1), 53−90.
Stone, A. A., & Brownell, K. D. (1994). The stress-eating paradox: Multiple daily measurements in adult males and females.(6), 425−436.
Stults-Kolehmainen, M. A., & Sinha, R. (2014). The effects of stress on physical activity and exercise.,(1), 81−121.
Sullivan, P. F., Fan, C., & Perou, C. M. (2006). Evaluating the comparability of gene expression in blood and brain.(3), 261−268.
Torres, S. J., & Nowson, C. A. (2007). Relationship between stress, eating behavior, and obesity.(11-12), 887−894.
Van Der Zwaluw, C. S., & Engels, R. C. (2009). Gene− environment interactions and alcohol use and dependence: Current status and future challenges.,(6), 907−914.
van Strien, T., Snoek, H. M., van der Zwaluw, C. S., & Engels, R. C. (2010). Parental control and the dopamine D2 receptor gene (DRD2) interaction on emotional eating in adolescence.,(2), 255−261.
Wardle, J., Steptoe, A., Oliver, G., & Lipsey, Z. (2000). Stress, dietary restraint and food intake.,(2), 195−202.
Webb, T. L., & Sheeran, P. (2007). How do implementation intentions promote goal attainment? A test of component processes.,(2), 295−302.
Willett, W. C. (1994). Diet and health: What should we eat?(5158), 532−537.
Yang, T. Z., & Huang, H. T. (2003). An epidemiological study on stress among urban residents in social transition period.(9), 760−764.
[杨廷忠, 黄汉腾. (2003). 社会转型中城市居民心理压力的流行病学研究.(9), 760−764.]
Zhou, H., Long, L. (2004). The procedure and statistical remedy for common method variance.12(6), 942−950.
[周浩, 龙立荣. (2004). 共同方法偏差的统计检验与控制方法.(6), 942−950.]
Moderating effects of CSF3R and action control between stress and healthy eating: Preliminary evidence for an individual health action against stress model
HU Yueqin1, WANG Lizhong2, CHEN Gang2, GAN Yiqun3
(1School of Psychology, Beijing Normal University, Beijing 100875, China) (2WeGene, Shenzhen Zaozhidao Technology Co. Ltd., Shenzhen 518042, China) (3School of Psychological and Cognitive Sciences and Beijing Key Laboratory of Behavior and Mental Health, Peking University, Beijing 100871, China)
A healthy diet is essential to maintaining a healthy lifestyle, yet many factors may hinder a healthy eating plan. Some studies have found that people tend to consume more unhealthy foods to cope with stress. But the opposite findings also exist. Some people under stress may still maintain a healthy diet. The mechanisms by which people make different dietary choices under stress are not yet clear.
This study combined health behavior theories and vagal tone theory and proposed a gene stress interaction model of dietary choice, arguing that different dietary choices under stress may be related to two types of vagal tone: trophotropic or ergotrophic, representing the tendency to regenerate and recover or the tendency to prepare for fight or flight. CSF3R is a granulocyte colony-stimulating factor receptor that is closely associated with chronic psychological stress responses, and its different genotypes may lead to different stress responses, exhibiting the aforementioned tendency toward or away from nutrition. In addition, action control suggested by HAPA (Health Action Process Approach) may also play a critical role in the implementation of healthy eating intentions into healthy eating behaviors.
A sample of 14675 Chinese adults completed genotyping of their saliva samples, as well as questionnaires on perceived stress, action control, and healthy dietary intentions and behaviors. CSF3R was used as a candidate gene reflecting vagal tone due to its proven impact on stress response. Regression analysis was used to test the effect of stress on healthy dietary intentions and behaviors, and the moderating effect of the CSF3R gene and action control.
Results found that stress predicted a significant reduction in healthy dietary intentions and a subsequent reduction in healthy dietary behaviors. The CSF3R gene rs4076431 and its linked loci rs4498771, rs10752589, rs9660229 moderated the relationship between stress and healthy eating intentions, while action control moderated the relationship between healthy eating intentions and behaviors. In rs4076431, for example, the negative relationship between stress and healthy eating intentions was stronger in AA genotype (trophotropic) than the G carriers (ergotrophic). And higher levels of action control were associated with more healthy eating behaviors and less indirect impact of stress on behavior.
These results supported the individual health action against stress model, which may be applied to healthy diet education and stress management. Individual's stress levels reflecting environmental influence, dominance of vagal tone (or genotype) and action control reflecting individual physiological and psychological factors may all have an impact on dietary choices.
healthy eating; perceived stress; gene; vagal tone
2022-09-12
* 国家自然科学基金项目(32171076; 3217070197)资助。
甘怡群, E-mail: ygan@pku.edu.cn
B845
