苯硼酸响应的增强型海藻酸钠载药微囊的制备与性能
2023-09-06林敏婕程修文杨云聪章明豪蔡玉荣
林敏婕 程修文 杨云聪 章明豪 蔡玉荣

摘 要: 以海藻酸钠为壳材,透明质酸钠为囊材,苯硼酸接枝的丝素蛋白纳米晶须为壳层增强相,采用同轴静电纺丝技术制备具有葡萄糖响应性的增强型海藻酸钠/透明质酸钠载药微囊,并对微囊的形貌结构、稳定性、葡萄糖响应性及细胞毒性进行分析。结果表明:采用同轴静电纺丝技术可成功制备具有核壳结构的海藻酸钠/透明质酸钠微囊,添加丝素蛋白纳米晶须可有效提高微囊的稳定性和药物包封率;丝素蛋白纳米晶须的添加量为1.0 mg/mL时,微囊的稳定性最佳,药物负载量达32.56%,药物缓释时间可长达24 h,该微囊具有灵敏的葡萄糖响应性和良好的生物相容性,是一种具有较好应用潜能的糖尿病药物载体。
关键词: 丝素蛋白纳米纤维晶须;苯硼酸;葡萄糖响应;海藻酸钠水凝胶;药物缓释
中图分类号: TB34 文献标志码: A 文章编号: 1673-3851 (2023) 03-0228-09
引文格式:林敏婕,程修文,杨云聪,等. 苯硼酸响应的增强型海藻酸钠载药微囊的制备与性能[J]. 浙江理工大学学报(自然科学),2023,49(2):228-236.
Reference Format: LIN Minjie, CHENG Xiuwen, YANG Yuncong, et al. Preparation and properties of glucose-responsive drug-loaded calcium alginate microcapsules[J]. Journal of Zhejiang Sci-Tech University,2023,49(2):228-236.
Preparation and properties of glucose-responsive drug-loaded calcium alginate microcapsules
LIN Minjie, CHENG Xiuwen, YANG Yuncong, ZHANG Minghao, CAI Yurong
(School of Materials Science & Engineering, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract: The enhanced sodium alginate/sodium hyaluronate microcapsules were prepared by coaxial electrospinning with sodium alginate as shell materials, sodium hyaluronate as the core material and silk fibroin nanowhiskers grafted by phenylboronic acid as the shell reinforcement phase. The morphology, stability, glucose responsiveness and cytotoxicity of the microcapsules were studied. The results show that the core-shell structured sodium alginate/sodium hyaluronate microcapsules can be successfully prepared by coaxial electrospinning, and the addition of silk fibroin nanowhiskers can effectively improve the stability and drug encapsulation rate of the microcapsules. When the dosage of silk fibroin nanowhiskers is 1.0 mg/mL, the stability of the microcapsules is the best, the drug loading efficiency reaches 32.56%, and the drug sustained release time can be prolonged to 24 h. As the microcapsules are sensitive to glucose and have good biocompatibility, they are a promising drug carrier for diabetes drugs.
Key words: silk fibroin nanowhiskers; phenylboronic acid; glucose-responsive; sodium alginate hydrogel; drug sustained release
0 引 言
糖尿病是一種严重威胁人类健康的代谢疾病,主要表现为长期高血糖,由糖尿病引起并发症包括高血压、眼部疾病、肾病、心脑血管疾病、皮肤感染和下肢损伤等。2019年,全球20~79岁的成年人估计有4.63亿患有糖尿病,400多万人死于糖尿病[1];预计2045年糖尿病患者将达到6.93亿人[2]。目前临床使用较多的药物有胰岛素、促进胰岛素分泌药物、胰岛素增敏剂和酶靶点调节剂;其中,以盐酸二甲双胍(Metformin hydrochloride, MH)为代表的胰岛素增敏剂,可增加葡萄糖运转、增强外周组织的糖利用率、有效减少肠道对葡萄糖的吸收,且具有价格便宜等优势,成为许多糖尿病患者的首选药物[3]。然而,MH直接服用存在利用度较低(50%~60%)、半衰期短且波动较大(0.9~2.6 h)的问题[4],在临床上需要大剂量多次用药才能维持有效血药浓度,但摄入过量容易引起乳酸中毒等并发症,加剧患者的病情[5]。
为保证MH的有效性,减少副作用,需要设计一种有缓释功能的载药微囊。海藻酸钠(Sodium alginate, SA)微球已用于MH缓释,有效提高了药物包封率和缓释性能[6]。为保持血糖稳定,载药微囊需要在病人血糖升高后及时释放药物,须在微囊中加入葡萄糖响应性结构单元[7]。葡萄糖响应性结构单元将葡萄糖浓度检测和药物释放结合在一起,在浓度较低的情况下缓慢释放药物,在高浓度下快速响应,释放更多药物,有效维持血糖的正常浓度[8]。用作葡萄糖响应的结构单元主要有葡萄糖氧化酶(GOx)、苯硼酸(PBA)及其衍生物和伴刀豆凝集素(Con A)3大类[8]。GOx和Con A为蛋白质,存在易变性失活的问题,应用受限[9]。苯硼酸是一种路易斯酸,易于修饰和改性,可以与含有邻二醇的物质(如葡萄糖)结合形成可逆的共价键[10]。苯硼酸在水溶液中存在电离平衡,有带负电的亲水离子和不带电的疏水分子两种形式;当葡萄糖浓度升高时,带负电的苯硼酸离子与葡萄糖结合,苯硼酸由疏水转为亲水而表现出葡萄糖响应性,利用苯硼酸的这一特性可有效构建葡萄糖响应的載药微囊[11]。
同轴静电纺丝技术可以制备出核壳结构微囊,可将药物包埋在微囊中实现药物的保护和缓释[12]。SA的生物相容性和稳定性较好,滴加入凝固浴中可制备成微囊,可以通过延长药物作用于靶点的时间来提高药效[13]。透明质酸(Hyaluronic acid, HA)作为生物体中广泛存在的物质,具有很好的生物亲和性,可以有效保护药物和人体细胞,降低感染的可能性[14]。丝素蛋白纳米纤维(Silk nanowhiskers, SNWs)作为一种天然的高分子材料,具有良好的机械性能和生物相容性,可以用于生物复合材料、抗菌材料、载物载体、组织学支架、医学移植等。
本文利用同轴静电纺丝技术,以SA为壳材,HA为囊材和MH为药物模型,制备SA/HA微囊;在SA/HA微囊中添加SNWs制备得到更加稳定、更高强度的SNWs-SA/HA微囊,并在SNWs上接枝PBA,制备得到具有葡萄糖响应性的PBA-SNWs-SA/HA微囊;分析微囊对小鼠成纤维细胞(L929细胞)的毒性,探究微囊的性能、药物负载和释放情况,以期获得兼具缓释和葡萄糖响应功能且生物相容性良好的载药微囊。
1 实验试剂与方法部分
1.1 实验试剂
蚕茧购于湖州新天丝生物技术有限公司,碳酸钠(Na2CO3)、海藻酸钠((C6H7O6Na)n)、透明质酸钠((C14H21NaNO11)n)、氯化钙(CaCl2)、氢氧化钠(NaOH)、尿素(CH4N2O)、盐酸二甲双胍(C4H12ClN5)、磷酸氢二钠(Na2HPO4)、磷酸二氢钠(NaH2PO4)、氯化钠(NaCl)、4-羧基苯硼酸(C7H7BO4)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐 (C8H17N3·HCl)(EDC)、N-羟基琥珀酰亚胺(C4H5NO3)(NHS)、葡萄糖(C6H12O6)均购自上海阿拉丁生化有限公司,DMEM培养基、PBS缓冲溶液(pH值7.4)、胰蛋白酶、青霉素链霉素双抗混合液、胎牛血清、二甲基亚砜(DMSO)和CCK-8均购自杭州兰堡海博生物技术有限公司。本文所有试剂均为分析纯。
1.2 SA/HA微囊的制备
以0.01 mol/L的CaCl2溶液为凝固浴,在静电纺丝机上利用同轴针头制备具有核壳结构的SA/HA微囊,其中主轴内是质量分数为1%的HA溶液,推速为0.0010 mm/min,副轴内是质量分数为1.5%的SA溶液,推速为0.0250 mm/min,电压为8.5 kV。
1.3 SNWs-SA/HA微囊的制备
将蚕茧剪成大小约为1×1 cm2,置于质量分数0.5%的Na2CO3溶液中,其中蚕茧和Na2CO3溶液的质量比为1∶100;煮沸1 h后捞出,用去离子水充分洗涤,除去蚕丝上未被完全溶解的丝胶,处理好的蚕丝放在50 ℃烘箱中烘干至恒重。SNWs制备方法参考Niu等[15],具体步骤如下:称取NaOH 6.48 g,尿素12.18 g,溶解在81.00 g的去离子水中,置于-20 ℃冰箱中预冷;4 h后称取3 g烘干蚕丝分散到溶液中,悬浮液每12 h搅拌10 min,共3 d;将悬浮液装入透析袋(MWCO=7 500 kDa)中透析3 d;最后将透析好的混合物在300 W的超声粉碎机中30 min,以4 500 r/min离心20 min回收上层悬浮液,得到SNWs。将SNWs掺杂到SA溶液中,得到SNWs掺杂量在0~1.6 mg/mL(梯度设置:0.2 mg/mL)的1.5% SA溶液,参照1.2中方法制备得到SNWs-SA/HA微囊。
1.4 PBA-SNWs-SA/HA微囊的制备
称取20 mg 4-羧基苯硼酸,通过超声波分散到10 mL PBS缓冲溶液中,加入80 mg EDC和120 mg NHS,于37 ℃摇床上150 r/min振荡15 min,快速离心,除去上清液;取20 mg SNWs加入10 mL PBS缓冲溶液后,加入活化后的4-羧基苯硼酸,于37 ℃摇床150 r/min振荡过夜,离心洗涤得到PBA-SNWs;将PBA-SNWs掺杂到SA溶液中,获得PBA-SNWs掺杂量为1.0 mg/mL的1.5% SA溶液,参照1.2中方法制备得到PBA-SNWs-SA/HA微囊。
1.5 载药微囊的制备
在质量分数为1%的HA溶液中添加MH,其中MH在混合溶液中的质量分数为10%,参照1.2中方法制备得到SA/HA、SNWs-SA/HA和PBA-SNWs-SA/HA载药微囊。
1.6 性能表征
1.6.1 理化性质
利用光学显微镜(E100,日本Nikon)拍摄微囊的形貌;利用场发射扫描电子显微镜(Ultra 55,德国Carl Zeiss)分析SNWs的结构形貌;利用傅里叶红外光谱(Nicolet 5700,美国Thermo Electron)分析PBA在SNWs上的接枝情况,测试范围为500~4 000 cm-1。
1.6.2 微囊的结构稳定性测试
利用Na2HPO4和NaH2PO4配制pH值为7.2、7.4和7.6的PBS缓冲液;向不同pH值的PBS缓冲溶液中放入SA/HA微囊、SNWs-SA/HA微囊、PBA-SNWs-SA/HA微囊各100颗,于37 ℃摇床150 r/min振荡,在6、12、24 h和48 h用显微镜观察微囊表面囊膜的完整性,计算破损率;测试微囊的化学稳定性,具体方法参考文献[16],每组设置3个平行样。配制质量分数0.9% NaCl溶液,重复上述实验,于37 ℃摇床150 r/min振荡72 h,通过显微镜观察微囊表面囊膜的完整性,根据式(1)计算破损率:
RB/%=(N破损/N总)×100(1)
其中:RB为微囊破损率;N破损为微囊的破损个数;N总为微囊总数。并测试微囊的机械稳定性,方法参考文献[16],每组设置3个平行样。
1.6.3 微囊的药物包封率和缓释分析
利用紫外分光光度计(UH4150,日本日立)测定1.0~10.0 μg/mL的MH溶液在233 nm处的吸光度,得到MH的标准曲线和拟合方程。具体方法如下:取分别制备了100颗SA/HA微囊、SNWs-SA/HA微囊的CaCl2溶液,测试CaCl2溶液在233 nm处的吸光度;由MH标准曲线确定CaCl2溶液中MH的浓度C非荷载,将制备得到的100颗SA/HA微囊、SNWs-SA/HA微囊分别加入去离子水,置于300 W超声粉碎机下超声10 min,离心取上清液,测试上清液在233 nm处的吸,具体方法参考文献[17],由MH标准曲线确定微囊中MH的浓度为C荷载,根据式(2)计算MH的包封率:
EC/%=【C荷载/C(荷载+C非荷载)】×100(2)
其中:EC为MH的包封率;C荷载为微囊中的MH的浓度;C非荷载为CaCl2溶液中MH的浓度。
将100颗SA/HA微囊、SNWs-SA/HA微囊分别置于30 mL pH值7.4的PBS缓冲溶液中,在37 ℃摇床上150 r/min进行振荡,在1、2、3、4、5、12 h和24 h时取上清液50 μL,并补加50 μL PBS缓冲溶液,测试上清液在233 nm处的吸光度,由MH标准曲线计算药物浓度,得到药物的累计释放率,每组设置3个平行样。
1.6.4 微囊的葡萄糖响应性及药物缓释
将SA/HA微囊、SNWs-SA/HA微囊、PBA-SNWs-SA/HA微囊放入0、1、2 mg/mL和3 mg/mL葡萄糖浓度的PBS缓冲溶液中,每隔30 min在显微镜下观察微囊的尺寸变化,每组设置3个平行样。将100颗载药后的SA/HA微囊、SNWs-SA/HA微囊、PBA-SNWs-SA/HA微囊放入0、1、2 mg/mL和3 mg/mL葡萄糖浓度的30 mL pH值7.4的PBS缓冲溶液中,于37 ℃摇床上150 r/min进行振荡,在1、2、3、4、5、12 h和24 h时取上清液50 μL,并补加50 μL PBS缓冲溶液,测试上清液在233 nm处的吸光度,由MH标准曲线计算药物浓度,得到药物的累计释放率。
1.6.5 细胞毒性评价
取SA/HA微囊、SNWs-SA/HA微囊、PBA-SNWs-SA/HA微囊各100个,分别放入10 mL完全培养基(DMEM培养基、胎牛血清、青霉素链霉素双抗溶液的体积比为100∶10∶1)中,在37 ℃培养箱中浸泡72 h,回收上清液作为微囊的浸出液。
以L929为细胞模型,将处于指数生长期的L929细胞接种在96孔板中,加入完全培养基100 μL/孔,培养箱培养过夜;细胞贴壁完成后,弃去原培养液,向孔板中分别加入各微囊的浸出液,各100 μL/孔,每组设置6个复孔,并设置阳性对照组(DMSO)和阴性对照组(完全培养基),在培养箱中孵育24 h;最后,向孔中滴加10 μL的CCK-8溶液,在培养箱中孵育1 h后取出,利用酶标仪测试孔板在450 nm处的吸光度。根据式(3)计算细胞的存活率:
CV/%=(OD实验/OD对照)×100(3)
其中:CV为细胞的存活率;OD实验为实验组在450 nm处的吸光度;OD对照为阴性对照组在450 nm处的吸光度。
利用Prism软件对SA/HA组、SNWs-SA/HA组、PBA-SNWs/HA组和阴性对照组进行p值分析。当p<0.05时,说明数据之间具有显著性差异,而当p值>0.05时,说明数据之间没有显著性差异。
2 结果与讨论
2.1 SNWs和PBA-SNWs的结构表征
利用SEM观察制备得到的SNWs微观形貌,结果如图1所示。由图1可知,SNWs的尺寸较为均匀,长度集中分布在500~1 000 nm,且分散性良好。纳米尺度及良好的分散性有利于SNWs在作为掺杂物时弥补基体的机械性能缺陷,提高材料的力学强度;SNWs掺杂有利于微囊在复杂生理环境中保持結构稳定[18];作为一种天然蛋白晶须,SNWs的两端存在大量裸露的羧基和氨基,有利于后续PBA的接枝[19]。
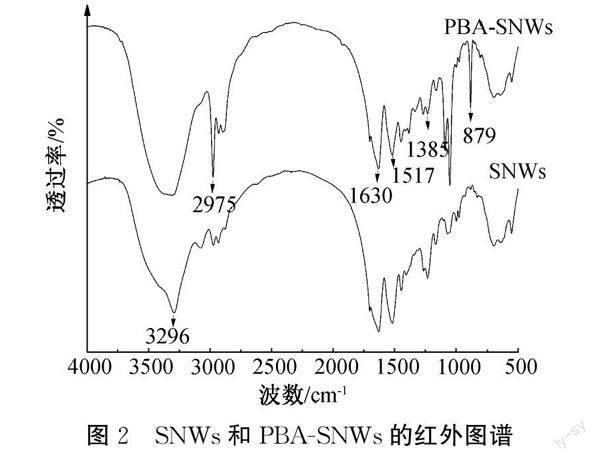
利用EDC、NHS对4-羧基苯硼酸进行活化,使4-羧基苯硼酸的羧基端与SNWs的氨基端发生酰胺化反应,实现接枝[20]。为实现葡萄糖响应,本文在SNWs上接枝PBA。利用FTIR对接枝后SNWs产物进行红外谱图分析,结果如图2所示。图2表明:接枝PBA后的SNWs基本保留了SNWs的原有结构,与SNWs相比,PBA-SNWs在3 296 cm-1处的峰减弱,3 296 cm-1是N—H键的伸缩振动吸收带是由于4-羧基苯硼酸和SNWs的氨基端发生反应,因此接枝后的SNWs在3 296 cm-1的峰几乎消失[21];在PBA-SNWs的FTIR谱图上,2 975 cm-1对应的是酰胺键的伸缩振动,1 517 cm-1和1 630 cm-1对应的是苯环的骨架震动,1 385 cm-1对应的是B—O键的伸缩振动,879cm-1处的峰说明苯环发生了单边对位二取代,进一步证明了PBA已经通过酰胺化反应成功接枝到SNWs上。
2.2 SA/HA微囊外观形态
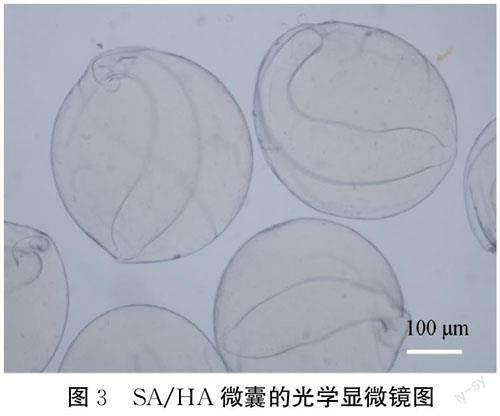
SA/HA微囊形态如图3所示。从图3可以看出,微囊呈现良好的分散性,直径约为500 μm,圆整度、尺寸均匀性良好,具有典型的核壳结构,说明利用同轴静电纺丝技术可以方便地制备具有核壳结构的微囊。
2.3 SNWs-SA/HA微囊的外观形态
为了增加SA/HA微囊的结构稳定性,向微囊的囊材中添加SNWs实现微囊的增强增韧[22],图4为不同SNWs掺杂量的SNWs-SA/HA微囊的形貌图。由图4可知:随着SNWs掺杂量的增加,SNWs-SA/HA微囊的颜色逐渐加深,微囊的直径呈现先增大后略有减小的趋势;当SNWs的掺杂量 为1.0 mg/mL,微囊直径达到最大,为600 μm;继续增加SNWs的掺杂量,微囊的直径略有减小;当SNWs的掺杂量为1.6 mg/mL时,微囊的直径缩小至约为530 μm,其原因是SNWs作为增强相,具有良好的强度,并与SA间有很好的亲和性;SNWs在SA溶液里均匀的分散,可使溶质之间相互作用力增加,溶液的黏度变大,液滴在同轴针头聚集,导致制备得到的微囊直径变大;当SNWs掺杂太多时,溶液中的纳米晶须会分散不均匀,晶须间甚至会缠绕连接,导致了微囊的体积收缩。
2.4 SNWs-SA/HA微囊的结构稳定性
人体内存在渗透压和pH值波动(pH值7.35~7.45),环境的变化会影响微囊的结构稳定性[23-24],本文分析离子强度对不同晶须掺杂量的微囊结构稳定性的影响,微囊的破损率如图5(a)所示。在0.9% NaCl溶液中浸泡72 h后,微囊出现了破损。随着SA/HA微囊中SNWs掺杂量的提高,微囊破损率呈现先下降后上升的趋势;当SNWs掺杂量达到1.0 mg/mL时,微囊破损率最低,为7%。随着SNWs掺杂量的继续增加,微囊破损率增加(见图5(a))。在不同pH条件下微囊的结构稳定性如图5(b)—(d)所示。由图6(b)—(d)可知:随着时间的延长,所有微囊的破损率都呈现升高趋势,其中未掺杂SNWs的SA/HA微囊的破损率受pH值的影响最大,随着环境pH值由7.2增加到7.6,微囊破损率由43%上升至73%;SNWs的掺杂有助于提高微囊的结构稳定性;当溶液pH值7.2时,随着SNWs在微囊中的掺杂量提升,微囊的破损率呈现先下降后上升的趋势,当SNWs的掺杂量为1.0 mg/mL时,微囊的破损率最低,为19%,对比没有掺杂SNWs时43%的微囊破损率,微囊的结构稳定性有明显提升。综合微囊的化学稳定性和机械稳定性测试可知,当SNWs掺杂量为1.0 mg/mL时,SA/HA微囊的结构稳定性最佳。
2.5 SNWs-SA/HA微囊的药物包封和缓释
选取SA/HA微囊和SNWs掺杂量为1.0 mg/mL的SNWs-SA/HA微囊进行药物包封和缓释测定,SA/HA微囊和SNWs-SA/HA微囊的药物包封率分别为11.58%和32.56%,说明SNWs的添加有利于药物的包封。本文进一步分析SA/HA和SNWs-SA/HA微囊(SNWs掺杂量为1.0 mg/mL)的药物释放动力学,结果如图6所示。由图6表明:SA/HA微囊中,药物释放速度很快,在5 h内药物的累计释放率已经达到了90.7%,并在后续基本维持不变;由于渗透作用和SA/HA微囊溶胀破损共同引起的药物快速释放,相较于MH直接在人体内使用时的释放周期为0.9~2.6 h[4],SA/HA微囊在一定程度上实现了MH缓释,但释放时间仍然较短;在SNWs-SA/HA微囊中,MH的释放可以分为2个阶段,分别为快速释放阶段和慢速释放阶段。前5 h为药物的快速释放阶段,药物的累计释放率达到25.55%;随后,微囊释药进入慢速阶段,到24 h时,药物的累计释放率达到43.15%,说明SNWs-SA/HA微囊具有很好的药物控释功能。以上结果显示:微囊的药物释放速率远远低于SA/HA微囊的药物释放速率,是由于SNWs的补强增韧作用赋予了微囊较好的强度和药物保护能力,SNWs中存在的大量氢键对药物也有一定的吸附作用,阻止药物提前外泄。因此,微囊的核壳结构以及SNWs的添加有助于实现微囊的药物缓释。
2.6 PBA-SNWs-SA/HA微囊的葡萄糖响应
为使SNWs-SA/HA微囊具有葡萄糖响应性,在SNWs上接枝了PBA,当葡萄糖浓度上升时,苯硼酸与葡萄糖结合,苯硼酸由疏水性转为亲水性,促使微囊膨胀,从而引发药物释放(见图7)。
微囊直径和药物释放在不同葡萄糖浓度中的变化情形如图8所示。由图8(a)可知,随着在溶液中浸泡时间的延长,微囊直径尺寸呈现单调增加趋势,且随着溶液中葡萄糖浓度的增加,胶囊尺寸增加的程度变大,可以证明微囊对葡萄糖的响应性。微囊的药物累计释放趋势与微囊的直径变化趋势相似,即随着浸泡时间的延长以及浸泡液中葡萄糖浓度的增加,药物释放速度变快(见图8(b)),其原因可能是PBA可以与溶液中的糖类物质可逆结合,在可逆结合过程中,SNWs网状结构会出现的膨胀[25],促使微囊的体积变大,微囊壁的通透性提升,进而加速MH的释放。以上结果说明PBA-SNWs-SA/HA微囊具有對葡萄糖响应性能,PBA-SNWs-SA/HA微囊在响应性药物载体方面具有较好的应用潜能。
2.7 微囊的细胞毒性评价
以L929为细胞模型,利用浸出液法测试各微囊的浸出液对细胞生长和增殖的影响,结果如图9所示。图9显示:SA/HA微囊浸出液的细胞活力高达98.27%,表现出良好的细胞相容性,与SA/HA微囊相比,SNWs-SA/HA及PBA-SNWs-SA/HA微囊浸出液的细胞活性与SA/HA微囊差异不明显,说明这两种微囊均具有良好的细胞相容性。本文对样品细胞毒性评价结果进行了p值分析:SA/HA、SNWs-SA/HA、PBA-SNWs/HA微囊组与阴性对照组的p值分别为0.12、0.58、0.75,均大于0.05,说明数据之间不存在显著性差异,即几组微囊浸出液对细胞的生长和增殖不存在明显毒性;而阳性对照组与阴性对照组的p值小于0.0001,具有显著性差异,说明细胞基本被DMSO杀死。以上结果表明,PBA-SNWs-SA/HA微囊对细胞生长和增殖的影响很小,具有良好的生物相容性。
3 結 论
本文利用同轴静电纺丝技术制备核壳结构的SA/HA微囊,向SA/HA微囊中添加SNWs以增强微囊的强度,通过在SNWs上接枝PBA赋予微囊葡萄糖响应性,探究了微囊的结构稳定性、载药能力、药物缓释能力和葡萄糖响应情况,并对微囊的细胞毒性进行了体外评价,结论如下:
a) 利用同轴静电纺丝技术可成功制备核壳结构的SA/HA微囊,方法简单,可操作性强;
b) 在SA/HA微囊壳层中添加SNWs可以有效提升微囊的结构稳定性和药物包封率,其中,当SNWs在壳层中添加比例为1.0 mg/mL时,增强效果最好,药物负载量可达32.56%;
c) PBA-SNWs-SA/HA微囊具有较好的葡萄糖响应性和药物缓释能力;
d) PBA-SNWs-SA/HA微囊具有较低生物毒性、较好应用潜力的药物递送系统。
参考文献:
[1]Saeedi P, Salpea P, Karuranga S, et al. Mortality attributable to diabetes in 20-79 years old adults, 2019 estimates: Results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Research and Clinical Practice, 2020, 162: 108086.
[2]Cho N H, Shaw J E, Karuranga S, et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2018, 138: 271-281.
[3]Howlett H C, Bailey C J. A risk-benefit assessment of metformin in type 2 diabetes mellitus[J]. Drug Safety, 1999, 20(6): 489-503.
[4]Balan G H, Timmins P, Greene D S, et al. In vitro -in vivo correlation (IVIVC) models for metformin after administration of modified-release (MR) oral dosage forms to healthy human volunteers[J]. Journal of Pharmaceutical Sciences, 2001, 90(8): 1176-1185.
[5]邹海明. 盐酸二甲双胍肠溶胶囊治疗2型糖尿病的临床效果及不良反应发生率[J]. 现代诊断与治疗, 2020, 31(23): 3734-3735.
[6]孙青, 罗威, 张俭, 等. 海藻酸钙/埃洛石载药微球的制备与缓释盐酸二甲双胍性能[J]. 化工进展, 2018, 37(8): 3138-3145.
[7]刘玉村, 岳明玮, 张莉莉, 等. 基于苯硼酸的树枝状凝胶及其刺激响应[J]. 化学研究与应用, 2019, 31(9): 1629-1634.
[8]李臻益, 胡晓玉, 强琚莉, 等. 闭路智能胰岛素载药体系的研究进展[J]. 有机化学, 2018, 38(1): 29-39.
[9]张宇琪, 俞计成, 沈群东, 等. 随葡萄糖响应的合成类闭路胰岛素递释系统[J]. 化学进展, 2015, 27(1): 11-26.
[10]吕娟, 马如江, 史林启. 含苯硼酸材料在药物投递中的研究进展[J]. 科学通报, 2016, 61(19): 2113-2123.
[11]尹子楚, 林敏婕, 程修文, 等. ZnO基葡萄糖响应性药物载体的制备与性能[J]. 浙江理工大学学报(自然科学版), 2021, 45(5): 581-587.
[12]Vaziri A S, Alemzadeh I, Vossoughi M, et al. Co-microencapsulation of Lactobacillus plantarum and DHA fatty acid in alginate-pectin-gelatin biocomposites[J]. Carbohydrate Polymers, 2018, 199: 266-275.
[13]Santagapita P R, Mazzobre M F, Buera M P. Formulation and drying of alginate beads for controlled release and stabilization of invertase[J]. Biomacromolecules, 2011, 12(9): 3147-3155.
[14]Ozoude C H, Azubuike C P, Ologunagba M O, et al. Formulation and development of metformin-loaded microspheres using Khaya senegalensis (Meliaceae) gum as co-polymer[J]. Future Journal of Pharmaceutical Sciences, 2020, 6: 120.
[15]Niu Q Q, Peng Q F, Lu L, et al. Single molecular layer of silk nanoribbon as potential basic building block of silk materials[J]. ACS Nano, 2018, 12(12): 11860-11870.
[16]刘锐, 蔡善君, 詹文芳, 等. ACA、APA微囊的强度、通透性及生物相容性研究[J]. 第三军医大学学报, 2009, 31(17): 1653-1656.
[17]Yin Z C, Lin M J, Xu Y, et al. Enzyme and Au nanoparticles encapsulated ZIF-8 for glucose responsive closed-loop drug delivery[J]. Materials Letters, 2021, 301: 130276.
[18]Sturcov A, Davies G R, Eichhorn S J. Elastic modulus and stress-transfer properties of tunicate cellulose whiskers[J]. Biomacromolecules, 2005, 6(2): 1055-1061.
[19]Pourabadeh A, Mirjalili M, Shahvazian M. Modification of silk fibroin nanofibers scaffold by PAMAM dendrimer for cell culture[J]. Journal of Experimental Nanoscience, 2020, 15(1): 297-306.
[20]Wang B L, Ma R J, Liu G, et al. Glucose-responsive micelles from self-assembly of poly(ethylene glycol)-b-poly(acrylic acid-co-acrylamidophenylboronic acid) and the controlled release of insulin[J]. Langmuir: the ACS Journal of Surfaces and Colloids, 2009, 25(21): 12522-12528.
[21]闻荻江, 王辉, 朱新生, 等. 丝素蛋白的构象与结晶性[J]. 纺织学报, 2005, 26(1): 110-112.
[22]Lin M J, Xie W J, Cheng X W, et al. Fabrication of silk fibroin film enhanced by acid hydrolyzed silk fibroin nanowhiskers to improve bacterial inhibition and biocompatibility efficacy[J]. Journal of Biomaterials Science, Polymer Edition, 2022, 33(10): 1308-1323.
[23]王中群. 重视糖尿病大血管并发症的发病、机制、评估与防治研究[J]. 中南医学科学杂志, 2022, 50(1): 1-6.
[24]李兆乾, 林建明, 吴季怀, 等. PEG致孔快速响应pH/温度双重敏感性PNIPAM/SA水凝胶的制备与性能[J]. 华侨大学学报(自然科学版), 2010, 31(6): 649-656.
[25]Mo R, Jiang T Y, Di J, et al. Emerging micro- and nanotechnology based synthetic approaches for insulin delivery[J]. Chemical Society Reviews, 2014, 43(10): 3595-3629.
(责任编辑:廖乾生)
收稿日期: 2022-03-02网络出版日期: 网络出版日期2022-10-08
基金项目: 浙江省国际科技合作项目-双边产业联合研发计划项目(2022C04027)
作者简介: 林敏婕(1997- ),女,浙江温州人,硕士研究生,主要从事生物医用材料的研究。
通信作者: 蔡玉榮,E-mail:caiyr@zstu.edu.cn
