不同梯度醇沉对红芪多糖提取含量的影响及其抗氧化活性和红外谱图的分析
2023-09-06海力茜陶尔大洪李明珠顾圆村钱方园阿曼妮萨麦提如则卡地尔亚库尔班
海力茜·陶尔大洪, 李明珠, 顾圆村, 钱方园, 阿曼妮萨·麦提如则, 卡地尔亚·库尔班, 杨 飞
(新疆医科大学药学院, 乌鲁木齐 830017)
关健词:水提分级醇沉; 红芪多糖; 含量测定; 抗氧化活性; 红外表征
红芪为豆科植物多序岩黄芪(HedysarumpolybotrysHand-Mazz)干燥的根,具有养血、壮阳、补气、消肿、止汗、通痹等功效[1-2],其主要活性成分为多糖,能够调节免疫力,抗肿瘤,减轻糖尿病并发症,改善血脂代谢紊乱等药理活性[3-7],临床上主要用于抗衰老[8]、糖尿病[9]、心脑血管疾病[10]、肿瘤[11]、溃疡[12]、骨质疏松[13]等的治疗。红芪多糖作为天然产物,与化学合成抗氧化药物相比,毒副作用小且安全,可长期使用不造成蓄积[14]。本实验针对红芪多糖分级醇沉所得各级醇沉物质进行抗氧化活性筛选,为后续红芪多糖的提取分离纯化、药理活性研究及药物开发提供理论依据,现报道如下。
1 仪器与试药
1.1 仪器SL-200型粉碎机(浙江省金华市永康松青五金厂);N-1001型旋转蒸发仪(上海爱朗仪器有限公司);HWS-28型电热恒温水浴锅(上海齐欣科学仪器有限公司);T6紫外-可见风光光度计(北京普析通用仪器有限责任公司)。
1.2 试剂双氧水(分析纯,上海远大过氧化物有限公司);新亚铜(分析纯,上海超聪化工有限公司;葡萄糖(分析纯,天津市北联精细化学品开发有限公司);苯酚(分析纯,成都维克奇生物科技有限公司)。
1.3 药材药材红芪于2021年2月购于甘肃完美商贸有限公司,经新疆医科大学药学院天然药物化学教研室丛媛媛教授鉴定为多序岩黄芪(HedysarumpolybotrysHand-Mazz)的干燥根。
2 方法与结果
2.1 红芪多糖的提取取10.0 g红芪药材粉碎,过筛备用。参考文献[15]的方法,采用水提法,按料液比1∶30加入纯化水,90℃水浴加热回流3 h,过滤后将滤渣再次用纯化水在90℃的水浴加热回流中提取3 h,合并两次提取液,并少量蒸馏水来洗涤残渣,次数为2次,将洗涤液合并后再加入提取液中。将提取液减压浓缩,平均分为4份,备用。
2.2 红芪多糖的分级醇沉取4份浓缩液,加入适量无水乙醇,使其乙醇终浓度分别为20%、40%、60%和80%,在4℃下静置12 h后弃去上清液,抽滤,收集沉淀物,将沉淀物进行冷冻干燥,备用,计算多糖提取率:多糖提取率/%=m1/m×100%(m1为红芪多糖质量,m为红芪的质量)。当乙醇浓度为20%、40%、60%和80%时,红芪多糖的提取率分别为66.21%、67.1%、83.10%和84.80%。
2.3 标准曲线及含量测定
2.3.1 对照品储备液的制备 称取10.00 mg葡萄糖对照品于100 mL容量瓶中,用纯化水定容至刻度,配置成0.1 mg/mL的对照品储备液,备用。
2.3.2 供试品储备液的制备 分别称取20%、40%、60%、80%醇沉红芪多糖沉淀样品各0.1 g,分别置于100 mL容量瓶中,用纯化水定容至刻度,分别吸取1 mL置于25 mL容量瓶中,用纯化水定容至刻度,备用。
2.3.3 标准曲线的绘制 取“2.3.1”项下的对照品储备液置于10 mL容量瓶,用纯化水定容至刻度,配制成浓度分别为0.002、0.003、0.004、0.005、0.006 mg/mL的系列对照品溶液。分别取系列对照品溶液2.00 mL,加入5%苯酚溶液1.00 mL和5.00 mL浓硫酸,静置30 min,用紫外分光光度计测定490 nm处吸光度,以多糖浓度为横坐标(X),吸光度为纵坐标(Y),绘制标准曲线,得回归方程:Y=15.25X-0.0512,r=0.999 7,红芪多糖浓度在0.018 5~0.058 9 mg/mL范围内线性关系良好。
2.3.4 含量测定 取“2.3.2”项下4组供试品储备液2.0 mL,按“2.3.3”项下方法测定多糖浓度,按公式:多糖含量/%=(C×V)÷m×100%计算,公式中C为红芪多糖溶液的浓度,V为红芪多糖溶液的体积,m为红芪多糖的质量。乙醇的浓度为20%、40%、60%和80%醇沉得到的红芪多糖含量分别为35.33%、37.76%、46.29%、61.62%。
2.4 方法学考察
2.4.1 精密度实验 精密量取同一供试品(乙醇体积分数80%醇沉红芪多糖)储备液2.0 mL,按“2.3.3”项下方法测定5次计算多糖含量及RSD值。经计算红芪多糖平均含量为63.24%,RSD为0.27%<2.0%,表明该方法精密度良好。
2.4.2 稳定性实验 精密量取80%醇沉红芪多糖供试品储备液2.0 mL,在室温的条件下放置,分别在时间为0、15、30、45、60 min按照“2.4.1”项下方法检测A值分别为0.717、0.719、0.720、0.719、0.721。经计算红芪多糖平均含量为63.11%,RSD为0.21%<2.0%,表明在1 h内该实验稳定性良好。
2.4.3 重复性实验 精密量取5份0.1 g的80%醇沉红芪多糖沉淀样品,按照“2.3.2”项下方法配制5份供试品溶液,精密量取每份供试品溶液2.0 mL,按”2.3.3”项下方法测定,计算多糖含量及RSD值。经测定A值分别为0.714、0.712、0.715、0.721、0.719,经计算红芪多糖平均含量为62.90%,RSD为0.50%<2.0%。表明该实验方法重复性良好。
2.4.4 加样回收率实验 取已知多糖含量的供试品储备液,每份各0.5 mL,依次加入对照品储备液0.1、0.2、0.3、0.4、0.5 mL,采用硫酸-苯酚法测定490 nm处吸光度A。计算红芪多糖的平均回收率为103.6%,RSD为1.31%<2.0%,表明该实验方法准确度可靠。
2.5 抗氧化实验
2.5.1 红芪多糖对羟基自由基(·OH)的清除率 取由20%、40%、60%、80%醇沉得到的红芪多糖,分别配置成0.25、0.5、1.00、2.00、3.00 mg/mL的多糖溶液,各取1 mL,并依次加入 Fe2SO4溶液(9 mol/mL)1 mL、水杨酸-乙醇溶液(9 mol/mL)1 mL、H2O2(8.8 mol/mL)1 mL,摇匀,反应1 h(37℃水浴)。测定510 nm处吸光度,重复上述操作3次,以Vc为阳性对照。计算·OH的清除率:·OH清除率/%=[1-(A1-A2)/A0]×100%,式中A0为空白组吸光度(纯化水代替多糖溶液或Vc);A1为实验组吸光度(Vc或多糖溶液);A2为底色校正吸光度(纯化水代替H2O2)。在多糖的浓度为3 mg/mL条件下,4个组分的红芪多糖对羟基自由基的清除率分别为:54.52%、41.24%、41.53%、65.43%,见表1。
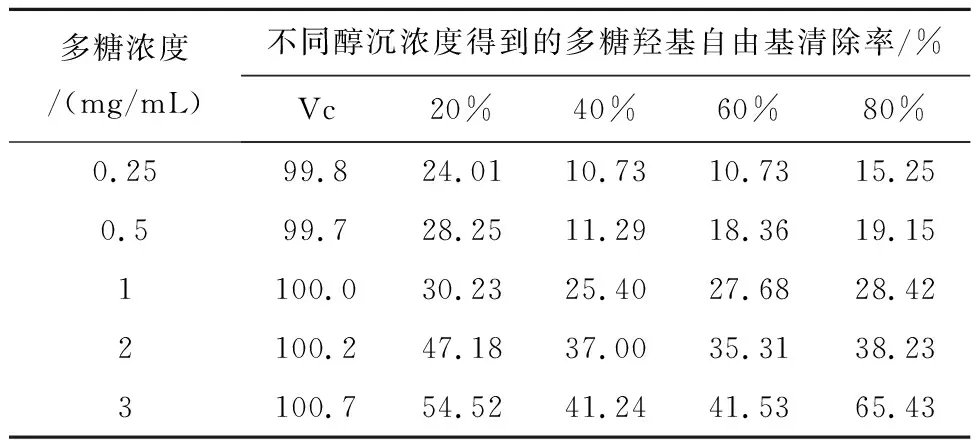
表1 羟自由基清除率的测定结果
2.5.2 红芪多糖对 DPPH自由基(·DPPH)的清除 取“2.5.1”项下配置的多糖溶液各2 mL,分布加入2 mol/mL的DPPH-无水乙醇溶液2 mL,混合均匀,在室温的条件下避光反应,反应时间为30 min,检测吸光值(517 nm),重复上述操作3次,将Vc作为阳性对照。利用以下公式求出·DPPH清除率:·DPPH清除率/%=[1-(A1-A2)/A0]×100%。上述式子中,A0为空白组吸光度(纯化水代替VC或多糖溶液);A1为实验组吸光度值(VC或多糖溶液);A2为底色校正吸光度(DPPH-无水乙醇溶液用无水乙醇来代替)。在多糖浓度为3 mg/mL条件下,4个组分的红芪多糖对DPPH自由基的清除率分别为:61.74%、20.03%、96.00%、97.20%,见表2。
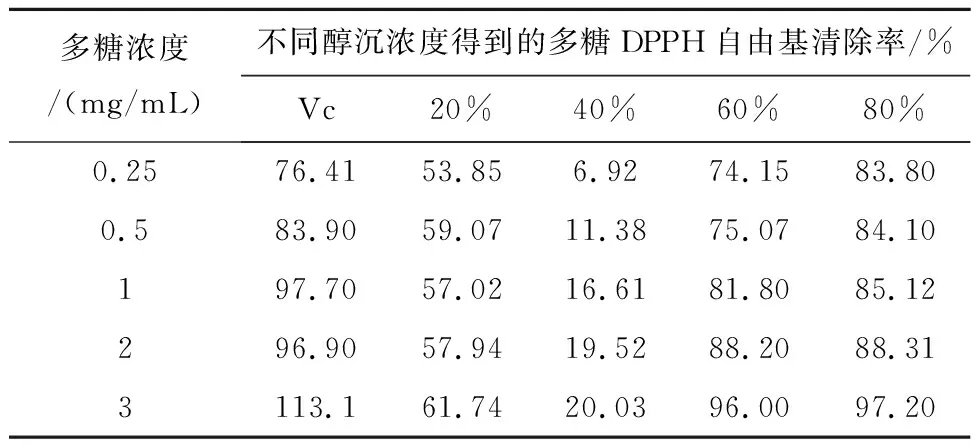
表2 红芪多糖对DPPH自由基清除率的测定结果
2.5.3 红芪多糖对与金属Cu2+螯合能力的测定 取“2.5.1”项下配置的多糖溶液各1 mL于试管内,依次加入2.5 mol/mL的新亚铜试剂1 mL和0.01 mol/L的CuSO4溶液1 mL,摇匀后加入0.2 mol/L的醋酸铵缓冲溶液1 mL,混匀并静置,静置时间为30 min,测定450 nm处吸光度值在波长;以Vc为阳性对照组。计算铜离子的还原率:铜离子还原率/%=(A1-A0)/(Amax-A0)×100%,以上式子中,A0为空白组吸光度(纯化水代替Vc或多糖溶液); A1为实验组吸光度(Vc或多糖溶液),Amax为最大吸光度值。在多糖浓度为3 mg/mL条件下,4个组分的红芪多糖对铜离子还原率分别为23.50%、24.60%、24.63%、25.64%,见表3。
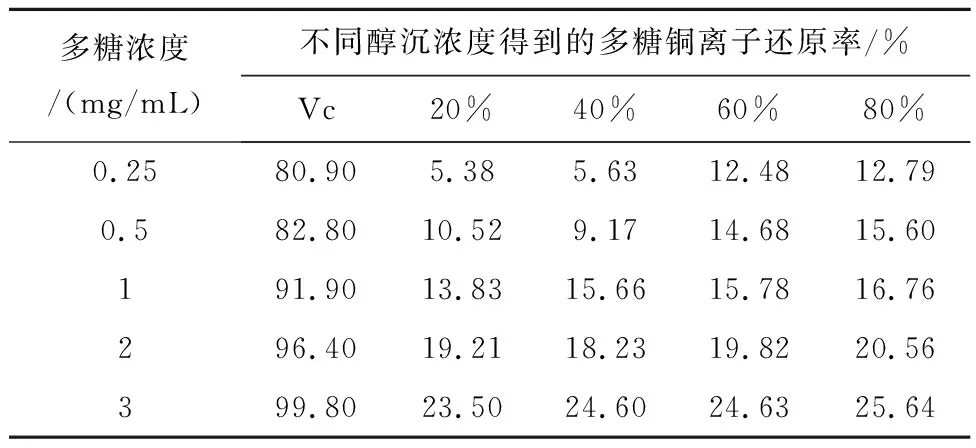
表3 红芪多糖对铜离子还原率测定的结果
2.6 红外结构表征分别称取2 mg 冷冻干燥的80%醇沉红芪多糖和200 mg溴化钾粉末,混匀研磨,压片,用红外光谱仪进行扫描,扫描的波长范围是近红外区(4 000~ 400 cm-1)。红芪多糖在3 282.84 cm-1处出现较宽的吸收峰,说明结构里存在官能团羟基(-OH)[16]。2 931.80 cm-1波长附近有次甲基(C-H)的吸收峰,1 624.06 cm-1波长附近有羰基(C=O)的吸收峰(伸缩振动产生),说明结构中含有糖醛酸。1 411.89 cm-1及1 045.42 cm-1波长的吸收峰是(C-O-C)和(C-O)的是,由伸缩振动引起的[17],见图1。

图1 红芪多糖的红外分析谱图
3 讨论
红芪多糖的提取方法多样,本课题组前期采用单因素和响应面法对红芪多糖水提加热回流的提取条件进行了研究[18],但对相应的醇沉条件缺乏研究。由于植物多糖结构多样,分子量跨度范围广,极性也有所不同,随着醇沉时乙醇浓度的增加,极性大的多糖先沉淀析出,而极性较小的多糖后析出,因此在本实验中,红芪多糖在最大乙醇体积分数时(80%)提取率和含量最高。
红芪多糖具有多种药理活性,特别是抗氧化活性,寇宁等[19]研究了不同提取方法对红芪多糖抗氧化活性的影响。本研究发现,高浓度的红芪多糖具有较好的抗氧化活性,且多糖浓度与醇沉浓度呈依赖性,故提取率和多糖含量最高的80%乙醇醇沉得到的红芪多糖具有较高的抗氧化活性,其对DPPH自由基的清除能力最为显著,且与天然抗氧化剂Vc的作用相近。但20%乙醇醇沉得到的红芪多糖整体抗氧化活性要强于40%乙醇醇沉得到的红芪多糖。由于植物多糖的抗氧化活性受其蛋白质、肽、和色素等的影响[20],推测是由于20%乙醇醇沉得到的红芪多糖含有更多的色素或蛋白质类杂质所致;另外植物多糖的生物活性亦与分子构型密切相关[20],而20%乙醇醇沉得到的红芪多糖皆是极性和分子量较大的分子,这也是其抗氧化活性强于40%乙醇醇沉得到的红芪多糖的原因。因此红芪多糖可以作为一种天然的抗氧化剂,来替代毒性较强的人工合成抗氧化剂,并以此为基础开发其药物、功能性食品和化妆品等领域的应用价值。
红外图谱分析结果得知抗氧化活性最优的80%乙醇醇沉得到的红芪多糖中富含羟基、羰基等还原性基团,初步推测其为红芪多糖抗氧化活性的结构基础。但是由于粗多糖种类多样、结构复杂的特点,本研究未能准确推断出红芪多糖的化学结构,可通过对红芪多糖甲基化、结合核磁共振与质谱技术进一步研究分析。本实验为后续红芪多糖的提取分离、药理活性研究及药物开发提供了理论依据,为红芪多糖的抗氧化活性和机制的相关研究奠定了实验基础。
