天然果胶的研究进展
2023-09-06宋娟易乐李琦冯湘沅杨琦席果果郑科段盛文成莉凤
宋娟,易乐,李琦,,冯湘沅,杨琦,席果果,郑科,段盛文∗,成莉凤∗
(1.中国农业科学院麻类研究所,湖南 长沙 410221;2.湖南利尔康生物股份有限公司,湖南 岳阳 414100)
果胶是植物相邻细胞壁间和胞间层中均存在的一种非均质杂多糖,由C、H、O 3 种元素组成。1825 年,法国化学家Braconnot 第一次提取到果胶,并把这种能形成凝胶的物质命名为“Pectin”,自此许多研究者将目光转向果胶,并致力于对果胶的研究[1]。 果胶无毒无害,安全可靠,是人体七大营养要素中的膳食纤维的主要成分之一,也是世界公认安全无毒的天然食品添加剂[2]。 果胶具有许多良好的性能如凝胶、增稠、稳定等,从而被广泛应用于食品、医药、日化、纺织等加工业。
现阶段,我国的果胶需求量大幅度增长,但80%依赖于进口[3]。 我国果胶资源丰富,但是果胶资源利用率低,果胶提取产业不成熟。 目前大量含果胶的原料被直接丢弃,既浪费资源,又污染环境。 因此,果胶原料综合利用符合“绿色、生态、环保”的理念。 大力开展非常规原料来源的果胶提取及利用,探索提高果胶产量和质量的新技术和新方法,在推动果胶产业发展中具有重要意义。
1 果胶来源
天然果胶来源广泛,橘子皮、苹果皮及马铃薯渣等果蔬植物原料中均有不同含量的果胶存在(表1)。 目前,商业化果胶主要是柑橘果胶和苹果果胶[4-5],其他来源的大部分果胶还停留在研究阶段[6-7]。
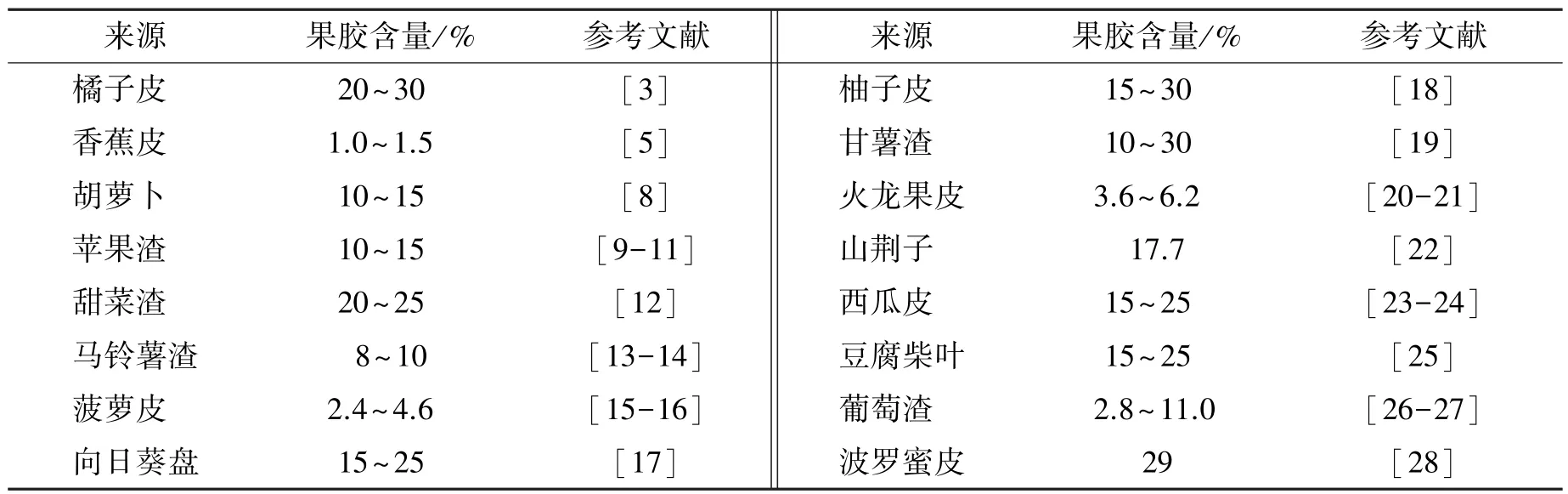
表1 果胶来源及含量Table 1 Pectin source and content
2 果胶提取方法
果胶有3 种形态,即原果胶、果胶和果胶酸[29]。 果胶在植物体内一般以不溶于水的原果胶和果胶酸盐的形式存在,不溶于水的果胶可溶于有机酸溶液或无机酸溶液。 通过一些物理、化学以及生物的手段使原料中的不溶性果胶转化成可溶性果胶从而分散到提取介质中,再经分离和纯化,得到产物果胶[30]。 常用的提取方法可以分为物理法、化学法和生物法,其均有各自的特点(表2)。
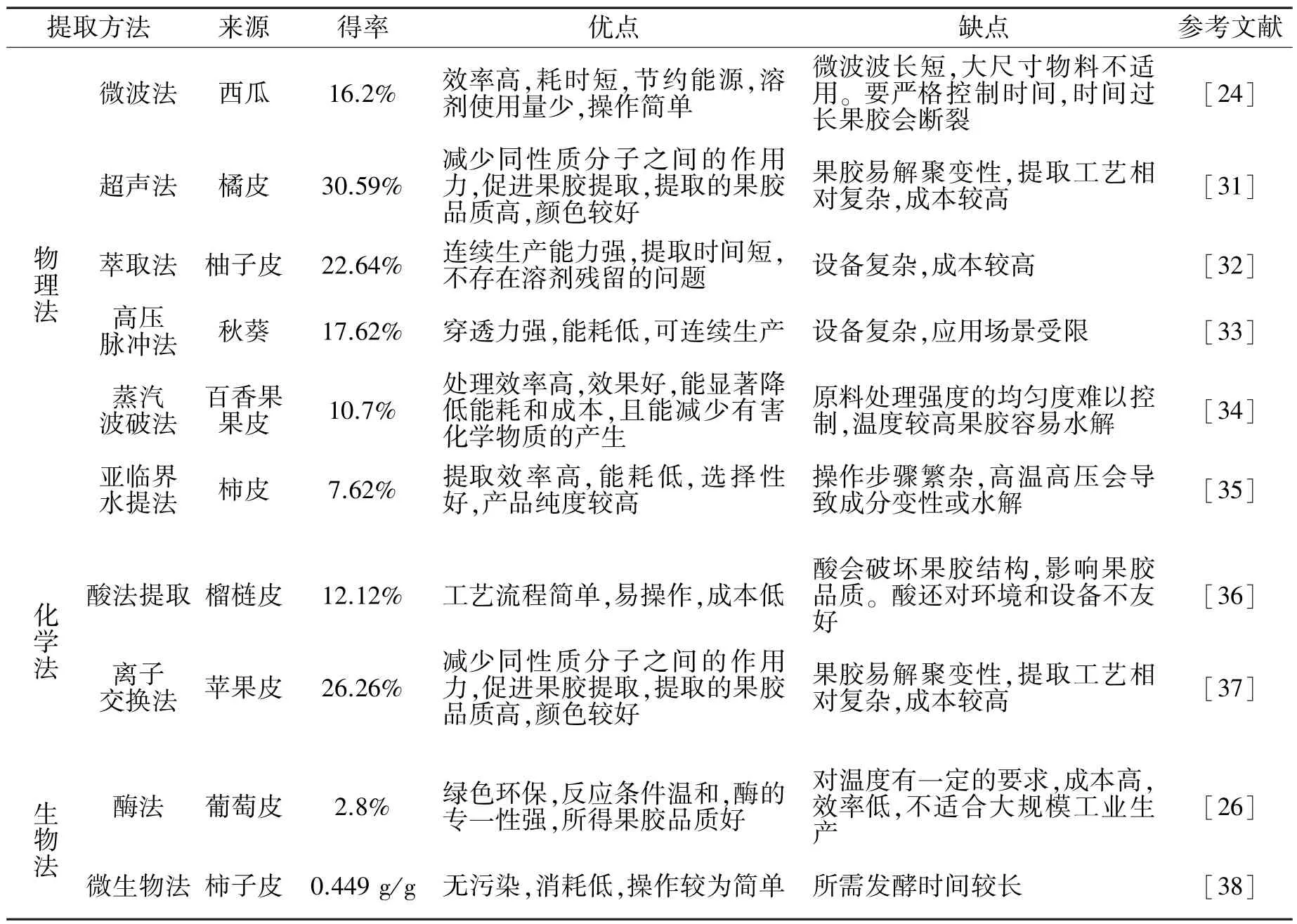
表2 果胶提取方法比较Table 2 Comparison of pectin extraction methods
2.1 物理法
2.1.1 微波法
微波是一种频率为300 MHz~300 GHz 的电磁波,微波可以穿透萃取介质,作用于材料中的极性部分,通过离子传导和偶极子旋转机制将其转化为热能。 热量加速传质,有助于分解果胶、纤维素和半纤维素之间复杂的交联结构,从而促进果胶的溶解和释放[10]。 Spinei 等[27]利用微波技术从葡萄渣中提取果胶,提取的最佳条件是微波功率560 W、pH 1.8、持续120 s,果胶得率为11.23%。程振玉等[39]使用微波法提取龙胆草果胶,在料液比1∶20、微波辐射功率700 W、提取时间15 min、提取温度90 ℃、龙胆草粒径0.120 mm、料液比1∶30(g/mL)时,果胶提取率达7.51%。 针对植物原料的类型,优化微波提取的功率和时间,对保证果胶的得率和品质至关重要。
2.1.2 超声法
超声波产生的空化效应、剪切力及粉碎等效应能综合作用在溶液中并传递强大的能量,破坏植物细胞壁的结构,增强溶剂的渗透力,使果胶更充分地溶解释放。 陈熠等[40]用超声法提取野生火棘果中的果胶,最优工艺参数为:料液比1∶10、超声功率300 W、温度70 ℃、提取时间40 min、pH 2,果胶得率为8.56%。 Dranca 等[11]使用超声提取法提取苹果渣中的果胶,工艺的优化结果表明,在超声频率100%、pH 1.8、料液比1∶10(g/mL)、30 min 时,果胶得率最高,为9.18%,半乳糖醛酸含量为98.13 g/100 g,酯化度为83.2%。 超声频率是影响提取效率的关键因素,可结合超声时间选取最佳超声条件。
2.1.3 萃取法
萃取是利用系统中组分在溶剂中有不同的溶解度来分离混合物的方法。 常用来提取果胶的萃取方法主要有超临界流体萃取法、连续逆流萃取法以及双水相萃取法。 使用最广泛的是超临界CO2萃取,CO2成本低,无毒无味无污染。 周先玉等[41]研究超临界CO2萃取火棘果实果胶,在温度35 ℃,压力15.0 MPa,二氧化碳流量40 L/h 的条件下,果胶提取率最高,为3.1%。 谢练武等[42]采用连续逆流萃取法与批量萃取法提取桔皮果胶,其果胶提取率分别为8.72%和6.57%。
常用的双水相系统有高聚物双水相体系、高聚物/无机盐双水相体系、低分子有机物/无机盐双水相体系以及表面活性剂双水相体系。 胡金梅等[20]利用PEG/硫酸铵双水相体系同时分离火龙果皮中的天然红色素和果胶,最佳的双水相分离条件为:质量分数16%的PEG 6000,19%硫酸铵双水相体系,pH 4.0,在此条件下,富集在上相的红色素和下相的果胶得率分别为1.82%和3.68%。胡金梅等[43]采用双水相体系分离脐橙皮中的果胶,其最优条件为乙醇体积分数35%、磷酸氢二钾18%、萃取温度78 ℃,果胶得率为8.35%。 双水相系统的操作条件温和,生物相容性好,不易使活性成分变性,适用于生物活性物质的提取。
2.1.4 高压脉冲电场法
高压脉冲电场法是利用高压脉冲波瞬间对植物细胞壁和细胞膜造成巨大破坏,加速体系中待提物质溶出[44]。 王文渊等[33]使用高压脉冲电场提取秋葵果胶,最佳条件为料液比1∶28(g/mL)、酶用量600 U/g、pH 5.5、提取温度53 ℃、电场强度10 kV/cm、脉冲数9 个、酶解时间20 min,果胶得率可达17.62%。 张佩琳[45]采用脉冲电场提取柚皮果胶,其果胶得率最高为4.77%。
2.1.5 蒸汽爆破法
蒸汽爆破法是将提取原料置于高温、高压的环境下,使原料孔隙被蒸汽充满,解除高压的瞬间,原料孔隙中的液体在释放压力的作用下迅速汽化,体积急剧膨胀使细胞爆破,从而促进细胞内果胶的溶出。 LIANG 等[34]利用蒸汽爆破对百香果果皮果胶进行提取,其果胶得率为10.7%。 物料的含水量以及粉碎细度在一定程度上会影响蒸汽爆破的效果,因此,原料预处理也是关键环节。
2.1.6 亚临界水提取法
亚临界水被定义为温度在100~374 ℃、压力在0.1~22.1 MPa 状态下的水。 通过调控亚临界水的温度和压力,使其极性可在较大范围内调整,从而实现连续有选择性地对物质分离提取。 由于亚临界水萃取使用的是价廉的水作为萃取剂,因此,该技术被视为绿色环保、前景广阔的一项变革性技术。 CUI 等[35]使用亚临界水萃取柿皮果胶,在138 ℃、2.84 min,液固比1∶10.02 条件下,获得最佳提取效果,其得率为7.62%。
2.2 化学法
2.2.1 酸法提取
酸提取法使用的酸可分为无机酸(硫酸、盐酸、硝酸)和有机酸(柠檬酸、乙酸)。 酸能水解细胞壁中复杂的交联网络,促进果胶溶解和释放[46]。 无机酸会对设备造成腐蚀并对环境造成污染,寻找合适的有机酸替代无机酸进行果胶提取是酸法提取的趋势。 Jarrín-Chacón 等[47]报道,柠檬酸、苹果酸和富马酸对可可果果胶的提取得率分别为6.17%、5.11%和3.2%。 TIAN 等[48]利用酸法提取山楂果胶,提取条件为料液比1∶3、0.1 mol/L 柠檬酸溶液、pH 2、55 ℃下提取20 min,得率为33.86%,果胶酯化度为45.58%。 这些研究结果表明,有机酸有望作为一种用于果胶提取的绿色溶剂替代无机酸。
2.2.2 草酸铵法
草酸铵可使非水溶性果胶酸钙转变为可溶性的果胶酸,钙离子和草酸根结合形成草酸钙沉淀[49]。 草酸铵具有很强的金属螯合作用,可与果胶酸钙中的钙离子螯合生成可溶性铵盐,增加果胶的溶解性,且处理条件较为温和。 李晓娟等[50]利用草酸铵法提取南瓜果胶,其果胶平均得率为6.09%。 CHENG 等[51]用草酸铵萃取法提取苎麻韧皮果胶,得到的最佳工艺组合为提取温度90 ℃、料液比1∶30、草酸铵浓度0.95%、萃取时间4 h,在此条件下得率为15.81%。
2.2.3 离子交换
离子交换树脂提取法中,阳离子树脂含有H+,可交换果胶中的Ca2+、Mg2+等阳离子,解除阳离子对果胶的束缚,加速果胶溶解,从而提高果胶得率[52]。 刘显明等[53]利用离子交换法从南瓜皮中提取果胶,最佳条件为提取时间2.5 h、提取温度80 ℃、pH 2.0、液固比30︰1 (mL/g),离子交换树脂用量为5%时,果胶得率为18.5%。 树脂可吸附果皮中的钙、镁离子,并通过置换反应解除其与果胶的离子键作用。 同时,树脂还能吸附小分子物质,消除果胶的机械性牵绊,降低从果皮提取果胶所需的最低能量,从而明显地提高果胶的产率。
2.3 生物法
2.3.1 微生物法
微生物发酵产生使果胶从植物组织中游离出来的酶,其能选择性地分解植物组织中的复合多糖体,从而有效地提取出植物组织中的果胶。 黄敏刚[54]运用微生物发酵法提取柑橘皮果胶,其最佳工艺条件为接种量10%、发酵时间40 h、发酵温度36 ℃、底物pH 7.0、尿素添加量为1%,在该条件下,果胶提取率最高可达到21.5%。 LIU 等[38]利用土曲霉发酵提取柿子皮果胶,最佳发酵条件为:发酵时间30.09 h、发酵温度25 ℃、发酵培养基初始pH 6.9,果胶产量达到最大值0.449 g/g。 采用微生物发酵法提取的果胶相对分子质量大、消耗低、污染低,果胶的胶凝度高,质量稳定[55]。
2.3.2 生物酶法
酶解提取法常应用蛋白酶、纤维素酶、半纤维素酶、木质素酶等复配,用于酶解植物细胞壁,促使果胶释放。 刘义武等[56]采用木瓜蛋白酶提取柠檬皮果胶,果胶得率达32.3%。 戴少庆等[57]利用超声波辅助复合酶法对椪柑皮中的果胶进行提取,半纤维素酶和纤维素酶组成复合酶共同参与提取,在料液比1∶20(g/mL)、超声波功率187.5 W、超声时间65.3 min、复合酶用量(m半纤维素酶:m纤维素酶=1∶1)5.6 mg、pH 4.82、温度41.8 ℃的条件下,果胶得率为11.93%。 与单酶法相比,复合酶法提取的处理时间缩短了4~5 h,且提高了提取效率。 石海燕[17]使用复合酶法提取向日葵果胶,得到最佳化提取工艺为料液比1∶27、酶解时间1.9 h、酶解温度60.5 ℃、酶解pH 5.3,果胶得率为11.94%。 Megías-Pérez 等[26]使用内切木聚糖酶和内切纤维素酶提取苹果渣中的果胶,结果表明,内切木聚糖酶对果胶的提取率最高,为19.8%,而内切纤维素酶提取的果胶分子量较低。 生物酶易变性失活,其用于果胶提取对温度要求一般为50 ℃左右,pH 值为3.5~4.5。
3 果胶纯化方法
果胶经提取后溶于液相中,得到提取液,需进一步分离才能得到目标果胶物质,利用果胶的物理化学性质进行分离。 纯化方法可以影响果胶的化学成分、分子量分布、平均分子量和胶凝能力。目前国内外最常用的分离纯化方法是醇沉法、盐析法、膜分离法等。 黄敏刚[54]分别采用醇沉法、盐析法分离柑橘皮渣果胶,结果表明:乙醇沉淀的最佳工艺条件为乙醇溶液浓度为75%、温度小于45 ℃、沉淀时间为60 min;盐沉析的最佳工艺条件为每50 mL 果胶提取液使用饱和氯化铁溶液5 mL,温度为60 ℃,沉析时间为60 min,所得果胶均符合国家标准。 Yapo 等[58]发现超滤纯化后醇沉淀的果胶与单独醇沉淀的果胶相比,可以使酸提取的甜菜果胶的灰分和蛋白质含量分别降低1.9和4.6 倍。 在酒精沉淀之前采用足够大分子量的膜进行超滤,可以有效去除果胶污染物“灰分和蛋白质”等成分,从而改善最终果胶产品的成分质量和可能的胶凝性能。
4 果胶的结构及理化特征
4.1 果胶的结构
果胶可以分成4 个部分,即聚半乳糖醛酸、鼠李半乳糖醛酸-Ⅰ、鼠李半乳糖醛酸-Ⅱ、木糖半乳糖醛酸[59]。 这些聚合物通过共价键互相连接,果胶的高度图解模型显示了广泛存在于果胶的4 个组成部分(图1),虽然不同来源的果胶各组分数量不同,但鼠李半乳糖醛酸-Ⅰ和聚半乳糖醛酸是主要“部件”,鼠李半乳糖醛酸-Ⅱ和木糖半乳糖醛酸是次要“部件”。 许多不同的变异存在于果胶,尤其是鼠李半乳糖醛酸-Ⅰ侧链。 两个在侧链含有芹菜糖残基的鼠李半乳糖醛酸-Ⅱ通过与一个硼酸酯连接从而形成鼠李半乳糖醛酸-Ⅱ二聚体[60]。
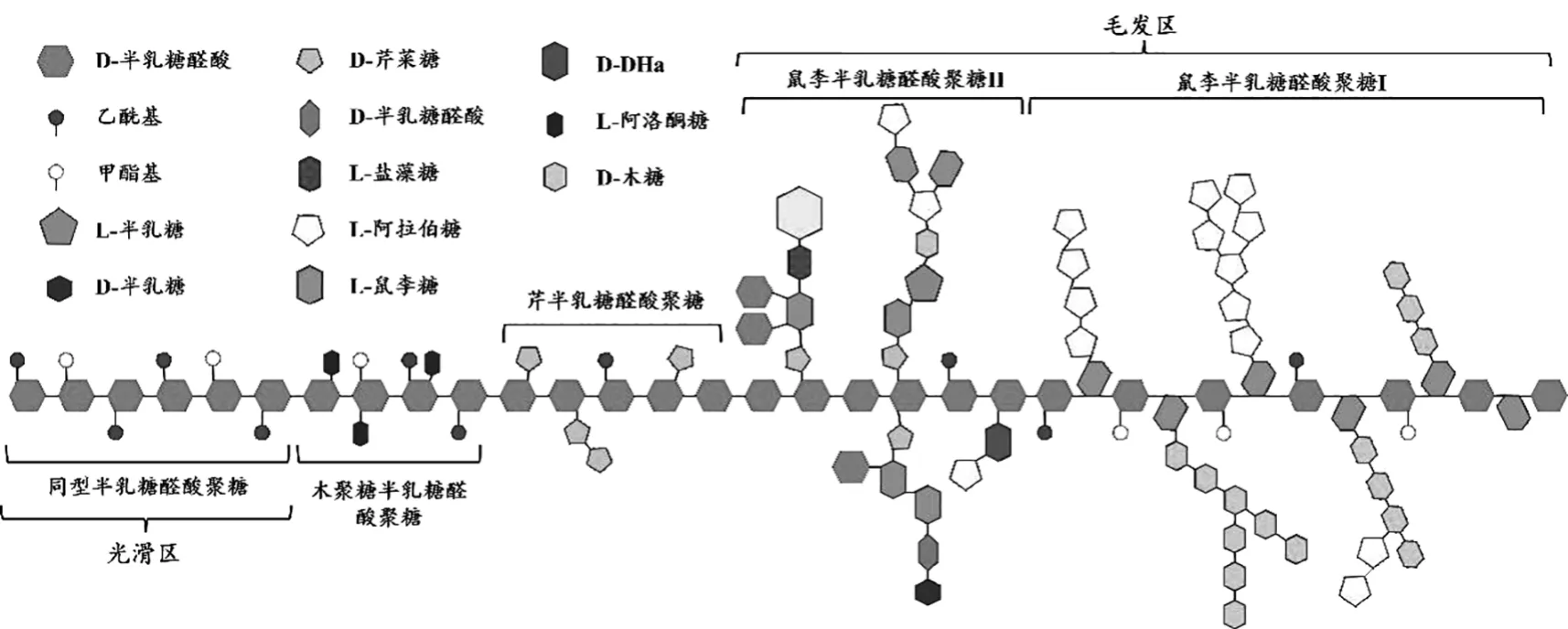
图1 果胶结构简图[60]Fig.1 Schematic structure of pectin
4.2 果胶的理化特征
纯果胶是淡米黄色粉末,无异味,溶于20 倍水中则呈黏稠状液体,不溶于有机溶剂。 不同植物原料和提取工艺得到的果胶,其酯化度、胶凝性、乳化性等理化特征差异大(表3)。
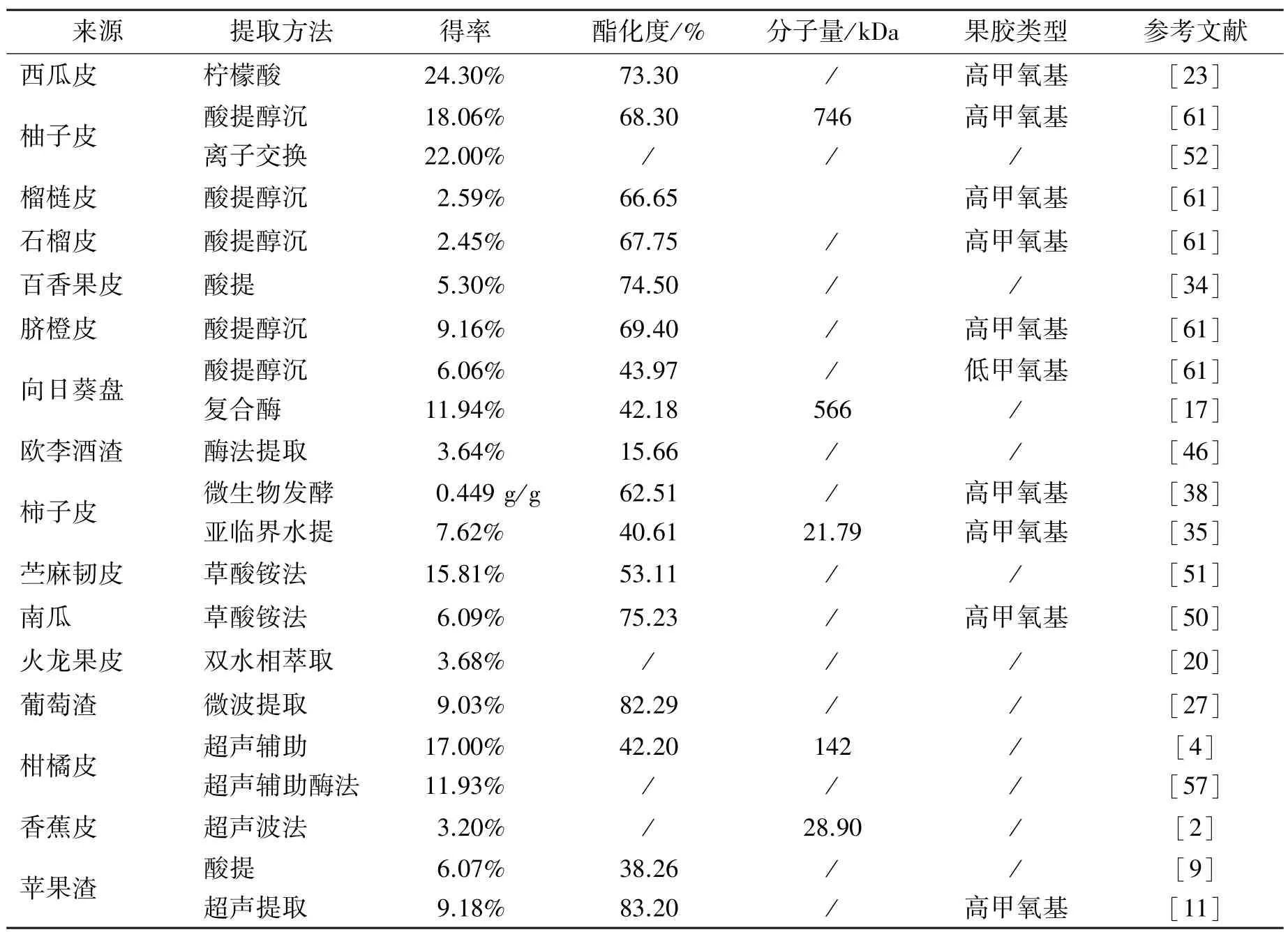
表3 果胶的理化特性Table 3 Physicochemical properties of pectin
4.2.1 酯化度
果胶的酯化度,是指甲基酯化的半乳糖醛酸单位与果胶中半乳糖醛酸单位的比例。 根据酯化度的大小可将果胶分为酯化度≥50%的高酯果胶和酯化度<50%的低酯果胶[6]。 酯化度是表征果胶性质的重要指标,能影响果胶的结构与构象[62]。 不同酯化度果胶之间存在结构与构象的差异,随着酯化度降低,果胶分子链柔性下降,链刚度增加。 此外,增大酯化度可减少果胶分子的伸展度和卷曲度,增加水合体积[63]。
4.2.2 凝胶性
果胶作为胶体,在一定条件下能在水溶液中形成胶体,具有优良的凝胶特性。 根据果胶中甲氧基含量不同分为高甲氧基果胶(HMP)和低甲氧基果胶(LMP)。 通常把甲氧基质量分数7.00%~16.32%的果胶称之为高甲氧基果胶;甲氧基含量低于7.00%的果胶称为低甲氧基果胶[64]。 高甲氧基果胶在适宜的糖度、pH 及较高温度下能形成凝胶(稍冷即凝);低甲氧基果胶在Ca2+或其他阳离子存在下无论有糖或无糖均能凝胶。 果胶的甲氧基化程度越高,果胶分子量越大,其胶凝能力越强[61]。
4.2.3 乳化性
果胶因为具有亲水性的羧基和疏水性的甲酯基和乙酰基,被证实具有一定的乳化能力。 王文霞等[13]发现马铃薯果胶具有良好乳化性,马铃薯果胶乳化能力与大豆可溶性多糖乳液粒径接近,并且乳化能力随果胶添加量增加而增大。
5 果胶的功能与应用
5.1 在食品中的应用
果胶是绿色、环保的天然植物提取产物,被认为是自然界最健康最安全的食品添加剂,是联合国粮农组织和世界卫生组织推荐的不受添加量限制的食品添加剂[64]。 果胶由于其独特的凝胶特性,添加在果冻、糖果、果酱以及冰淇淋中,改善口感,保持风味;因其优越的乳化稳定性,添加在酸奶等乳制品中,使酸奶稳定不离析分层;作为增调剂,用于果汁和软饮料中改善口感。 此外,果胶凭借低糖、低热量的特性,可在保健食品中作脂肪替代品[65];果胶还可在焙烤食品中提高面团的持气性[19]。
5.2 在医药中的应用
果胶作为一种再生性、凝胶性、生物降解性及相容性等良好的天然产物,有抗菌、抗癌、降血脂、抗腹泻等多种药理及其他生理功能[66]。 果胶可降低血糖和胆固醇含量,促进肠胃蠕动,润肠通便;果胶还可抑制癌细胞的聚集,阻止其扩散转移等[67]。 同时,果胶具有一定的心脏保护作用[68]。果胶具有很强的吸水保水能力,食用后会让人产生饱腹感,减少进食,有利于减肥。 同时食用果胶能够吸附残留在肠胃中的铅和汞等有毒离子。 此外,果胶还具有结肠定位分解的特性,可用作口服型药物载体将定位释放至结肠中,作为医药控释载体,递送药物[69]。 果胶与壳聚糖形成水凝胶,能够促使细胞增殖且安全无毒,可以作为伤口敷料[70]。
5.3 其他应用
此外,果胶因其较好的成膜性、持水性、抗辐射性以及一定的黏性,可用于纸业、纺织、化妆品等行业[71]。 在化妆品中作乳化剂[72];在微生物的培养基中可替代琼脂作胶凝剂;利用天然果胶成膜性可制备超速离心膜和电渗析膜等[73];在水处理行业中,开发以果胶为基质的绿色阻垢剂阻垢硫酸钙[74];在新型可降解生物材料中,果胶作为打印材料基质用于3D 打印[75-76],以及其他一些活性包装材料[77-78]。
6 总结与展望
果胶来源丰富,提取方法多样,探讨从农副产品废弃物中合理开发及利用果胶对于有效提高农副产品附加值及助力乡村振兴具有重要意义。 然而,目前果胶产业还存在两个主要问题:(1)污染重、能耗高。 现阶段果胶提取主要是化学法,强酸强碱的提取环境易造成环境污染,也易破坏果胶结构。 采用生物法提取能有效缓解环境污染大和能耗高的问题,加大果胶提取生物助剂(菌制剂和酶制剂)的开发与利用势在必行。 (2)新原料不足。 目前商品化果胶主要是柑橘果胶和苹果皮果胶,其他来源的果胶产业化程度还远远不够。
因此,大力开展果胶的研究与开发、探索提高果胶产量和质量的新方法、发掘优质果胶及其新原料以及果胶的绿色环保生产和高效利用成为亟待解决的问题。 随着新兴技术的不断出现,有关果胶的新原料、新工艺、新产品将不断涌现,有望改变我国果胶长期依赖于进口的局面。
