河南省安阳市副猪嗜血杆菌流行菌株调查与耐药性分析
2023-09-06刘亚辉苏玉贤
杜 娟,刘亚辉,苏玉贤
(1.开封市畜牧工作站,河南开封 475000;2.平顶山市畜牧发展中心,河南平顶山 467000)
副猪嗜血杆菌病也称为格拉瑟病(Glasser's disease),是由副猪嗜血杆菌(Haemophilus parasuis,HPS)引起的猪细菌性传染病,以关节炎、心包炎、多发性浆膜炎、脑膜炎和败血症为病理特征,临床表现为体温升高、呼吸困难、咳嗽、跛行、神经失调等多种症状。HPS 是条件致病菌,通常定殖于上呼吸道,很少单独引起发病,在猪体发生免疫抑制或环境应激反应导致免疫力下降时,可与猪圆环病毒、猪繁殖与呼吸综合征病毒、链球菌等病原体发生混合感染,加重病情。HPS 在我国猪群中普遍存在,主要侵害4~8 周龄仔猪,引起的发病率为10%~15%,病死率可达50%以上[1],给养猪业造成严重经济损失。
HPS 血清型较多,按照Kieleein-Rapp-Gabriedson(KRG)琼脂扩散方法分类至少有15 种,有约20%的菌株未能定型[2]。HPS 有明显的区域性和时期性特征,不同时期、不同地区甚至同一个养殖场可能存在不同血清型菌株流行,且不同血清型菌株间致病力差异大,缺乏完全交叉免疫保护或者交叉免疫保护率低[3-4]。尽管疫苗接种是有效防控HPS 感染的主要手段,但是HPS 商品疫苗仅有2~3 种血清型,疫苗株与流行的致病菌株血清型难以匹配,因而免疫保护作用有限[5]。目前,临床上使用抗生素是防治细菌性疫病不可或缺的重要措施。但是,HPS 易产生耐药性,长期滥用抗生素导致HPS 耐药性增强和新耐药菌株不断出现,给防治该病带来很大困难。因此,分离鉴定地方菌株,了解本地区HPS 流行菌株特点和开展耐药性监测可以提高疫苗免疫效果,减少药物盲目使用,对有效防控该病流行具有指导意义。本研究于2022 年从河南省安阳市25 家猪场采集临床疑似HPS 感染病死猪的肺脏、肝脏、心血等病料进行HPS 分离鉴定,并进行血清型分型、耐药性检测,以了解该地区猪场HPS 流行菌株血清型和耐药情况,为今后疫苗研制和临床药物筛选提供基础资料。
1 材料与方法
1.1 病料来源
2022 年1—12 月在河南省安阳市不同区域选择25 家养猪场,无菌采集68 头临床疑似感染HPS病死仔猪和保育猪的肺脏、心血、关节液、脑、肝脏等组织病料,共175 份,其中肺脏47 份、脑组织44 份、肝脏18 份、心血19 份、关节液18 份、气管29 份,每个采集部位计为1 份病料。病猪死前主要表现为发热、咳嗽、关节肿大、站立不稳、皮肤黏膜发绀,剖检可见关节炎、腹膜炎、肺炎和心包炎等病变。25 家猪场病料采集信息见表1。
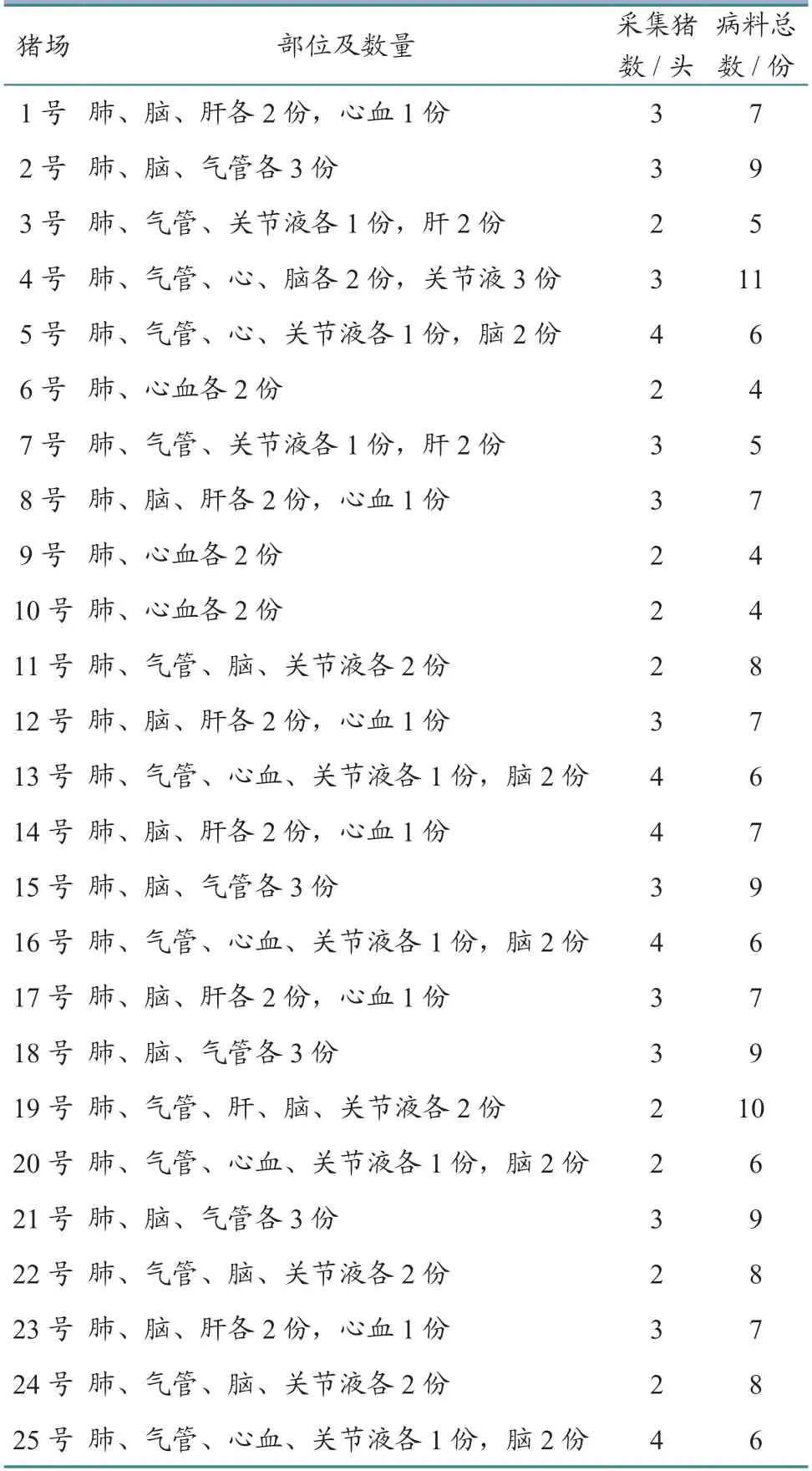
表1 25 家猪场病料采集信息统计
1.2 主要试剂、菌株及试验小鼠
胰蛋白大豆肉汤(TSB)、胰蛋白大豆琼脂(TSA)、烟酰胺腺嘌呤二核苷酸(NAD)、5%绵羊鲜血琼脂平板、犊牛血清,购自青岛海博有限公司;细菌基因组 DNA 小量抽提试剂盒(离心柱式),购自上海碧云天生物有限公司;胸膜肺炎放线杆菌(ATCC27090)质控菌株、16 种细菌药敏纸片、微量生化鉴定管,购自杭州微生物试剂有限公司;ATCC25923 金黄色葡萄球菌、HPS 1~15 型单因子标准阳性血清,购自中国兽医药品监察所;DL 2000 DNA Marker、2×TaqMaster Mix、PCR试剂盒、DNA 凝胶回收试剂盒等,均购自天根生化科技(北京)有限公司;BALB/c 小鼠,购自浙江中医药大学动物实验研究中心。
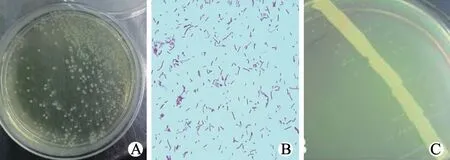
图1 分离菌菌落培养和镜检结果
1.3 病原菌分离培养
用接种环无菌挑取病料分别接种于TSA 培养基(含有犊牛血清和0.01% NAD),37 ℃培养24~36 h 后,挑取形态为光滑湿润、无色透明、针尖大小的疑似HPS 菌落,再接种于TSA 培养基进行连续传代纯化培养;挑取疑似HPS 菌落制作细菌涂片,革兰氏染色、镜检,观察细菌形态和染色;挑取上述纯化培养菌落分别划线接种于含犊牛血清、未含NAD 的TSA 培养基,未含犊牛血清、NAD 的TSA 培养基,置恒温箱37 ℃培养24~36 h,观察菌落形态和生长情况。
1.4 病原菌“卫星生长”试验
挑取纯化培养的疑似HPS 菌落水平划线接种于5%绵羊鲜血琼脂平板,再垂直于上述水平划线接种金黄色葡萄球菌,于5% CO2培养箱,37 ℃培养24~36 h,观察是否有“卫星生长”(即待检菌落在靠近金黄色葡萄球菌处较多,越远菌落越少,直至不能生长[6])和细菌溶血现象。
1.5 生化试验鉴定
挑取纯化培养的疑似HPS 菌落,分别接种于添加有2% NAD 和5%胎牛血清的葡萄糖、果糖、H2S 等微量生化鉴定试剂管,在5% CO2培养箱中37 ℃培养24~36 h 后进行接触酶、氧化酶试验,按照说明书进行操作并观察试验结果。
1.6 PCR 扩增鉴定
参考Oliveira 等[7]报道的方法设计合成HPS 16S rRNA 基因(GenBank 登录号M75065)特异性扩增引物(上游引物HPS-F:5'-GTGATGAGGAAGGGTGGTGT-3';下游引物HPS-R:5'-GGCTTCGTCACCCTCTGT-3')。引物由深圳华大基因科技有限公司合成,预期扩增片段大小为821 bp。挑取TSA 培养基(添加有2%NAD 和5%犊牛血清)上的菌落,按照说明书利用基因组DNA 抽提试剂盒提取菌株DNA,以提取纯化的DNA 为模板用于PCR 扩增。PCR 反应体系(25.0 μL):细菌DNA 模板 2.0 μL,2×TaqMaster Mix 12.5 μL,上、下游引物(10 pmol/μL)各1.0 μL,加入灭菌超纯水至25.0 μL。PCR 反应参数:95 ℃预变性3 min,95 ℃变性30 min,56 ℃退火55 s,72 ℃延伸1 min,共运行30 个循环,最后72 ℃延伸10 min。取PCR 扩增产物利用1.2%琼脂糖凝胶进行电泳检测,在自动紫外凝胶成像仪下观察拍照,记录结果,同时设阴、阳性对照。扩增产物克隆、纯化后,送深圳华大基因科技有限公司测序,用BLAST 软件对测得的基因序列与GenBank 中公布的HPS 16S rRNA 序列进行同源性比对分析。
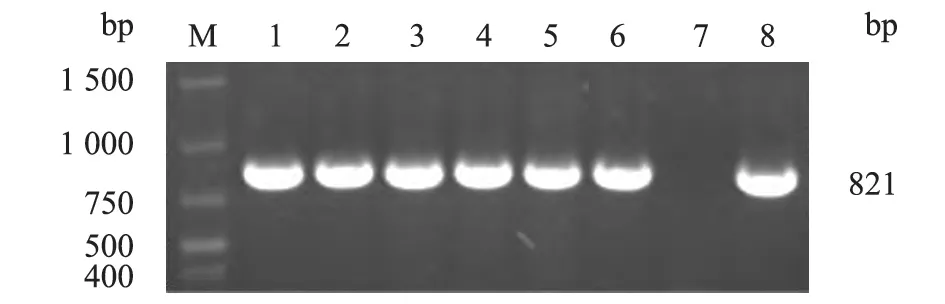
图2 部分分离菌株16S rRNA PCR 扩增电泳结果
1.7 分离菌株血清分型
采用文献[8]中的免疫琼脂扩散试验方法进行分离菌株血清型鉴定。
1.7.1 分离菌株分型抗原制备 取分离菌株接种于TSA 培养基,37 ℃培养24~36 h,再挑取菌落接种于TSA 培养基对分离菌进行复壮培养。用PBS(pH 7.2)缓冲液洗脱菌苔,将其装入离心管中,12 000 r/min 离心2~3 min;弃掉上清液,加入9 倍于沉淀物体积的PBS(pH 7.2)缓冲液,混匀,121 ℃高压处理1~2 h,12 000 r/min 离心2~3 min;收取上清液,即为分离菌株血清学分型抗原。
1.7.2 血清分型琼脂扩散试验 分别称取0.85 g NaCL、1.00 g 琼脂糖,加入PBS(pH 7.2)缓冲液100 mL,混匀加热溶解,制成厚度约4 mm 的琼脂平板,倒置于冰箱,4 ℃保存备用。用打孔器在平板中央和周围根据需要打出孔间距3 mm、孔直径4 mm 的圆孔,火焰封底。中央孔添加分离菌株分型抗原,周围孔添加HPS 1~15 型单因子标准阳性血清,37 ℃条件下,在湿盒中作用24~36 h,观察判断试验结果。如果抗体孔与抗原孔之间出现清晰的白色沉淀线,则判分离菌为对应的阳性血清型菌株,反之判为阴性菌株。
1.8 耐药性试验
对34 株分离菌采用K-B 纸片法进行药敏检测。将分离菌株接种于含有0.01% NAD、5%犊牛血清的TSB 液体培养基,37 ℃培养12~24 h后,接种于生理盐水,漩涡混匀,调整菌液浓度至0.5 麦氏浊度,用灭菌棉签蘸取菌液,均匀涂布于含有0.01% NAD、5%犊牛血清的TSA 培养基上;用无菌镊子分别夹取16 种细菌药敏纸片均匀平贴于TSA 培养基上面,在5% CO2、37 ℃条件下培养24~36 h,测定每种药敏纸片抑菌环直径大小。由于美国临床和实验室标准系会(Clinical Laboratory Standard Institute,CLSI)中尚无HPS药物敏感性测定的标准方法,而胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae)与HPS 均为引起猪呼吸道病的病原菌,且亲缘性较近,本次药敏试验采用CLSI(2015 版)规定的胸膜肺炎放线杆菌药敏测定方法,以胸膜肺炎放线杆菌(ATCC27090)为质控菌株,按照CLSI(2015 版)标准判读药敏试验结果[9],判定标准见表2。

表2 药物敏感性判断标准 单位:mm
2 结果
2.1 病原菌分离培养
培养36 h 后观察培养基上菌落形态和生长情况,可见在TSA 培养基(含有犊牛血清和0.01%NAD)上产生针尖大小(直径0.5~2 mm)、无色透明、光滑湿润的菌落,而在添加犊牛血清、未添加NAD 的TSA 培养基和未添加犊牛血清和NAD的TSA 培养基上均无上述菌落生长。对单个菌落革兰氏染色镜检,可见菌体为革兰氏阴性菌,且呈细丝状、长杆状和球杆状等不同形态。将34 株疑似HPS 菌落和金黄色葡萄球菌接种在5%绵羊鲜血平板上,均可见靠近金黄色葡萄球菌划线两侧出现明显的“卫星生长”现象,而远离划线处菌落稀少或无菌落生长,且菌落不溶血。共从175 份病料中分离培养出34 株疑似HPS。菌落培养和镜检结果见图1。
2.2 生化试验
利用微量生化反应鉴定管对34 株分离菌进行生化试验。结果显示:所有分离菌株发酵葡萄糖、蔗糖、半乳糖、麦芽糖生化反应均为阳性,而对木糖、乳糖、甘露醇生化反应结果不一致;对脲酶、H2S、吲哚、赖氨酸、苯丙氨酸、氧化酶生化反应均为阴性,氧化酶、接触酶试验均为阳性。34 株分离菌株生化特性均符合标准HPS 的生化特性。生化试验结果见表3。

表3 34 株分离菌生化试验结果
2.3 分离菌PCR 鉴定
以分离株DNA 为模板,利用HPS 的16S rRNA 基因特异性引物进行PCR 扩增,将产物经1.5%琼脂糖凝胶电泳鉴定。PCR 鉴定结果显示:对所有分离菌株16S rRNA 基因PCR 扩增,均获得大小为821 bp 的目的条带,与预期目的条带相吻合。经BLSA 比对,测得序列与GenBank 中公布的HPS 16S rRNA 序列同源性在97%以上。结合分离菌株分离培养、镜检、生化特性试验及PCR鉴定结果,综合判定34 株分离菌株均为HPS,检出率为19.43%(34/175)。PCR 电泳检测结果见图2。
2.4 血清学分型鉴定
采用免疫琼脂扩散方法,对34 株HPS 分离菌株进行血清学分型鉴定试验。结果显示:分离率最高的是血清4 型14 株,占41.18%;血清5 型4 株,占11.76%;血清6 型3 株,占8.82%;血清13 型8 株,占23.53%;未定血清型5 株,占14.71%。分型菌株占菌株总数的85.29%。结果表明,河南省安阳市存在HPS 血清4、5、6 和13 型流行,其中血清4 型为优势血清型。25 家猪场分离菌株数量及血清型分布情况见表4。

表4 25 家猪场分离菌株数量及血清型分布情况
2.5 耐药性检测
采用K-B 纸片法对临床分离鉴定的34 株HPS进行药敏试验,并根据CLSI M100—S25 标准判断。结果(表5~6)显示:分离的HPS 菌株对16 种抗生素的耐药性差异较大。对阿莫西林、青霉素G、链霉素、土霉素4 种抗生素耐药性最高,耐药率为88.24%~94.12%;对林可霉素、磺胺间甲氧嘧啶、大观霉素、阿奇霉素等7 种抗生素耐药性相对较低,耐药率为47.06%~73.53%;对头孢噻呋、头孢氨苄、诺氟沙星、环丙沙星、替米考星5 种抗生素耐药性最低,耐药率为8.82%~20.59%。34 株HPS分离菌株多重耐药性较严重,对5 种以上抗生素产生了耐药性,最多的为12 种。其中,耐9 种抗生素菌株最多,占菌株总数的29.41%。结果表明,河南省安阳市流行的HPS 菌株耐药性较严重。
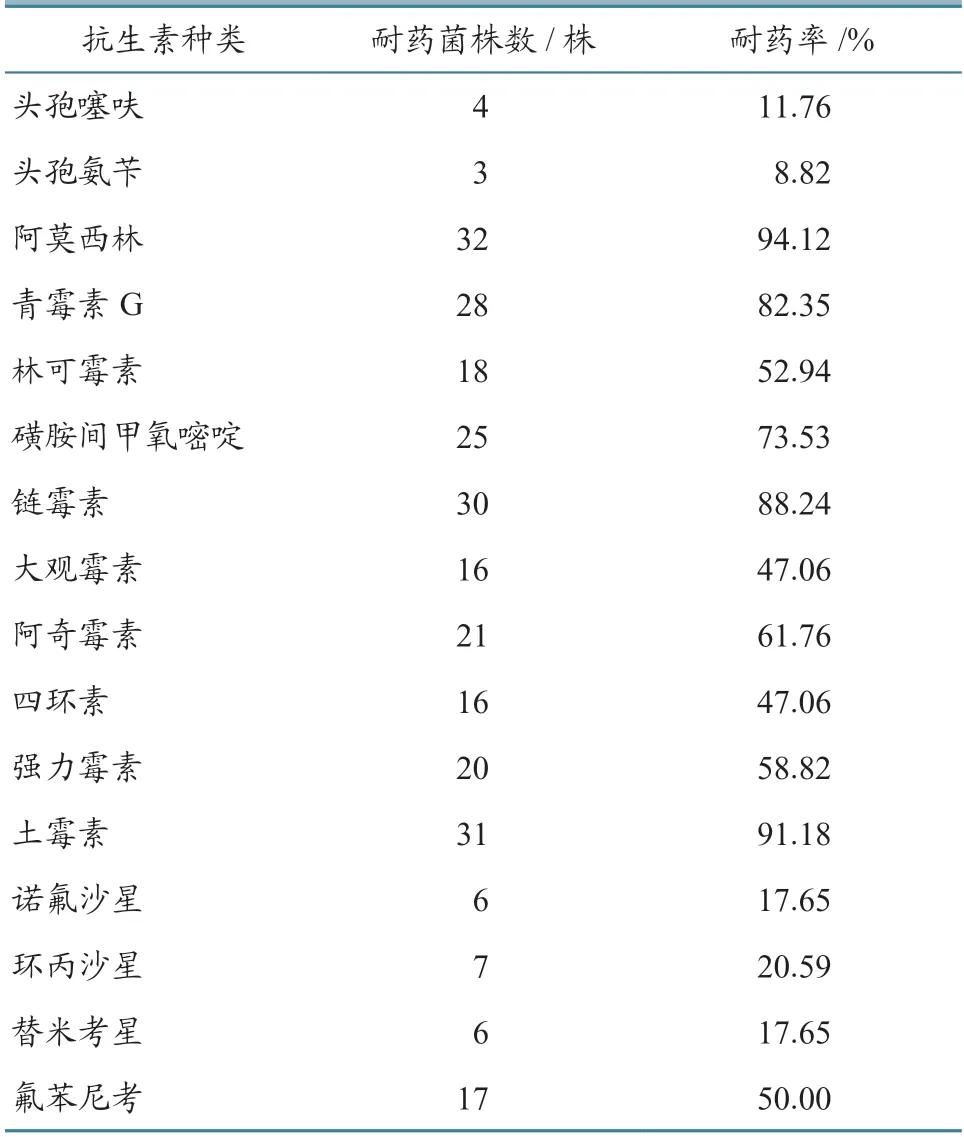
表5 34 株HPS 分离株耐药性检测结果
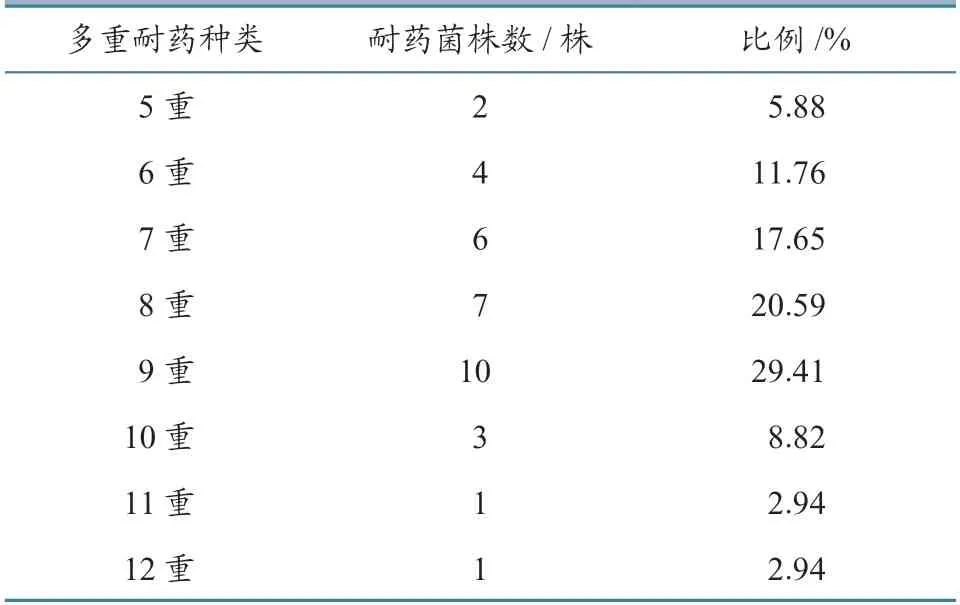
表6 HPS 分离株多重耐药检测结果
不同血清型中,除血清4 型对头孢氨苄,5 型对头孢氨苄、诺氟沙星、环丙沙星,6 型对头孢噻呋、林可霉素,13 型对头孢噻呋、环丙沙星,未定型对替米考星没有产生耐药性外,分离的4 种HPS血清型菌株对多种抗生素存在不同程度的耐药性,其中血清4 型不但耐药菌株数最多,对15 种抗生素的耐药性也较高(表7)。
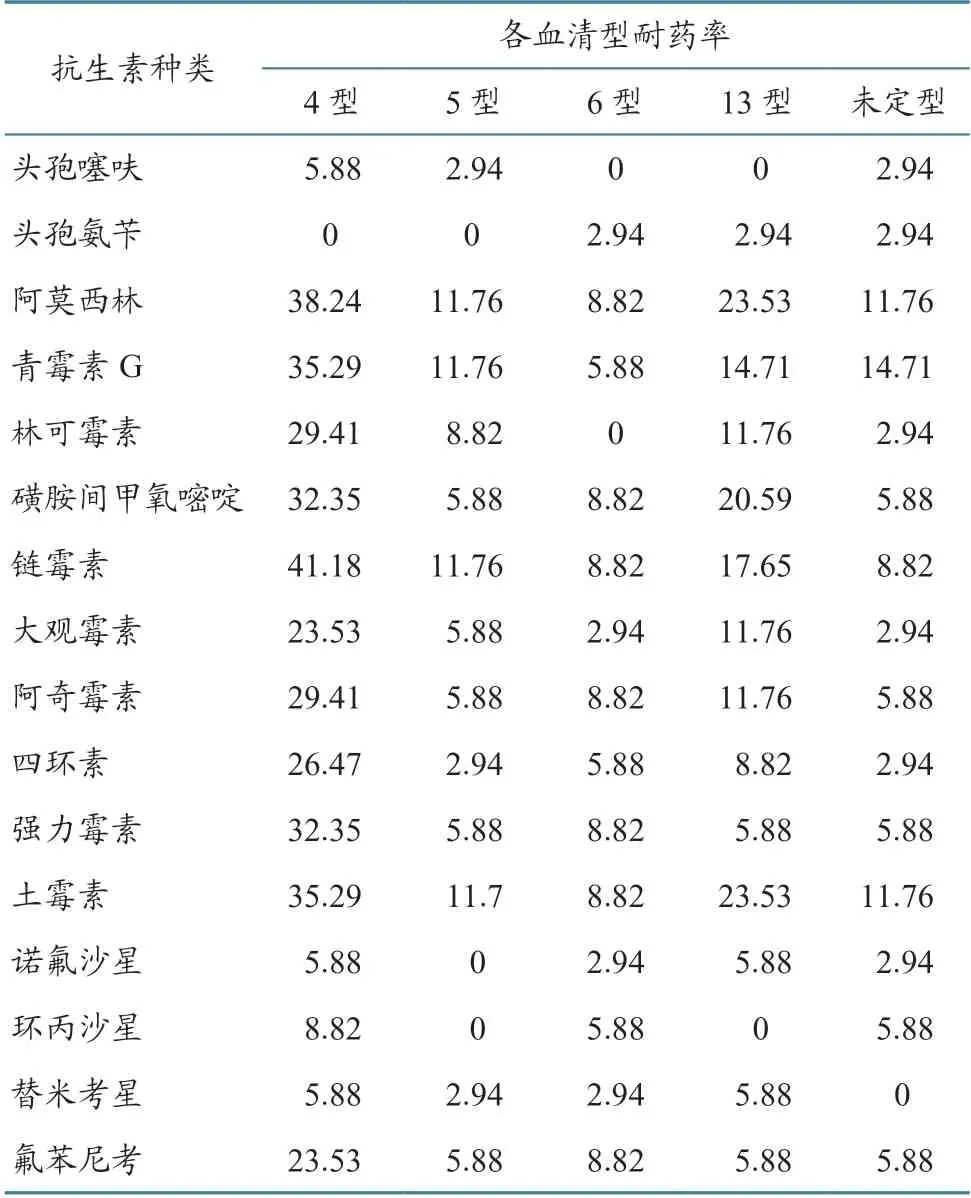
表7 不同血清型HPS 菌株对16 抗生素的耐药性检测结果 单位:%
3 讨论
本研究收集河南省安阳市25 家养猪场疑似感染HPS 病死猪的肺脏、心血等175 份组织病料,通过细菌分离培养、菌落形态观察、生化试验、PCR 鉴定等方法,分离出34 株HPS,检出率为19.43%。该结果低于王翠等[10]对豫北地区和王庆云[11]对河南省安阳市猪场HPS 鉴定的结果。HPS培养条件要求较高,分离难度大,病料样本数量、采集时间、部位和分离培养等因素都会影响调查结果,此外不同地区猪场的饲养环境和管理水平也与调查结果密切相关。本研究结果提示,河南省安阳市猪场存在一定程度的HPS 感染。因HPS 为条件致病菌,会在外部环境和饲养管理发生变化时导致感染猪群发病,且常与其他病原发生混合感染。因此,对于该病应开展常态化监测,加强综合防控,避免疫病暴发流行。
HPS 血清型较多,国内不同地区流行的血清型差异性较大,因此明确本地区HPS 血清型对本病防控具有非常重要意义。张青娴等[12]报道,2017—2018 年在河南省46 株HPS 菌株中,共检测出7 种血清型(2、4、5/12、6、7、11、13),其中血清型5/12 和4 型为优势血清型;李新果等[4]从2017—2018 年采自河南省不同地区的45份疑似病料中,分离鉴定出12 株HPS,血清型包括1、2、4、5、7、13 型;徐引弟等[13]报道,河南省流行的主要血清型包括4、5、7、13 型;郭龙等[14]2017 年对全国20 个省市疑似HPS 感染的样品进行细菌分离培养、PCR 鉴定分型,发现我国规模化猪场中主要流行的血清型为4、5/12 和14 型。本研究结果显示,河南省安阳市流行的HPS 血清型为4、5、6 和13,其中血清4 型为优势血清型,与上述学者报道基本一致。此外,本研究发现,在25 家猪场中有9 家猪场分离出2 种血清型HPS 菌株,其中4 家猪场的菌株来自不同的病料组织。从175 份病料组织的HPS 分离菌株数量看,有20 株来自肺脏,占比最高,分离率为42.55%(20/47),其次是关节液16.67%(3/18)、心血15.79%(3/19)、气管10.34%(3/29)、脑9.09%(4/44)、肝脏5.56%(1/18)。该结果与丁文文等[15]研究报道的发病猪不同组织器官分离的HPS 结果基本一致。本研究结果表明,HPS 最易导致呼吸系统感染,主要存在肺部,也可以进入血液循环系统造成全身性感染。不同血清型HPS 菌株的致病性也不同,其中血清1、5、10、12、13、14 型为高毒力菌株,2、4、5 型为中等毒力菌株,其他血清型为无毒力[16]。本研究表明,该地区流行的血清型较多,至少4 种,且主要为中等毒力和高毒力菌株。
养殖业滥用抗生素对HPS 形成持续的药物选择压力,造成其耐药性逐渐增强,多重耐药现象严重。通过分离菌耐药性检测了解猪场HPS 对常见抗生素的耐药情况,可以为临床用药提供指导。本研究采用K-B 纸片法进行34 株HPS 对16 种抗生素耐药性试验发现:分离菌株对阿莫西林、青霉素G、链霉素、土霉素耐药性4 种抗生素耐药率较高;多重耐药性比较严重,介于5~12 种,耐9 种抗生素菌株最多,占菌株总数的29.41%。与其他学者对HPS 耐药性研究报道的结果[17]有所不同,这是因为细菌耐药性形成机制复杂,菌株耐药性与耐药基因携带、传播,以及细菌结构特性、地区环境及抗生素使用等诸多因素密切相关。
HPS 感染是猪场常见的呼吸道疫病,流行于世界各地养猪场,也是危害我国养猪业的典型细菌性疫病之一,且随着猪场规模化不断发展,呈现地方流行性散发态势。HPS 是存在于正常健康猪群体内上呼吸道的共生菌和条件菌,如果猪体发生免疫抑制,导致免疫力下降,就会出现临床症状,也可引起全身性感染,在肺部、肝脏、关节渗出液等部位能检测出HPS。HPS 常作为继发性病原菌,在感染圆环病毒2 型、猪繁殖与呼吸综合征病毒、流感病毒和伪狂犬病病毒等病原后导致猪群发病,也通常与巴氏杆菌、放线杆菌和链球菌等混合感染猪群,使猪病情复杂,诊断和防治难度增大。因此,病原的分离鉴定、敏感药物筛选是控制本病的重要前提。同时,要强化猪群日常管理,尤其是断奶猪和保育猪,应给猪群提供良好的饲养环境和营养均衡的日粮,提高猪体免疫力;积极实施疫苗免疫接种,尽量保持疫苗株和流行株一致。临床治疗用药要结合药敏检测分析结果,筛选敏感性药物,轮换交替用药,以减少HPS 耐药性。
4 结论
本研究发现:河南省安阳市猪场存在一定程度的HPS 流行;流行菌株血清型主要为4、5、6和13 型,其中血清4 型为优势血清型;流行菌株存在较高的耐药性,且多重耐药较严重。因此,当地应加强对HPS 感染的综合防治,合理使用抗生素。
