经导管主动脉瓣植入术后发生传导阻滞的预测研究
2023-09-06洪景宣郭延松陈新敬方明程
洪景宣 郭延松 陈新敬 方明程
365001 福州,福建省立医院心内科
主动脉瓣狭窄(aortic stenosis,AS)是一种常见的心血管疾病,仅次于高血压和冠心病。据相关报道指出,重度AS患者3年的死亡率为50%~75%[1]。近年来,经导管主动脉瓣植入(transcatheter aortic valve implantation,TAVI)手术在国内外快速发展,已成为中高危重度AS患者的一线治疗方案[2-3]。然而,TAVI相关的各种并发症依然多见,尤其是术后出现心脏传导阻滞最为常见,该并发症并未随着瓣膜系统的更新以及术者操作水平的提高而明显下降[4-5]。TAVI手术是一个较为复杂的过程,治疗对象多为高龄且病情危重患者,围手术期出现心脏传导阻滞容易导致左右心室收缩不同步,进而诱发急性心力衰竭,甚至增加死亡风险,给临床医生带来巨大挑战。因此,早期预测TAVI相关心脏传导阻滞的危险因素,对改善患者的预后具有重要意义。本研究通过回顾性病例对照研究,探讨TAVI术后心脏传导阻滞的相关因素。
1 对象和方法
1.1 研究对象
回顾性分析2018年7月至2022年3月就诊福建省立医院心内科行TAVI介入治疗的重度AS患者,术后连续心电监测,将发生心脏传导阻滞23例作为研究组。其中,8例为高度房室传导阻滞(atrioventricular block,AVB),15例为持续性左束支传导阻滞(left bundle-branch block,LBBB),将同期行TAVI手术且未发生任何心脏传导阻滞37例作为对照组。所有患者均选用启明(Venus A)人工瓣膜,入路途径常规经股动脉。本研究符合医学研究伦理学要求,患者均知情同意。
1.2 纳入标准和排除标准
纳入标准:(1)外科手术评分为中高危者[美国胸外科医师协会(Society of Thoracic Surgeons,STS)评分≥4%],并且行TAVI介入治疗的重度AS患者。重度AS的诊断标准如下:经胸超声心动图测量主动脉瓣口面积<1.0 cm2或主动脉瓣血流速度大于4 m/s或平均跨瓣压差≥40 mmHg[6];(2)TAVI术后1周内新发的心脏传导阻滞,包括LBBB及高度AVB。 排除标准:(1)术前筛查合并心脏传导阻滞者,包括LBBB、右束支传导阻滞(right bundle-branch block,RBBB)、任何类型AVB;(2)急性心肌梗死或冠状动脉CT血管成像提示严重左主干病变或三支病变;(3)感染性心内膜炎或心腔内血栓形成;(4)合并其他心脏瓣膜严重病变者,如二尖瓣、三尖瓣重度狭窄或反流;(5)合并肿瘤,预期寿命<1年;(6)活动性出血性疾病,无法耐受抗血小板或抗凝治疗。
1.3 观察指标
收集所有患者一般临床资料,包括性别、年龄、体质指数(body mass index,BMI)、STS评分、高血压、糖尿病、肾功能;超声心动图指标,包括左心室舒张期内径(left ventricular end-diastolic diameter,LVDD)、左心室射血分数(left ventricular ejection fraction,LVEF)、主动脉瓣平均跨瓣压差(mean pressure gradient,mPG)、主动脉瓣最大流速(Vmax)、左室流出道内径(left ventricular outflow tract diameter,LVOT)、室间隔厚度、瓣叶类型、瓣环平均直径;计算冠瓣钙化体积(采用3mensio软件,钙化阈值设定为850 HU,标测主动脉瓣膜及瓣环位置后,系统自动测算左冠瓣、右冠瓣及无冠瓣钙化体积);TAVI术中相关资料,包括瓣膜规格、球囊预扩张、球囊后扩张以及瓣膜植入的深度(人工瓣膜最低点到主动脉瓣环距离)。
1.4 统计学方法

2 结果
2.1 两组基本情况
研究组受试者23例,其中男性13 例,女性10例,平均年龄为(76.2±6.3)岁;对照组受试者37例,其中男性23 例,女性14例,平均年龄为(75.2±7.1)岁。两组间的基本临床资料相似,差异无统计学意义(均为P>0.05)(表1)。
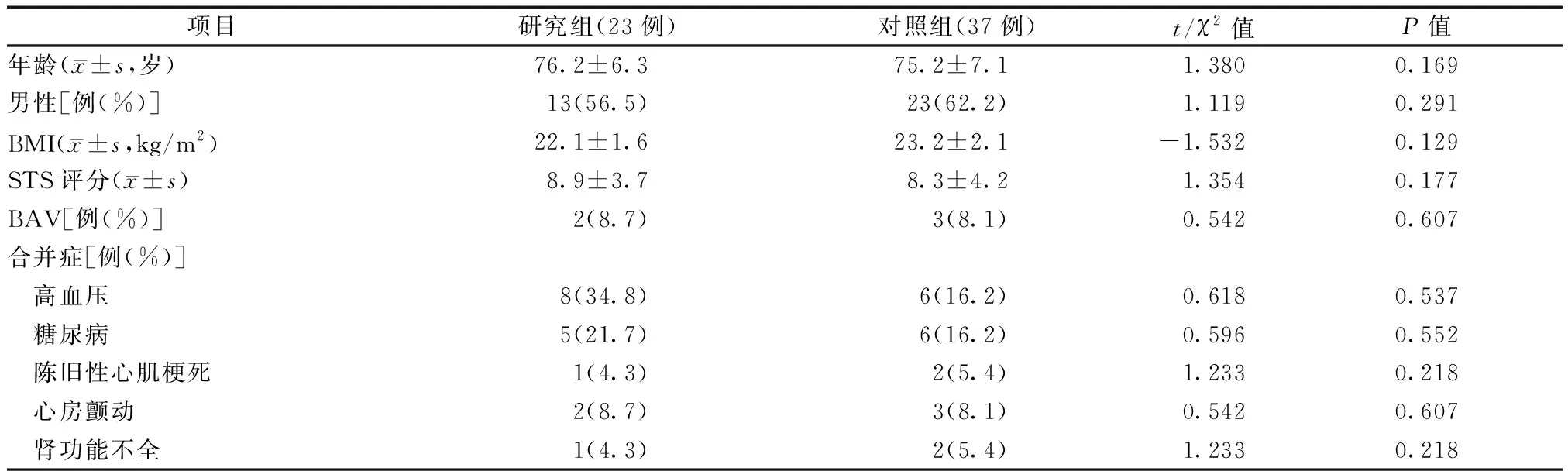
表1 两组的基本临床资料比较
2.2 两组超声心动图指标、瓣环平均直径及冠瓣钙化体积对比
研究组受试者无冠瓣钙化体积显著高于对照组,差异有统计学意义(P=0.005),而LVDD、LVEF、mPG、Vmax、LVOT、室间隔厚度、瓣环平均直径、左冠瓣及右冠瓣钙化体积等的差异均无统计学意义(均为P>0.05)(表2、图1)。
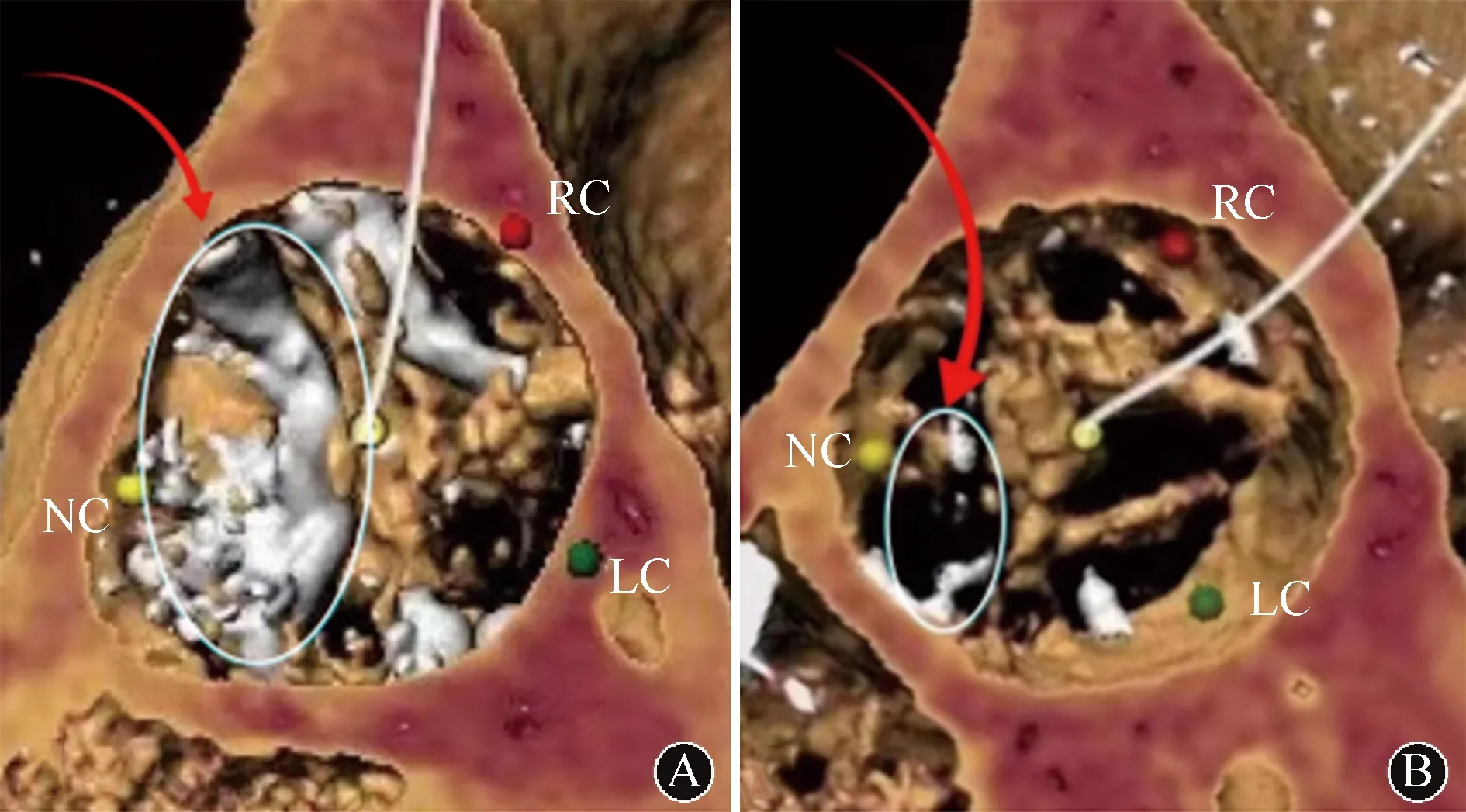
NC:无冠瓣;RC:右冠瓣;LC:左冠瓣图1 研究组(A)与对照组(B)无冠瓣钙化体积比较
表2 两组超声心动图指标、瓣环平均直径及冠瓣钙化体积比较
2.3 两组TAVI术中相关资料比较
所有受试者均在气管插管全麻下施行TAVI术,均采用股动脉途径入路,应用20F股动脉鞘管,均予球囊预扩张处理钙化病变,采用启明(Venus A)瓣膜,研究组选用的瓣膜规格分别为23 mm、26 mm、29 mm、32 mm,相应例数分别为5例、11例、5例、2例;对照组选用的瓣膜规格分别为23 mm、26 mm、29 mm、32 mm,相应的例数分别为11例、14例、9例、3例。两组LVOT/瓣膜直径、瓣环直径/瓣膜直径、LVOT/瓣环直径比值,差异均无统计学意义(均为P>0.05);研究组瓣膜植入的深度大于对照组(图2)、球囊后扩张的比例高于对照组,差异均有统计学意义(均为P<0.05)(表3)。

图2 研究组(A)与对照组(B)瓣膜植入深度比较
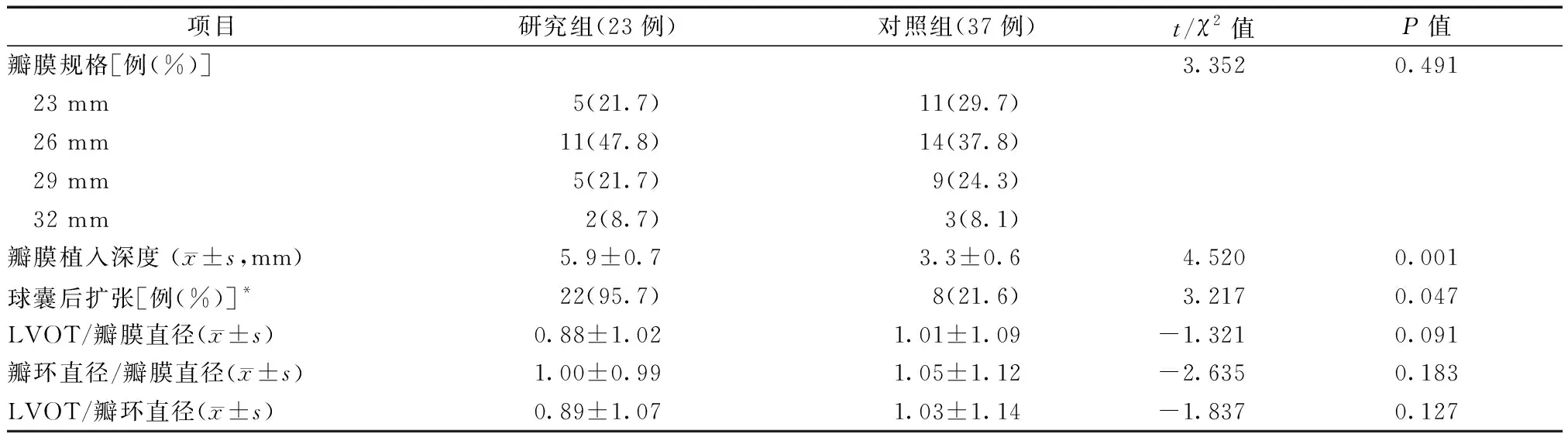
表3 两组围手术期情况比较
2.4 发生心脏传导阻滞的相关因素分析
采用多元logistic回归模型分析显示, 无冠瓣钙化体积(OR=3.235,95%CI:2.121~12.161,P=0.005)、瓣膜植入深度(OR=2.212,95%CI:1.256~7.361,P=0.023)和球囊后扩张(OR=1.243,95%CI:1.056~2.526,P=0.031)均是发生心脏传导阻滞的相关因素。
3 讨论
TAVI是通过外周血管介入的方式置入人工瓣膜,在功能上实现主动脉瓣膜的替换,已成为中高危重度AS患者的一线治疗方案。然而,TAVI术后容易出现各种并发症,主要包括心脏传导阻滞、外周血管穿孔、瓣周漏、瓣膜脱落、主动脉夹层、急性心肌梗死、急性心包压塞、急性肾衰竭及脑卒中等,其中心脏传导阻滞最为常见,具有临床意义的传导阻滞包括LBBB及高度AVB。研究发现,约90%的新发LBBB在TAVI术中或术后24 h内发生[7],约60%新发LBBB将长期存在[8-9]。LBBB易引起心室收缩不同步,诱发心力衰竭发作[10],进而影响患者预后。与LBBB相比,三度AVB是TAVI术后较严重的并发症,Siontis等[11]荟萃分析共纳入41项研究数据包括11 210例TAVI患者,发现TAVI相关三度AVB的发生率约为10%~25%。TAVI患者术后出现三度AVB,可能增加阿斯发作及心脏骤停的风险,通常预后不佳,13%~17%需要植入永久起搏器治疗[12]。本研究的研究组纳入23例受试者中有8例新发的三度AVB,最终有6例完全依赖起搏器,分别在术后1~5 d内植入永久起搏器治疗,起搏器植入率为26%,与Khatri等[12]研究结果相近。TAVI术后出现心脏传导阻滞,主要基于心脏传导系统自房室结延伸出希氏束后与主动脉瓣为解剖毗邻关系,在TAVI手术过程中送入加硬导丝、球囊扩张以及人工瓣膜释放等外在因素作用下,可直接或间接地损伤心脏传导系统,最终导致心脏传导阻滞[13]。本研究通过对比影像学相关指标,探讨心脏解剖因素对TAVI术后传导阻滞的影响,结果显示研究组无冠瓣钙化体积高于对照组;通过多元回归分析发现,无冠瓣钙化斑块大小是引起心脏传导阻滞的独立危险因素。基于心脏传导系统与无冠瓣为解剖毗邻关系,无冠瓣环存在钙化斑,在植入人工瓣膜时,增加了斑块移位的风险,直接压迫传导系统周围的心肌组织,引起心肌缺血、水肿,进而出现心脏传导阻滞,部分患者可能随着心肌水肿消退而恢复正常传导节律[14]。
TAVR术后发生高度AVB患者的尸检研究报告显示,显微镜下显示瓣膜扩张部位室间隔内局限性血肿,并且压迫His束[13],基于His束与室间隔的解剖关系,室间隔病变可能引起传导阻滞,目前尚无相关临床研究报道。本研究对比两组受试者的室间隔厚度,差异无统计学意义,室间隔厚度与传导阻滞是否有相关性,有待更大样本研究证实。
此外,本研究进一步探讨TAVI术中外在因素对心脏传导系统的影响,如所选用的瓣膜规格、球囊预扩张、球囊后扩张、瓣膜植入深度等,结果发现研究组瓣膜植入深度、球囊后扩张例数均高于对照组,表明TAVI术中进行球囊后扩张以及人工瓣膜的植入位置过深会增加心脏传导阻滞的风险,这与Katsanos等[15]的研究相符。通过多元回归分析发现球囊后扩张及瓣膜植入深度是TAVI术后发生心脏传导阻滞的独立危险因素,进一步表明在TAVI的技术方面,球囊膨胀扩张[16]和瓣膜植入深度[7-8]是直接决定传导系统急性机械损伤的主要因素。相对于LVOT和左心室舒张末内径,过大规格的瓣膜是心脏传导阻滞的危险因素[17]。本研究两组受试者所选用的瓣膜规格例数差异无统计学意义,与Nazif等[17]研究不相符,考虑与样本量及瓣膜类型差异有关。
本研究存在一些局限性。为单中心研究,样本量有限;同时,RBBB被认为是TAVI术后发生心脏高度AVB的独立危险因素[18],但本研究在入组时已排除LBBB、RBBB、一度AVB等心律失常的患者,故无法判断心脏基线传导水平与新发传导阻滞的相关性。
总之,TAVI相关的心脏传导阻滞是心脏解剖因素、术者操作因素等多重因素共同作用的结果[19-22],无冠瓣的钙化程度是不可控的解剖因素,但对于预测心脏传导阻滞的发生具有重要意义;术中控制瓣膜植入深度以及减少球囊后扩张可在一定程度上降低心脏传导阻滞的发生。
利益冲突:无