EMS诱变创制胡麻新种质的研究
2023-09-06叶春雷罗俊杰王剑虹
王 炜 陈 军 陈 琛 叶春雷,* 罗俊杰 王 一 王剑虹
(1甘肃省农业科学院生物技术研究所,甘肃 兰州 730070;2福建农林大学植物保护学院,福建 福州 350002;3兰州市职业技术学院,甘肃 兰州 730070)
胡麻是油用亚麻(Linum usitatissimumL.)的俗称,主要在中国、加拿大、印度、俄罗斯等国家种植[1],我国主要分布在甘肃、内蒙、新疆、山西、河北等西北和华北等干旱和半干旱地区,是当地重要的油料和经济作物[2-3]。胡麻籽粒除了可以油用外,还富含α-亚麻酸、木酚素、膳食纤维、亚麻胶等功能成分[4],在食品、饲料、医疗保健等领域也有较大的应用价值[5]。胡麻育种中亲本资源相对狭窄,育成突破性品种的难度逐渐加大,因此,不断创制新的种质资源是一项长期性和基础性的重要工作。
化学诱变是最常用的种质创制的方法之一。甲基磺酸乙酯(ethyl methane sulfonate,EMS)因其操作简单易行、诱变效果突出,且产生的突变体多为单基因突变,使得诱变后代能够很快稳定,是国内外研究者最为常用的化学诱变剂[6]。陈天子等[7]采用EMS 诱变获得了抗咪唑啉酮除草剂种质;李晓等[8]采用EMS 诱变构建了含867 个株系的小麦M2突变群体;周文期等[9]则采用此方法筛选到包括株型、叶型、叶色、育性、抗逆、表皮形态建成等表型变异的一系列玉米突变体;此外,EMS 在棉花[10]、油菜[11]、马铃薯[12]、高粱[13]、花生[14]、谷子[15]等多种作物的种质资源创制和突变体库构建研究中也得到了广泛应用。
在胡麻EMS诱变研究中,Rowland[16]、Green等[17-18]、Nichterlein 等[19]在M4或M5代获得了若干低亚麻酸含量的胡麻突变体;Saeidi 等[20]在M2代获得了粒色为杂色的突变体;Bretagne-Sagnard 等[21]获得了白化突变体;Chantreau 等[22]创制了包含4 894 份M2代的胡麻突变体库和TILLinG 平台;王玥等[23]通过研究获得了纤用亚麻材料范尼萌动种子的最佳EMS 诱变体系,并筛选到2 个干旱敏感突变体;王斌等[24]通过研究获得了不同籽粒颜色(褐色和浅黄色)胡麻品种的最佳诱变条件,并在M3代筛选到了高粗脂肪、高木酚素含量及高亚麻酸含量的材料。以上报道中创制的多数为性状尚未稳定(M6代之前)的材料,还不能作为种质资源进行使用。鉴于此,本研究以胡麻品种陇亚10 号为试验材料,采用EMS 诱变技术进行胡麻种质资源的创制,以期获得具有抗病、早熟、矮秆或高秆等特异性状的突变材料,为胡麻新品种的培育及重要性状的基因发掘提供基础材料。
1 材料与方法
1.1 试验材料
用于诱变的原始野生型材料为胡麻品种陇亚10 号,由甘肃省农业科学院作物研究所胡麻课题组提供;诱变剂采用美国Sigma 公司生产的EMS,货号为M0880-5G。
1.2 试验方法
按照王炜等[25]的方法,2014 年分别配制0.1%、0.2%、0.4%的EMS 溶液,对照为蒸馏水,终止溶液为Na2S2O3。选取籽粒饱满、大小基本一致的陇亚10 号种子,自来水冲洗5 min 以清除胡麻种子表面杂质,蒸馏水冲洗3 次后吸干种子表面水分,放入150 mL 的三角瓶中,分别加入3 种浓度的EMS 溶液120 mL 分别处理3 000粒种子,处理时间为24 h,处理期间均置于黑布覆盖的摇床中(转速60 r·min-1、温度25 ℃)。处理完成后,分别用1 mol·L-1的Na2S2O3清洗1 遍,100 mmol·L-1的Na2S2O3终止反应,清洗掉种子表面残留的EMS,吸干表面水分,自然风干后将处理后的种子点播于甘肃省农业科学院兰州细胞工程育种试验地。每行播种100粒,行长1.2 m,行距0.2 m,每30行种植2行对照(未诱变处理的陇亚10号种子),常规田间管理。籽粒成熟后全部按单株收获。按以下公式计算出苗率、成苗率及致死率:
出苗率=出苗数/点播种子总数×100%;
成苗率=诱变苗存活数/点播种子总数×100%;
致死率=(1-诱变成苗率/对照成苗率)×100%。
2015年3月9日取大小均匀一致、饱满的陇亚10号种子10 000粒,用筛选获得的适宜陇亚10号EMS诱变处理浓度和时间(0.2%、24 h)按上述方法处理陇亚10号种子,处理后的种子播种的地点、行长、行距和的每行粒数与上年相同,每25行设一对照(2行),常规管理,M1代成熟后全部按单株收获。M2代时,将在M1代时获得的单株籽粒在1~15粒之间的点播于育苗钵中,待苗高5~10 cm时移栽于田间;单株籽粒在15粒以上的点播于田间,其中15~60粒之间的种植1行;60~120粒之间的平均分为2行种植;120~180粒之间的平均分为3行种植,依此类推。每30 行种2 行陇亚10 号作为对照。在胡麻全生育期对诱变M2代的表型性状进行观察记载;待对照品种陇亚10 号白粉病完全发病时,考察诱变单株的抗病情况;成熟后按照单株收获,对其中表型性状较为明显的单株进行考种。M3~M4代时重复上述过程,并淘汰连续两代与对照表型性状基本相同的单株;M5代及以后世代,将具有明显变异的、基本稳定的材料按株系播种,未稳定的材料依旧按单株收获,单株播种,按照上述方法进行鉴定和筛选。诱变材料稳定后按株行收获。
1.3 数据测定与统计分析
白粉病病株的分级方法参考罗俊杰等[26]的方法:0级:无病斑(免疫);1级:病斑面积占整个植株叶面积的1/4 以下(高抗);3 级:病斑面积占整个植株叶面积的1/4~1/2(中抗);5级:病斑面积占整个植株叶面积的1/2~3/4(中感);7级:病斑面积占整个植株叶面积的3/4以上(高感)。
按照《亚麻种质资源描述规范和数据标准》[27]对生育期、株高、单株果数、千粒重等主要农艺性状进行调查记载及考种;采用Excel 2010 软件进行数据统计及作图,用SPSS 19.0软件进行数据分析。
2 结果与分析
2.1 诱变胡麻种子的EMS浓度与时间组合
采用3个EMS 浓度梯度(0.1%、0.2%、0.4%)处理陇亚10 号种子24 h。结果表明(表1),EMS 诱变处理表现出较强的浓度依赖性。当浓度时间的处理组合为0.2%/24 h 时,陇亚10 号的致死率为51.97%,接近于半致死剂量,因此确定0.2%/24 h 为最优的胡麻种子EMS诱变处理组合。

表1 不同EMS浓度对陇亚10号种子处理24 h的出苗率、成苗率及致死率Table 1 The germination percentage,plantlet survival percentage and mortality percentage of Longya 10 seeds treated by different EMS concentrations for 24 h /%
2.2 诱变M1代出苗率、成苗率及表型变异
用筛选出的EMS 浓度(0.2%)处理10 000 粒陇亚10 号种子24 h 后播种在田间,出苗4 926 株,出苗率49.26%,最终成活3 038 株,成苗率30.38%,致死率为61.25%。由于受到药物毒害,M1代苗前期生长缓慢,大部分苗的生育期较对照延长,同时发现一部分诱变苗丧失育性,成熟期调查结实的单株共有2 513株。通过对这些植株的株高、工艺长度、有效分茎数、有效分枝数、单株果数、不实果数、单株粒数等农艺性状进行观测和考种测定(表2、表3)。对照陇亚10 号生育期92 d、株高76.33 cm、工艺长度49.32 cm、有效分茎数1.57、有效分枝数5.97、单株果数45.36、单株不实果数3.42、单株粒数292.67,花瓣蓝色、籽粒褐色、高感白粉病。与对照相比,M1代诱变单株在生育期、株高、花色、叶部、茎部、籽粒、育性、白粉病抗性等多个性状上出现广泛变异(表2);考种结果表明(表3),株高、工艺长度、有效分茎数、单株果数、单株粒数等显著下降,但有效分枝数没有其他性状的变异幅度大。
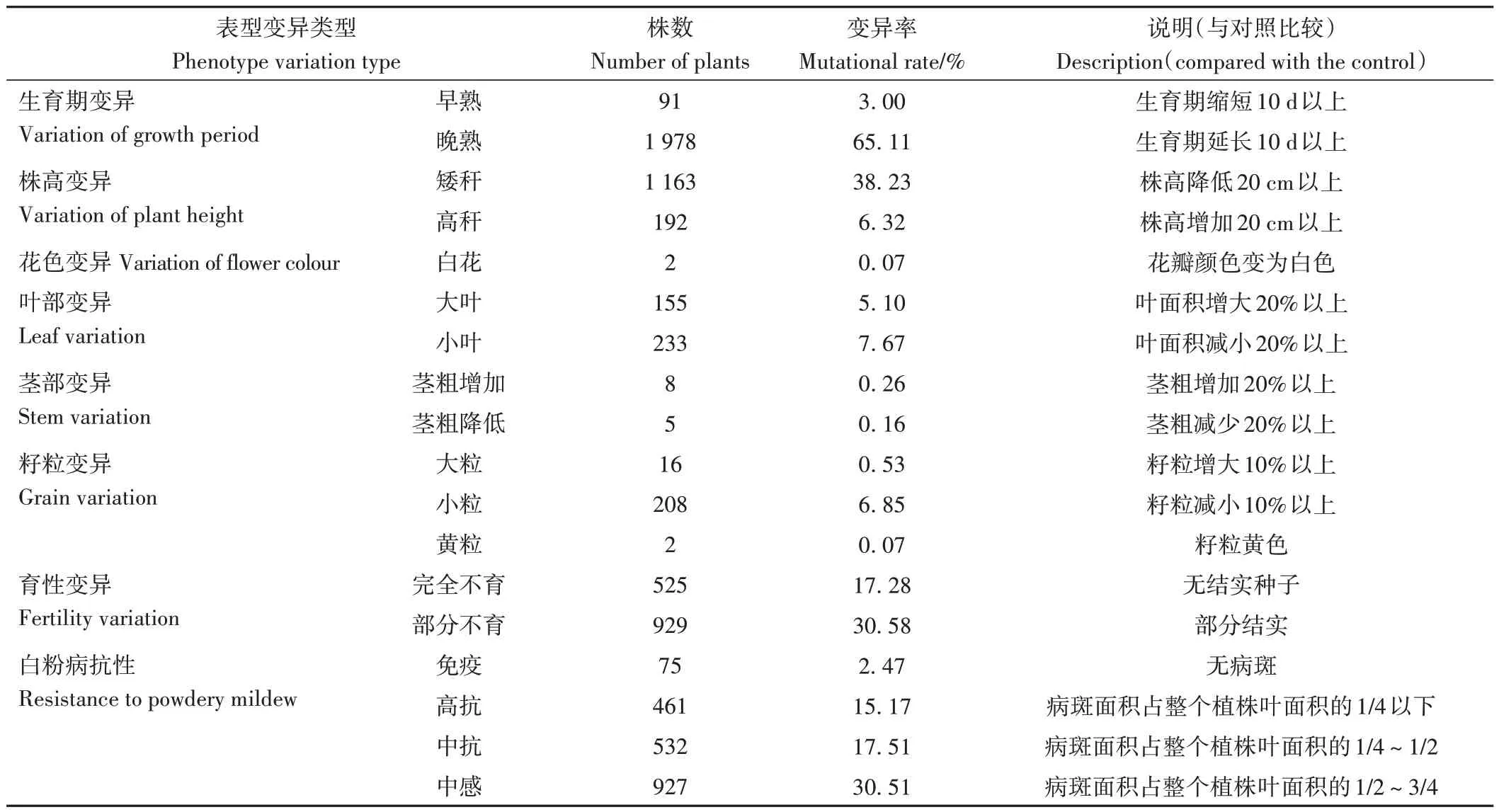
表2 胡麻M1代诱变单株表型性状变异Table 2 Phenotypic variation of mutagenic single plant in oil flax in M1 generation
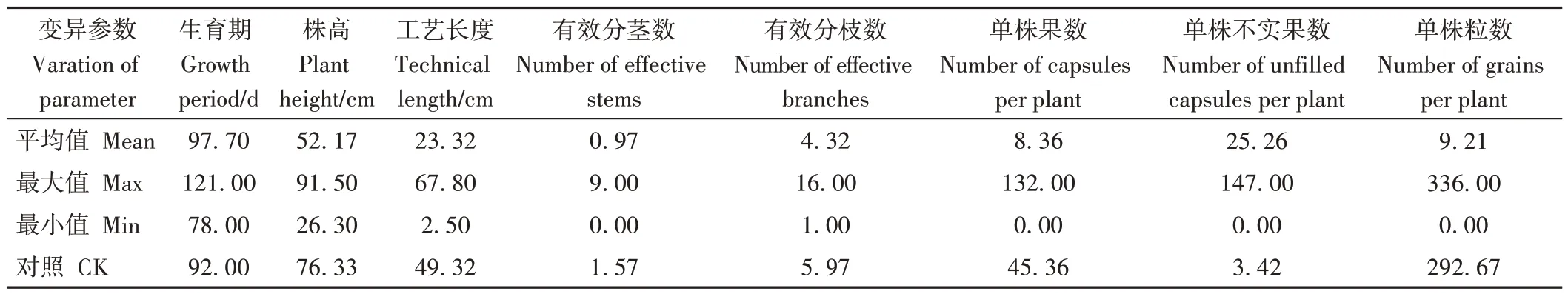
表3 胡麻M1代诱变单株主要农艺性状变异分析Table 3 Analysis of variation in agronomic traits of mutagenic single plant in oil flax M1 generation
2.3 胡麻M2~M4代诱变材料的农艺性状鉴定筛选
M2代的田间表现与M1代相比,大部分变异性状相似,但晚熟、矮秆和不育等性状变异幅度和数量占比有所降低,这可能与M1代受到药物处理后的物理损伤有关。随机选取500 株进行观测和考种,结果表明,诱变株的平均株高和工艺长度与对照相比变化不大,而有效分枝数、单株果数、单株不实果数均较对照有明显增加。M3代的田间农艺性状与M2代基本相似(表4)。
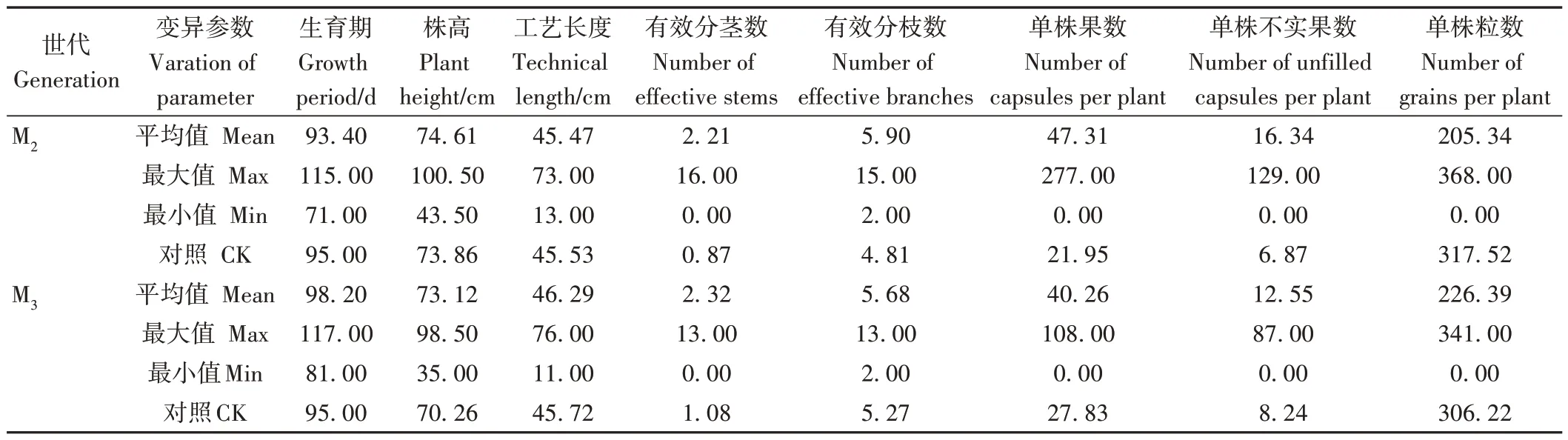
表4 胡麻诱变M2~M3代材料主要农艺性状变异分析Table 4 Analysis of variation in agronomic traits of mutagenic materials in oil flax M2~M3 generation
在M4代时,M3代所表现出花色变异、茎粗变异、叶片变异、生育期变异等能够遗传到M4代,说明部分胡麻诱变材料已基本稳定。图1 显示了胡麻M2~M4诱变材料的部分性状变异情况,其中图1-H 和I 是上述情况的有力佐证。

图1 胡麻M2~M4代部分诱变材料的性状表现Fig.1 Phenotypic variation of some oil flax mutagenic materials in M2-M4 generations
2.4 胡麻M5~M8代逐代鉴定筛选及种质资源的获得
在M5~M8代继续进行表型观察及部分性状鉴定,通过逐代筛选,在M8代获得了已经稳定的种质22 份(表5、图2),其中早熟材料4份(H70、H71、D68和D406)、大粒材料1份(H71)、矮秆和半矮秆材料3份(H2-5、H70和H71)、高秆材料2 份(H16-1、D12)、抗白粉病材料17 份(其中免疫2 份,为H47 和H98-3;高抗6 份,为H16-1、H98-1、H99-2、D12、D491 和D587;中抗7 份,为H2-5、H9-1、H97-1、D42、D382、D439、D585)、白花材料2份(H9-1、H9-6)、持绿性材料2份(D213和D481)。2022 年已将3 份材料(H71、D62 和D367)提交进入国家亚麻种质资源库。

图2 诱变获得的部分胡麻种质材料Fig.2 Some germplasm materials of oil flax obtained by EMS mutation
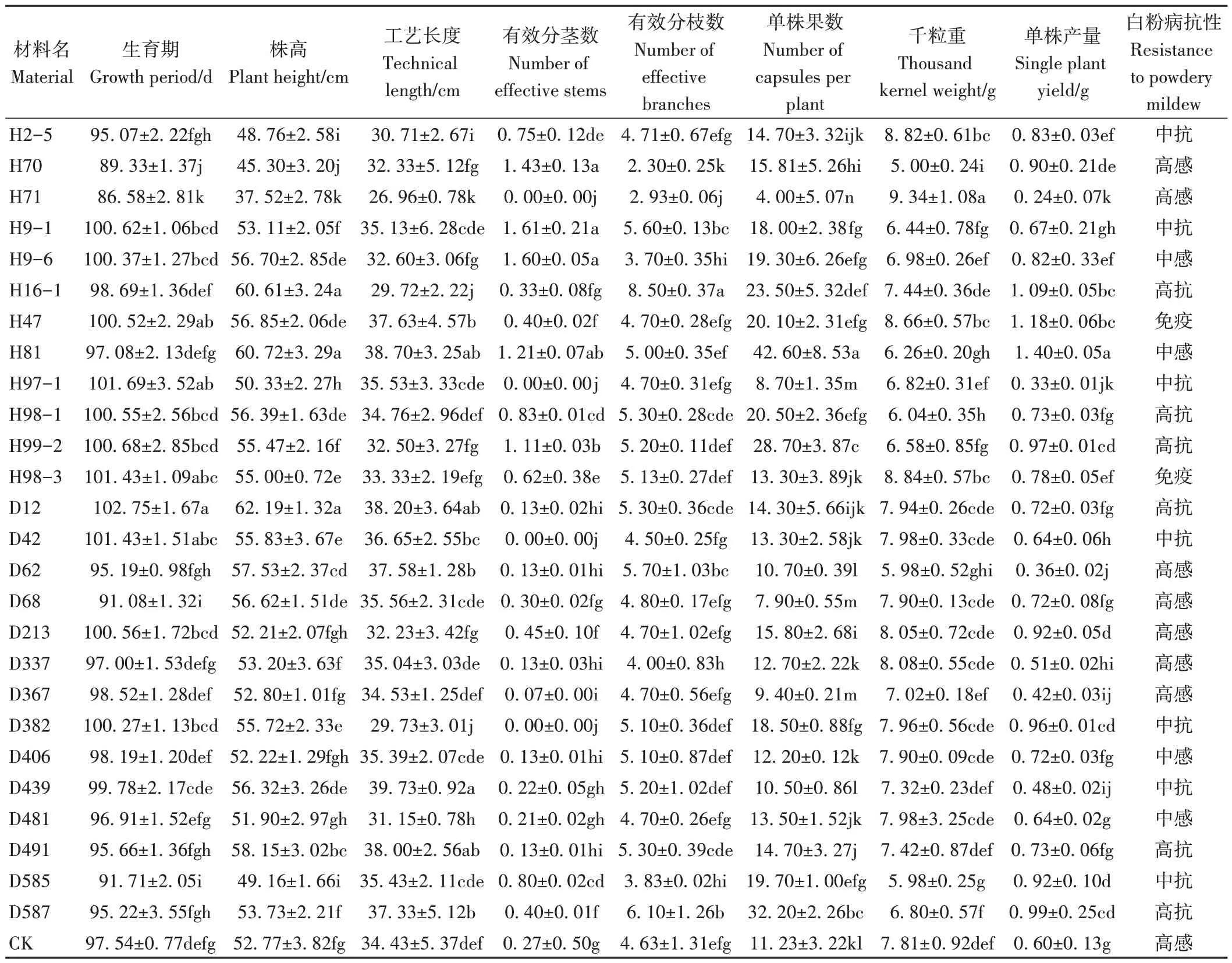
表5 胡麻诱变种质材料M8代的部分性状表现Table 5 Some traits of EMS mutagenic oil flax germplasms in M8 generation
3 讨论
EMS 诱变构建作物突变体库和种质资源创制中,适宜的处理浓度和时间是获得成功的关键。然而不同作物或者同一作物的不同供试基因型,效果较好或最佳的EMS 浓度与时间并不完全相同[6-15,23-24]。在亚麻EMS 诱变研究中,Green 等[17]和Rowland 等[28]采用0.3%和0.4%的EMS 先在2 ℃下处理2 h,再在20 ℃处理2 h;王斌等[24]研究认为,褐色籽粒胡麻品种最佳EMS 处理浓度为0.6%,时间为4 或2 h,浅黄色籽粒品种为0.3%和4 h;于莹等[29]对亚麻品种黑亚19的种子用0.2%的EMS 处理30 h 和0.3%处理24 h 后产生了大量不育株。上述研究表明,在筛选效果好的EMS 处理参数时,可用高浓度短时间或低浓度长时间组合。本研究所筛选的适宜胡麻种子EMS 诱变的处理参数为0.2%/24 h,这与上述研究结果基本吻合。
在EMS诱变后产生的突变体的性状存在随机性,必然会产生优良和不利的性状。因此,由于研究目标不同,对于诱变后代的观察、鉴定和筛选的关注点也会有所不同,最终获得的种质材料就存在差别。如Green 等[17]、Rowland 等[28]和王斌等[24]的主要目标是获得在品质方面的胡麻突变体,因此获得了一些低/高亚麻酸含量、高粗脂肪含量、高木酚素含量的材料。陇亚10 号是甘肃省农业科学院作物研究所2006 年育成的品种,该品种稳产高产,综合性状优良[30-31],但高感白粉病。本研究从2014年开始,通过对该品种进行EMS处理的诱变后代(M1~M8)进行连续8年的表型逐代观测、鉴定和筛选,获得了稳定的具有早熟、矮秆、大粒、抗白粉病等特性的胡麻种质材料26 份(表5),目前本课题组已对H99-2 的抗白粉病基因进行了初步定位研究[32];D439和H47 因综合性状优良、丰产性好,先后于2021 年和2022 年分别提交参加了甘肃省和全国的胡麻区域试验。本研究所获得的这些材料既可以应用于胡麻相关性状基因的研究,也可应用于胡麻遗传改良研究,且部分综合农艺性状优良、丰产性好的材料经进一步的培育可以作为品种应用于胡麻生产中。
4 结论
本研究结果表明,EMS诱变处理胡麻品种陇亚10号种子的浓度与时间组合为0.2%/24 h;经连续8 年的鉴定筛选,在M8代时获得了与原对照相比具有明显性状差异的种质材料22份,其中早熟材料4份、大粒材料1份、矮秆和半矮秆材料3 份、高秆材料2 份、抗白粉病材料17份、白花材料2份、持绿性材料2份。
