氮离子注入对金莲花种子发芽率及幼苗生理特性的影响
2023-09-06曹天光张新旭耿金鹏
曹天光 张新旭 秦 垒 王 慧 耿金鹏
(河北工业大学生物物理研究所,天津 300401)
金莲花(Trollius chinensisBunge)为毛茛科(Ranunculaceae)金莲花属多年生草本植物,分布于华北、东北等地区的海拔1 800 m 以上的高山草甸[1],其花、茎、叶均可入药,主要药用成分为黄酮类及生物碱类化合物[2],有良好的清热去毒、抗菌消炎等作用[3-4],已被选为预防严重急性呼吸道综合征疾病[5]和新型冠状病毒肺炎[6]的中药处方成分。目前由于过度采摘利用,野生金莲花资源已经非常稀少,而人工栽培存在种质资源匮乏、种源繁殖系数低和品质下降等问题,产量不能满足日益增长的市场需求。此外,金莲花喜冷凉湿润环境、根系浅、怕干旱、忌水涝,使人工栽培和引种繁殖面临着一系列问题[7-8]。因此,利用现代育种技术对金莲花进行品质改良,对丰富金莲花种质资源以满足市场需求具有重要意义。
离子束注入诱变育种技术利用加速的气体离子(等离子体)轰击生物材料,使之发生遗传变异,从而创制出新的品种[9]。离子注入装置的示意图如图1 所示。与传统的X、γ 射线等辐射技术相比,离子束诱变具有作用效应局部、可控[10]、损伤轻、存活率和突变率高等特点[11-12],已越来越多地应用于谷物[13]、经济作物[14]、花卉[15]等植物的诱变育种。
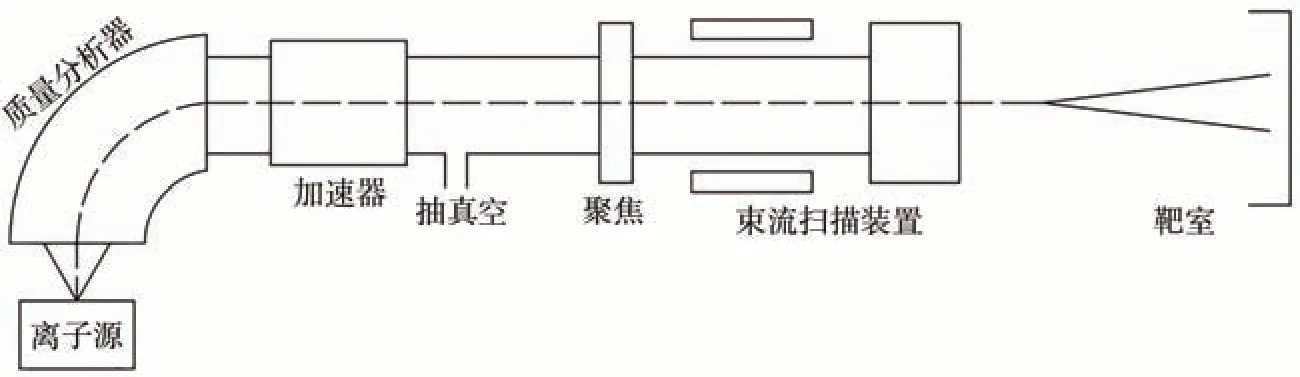
图1 离子注入装置示意图Fig.1 Schematic diagram of ion implantation machine
前人研究表明,一定剂量的离子注入可刺激植物的生长发育。例如,张红等[16]研究发现,低能量低剂量的氮离子注入可以增加大豆种子的活力,提高其发芽率。赵子睿等[17]发现30 keV 氮离子注入毛叶山桐子种子可显著增加种子发芽率、幼苗株高、冠幅、叶片数等表观性状。李海金等[18]发现,低剂量氮离子注入红小豆种子,显著提升了红小豆的株高、单株荚数等农艺性状。离子注入作为一种非生物胁迫,会使植物体内产生大量的活性氧(reactive oxygen species,ROS),这些ROS 会攻击生物大分子[19],引起蛋白质、核酸等的损伤。植物体会启动自身的保护系统,诱导抗氧化系统的活性,进行自我修复,清除ROS,缓解氧化损伤[20]。同时抗氧化能力的增强有助于提高生物体抵御逆境的能力,从而保证正常的生理代谢[21]。吴座功等[22]将氮离子注入蒙古黄芪种子后,通过分析抗氧化酶发现,低剂量的离子注入有利于抗氧化酶的活化,促进种子萌发。张红等[16]发现,一定剂量的氮离子注入大豆种子后,其植株的超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)活性,可溶性蛋白含量都表现出明显增加现象。黄洪云等[23]认为氮离子注入能有效提高干旱胁迫下玉米幼苗叶片脯氨酸含量、SOD 和POD 活性,从而增强玉米叶片的抗旱性。然而,关于氮离子注入对金莲花生长发育的影响,目前鲜有研究报道。
因此,本研究以金莲花种子为材料,通过低能氮离子注入金莲花种子,探讨氮离子注入对金莲花种子萌发和幼苗生理特性的影响,以期为氮离子注入诱变金莲花提供理论参考。
1 材料与方法
1.1 试验材料
金莲花种子采于河北省承德市围场满族蒙古族自治县,经河北工业大学耿金鹏副教授鉴定为性状稳定的野生金莲花种子。
SOD、POD、CAT、过氧化氢(hydrogen peroxide,H2O2)测试试剂盒,北京索莱宝科技有限公司;Trizol,美国Invitrogen 公司;PrimeScriptTMRT reagent Kit(Perfect Real Time)、TB Green®Premix Ex TaqTMII(Tli RNaseH Plus)测试试剂盒,日本TaKaRa 公司;三氯乙酸(分析纯)、牛血清蛋白(生物技术级,96%)、85%磷酸、考马斯亮蓝G250(分析纯)、2-硫代巴比妥酸,阿拉丁试剂(上海)有限公司。
1.2 仪器与设备
5424R 冷冻高速离心机,德国Eppendorf 公司;SpectraMax i3x 酶标仪,美国Moleculer Devices 公司;CFX96 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪,美国Bio-Rad 公司;UV5Nano 超微量紫外可见分光光度计,美国Mettler Toledo 公司;TYS-4N植物叶绿素测定仪,北京中科维禾科技发展有限公司。
1.3 样品制备
1.3.1 种子处理 氮离子注入试验在河北工业大学生物物理研究所离子注入机室完成。氮离子注入能量为30 keV,注入剂量为1.0×1015、2.0×1015、3.0×1015、4.0×1015、5.0×1015、6.0×1015、7.0×1015、8.0×1015ions·cm-2。以同批次相同数量未经处理的种子作为对照。试验挑选颗粒饱满、大小均匀的金莲花种子,每组3 次重复,每重复500粒。
1.3.2 种子发芽试验 取经过氮离子注入处理的种子和未经过注入的种子各100粒,3个重复。使用赤霉素(600 mg·L-1)浸泡金莲花种子24 h 打破种子休眠,后用75%乙醇处理30 s,无菌水冲洗,2%次氯酸钠消毒20 min,放置于铺有2 层湿润滤纸的培养皿中25 °C恒温培养,每天光照12 h。
1.3.3 幼苗培养 种子萌发后播种于将其移植于含有草炭土的穴盘内,种植于河北工业大学辐照研究基地。每2 d浇水1次,后将其转移至花盆中,2个月后取叶片,测定各项生理指标。
1.4 测定指标和方法
1.4.1 发芽指标 发芽第4 天开始记录发芽数量,每天观察记录种子的发芽情况,共培养至16 d。发芽结束后计算种子的发芽率。
1.4.2 生理指标的测定 取金莲花幼苗相同部位叶片鲜样,用蒸馏水冲洗干净,吸水纸擦干后用于生理生化指标的测量,SOD、CAT、POD 活性和H2O2含量的测定参照试剂盒说明书;MDA 含量测定采用硫代巴比妥酸法;可溶性蛋白含量测定采用考马斯亮蓝法;叶绿素含量(相对值)测定采用TYS-4N植物叶绿素测定仪。
1.4.3 抗氧化相关基因的表达检测 采用荧光定量PCR 法检测离子注入前后金莲花幼苗叶片基因的表达。采集各处理组的叶片样品并采用Trizol 法提取总RNA,采用PrimeScriptTM1stStrand cDNA Synthesis Kit试剂盒进行反转录合成cDNA。qRT-PCR分析采用TB Green®Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒,每个样品重复3 次。根据前期测序结果筛选Fe/Mn-SOD1、Cu/Zn-SOD1、CAT3、POD2基因及内参基因肌动蛋白(actin,ACT)的序列[24]合成引物,引物序列如表1 所示。引物由生工生物工程(上海)股份有限公司合成。采用2-ΔΔCt方法计算目的基因的相对表达量[25]。

表1 用于检测基因表达的引物Table 1 Primers used to detect gene expression
1.5 数据统计与分析
所有数据均来自3 个独立的重复试验(n=3)。以平均值±标准偏差的方式表示。采用SPSS对数据的差异性进行单因素方差(analysis of variance,ANOVA)检验,采用Origin绘制图表。
2 结果与分析
2.1 低能氮离子注入对金莲花发芽率的影响
种子的发芽率是衡量种子活力的主要指标。如图2所示,低能氮离子注入处理的金莲花种子的发芽率随注入剂量的增加呈现“升-降-升-降”的变化趋势。与对照相比,在注入剂量为2.0×1015、3.0×1015、5.0×1015ions·cm-2时,种子的发芽率均显著升高(P<0.05),在3.0×1015ions·cm-2时最高,比对照升高了14 个百分点。在剂量为7.0×1015、8.0×1015ions·cm-2时,种子发芽率大幅下降,比对照分别降低了20 和40 个百分点(P<0.05)。结果表明,氮离子注入对金莲花种子具有刺激作用,在较低剂量时促进了种子的萌发,在较高剂量时抑制了种子的萌发。
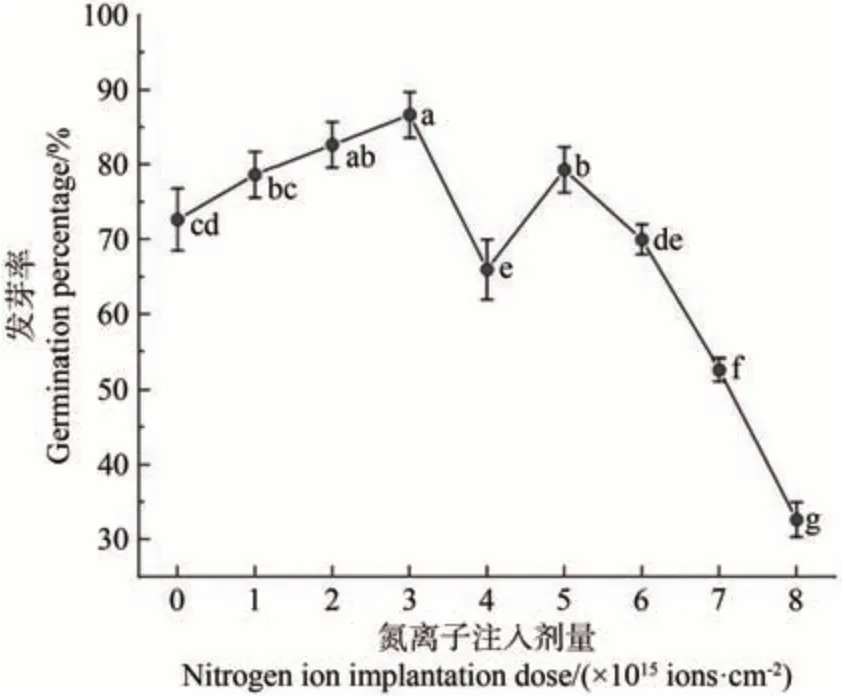
图2 金莲花种子发芽率与氮离子注入剂量的关系Fig.2 Relationship between the germination rate of T.chinensis seeds and the dose of nitrogen ion implantation
2.2 低能氮离子注入对金莲花幼苗叶绿素相对含量(soil and plant analyze development, SPAD)的影响
叶绿素是光合作用的主要色素,是反映光合作用的强弱的重要指标,其含量增加有助于碳水化合物在幼苗体内的累积。由图3可知,低能氮离子注入处理的金莲花种子萌发后,其幼苗的叶绿素相对含量随注入剂量的增加呈现“升-降-升-降”的变化趋势。在氮离子注入剂量为5.0×1015ions·cm-2时,叶绿素含量最高,比对照显著升高了28.93%(P<0.05)。当剂量超过5.0×1015ions·cm-2时,幼苗叶绿素含量开始下降,在剂量为8.0×1015ions·cm-2时最低,比对照降低了6.40%(P>0.05)。
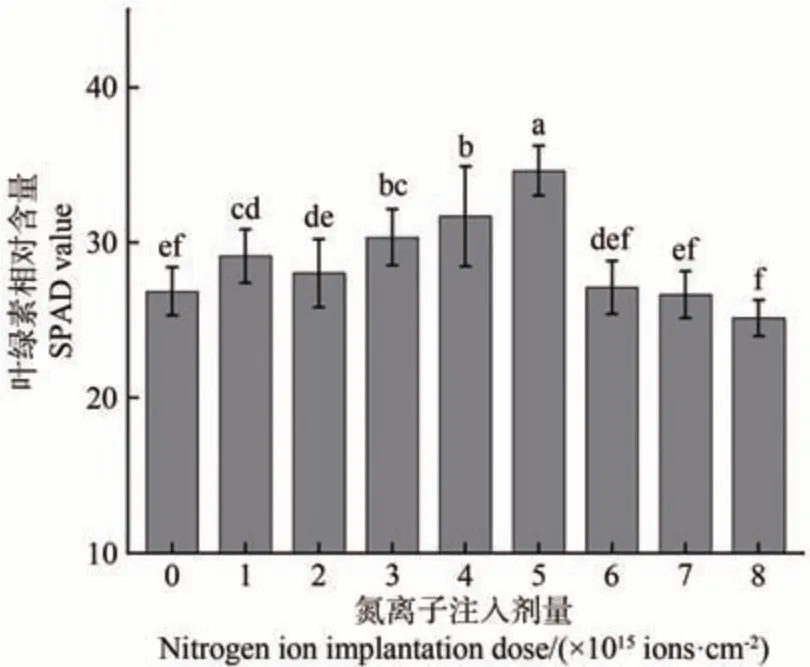
图3 金莲花幼苗SPAD值与氮离子注入剂量的关系Fig.3 Relationship between the SPAD value of T. chinensis seedlings and the dose of nitrogen ion implantation
2.3 低能氮离子注入对金莲花幼苗可溶性蛋白的影响
植物体内的可溶性蛋白质大多数是参与各种代谢活动的酶类,是重要的渗透调节物质和营养物质,其含量的增加可提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用,是筛选抗性的指标之一。由图4 可知,氮离子注入处理的金莲花种子萌发后,其幼苗的可溶性蛋白含量随注入剂量的增加呈现“升-降-升-降”的变化趋势。与对照相比,在氮离子注入剂量为1.0×1015、2.0×1015、3.0×1015、6.0×1015、7.0×1015ions·cm-2时,幼苗的可溶性蛋白含量均升高,在剂量为3.0×1015ions·cm-2时最高,比对照升高了28.63%(P<0.05)。在注入剂量为4.0×1015、5.0×1015、8.0×1015ions·cm-2时,幼苗的可溶性蛋白含量降低,在剂量为5.0×1015ions·cm-2时最低,比对照降低了9.5%(P<0.05)。
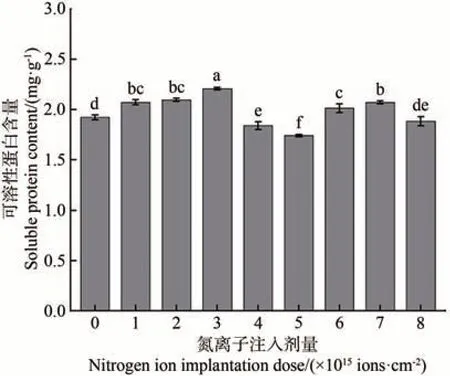
图4 金莲花幼苗可溶性蛋白与氮离子注入剂量的关系Fig.4 Relationship between the soluble protein content of T.chinensis seedlings and the dose of nitrogen ion implantation
2.4 低能氮离子注入对金莲花幼苗MDA 和H2O2含量的影响
MDA 和H2O2通常被认为是氧化应激的主要指标,能够反映细胞受损伤的程度。
由图5-A可知,低能氮离子注入处理金莲花种子萌发后,其幼苗的MDA 含量随注入剂量的增加呈现“升-降-升-降”的变化趋势。与对照相比,在氮离子注入剂量为1.0×1015、2.0×1015、5.0×1015、6.0×1015ions·cm-2时,幼苗的MDA含量均升高,在剂量为5×1015ions·cm-2时最高,比对照升高了30.34%(P<0.05)。当注入剂量为3.0×1015、4.0×1015、7.0×1015、8.0×1015ions·cm-2时,幼苗的MDA 含量降低,在剂量为3.0×1015ions·cm-2时最低,比对照降低了2.11%(P>0.05)。
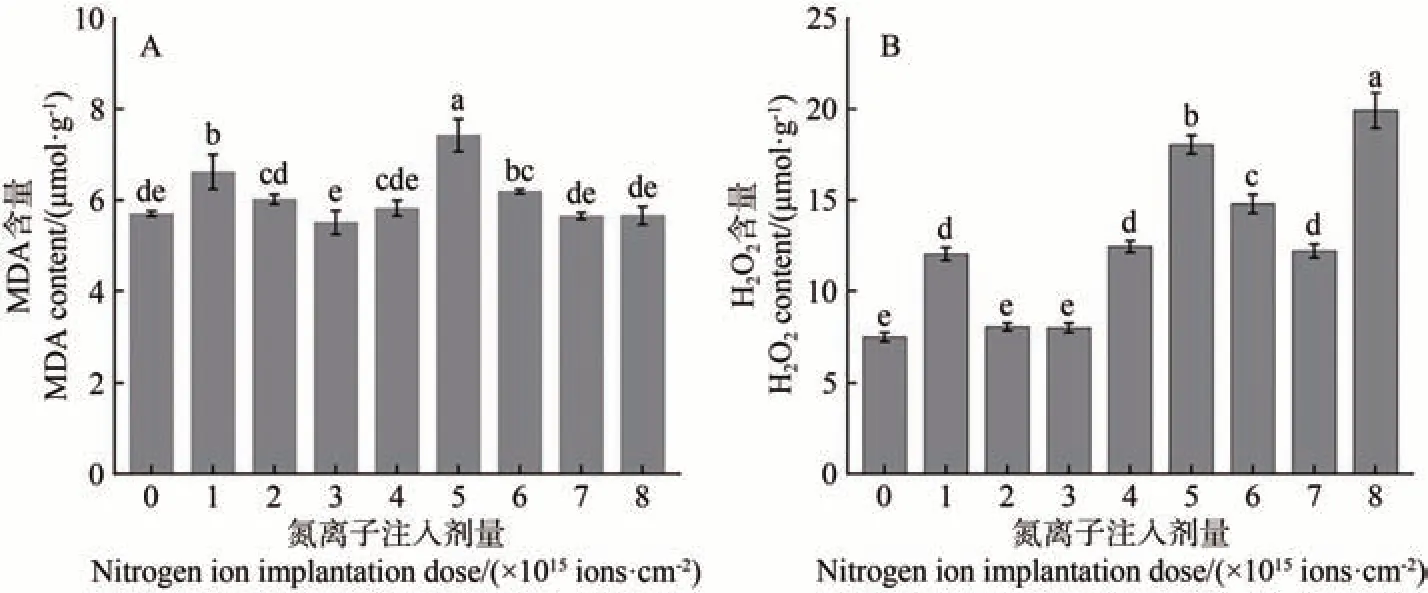
图5 金莲花幼苗MDA(A)和 H2O2(B)含量与氮离子注入剂量的关系Fig.5 Relationship between the MDA (A) and H2O2 (B) content of T. chinensis seedlings and the dose of nitrogen ion implantation
由图5-B 可知,低能氮离子注入金莲花种子萌发后,其幼苗的H2O2含量随注入剂量的增加呈“升-降-升-降-升”的变化趋势。与对照相比,不同剂量氮离子注入后其含量均有不同程度的升高,在剂量为8.0×1015ions·cm-2时最高,比对照升高了162.31%(P<0.05),在剂量为2.0×1015、3.0×1015ions·cm-2时,分别比对照增高了7.47%、6.87%(P>0.05)。
上述结果表明,不同剂量氮离子注入均会导致金莲花幼苗一定的氧化应激反应。
2.5 低能氮离子注入对金莲花幼苗抗氧化系统的影响
为探讨金莲花幼苗对氮离子注入诱导的氧化应激的抗氧化反应,研究了3种具有代表性的细胞内抗氧化酶(SOD、CAT、POD)活性随注入剂量的变化情况。SOD对植物体内超氧阴离子有清除作用;POD与光合作用、呼吸作用及生长素的氧化等有密切关系;CAT可催化H2O2分解成氧和水,并且与植物代谢强度及抗性有关。
由图6-A可知,低能氮离子注入处理金莲花种子萌发后,其幼苗的SOD 活性随剂量的增加呈现“升-降-升-降”的变化趋势。与对照组相比,在氮离子注入剂量为2.0×1015、3.0×1015ions·cm-2时,幼苗的SOD活性升高,分别比对照升高了56.64%(P<0.05)、21.48%(P<0.05)。在注入剂量为1.0×1015、4.0×1015~8.0×1015ions·cm-2时,幼苗的SOD 活性下降,在剂量为8.0×1015ions·cm-2时最低,比对照降低了45.20%(P<0.05)。
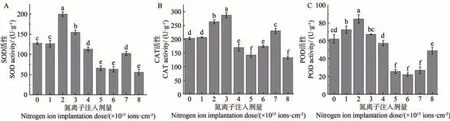
图6 金莲花幼苗 SOD(A)、CAT(B)和 POD(C)含量与氮离子注入剂量的关系Fig.6 Relationship between the SOD(A),CAT(B) and POD(C) content of T. chinensis seedlings and the dose of nitrogen ion implantation
金莲花幼苗的CAT 活性随氮离子注入剂量增加的变化趋势与SOD 大致相同。由图6-B 可知,与对照相比,在注入剂量为1.0×1015~3.0×1015、7.0×1015ions·cm-2时,幼苗的CAT 活性升高,其中在剂量为3.0×1015ions·cm-2时最高,比对照升高了41.35%(P<0.05)。在注入剂量为4.0×1015~6.0×1015、8.0×1015ions·cm-2时,幼苗的CAT活性下降,在剂量为8.0×1015ions·cm-2时最低,比对照降低了34.59%(P<0.05)。
由图6-C 可知,金莲花幼苗的POD 活性随氮离子注入剂量增加呈现“升-降-升”的变化趋势。与对照相比,在注入剂量为1.0×1015~3.0×1015ions·cm-2时,幼苗的POD 活性升高,分别比对照升高了16.69%(P<0.05)、36.24%(P<0.05)、8.42%(P<0.05)。在注入剂量为4.0×1015~8.0×1015ions·cm-2时,幼苗的POD 活性下降,在剂量为6.0×1015ions·cm-2时最低,比对照降低了21.20%(P<0.05)。
2.6 各生理指标相关性分析
不同剂量氮离子注入金莲花种子后,所测各生理指标的相关性如表2 所示。注入剂量与金莲花的发芽率、SOD 和POD 活性呈显著负相关关系(P<0.05),与H2O2含量呈极显著负相关关系(P<0.01),与叶绿素、可溶性蛋白、MDA 含量和CAT 活性为负相关关系,但无显著性。金莲花种子的发芽率与H2O2呈显著负相关关系(P<0.05),与SOD 活性呈显著正相关关系(P<0.05),与叶绿素、可溶性蛋白、MDA、CAT 和POD 呈正相关关系但不显著。叶绿素含量与丙二醛含量呈显著正相关关系(P<0.05),与可溶性蛋白、CAT 和POD 呈负相关关系但不显著,与H2O2和SOD 呈正相关关系但不显著。可溶性蛋白与MDA 呈负相关关系但不显著,与H2O2呈显著负相关关系(P<0.05),与SOD 与CAT 呈显著(P<0.05)或极显著(P<0.01)正相关关系,与POD呈正相关关系但不显著。MDA 与H2O2呈正相关关系但不显著,与SOD、CAT和POD呈负相关关系但不显著。SOD 与CAT 和POD 呈极显著正相关关系(P<0.01)。说明氮离子注入导致的金莲花一系列生理指标的变化之间存在相互关联。
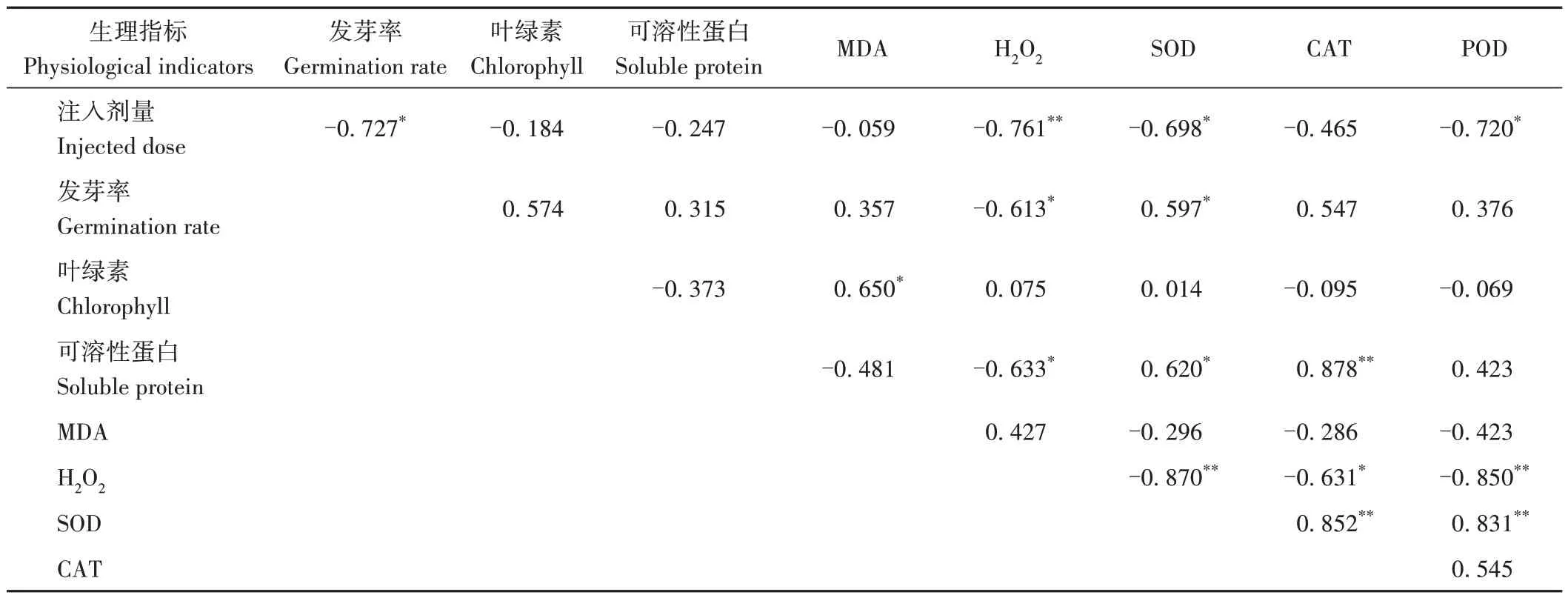
表2 生理指标的相关性分析Table 2 Correlation analysis of physiological indexes
2.7 氮离子注入对抗氧化相关基因表达的影响
为了进一步从遗传方面研究氮离子注入对金莲花幼苗生长的刺激作用,本研究选取了4 个抗氧化酶系统相关基因Fe/Mn-SOD1、Cu/Zn-SOD1、CAT3和POD2,采用qRT-PCR测定了其在对照和3.0×1015ions·cm-2氮离子注入组的金莲花幼苗叶片中的表达量,结果如图7 所示。与对照相比,Fe/Mn-SOD1、Cu/Zn-SOD1和CAT3基因的表达水平均上调,分别提高了175%(P<0.01)、5.11%(P>0.05)和48.86%(P<0.05)。POD2基因的表达水平比对照显著下调(P<0.05)。
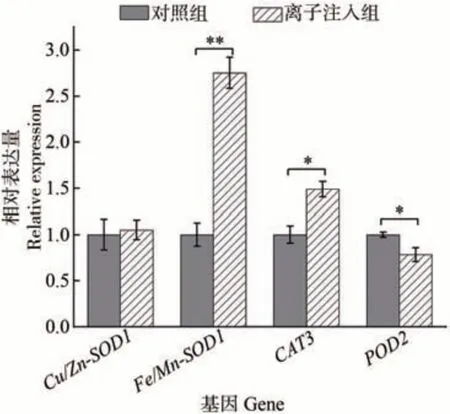
图7 对照和3.0×1015 ions·cm-2氮离子注入组的金莲花幼苗中4个抗氧化相关基因的相对表达量Fig.7 Relative expressions of four antioxidation-related genes in T. chinensis seedlings in the control and 3×1015 ions·cm-2 nitrogen ion implantation groups
3 讨论
前人研究表明,离子注入微生物、植物细胞及其种子后,其存活率与注入剂量呈现独特的“马鞍型”效应曲线[26]。在本研究中,不同剂量(1.0~8.0×1015ions·cm-2)氮离子注入的金莲花种子发芽率随注入剂量的增加呈“升-降-升-降”的“马鞍型”趋势,这与刘志高等[27]通过不同剂量的钛离子注入石蒜种子得到的结果基本一致。原因可能是金莲花具有休眠期,当氮离子注入剂量较低时,对金莲花种子有一定刺激作用,打破了金莲花的休眠,因此促进了金莲花种子的萌发,而剂量较高时造成的损伤较重,抑制了种子的萌发。
叶绿素是植物光合作用的基础,本试验通过分析氮离子注入对SPAD 值的影响,结果表明,随着氮离子注入剂量的增加,金莲花叶片中SPAD 值呈“升-降-升-降”的趋势,注入剂量过高时,SPAD 值开始低于对照。这与吴座功等[22]用低能氮离子注入蒙古黄芪种子时得到的研究结果一致。原因可能是氮离子注入后,促进了叶片组织中叶绿素相关物质的合成;注入剂量过高时,生理损伤加重,抑制了叶绿素的合成。
在逆境条件下,植物会主动积累可溶性蛋白,对细胞的生命物质及生物膜起到保护作用[28]。本试验中可溶性蛋白含量随着氮离子注入剂量的增加出现“升-降-升-降”的变化趋势,这与周小云等[29]研究氮离子注入小麦种子新春11 号得到的可溶性蛋白的变化趋势一致。说明金莲花幼苗在氮离子注入后可通过积累可溶性蛋白修复氮离子引起的损伤。在注入剂量为3.0×1015ions·cm-2时,可溶性蛋白含量最高,修复能力最强,超过该剂量后可溶性蛋白含量降低,可能是由于氮离子注入打破了金莲花细胞内的酶系统平衡,导致修复能力逐渐减弱,而在更高剂量时细胞自身又重新建立了酶系统并开始自我修复,使可溶性蛋白含量再升高。
离子注入是一种非生物胁迫,能够诱导植物产生ROS (例如H2O2),对机体造成伤害。氮离子注入的金莲花幼苗H2O2含量均大于对照组,与Semsang 等[30]提出的低能氮离子注入导致泰国茉莉水稻幼苗的ROS含量升高的结果相似。植物体通过SOD、POD、CAT 等抗氧化酶缓解ROS伤害。本试验3种抗氧化酶活性大致呈“升-降-升-降”的变化趋势,在氮离子注入剂量为1.0×1015~3.0×1015ions·cm-2时,幼苗体内的POD、CAT、SOD 活性基本均高于对照组,这可能是氮离子注入在金莲花体内产生的ROS 启动了细胞的修复保护反应,刺激了编码抗氧化酶的基因应答,从而使抗氧化酶活性提高[31-32]。MDA 含量在氮离子注入后的变化趋势与3 种酶含量的变化趋势基本相反,间接地证实氮离子注入对金莲花的影响以及金莲花自身所具有的协调修复作用。当氮离子注入剂量继续增大时,抗氧化酶活性开始下降,可能是离子注入造成细胞伤害严重,致使代谢紊乱,酶的合成受阻;在更高剂量时酶活性又出现上升的趋势,可能是由于细胞重新建立了酶系统,细胞开始自我修复。
本研究发现,氮离子注入会导致金莲花生理指标的变化,而这种变化并不表现在某一项生理指标上,而是各个指标相互关联相互影响。由此推测,氮离子注入会对金莲花造成了一系列损伤,在较低剂量氮离子注入金莲花时,活性较高的抗氧化酶能有效清除离子注入产生的ROS、维持细胞膜结构的稳定性,同时植物体积累的可溶性蛋白等渗透调节物质对氮离子引起的损伤进行修复,抗氧化酶和渗透调节物质的增加在一定程度上促进了植物体的代谢活动,使叶绿素含量增加,最终促进了植物体生长发育。而随着注入剂量的增加,金莲花幼苗中没有足够的抗氧化酶和渗透调节物质来消除过量的ROS,从而导致幼苗生长受到抑制。
研究表明,氮离子注入会对植物分子水平造成一定影响。一方面,离子注入使植株体内基因序列、表达发生改变,有研究揭示离子注入会影响植物基因的表达量[33-34]。然而关于金莲花抗氧化相关基因在氮离子注入下的转录反应,目前鲜有研究。植物的SOD 根据金属辅基可以分为Mn-SOD,Cu/Zn-SOD 和Fe-SOD。研究表明,在应对非生物胁迫时,植物CSD1、CSD2和MSD1基因的表达显著上调[35],该结论与本试验的结果类似。本研究选取前期各生理生化指标良好的3.0×1015ions·cm-2氮离子注入金莲花幼苗与对照组进行比较,发现Cu/Zn-SOD、Fe/Mn-SOD和CAT基因的转录水平与对照相比均上调,说明3.0×1015ions·cm-2氮离子注入能够增加编码SOD和CAT基因的表达,其中CAT基因的结果与Du等[36]的研究一致。总的来说,抗氧化酶相关基因在缓解相对低剂量氮离子注入诱导的氧化胁迫中起到了关键作用,3.0×1015ions·cm-2氮离子注入可以通过增强抗氧化相关基因的表达,提高了抗氧化系统活性,清除了氮离子注入产生的过量ROS,促进了金莲花幼苗的生长。另一方面,离子注入改变了植物体内甲基化、转座子和DNA 结构等。龚佳梦等[37]发现快中子、返回式卫星搭载、重离子等不同电离辐射下金莲花的基因多态性存在明显差异,说明各种电离辐射可有效引起金莲花DNA 分子的变异。因此推测氮离子注入金莲花的过程中发生能量沉积、动量传递,刺激DNA 的损伤修复、相关基因的表达和生化代谢网络的调控,最终引起金莲花M1代的生物诱变效应。
本试验结果均来自于金莲花当代,其有益性状可以通过组织培养技术保存和扩繁,后续也可以进行多代跟踪研究,筛选获得稳定遗传的有益突变材料。
4 结论
本试验研究了不同剂量的氮离子注入对金莲花种子发芽率及幼苗生理生化特性的影响,发现一定剂量氮离子注入能够促进金莲花种子的萌发、提高苗期叶绿素和可溶性蛋白含量、促进抗氧化相关基因的表达、增强金莲花抗氧化系统的活性、有效清除低剂量离子注入幼苗中适量的ROS,从而促进幼苗生长。3.0×1015ions·cm-2可以作为氮离子注入诱变金莲花的优选剂量。
